- Synthesis of Sulfur-Citral Copolymers and Their Application to Cathode Materials for Lithium-Sulfur Batteries
Guk Yun Noh*,**, So Huyn Park*, Ji Mok Lee*,***, Byoung Gak Kim*,**, Jungdon Suk*,**, Dong-Gyun Kim*,†
 , and Yong Seok Kim*,**,†
, and Yong Seok Kim*,**,† 
*Advanced Materials Division, Korea Research Institute of Chemical Technology, 141 Gajeong-ro, Yuseong-gu, Daejeon 34114, Korea
**Chemical Convergence Materials and Processes, University of Science and Technology, 217 Gajeong-ro, Yuseong-gu, Daejeon 34114, Korea
***Department of Materials Science and Engineering, Korea University, 145 Anam-ro, Sungbuk-gu, Seoul 02841, Korea- 황-시트랄 공중합체의 합성 및 리튬-황 전지용 양극 소재로의 응용
노국윤*,** · 박소현* · 이지목*,*** · 김병각*,** · 석정돈*,** · 김동균*,†
 · 김용석*,**,†
· 김용석*,**,† 
*한국화학연구원 화학소재연구본부, **과학기술연합대학원대학교 KRICT 스쿨, ***고려대학교 신소재공학부
Lithium-sulfur batteries (LSBs) have been of particular interest over the last decade but the long-term problem of polysulfide elution that causes deterioration of cell performance remains a challenge. Herein, an effective cathode active material applicable to LSBs was prepared through the inverse vulcanization reaction of citral, a natural product. During the inverse vulcanization reaction, a sulfur-citral copolymer (SCPs) having a high sulfur content of 78-93% was prepared by controlling the equivalence ratio of elemental sulfur and citral. In particular, LSBs, in which a sulfur-citral copolymer having a sulfur content of 89% was applied as a cathode active material, were confirmed to have limited polysulfide elution, and thus showed excellent capacity retention. This is attributed to the large content of electrolyte-insoluble long polymer chains as well as low content of unreacted elemental sulfur presented in polymer chain.
리튬-황 전지는 지난 십여 년간 많은 관심 속에 연구되었지만, 장기적으로 전지 성능 저하를 야기하는 폴리 설파이드 용출 문제가 여전히 당면 과제로 남아있다. 본 논문에서는 천연물 유래인 시트랄에 역가황 반응을 통하여 리튬-황 전지에 적용 가능한 효과적인 양극 활 물질을 제조하였다. 역가황 반응 시, 원소 황과 시트랄의 당량비를 조절하여 78-93%의 높은 황 함유랑을 갖는 황-시트랄 공중합체를 합성하였다. 특히, 89%의 황 함유량을 갖는 황-시트랄 공중합체를 양극 활 물질로 적용한 리튬-황 전지는 폴리설파이드 용출이 제한됨을 확인하였고, 그에 따라 우수한 용량 유지율을 보였다. 이는 공중합체에 존재하는 미반응 원소 황이 적을뿐 아니라, 전해액에 불용성인 긴 폴리설파이드 사슬의 함량이 높기 때문이다.
Keywords: lithium-sulfur batteries, inverse vulcanization, elemental sulfur, citral
본 연구는 한국화학연구원 주요사업(SI1803-03) 및 산업핵심기술개발사업(10052913)의 지원으로 수행되었으므로 이에 사의를 표합니다.
최근 전기 자동차 산업 등 첨단 분야에 저비용, 긴 수명, 고안전성, 고에너지 밀도를 갖는 이차 전지의 필요성이 부각되고 있다. 상용화된 리튬 이온 이차전지를 대체할 차세대 이차 전지 중 하나인 리튬-황 전지는 석유 정제 공정에서 부산물로 생성되는 황을 양극 활 물질로 활용하기 때문에 값싸고 친환경적일 뿐만 아니라, 높은 이론용량(1675 mAh/g)과 에너지 밀도(2600 Wh/kg)를 갖는다.1-3 리튬-황 전지는 방전과정에서 식 (1)과 같이 황, 리튬이온, 전자가 반응하여 리튬설파이드(Li2S)가 생성되며 이 과정에서 전기에너지가 발생한다.
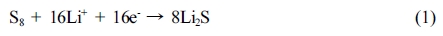
보다 구체적으로는 전압 2.3-2.4 V에서
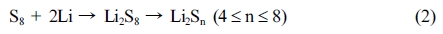
의 과정이 진행되고, 전압 1.9-2.1 V에서

의 과정이 진행된다. 식 (2)의 생성물은 전해질에 녹는 반면, 식 (3)의 생성물은 전해질에 녹지 않는다. 이러한 특성으로 리튬-황 전지의 가장 큰 문제점이 발생하는데, 식 (2)의 과정으로 생성되는 리튬 폴리설파이드 일부가 전해질에 용출되고 음극으로 이동하여 음극의 부식을 유발한다. 이를 ‘셔틀 효과’라고 하며 결과적으로 짧은 수명, 자가 방전, 부피 변화를 야기한다.4-6
폴리설파이드 용출 문제를 해결하기 위해 다양한 방법들이 연구되어 왔다. 다공성 탄소 구조에 황을 담지하여 폴리설파이드 용출을 물리적으로 억제하는 방법,7-10 폴리설파이드와의 물리/화학적 결합을 통해 용출을 저하시키는 방법11-15 등이 연구되었다. 이러한 방법은 폴리설파이드 용출 문제를 어느 정도 해결할 수 있지만, 복잡한 공정 측면에서 상업화에 적합하지 않은 방법이다. 2013년, Pyun 연구팀은 전기화학적인 활성을 지닌 황 사슬을 주사슬로 갖는 높은 황 함유량의 가교 결합된 공중합체를 합성할 수 있는 역가황(inverse vulcanization) 방법을 개발하였다.16 고온 반응 시, 황에서 발생하는 라디칼과 2개 이상의 작용기를 갖는 불포화 탄화수소가 반응하여 황 함량이 높고 분자량 분포가 넓은 고분자가 만들어지는데 간단하고 경제적이며 용매를 사용하지 않는 장점이 있다. 특히 역가황으로 만들어진 공중합체는 폴리설파이드 용출이 억제되어 우수한 전지 용량 유지율을 나타냈고, 이를 기반으로 다양한 역가황 공중합체 활 물질 연구가 수행되었다.17-19 하지만, 다양한 역가황 공중합체 연구에도 불구하고 최근까지 폴리설파이드 용출 억제 메커니즘이 명확하게 제시되지 못한 실정이었다.
최근 Lee 연구팀은 역가황 공중합체 활 물질의 전기화학반응을 고체상 핵자기공명(Solid-State Nuclear Magnetic Resonance)을 이용하여 분석함으로써, 폴리설파이드 용출 억제 메커니즘을 밝혔다.20 원소 황을 1,3-diisopropenylbenzene으로 역가황하여 합성한 높은 황 함유량(90 wt%)의 고분자는 높은 가교 밀도와 함께 긴 황 고분자 사슬로 구성되어 있기 때문에, 방전과정 시 생성되는 폴리설파이드 또한 전해액 용해도가 낮은 긴 황 사슬 및 큰 분자량으로 구성되어, 일반적인 폴리설파이드 용출 메커니즘을 따르지 않는다. 따라서 역가황 방법은 폴리설파이드 용출을 간단하게 억제하여 리튬-황 전지의 사이클 안정성을 향상시킬 수 있는 효과적인 방법이다.
본 논문에서는 역가황 방법으로 원소 황을 레몬에서 추출되는 천연물유래 물질인 시트랄(citral)로 역가황하여 높은 황 함유량의 황-시트랄 공중합체(sulfur-citral copolymer, 이하 SCP)를 합성하였다. 다양한 황 함유량의 공중합체 중, 89 wt%의 황 함유량을 갖는 공중합체(SCP89)는 리튬-황 전지 양극 활 물질로 적용 시, 높은 용량과 우수한 용량 유지율을 보인다. 이는 SCP89에 존재하는 전해액 용해도가 낮은 긴 고분자 사슬과 적은 함량의 미반응 원소 황 때문이다.
재료. Sulfur(purum p.a., ≥99.5%(T)), citral(95%), 1,3-dioxolane(DOL), 1,2-dimethoxy-ethane(DME), N-methylpy-rrolidone(NMP), bis(trifluoromethylsulfonyl)amine lithium salt (LiTFSI), lithium nitrate(LiNO3)는 Sigma-Aldrich에서 구매하여 사용하였으며, super P(TMCAL), Li foil(HONJO METAL CO.LTD.), polyethylene 분리막(Celgard 2400), polyvinylidene fluoride(PVdF, Kynar flex 2851)도 각각 구매하여 사용하였다. 1,3-dioxolane(DOL), 1,2-di-methoxyethane(DME)는 4 Å의 크기를 갖는 molecular sieve를 사용하여 1 ppm 이하로 수분을 제거하여 사용하였다. Bis-(trifluoromethylsulfonyl)amine lithium salt(LiTFSI), lithium nitrate(LiNO3)은 120 ℃ 진공 오븐에서 24시간 동안 건조하여 사용하였다.
황-시트랄 공중합체 합성. 다양한 당량비로 원소 황과 시트랄을 벌크 중합(bulk-polymerization)하였다. 질소 분위기 하에서 100 mL 둥근 바닥 플라스크를 이용하여 160 ℃에서 2시간 동안 교반하였다. 반응이 끝난 후 상온으로 식힌 뒤 고체상 공중합체를 수득하였고 전지 특성 평가에 사용되는 전해액 용매인 DOL:DME(1:1 v/v)로 수 차례 세척 후 45 ℃의 진공 오븐에서 24시간 건조하여 최종 고분자를 수득하였다. 황-시트랄 공중합체는 SCP#으로 명명하였고, 여기서 #은 정제 후 원소분석을 통해 확인한 공중합체 내 황 함유량(wt%)을 나타낸다. 아래 구체적인 실험 당량비가 제시되어 있다.
황 78 wt% Sulfur-citral polymer(SCP78) 합성: 원소 황(3.2 g, 12.5 mmol)과 시트랄(0.8 g, 5.3 mmol) 중합(수득률: 68.6%).
황 89 wt% Sulfur-citral polymer(SCP89) 합성: 원소 황(3.4 g, 13.3 mmol)과 시트랄(0.6 g, 3.9 mmol) 중합(수득률: 79%).
황 93 wt% Sulfur-citral polymer(SCP93) 합성: 원소 황 (3.6 g, 14.0 mmol)과 시트랄(0.4 g, 2.6 mmol) 중합(수득률: 90%).
기기 및 분석. 황-시트랄 공중합체 유리전이 온도(Tg), 용융 온도(Tm)를 측정하기 위해 시차주사열량계(DSC, TA사 Q1000)를 이용하여 질소 분위기에서 알루미늄 팬에 캡슐화된 샘플(5-10 mg)을 10 ℃/min의 일정한 속도로 25 ℃에서 150 ℃로 가열하였고 10 ℃/min의 일정한 속도로 -50 ℃로 냉각했으며 다시 150 ℃까지 가열하여 측정하였다. 원소분석(elemental analysis, EA)은 Thermo Scientific FLASH EA-2000 Organic Elemental Analyzer로 수행했다. 열 중량 분석(TGA)은 10 ℃/min의 가열 속도로 질소 분위기에서 TA사 Q5000장비로 수행했다. Fourier transform infrared(FTIR) 분석은 KBr 펠렛을 사용하여 Bruker사 ALPHA-T장비로 수행했다.
전지특성 평가. 양극 재료의 조성은 SCP, carbon black (super P), binder(PVdF)를 질량비 7:2:1로 고정하였다. 상기 조성물을 agate mortar에서 NMP와 혼합하여 slurry로 만든 후 doctor blade를 이용하여 Al foil에 코팅하였고 40 ℃ 진공오븐에서 밤새 건조시킨 뒤 무게를 측정하여 황의 loading값을 얻었다. 황의 loading양은 SCP78, 89, 93이 적용된 전극에서 각각 1.10, 1.41, 1.86 mg/cm2였다. 이후 Ar 분위기의 glove box에서 양극물질이 코팅된 Al foil을 14 mm로 펀칭하였고 Li 금속을 음극으로 하여 CR2032 type coin cell로 조립하였다. 전지의 충⋅방전 실험은 배터리 테스트 장비(TOSCAT-3100U, Toyo Inc.)를 사용하여 상온에서 실시하였다. 전지 테스트는 1.8-2.6 V의 전압범위와 황의 이론용량 1675 mAh/gsulfur를 기준으로 C-rate을 계산하여 실시하였다.
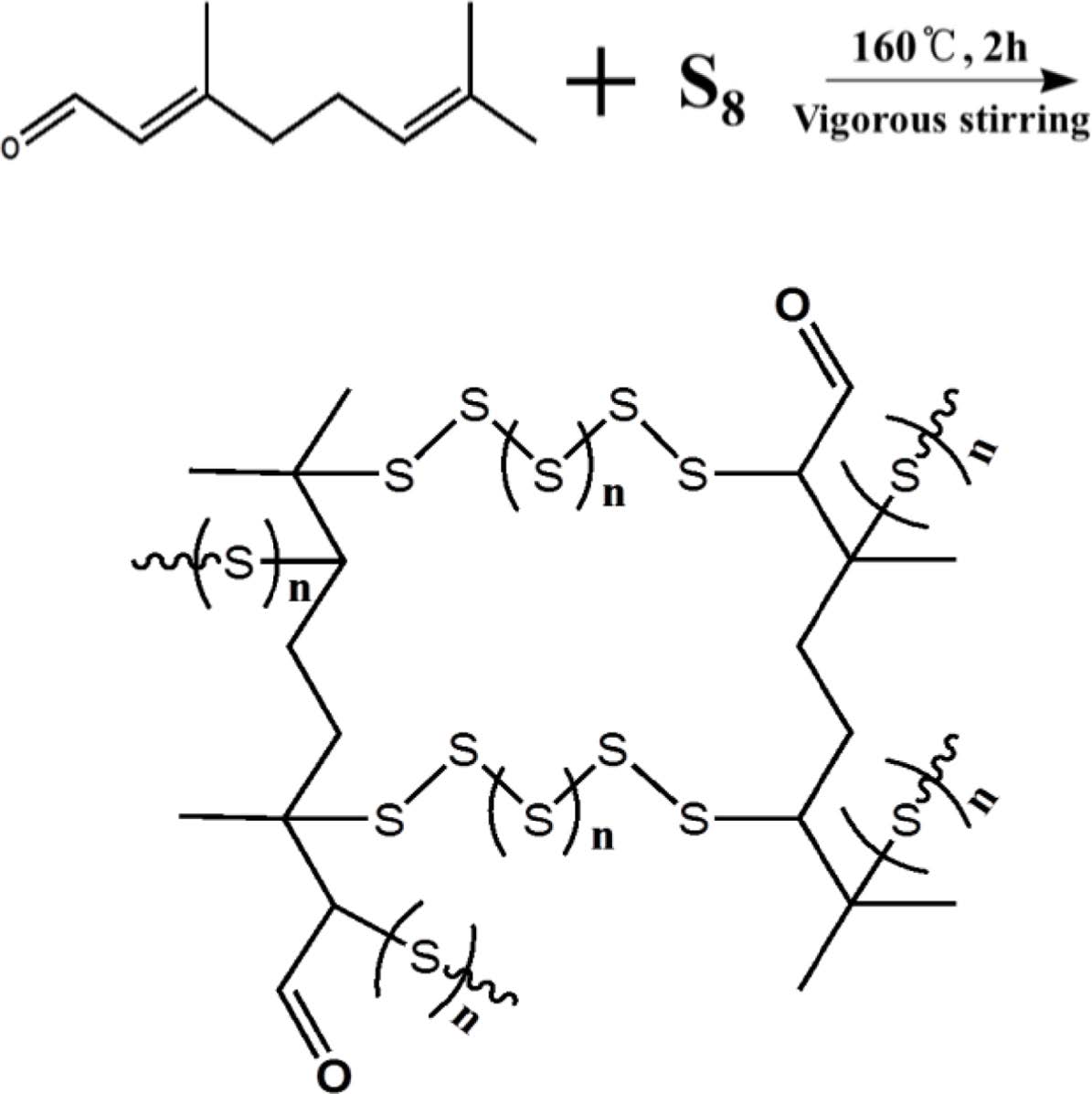
황-시트랄 공중합체 합성 및 구조 분석. 리튬-황 전지의 양극 활 물질로의 응용을 위해 원소 황을 시트랄을 사용하여 역가황함으로써 황-시트랄 공중합체(SCP#)를 합성하였다. 황-시트랄 공중합체는 반응 시 투입하는 황 중량비를 80, 85 및 90 wt%로 하여 황과 시트랄을 둥근바닥 플라스크에 넣고 질소분위기 하에서 가열·교반(160 ℃, 2시간)하였다. 가열이 진행됨에 따라 용융된 황이 노란색을 띄는데 점차 라디칼이 생성되면서 오렌지색으로 변한다.21 이 라디칼은 시트랄에 존재하는 C=C 결합과 반응하여 C-S 공유결합이 형성되며,21 다양한 길이의 황이 소량의 시트랄에 의해 가교된 높은 황 함유량의 고분자가 형성된다(Figure 1). 반응 후, 얻어진 공중합체는 양극 활 물질로의 응용을 위해, 전해질 용매인 DOL: DME(1:1 v/v)로 수 차례 워싱 후 45 ℃의 진공 오븐에서 24시간 건조하여 최종 생성물을 수득하였다.
원소 분석을 통해, 합성한 SCP의 황 함유량을 분석한 결과(Table 1), 반응 시 투입한 황 함유량이 80, 85, 90 wt%일 때, 각각 77.9, 88.8, 92.7 wt%의 최종 황 함유량을 갖는 공중합체가 얻어졌음을 확인했다. 원소분석 결과로부터 시트랄 대비 평균 황 원소 개수, 그리고 이것으로부터 평균 S-S 결합 수(황 랭크)를 계산한 결과, 공중합체 내 황 함유량이 78-93 wt%로 증가함에 따라, 평균 S-S 결합 수가 3.7에서 13.3까지 급격하게 증가함을 확인할 수 있었다. 일반적으로, S-S 결합은 8 이상이 될 경우 속도론적으로 형성이 불리하며 열역학적으로도 불안정해지기 때문에,22 SCP89, 93의 경우 공중합체 내 미반응 원소 황이 존재할 것으로 예측될 수 있다.
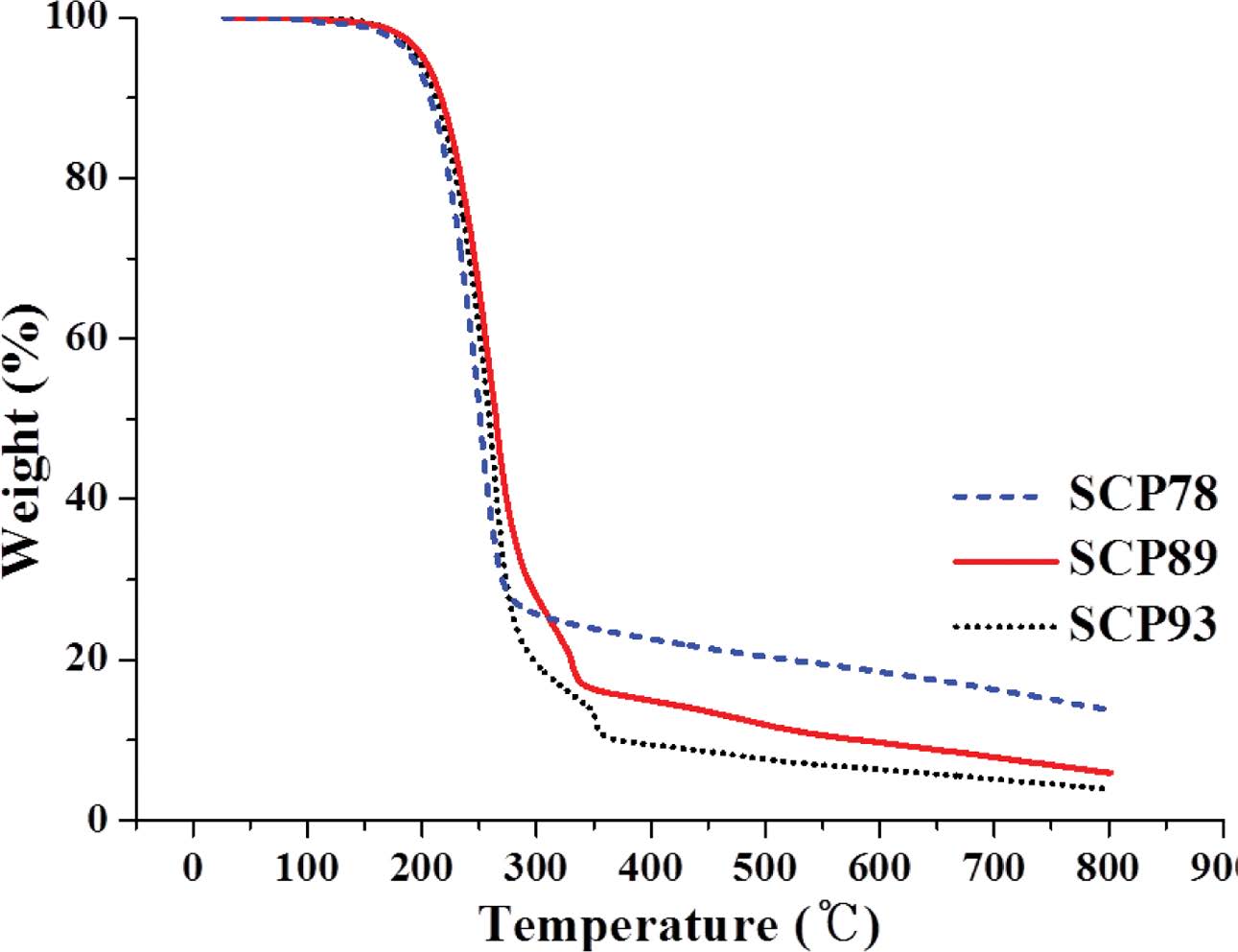
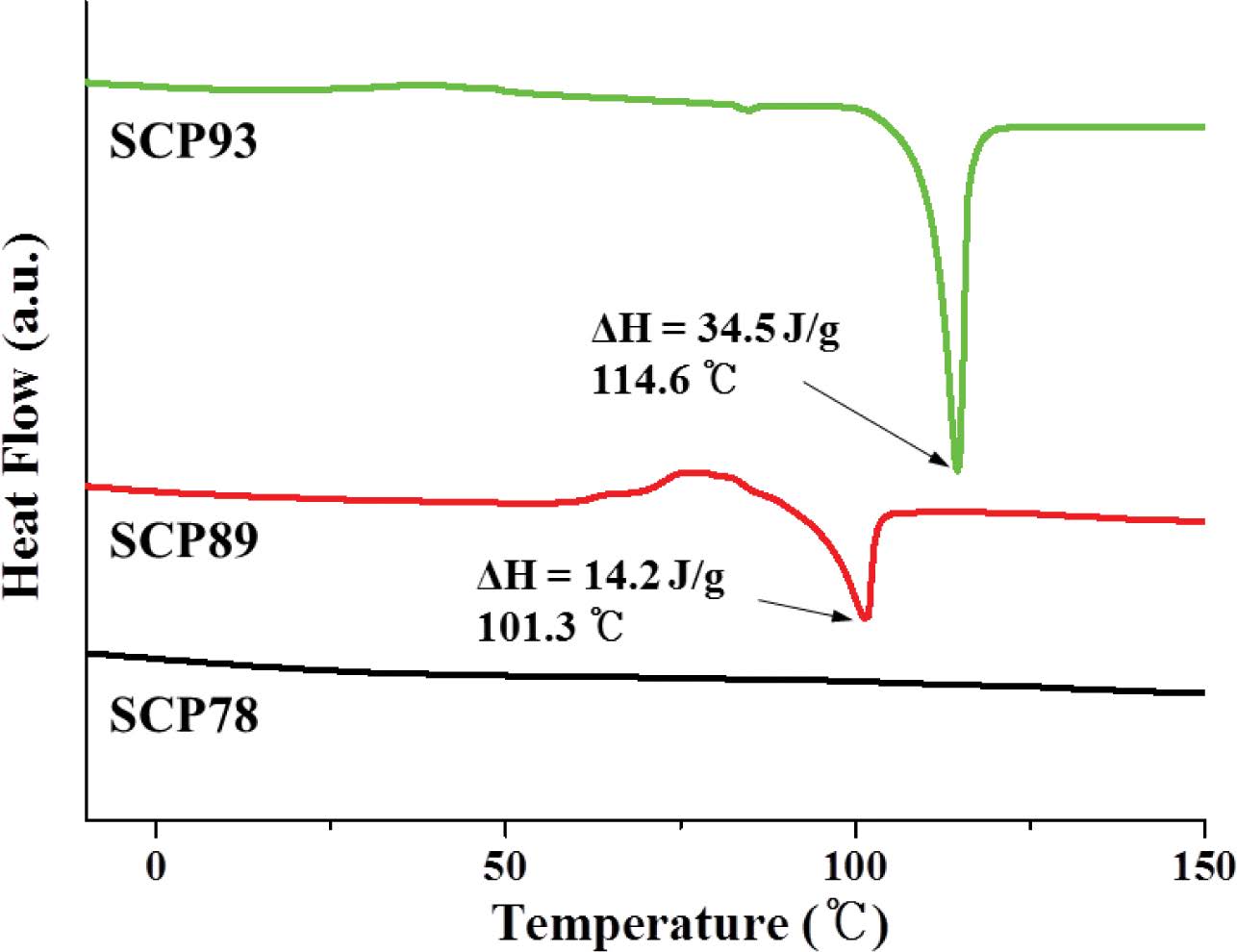
TGA 분석 결과(Figure 2), 상기 SCP 모두 200 ℃ 부근에서 공중합체 내 황 결합의 열분해가 시작되며 300-350 ℃ 부근에서 분해가 멈추는데 이 때의 잔량이 원소분석을 통해 확인한 황 함유량과 일치한다. 이는 EA 분석결과에 나타난 S함량과 TGA에서 나타난 S함량이 일치한다. 공중합체의 DSC는 분해 및 부반응(159 ℃이상에서 황의 라디칼 생성)을 피하기 위해 질소 분위기 하에 150 ℃까지만 가열하였고 냉각 후 두 번째 가열그래프를 분석에 이용했다(Figure 3). SCP93은 114.6 ℃에서 용융점(Tm, ΔH = 34.5 J/g)을 나타냈고, SCP89는 101.3 ℃에서 약한 Tm(ΔH = 14.2 J/g)을 나타냈다. 반면, 황 함유량 78 wt%인 SCP78은 Tm이 확인되지 않았다. 앞서 원소 분석을 통해 예상한 것과 같이 89 wt% 이상으로 황 함유량이 높은 공중합체의 경우 사슬 내에 미반응 원소 황이 함께 존재하는 것을 알 수 있다.23 특히 SCP89 에서는 95 ℃ 이상에서 관찰되는 전형적인 α-sulfur에서 β-sulfur로의 결정구조 전이를 흡열피크로 확인할 수 있었다.
합성한 SCP는 황 함유량의 높을수록 클로로포름, 톨루엔, 전해질 용매(DOL:DME) 등 유기 용매에 낮은 용해도를 갖는 것을 확인했다. 역가황 반응 후, 리튬-황 전지 적용을 위해 전해질 용액으로 수 차례 세척했을 때, SCP89, 93의 경우 낮은 용해도로 인해 79% 이상의 수득률을 얻었으나, 황 함유량이 작은 SCP78의 경우, 높은 용해도로 인해 68.6%의 낮은 수득률을 보였다. SCP93의 경우 전해질 용매에 10%, SCP89의 경우 21%, SCP78의 경우 31.4%의 용해도를 나타냈다. 전해질 용매에 용해되는 물질은 유기용매에 대한 용해도가 높은 시트랄 과량의 분자량 및 가교도가 낮은 고분자로 예상된다. 따라서 본 논문에서는 전해질에 대한 용해도가 제어된 60% 이상의 수득률을 갖는 황 함유율 78 wt% 이상의 SCP를 리튬-황 전지 양극 활 물질로 사용했다.
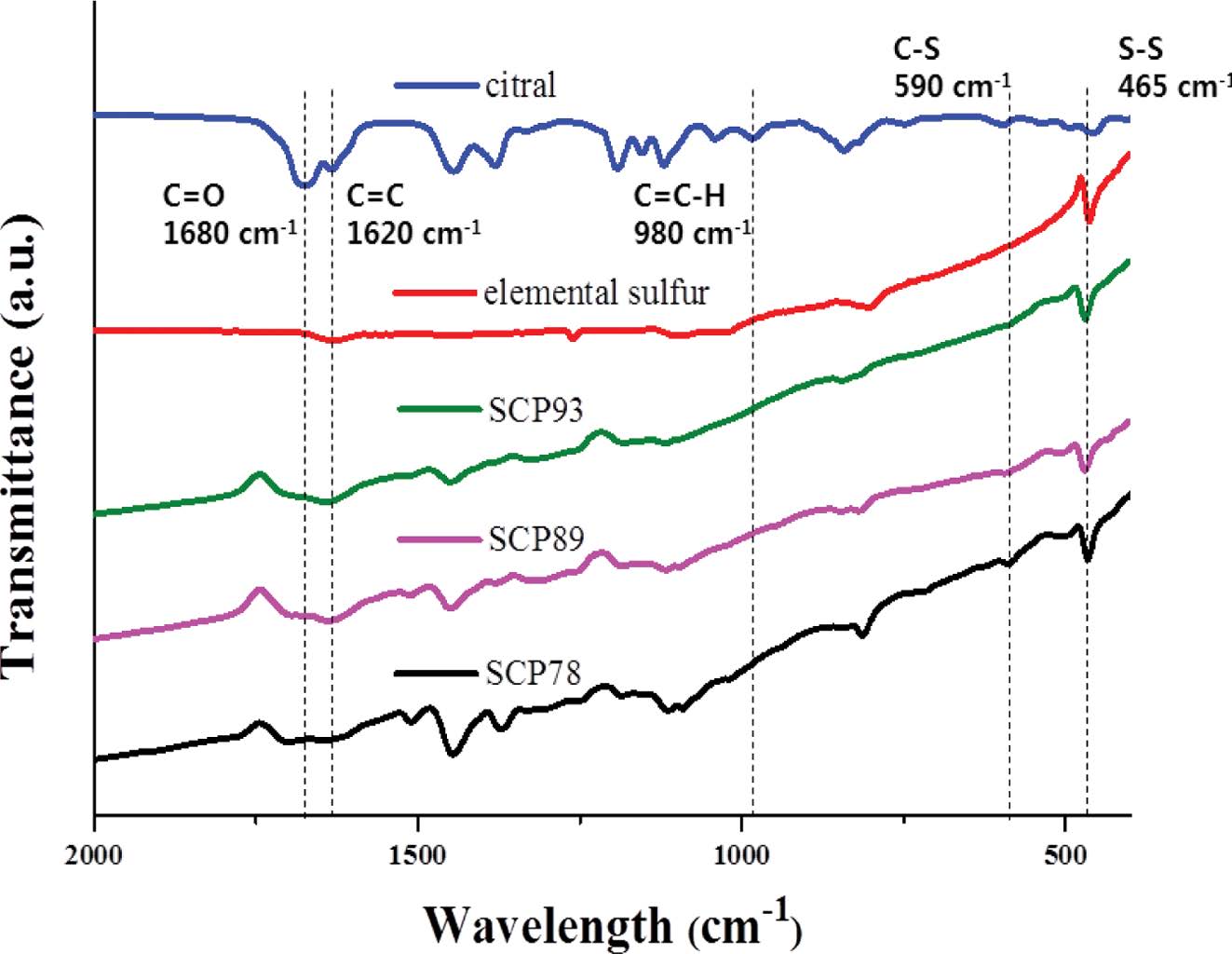
역가황 반응을 통해 황-시트랄 사이의 공유결합이 형성되었음을 확인하기 위해, 원소 황, 시트랄, SCP의 FTIR 분석을 수행하였다(Figure 4). SCP89, 93 뿐만 아니라, 미반응 황이 존재하지 않는 SCP78의 경우에도, 465 cm-1에서 S-S 결합 피크가 선명하게 관찰되므로, SCP내 폴리설파이드가 존재함을 확인할 수 있다.24 반면, 590 cm-1에서 관찰되는 C-S 결합 피크는 SCP78에서 확연하게 나타나고 시트랄에서 나타나는 C=C 결합(1620 cm-1) 피크가 역가황 반응이 진행됨에 따라 관찰되지 않음을 통해 원소 황과 시트랄이 역가황 반응에 의해 공유결합 네트워크를 형성했음을 확인할 수 있다.25,26 C=O 결합에 해당하는 1680 cm-1 피크의 세기가 SCP 시리즈에서 줄어드는 것은 역가황 반응 시 황 라디칼이 카보닐과 반응하여 소모되는 것으로 추정된다.27
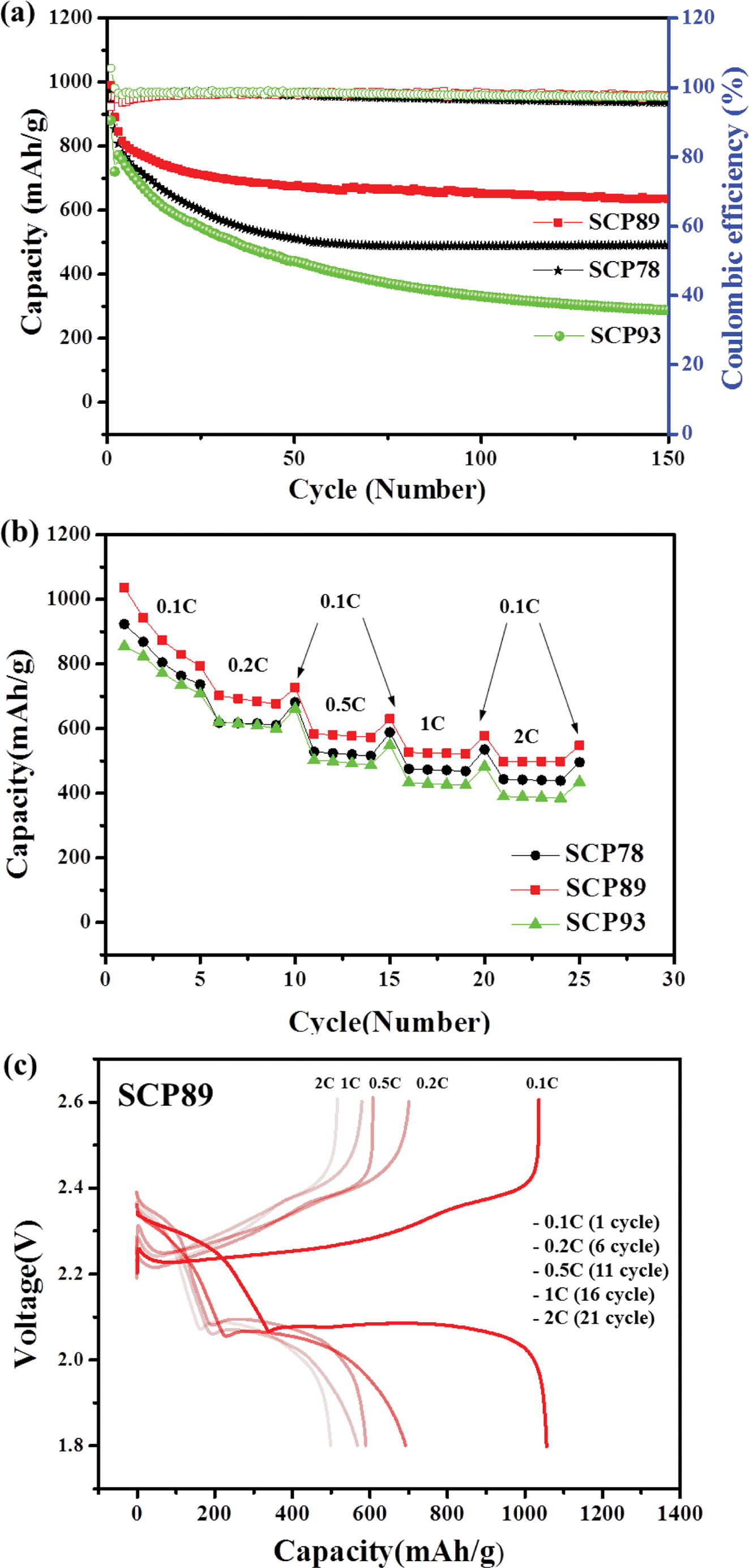
리튬-황 전지 특성 평가. 전지 특성 평가를 위해 SCP를 양극 활 물질로 사용하여 전극을 제조하였고, 이를 이용하여 리튬/전해질/SCP 전지(CR2032 코인셀)를 조립하였다. 황 함량이 다른 세 가지 SCP78, 89, 93이 적용된 리튬-황 전지 특성을 평가하였다(Figure 5). 먼저, 0.1C 충·방전 속도로 첫 사이클 후, 0.5C로 충·방전을 진행했을 때, SCP89, 93 전극을 포함하는 전지에서 초기 용량 900 mAh/g 이상, 쿨롱효율 95%이상의 우수한 성능이 관찰되었다. 가장 우수한 성능을 보인 것은 SCP89가 적용된 전지로 0.5C에서 991 mAh/g으로 높은 초기 용량을 보였으며 사이클 당 용량 감소 값은 초기 solid electrolyte interphase(SEI) 형성 사이클 후 3-150 사이클까지 사이클당 0.16%였고 97.5%의 높은 쿨롱효율을 보였다. 결과적으로 150 사이클 후, SCP89가 적용된 전지는 635 mAh/g의 높은 용량을 유지했다. SCP93이 적용된 전지의 경우, 초기 성능은 SCP89가 적용된 전지와 유사하나, 사이클이 진행됨에 따라 급격한 용량 감소를 보이며 150 사이클 후 결과적으로 가장 낮은 용량을 나타냈다. 충·방전 속도에 따른 전지 특성 평가 결과, 세가지 전극 소재 모두 충·방전 속도가 증가함에 따라 점차 용량이 감소하는 거동을 보였으며, SCP89가 적용된 전지가 가장 높은 용량 유지율을 나타냈다(Figure 5(b)). Figure 5(c)는 SCP89의 충⋅방전 속도에 따른 프로파일을 나타내는데, 기존에 보고된 역가황 고분자 전극들과 같이 부반응없이 안정적으로 충∙방전이 진행됨을 확인할 수 있다.16-19
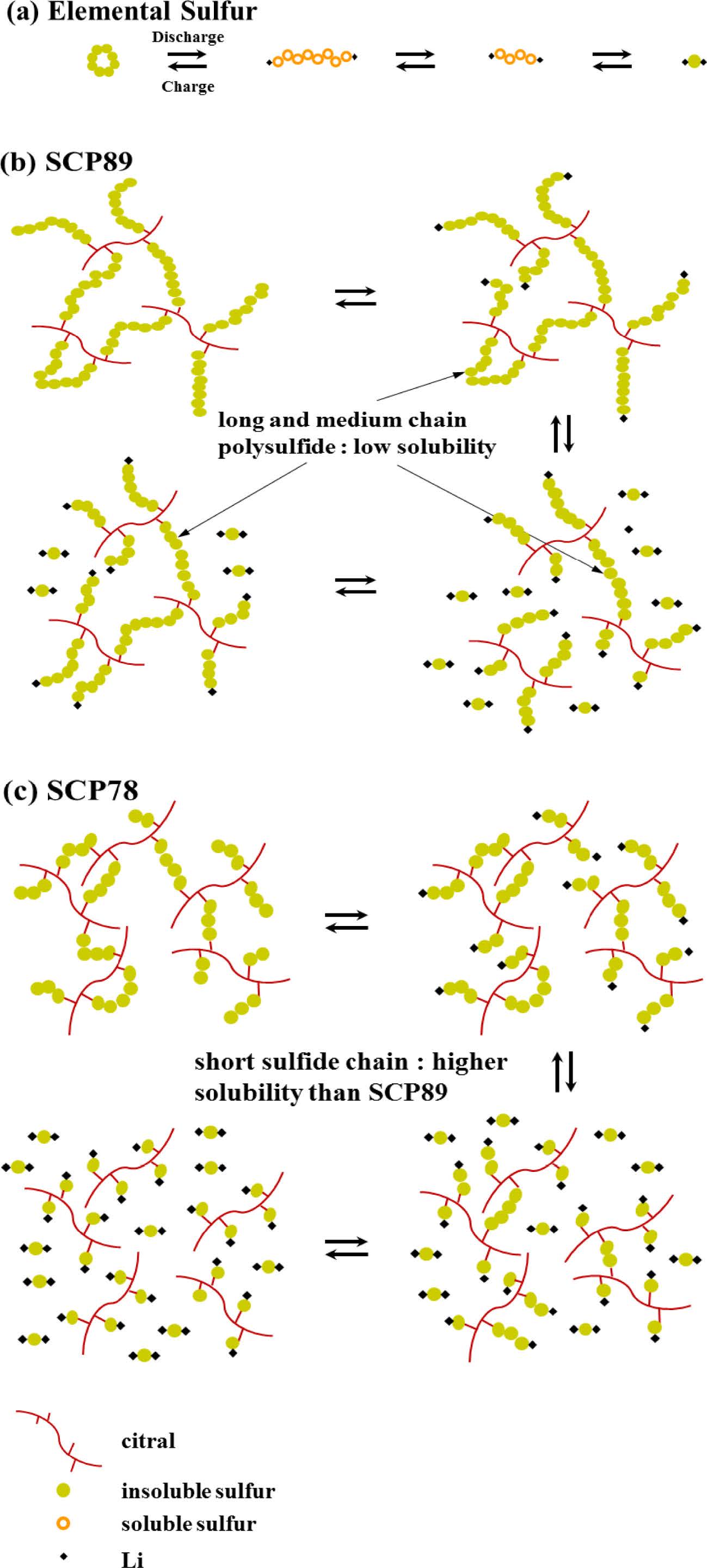
역가황 방법으로 생성된 SCP는 Lee 연구팀이 밝힌 것과 같이 방전 시 식 (2), (3)의 과정을 따르지 않고 다음과 같은 반응 메커니즘을 따른다(Figure 6).20
고전압(2.3 - 2.4 V)에서,
저전압(1.9 - 2.1 V)에서,

과정으로 환원되는데 식 (4), (5)과정에 생성되는 unit의 길이가 길수록 전해질에 낮은 용해도를 갖는다. 낮은 용해도 효과뿐만 아니라 C-S 결합 또한 폴리설파이드 확산을 저하시키기 때문에 전지의 사이클 안정성을 높일 수 있다. Figure 6(a)와 같이 일반적인 원소 황으로 구성된 양극은 식(2), (3)의 과정을 거치면서 전해질에 쉽게 용해되는 폴리설파이드가 생성된다. 미반응 원소 황을 다량 포함하고 있는 SCP93의 경우, 이와 같은 메커니즘을 따르기 때문에 다량의 폴리설파이드 용출이 발생하고 이에 따라 전지 용량이 급격하게 감소하게 된다. 반면, 가장 우수한 용량 유지율을 보인 SCP89는 미반응 황이 일부 포함되어 있긴 하지만 대부분이 긴 황 사슬로 구성된 공중합체이기 때문에 식 (4), (5)과정을 통해 생성되는 고분자 사슬 C(시트랄)(or Li)-Sx-Li의 길이가 길거나 중간 길이가 많이 생성되어 전해질에 대한 용해도가 가장 낮다 (Figure 6(b)). SCP78의 경우, 미반응 황이 전혀 존재하지 않지만, SCP89에 비해 초기 황 사슬이 짧기 때문에 방전 반응시 전해질에 쉽게 용해되는 짧은 사슬의 C(시트랄)(or Li)-Sx-Li가 다량 생성되어 전지 특성 평가 시 용량 유지율이 낮게 관찰된다(Figure 6(c)).
|
Figure 1 Inverse vulcanization of elemental sulfur with citral. |
|
Figure 2 Thermogravimetric analysis of SCPs under N2 flow at a heating rate of 10 ℃ min-1. |
|
Figure 3 Second running DSC thermograms of SCPs obtained at a rate of 10 ℃ min-1. |
|
Figure 4 FTIR spectra of citral, elemental sulfur, and SCP78. |
|
Figure 5 Electrochemical performace of Li/electrolyte/SCP cells cycled at 25 ℃. (a) Long-term cycling performance of the cells containing SCPs at 0.5C (1st cycle at 0.1C); (b) rate capacity of the cells with SCPs at various C-rates from 0.1 to 2C; (c) charge/discharge voltage profiles of the cell with SCP89 corresponding to figure (b). |
|
Figure 6 Schematic illustration of the electrochemical reaction mechanisms of (a) elemental sulfur; (b) SCP89; (c) SCP78 during the discharge/charge cycle. |
|
Table 1 Elemental Analysis Results of Sulfur-citral Copolymers and the Calculated Number of Sulfur Atoms per One Citral Molecule |
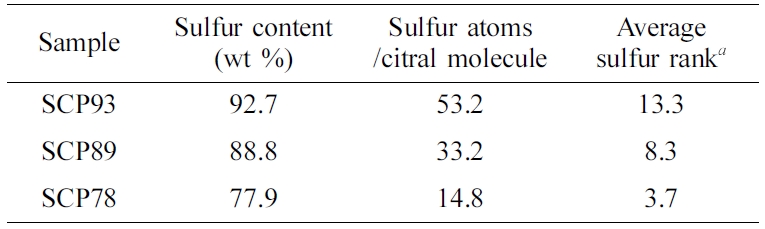
aNumber of S-S bonds. |
원소 황을 재생가능한 원자재인 레몬 유래 시트랄을 이용하여 역가황함으로써, 리튬-황 전지 사이클 안정성 향상에 기여할 높은 황 함유량의 황-시트랄 공중합체 양극 활 물질을 개발하였다. 89 wt%의 황 함유량을 갖는 공중합체(SCP89)는 전해액에 대한 용해도가 낮은 긴 고분자 사슬로 이루어져 있으며, 미반응 원소 황 함량이 적어 전지 적용 시 폴리설파이드 용출이 효과적으로 억제되었다. SCP89가 적용된 리튬-황 전지는 초기 용량 991 mAh/g(at 0.1C), 150 사이클(at 0.5C) 후 용량 유지율 64%, 높은 쿨롱 효율을 갖는 우수한 성능을 보였다. 따라서 본 연구는 천연물 유래 물질을 활용하여 공중합체를 합성하고 및 리튬-황 전지의 전극 소재로의 응용 가능성을 확인하였다는데 의미가 있다.
- 1. T. B. Rauchfuss, Nat. Chem., 3, 648 (2011).
- 2. R. J. Angelici, Acc. Chem. Res., 21, 387 (1988).
-

- 3. X. Ji and L. F. Nazar, J. Mater. Chem., 20, 9821 (2010).
-

- 4. A. Manthiram, Y. Fu, S. Chung, C. Zu, and Y. Su, Chem. Rev., 114, 11751 (2014).
-

- 5. X. Liang, C. Hart, Q. Pang, A. Garsuch, T. Weiss, and L. F. Nazar, Nat. Commun., 6, 5682 (2015).
-

- 6. D.-W. Wang, Q. Zeng, G. Zhou, L. Yin, F. Li, H.-M. Cheng, I. R. Gentle, and G. Q. M. Lu, J. Mater. Chem., A, 1, 9382 (2013).
-

- 7. X. Ji, K. T. Lee, and L. F. Nazar, Nat. Mater., 8, 500 (2009).
- 8. S. Evers and L. F. Nazar, Acc. Chem. Res., 46, 1135 (2013).
-

- 9. Y. Yang, G. Zheng, and Y. Cui, Chem. Soc. Rev., 42, 3018 (2013).
-

- 10. N. Jayaprakash, J. Shen, S. S. Moganty, A. Corona, and L. A. Archer, Angew. Chem., 50, 5904 (2011).
-

- 11. R. Raccichini, A. Varzi, S. Passerini, and B. Scrosati, Nat. Mater., 14, 271 (2014).
- 12. L. Zhang, L. Ji, P.-A. Glans, Y. Zhang, J. Zhu, and J. Guo, Phys. Chem. Chem. Phys., 14, 13670 (2012).
-

- 13. J. Zheng, J. Tian, D. Wu, M. Gu, W. Xu, C. Wang, F. Gao, M. H. Engelhard, J.-G. Zhang, J. Liu, and J. Xiao, Nano Lett., 14, 2345 (2014).
-

- 14. Z. Zhao, S. Wang, R. Liang, Z. Li, Z. Shi, and G. Chen, J. Mater. Chem. A, 2, 13509 (2014).
-

- 15. J. Zhou, R. Li, X. Fan, Y. Chen, R. Han, W. Li, J. Zheng, B. Wang, and X. Li, Energy Environ. Sci., 7, 2715 (2014).
-

- 16. A. G. Simmonds, J. J. Griebel, J. Park, K. R. Kim, W. J. Chung, V. P. Oleshko, J. Kim, E. T. Kim, R. S. Glass, C. L. Soles, Y.-E. Sung, K. Char, and J. Pyun, ACS Macro Lett., 3, 229 (2014).
-

- 17. S. H. Je, T. H. Hwang, S. N. Talapaneni, O. Buyukcakir, H. J. Kim, J.-S. Yu, S.-G. Woo, M. C. Jang, B. K. Son, A. Coskun, and J. W. Choi, ACS Energy Lett., 1, 566 (2016).
-

- 18. H. Kim, J. Lee, H. Ahn, O. Kim, and M. J. Park, Nat. Commun., 6, 7278 (2015).
- 19. Y. Zhang, J. J. Griebel, P. T. Dirlam, N. A. Nguyen, R. S. Glass, M. E. Mackay, K. Char, and J. Pyun, J. Polym. Sci., Part A: Polym. Chem., 55, 107 (2017).
-

- 20. A. Hoefling, D. T. Nguyen, P. Partovi-Azar, D. Sebastiani, P. Theato, S.-W. Song, and Y. J. Lee, Chem. Mater., 30, 2915 (2018).
-

- 21. W. J. Chung, J. J. Griebel, E. T. Kim, H. Yoon, A. G. Simmonds, H. J. Ji, P. T. Dirlam, R. S. Glass, J. J. Wie, N. A. Nguyen, B. W. Guralnick, J. Park, Á. Somogyi, P. Theato, M. E. Mackay, Y.-E. Sung, K. Char, and J. Pyun, Nat. Chem., 5, 518 (2013).
- 22. B. Meyer, Chem. Rev., 76, 367 (1976).
-

- 23. Z. Sun, M. Xiao, S. Wang, D. Han, S. Song, G. Chen, and Y. Meng, J. Mater. Chem. A, 2, 9280 (2014).
-

- 24. I. Gomez, D. Mecerreyes, J. A. Blazquez, O. Leonet, H. B. Youcef, C. Li, J. L. Gómez-Cámer, O. Bondarchuk, and L. Rodriguez-Martinez, J. Power Sources, 329, 72 (2016).
-

- 25. A. Benedetii, A. C. Fabretti, and G. C. Franchini, Polyhedron, 4, 2059 (1985).
-

- 26. S. Shukla, A. Ghosh, U. K. Sen, P. K. Roy, S. Mitra, and B. Lochab, ChemistrySelect, 1, 594 (2016).
-

- 27. A. Clerici and O. Porta, J. Org. Chem., 54, 3872 (1989).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(2): 282-288
Published online Mar 25, 2019
- 10.7317/pk.2019.43.2.282
- Received on Nov 29, 2018
- Revised on Dec 20, 2018
- Accepted on Dec 20, 2018
 Services
Services
Shared
 Correspondence to
Correspondence to
- Dong-Gyun Kim* , and Yong Seok Kim*,**
-
*Advanced Materials Division, Korea Research Institute of Chemical Technology, 141 Gajeong-ro, Yuseong-gu, Daejeon 34114, Korea
**Chemical Convergence Materials and Processes, University of Science and Technology, 217 Gajeong-ro, Yuseong-gu, Daejeon 34114, Korea - E-mail: dgkim@krict.re.kr, yongskim@krict.re.kr
- ORCID:
0000-0003-0384-0067, 0000-0001-6342-9179









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.