- Fabrication of Microneedles Array Combining Biodegradable Hyaluronic Acid and Herbal Medicine Lonicera Flos
Department of Emergency Medicine, Kangbuk Samsung Hospital, Sungkyunkwan University School of Medicine, Seoul 03181, Korea
*Department of Pharmaceutical Science and Engineering, Seowon University, Chungju 28674, Korea- 생분해성 히알루론산과 한약소재 금은화를 융합한 마이크로 니들 어레이의 제조
성균관대학교 의과대학 강북삼성병원 응급의학과, *서원대학교 BIT융합대학 제약식품공학부
Skin has been exposed to the physical and chemical damages caused by external contact. The occurrence of scarring can cause not only cosmetic problems but also health problems. In general, hyaluronic acid is known to construct human exfoliated cells to protect skin from skin damage and the regeneration of exfoliation through external stress factors, and is known to be effective in healing wounds as well as in moisture content. In this study, we fabricated hyaluronic acid microneedles (HaMNs) array containing Lonicera flos (Lfs) for transdermal delivery system (TDDS). And then, the shapes of HaMNs were imaged by scanning electron microscopy. Skin permeability and cell viability were measured to confirm mechanical strength and cytotoxicity, respectively. Also, the stability of the Lfs component was confirmed through the Folin–Ciocalteu method. HaMNs containing lonicera confirmed to be well fabricated for TDDS and did not show significant cytotoxicity. These results suggest that HaMNs represent a promising technology to deliver active compounds into the skin.
피부는 외부와 접촉하고 있어 물리적 화학적 영향으로 인한 크고 작은 손상에 노출되고 있으며, 흉터의 발생은 미용상 문제뿐만 아니라 건강상의 문제를 유발시킬 수 있다. 이 연구에서는 외부적 스트레스 요인으로 인한 피부의 손상 및 각질의 생성으로부터 피부를 보호하고 피부 트러블을 개선하기 위한 경피 제형을 제조하기 위해 인체 각질세포를 구성하고 수분의 함유뿐만 아니라 상처의 회복에도 효과가 있는 것으로 알려진 생분해성 히알루론산(hyaluronic acid, Ha)과 염증 개선효과가 있는 것으로 알려진 한의약 소재 금은화(Lonicera flos, Lfs) 성분을 결합한 히알루론산 마이크로 니들(HaMNs) 어레이를 제작하였다. 전자주사현미경(SEM)을 통해 HaMNs 어레이의 형상을 확인하였고, HaMNs의 기계적 특성을 확인하기 위해 피부 투과성을 측정하였다. 또한 Lfs를 융합한 HaMNs의 세포독성을 MTT-assay법을 이용하여 확인하였고, HaMNs 어레이 제조후 Lfs 성분의 안정성을 폴리페놀 함량측정법(Folin–Ciocalteu method)을 통해 확인하였다. Ha과 Lfs 성분이 융합된 HaMNs 어레이가 잘 제작되었으며, 세포독성도 확인되지 않았다. 이러한 결과들을 통해 HaMNs는 피부로 유효성분을 전달할 수 있는 유용한 제형 기술로 판단된다.
In general, hyaluronic acid is known to construct human exfoliated cells to protect skin from skin damage and the regeneration of exfoliation through external stress factors, and is known to be effective in healing wounds as well as in moisture content. In this study, we fabricated hyaluronic acid microneedles (HaMNs) array containing Lonicera flos (Lfs) for transdermal delivery system.
Keywords: microneedles, lonicera, herbal medicine, hyaluronic acid
Ha와 Lfs의 효능과 효과를 동시에 피부를 통해 전달하기 위해서는 각질층의 한계를 극복할 수 있는 새로운 형태의 전달 제형으로 설계되어야 한다. 이 연구에서는 융용성 마이크로 니들로 설계하여 염증개선 효과가 있는 것으로 알려진 한의약 소재 Lfs 성분을 포함하는 생분해성 히알루론산 마이크로 니들(HaMNs, hyaluronic acid microneedles) 어레이를 제작하고, HaMNs의 특성 분석 및 Lfs의 제형 안정성을 확인하였다.
또한 Ha와 융합한 활성물질로 인동덩굴(Lonicera japonica)의 미개화한 꽃봉오리 Lfs를 사용하였으며, 동 식물의 덩굴줄기 또한 인동등으로 불리며 한약재로 각각 사용되어 왔다. 인동등에 관한 약리적 효과에 대해서 항염증, 진통작용, glucose oxidase로 인한 산화 스트레스에 대한 보호효과, 피부와 관련된 효과로는 인동덩굴에서 분리한 sweroside의 멜라닌 생성 억제, 피부 감염 진균에 대한 항진균효과 및 보습효과 등이 있는 것으로 보고되었다.13-15 또한 전통적으로 인체의 외부와 내부를 막론하고 항염효과를 목적으로 사용되어온 기록이 각종 기성한의서에도 수록되어 있으며, 오늘날에도 식품의약품공용원료로 부작용이 적고 유의한 효능효과를 담보할 수 있는 안전한 소재로써 Lfs와 Ha 마이크로 니들을 접목하고 그에 대한 유효성과 안정성을 확인하고자 하였다.16,17
이 연구에서는 용융성 마이크로 니들 제형으로 설계하여 피부 투과 시 수분에 의해 MNs이 용해될 수 있도록 생분해성 히알루론산(hyaluronic acid, Ha)과 한약 성분인 금은화(Lonicera flos, Lfs)를 융합하여 제조하였다. Ha는 포유류의 다양한 결합 조직에서 발견되는 산성 다당류로 세포외기질의 성분인 glycosaminoglycan(GAG)의 일종으며 인체 피부조직에서 세포 외부 기질에 주로 분포하는 생체 구성 물질로 수분과의 결합력이 탁월하여 피부의 수분유지에 매우 중요한 역할을 하는 것으로 알려져 있다. 피부의 보습과 관련하여 중요한 역할을 하는 Ha는 노화가 진행됨에 따라 자연스럽게 감소되며, 자외선이나 건조한 공기 등에 지속적으로 노출될 경우에도 감소되는 경향을 보이는 것이 일반적이다. 이와 같이 다양한 원인으로 인한 피부조직 내 Ha의 감소는 피부의 탄력 저하를 유발하고, 그로 인한 주름 유발 및 거친 피부를 형성하게 하는 중요한 요인으로 작용하게 된다. 따라서 피부의 노화 및 주름의 생성을 억제할 목적으로 Ha의 형성 또는 감소를 억제하는 연구가 다양하게 시도되고 있다.7-12
MNs의 종류에는 약물의 사용방법에 따라 크게 4종류로 분류할 수 있다. 첫째로 약물을 MNs 자체에 함유시켜 각질층을 뚫고 약물을 전달하며 MNs 물질 모두 녹을 수 있어 니들의 잔여물이 남지 않아 안전하지만 약물 전달 속도가 느려 오랫동안 적용하고 있어야 하는 단점을 가지고 있으나 융용성 고분자의 분자량에 의한 녹는 속도 조절이 가능하여 서방형 제형으로써 약물 전달이 가능한 용융성 마이크로 니들(dissolving microneedles), 두번째로 피부표면에 미세 구멍을 생성하는 피부 전처리(skin pretreatment)용으로 사용하여, 피부에 미세 구멍이 생성되면 이곳에 약물 패치를 얹혀 지속적으로 약물을 전달시키는 방식의 고체 마이크로 니들(solid microneedles), 세번째로 수용성 기질을 가지고 있는 약물을 니들 표면에 코팅을 한 뒤, 빠르게 약물을 피부 내부로 전달시키고 니들을 제거하는 형식으로 이뤄진 코팅 마이크로 니들(coated microneedles), 네번째로 할로우 마이크로 니들(hollow microneedles)은 니들의 개수가 하나인 단일형과 여러 개인 복합형이 있는데 니들의 길이가 수 mm 이하여서 기존 피하주사가 가지고 있는 단점인 고통을 최소화시킬 수 있는 장점이 있지만 배압(back pressure)이 높을 수 있어 흐름제어(flow control)가 정교해야 한다.3-6
피부는 외부 환경으로부터 인체를 보호하는 역할을 담당하며 피부에 접촉한 물질은 우수한 피부 장벽에 의해 체내로 침투하기는 매우 어렵다. 그러나 피부는 외부와 항상 접촉하고 있어 물리적 화학적 영향으로 인한 크고 작은 손상에 노출되고 있으며, 피부의 재생력의 한계와 노화로 인한 재생력의 감소로 인하여 흉터의 발생은 미용상 문제뿐만 아니라 건강상의 문제를 유발시킬 수 있다. 경구약물 전달 방식의 경우 위장 내의 pH, 장 내의 체류시간과 음식물, 장내 세균과 운동성에 의해 약물의 변화가 불가피하고 흡수율도 저하될 수 있다. 또한 위, 간, 소장 내에서 효소에 의해 분해가 되는 약물은 생체 이용률이 떨어지고 약물에 의한 위장관의 장애를 초래할 수 있다. 하지만, 피부를 통한 경피 약물 전달 시스템의 경우 소화기관에서 약물의 분해를 막을 수 있어서 경구약물 전달 방식의 단점을 보완할 수 있고 또한 직접 정맥으로 주사하여 약물을 전달하는 주사투여 방식을 이용한 다른 전달방법에 비해 쉽고 편하고 보다 안전하게 국소부위에 적절하게 직접적으로 작용하며 부작용이 미미하여 최근 약물전달시스템의 대안으로 인식되고 있다. 이렇게 경피로 약물을 전달하기 위해서는 피부 장벽인 각질층을 투과하여 적어도 표피까지 유효약물을 전달해야 한다. 그러나 각질층에 의한 낮은 흡수력에 의해 사용에 제한을 받고 있어 이러한 단점을 극복하기 위한 경피 약물 전달방식인 마이크로 니들(microneedles, MNs)은 한 번의 찌름으로 인하여 조직 내 원하는 부위에 유효약물의 전달이 가능하여 부작용에 의한 위험을 최소화할 수 있다. 이러한, MNs는 기존 경피형 제제 시스템의 문제점인 각질층에 의한 약물전달의 한계를 극복할 수 있는 새로운 형태의 전달 방식으로 각질층에 물리적으로 작은 구멍을 뚫어 그 통로를 이용하여 약물을 전달하는 방식이다.1-3
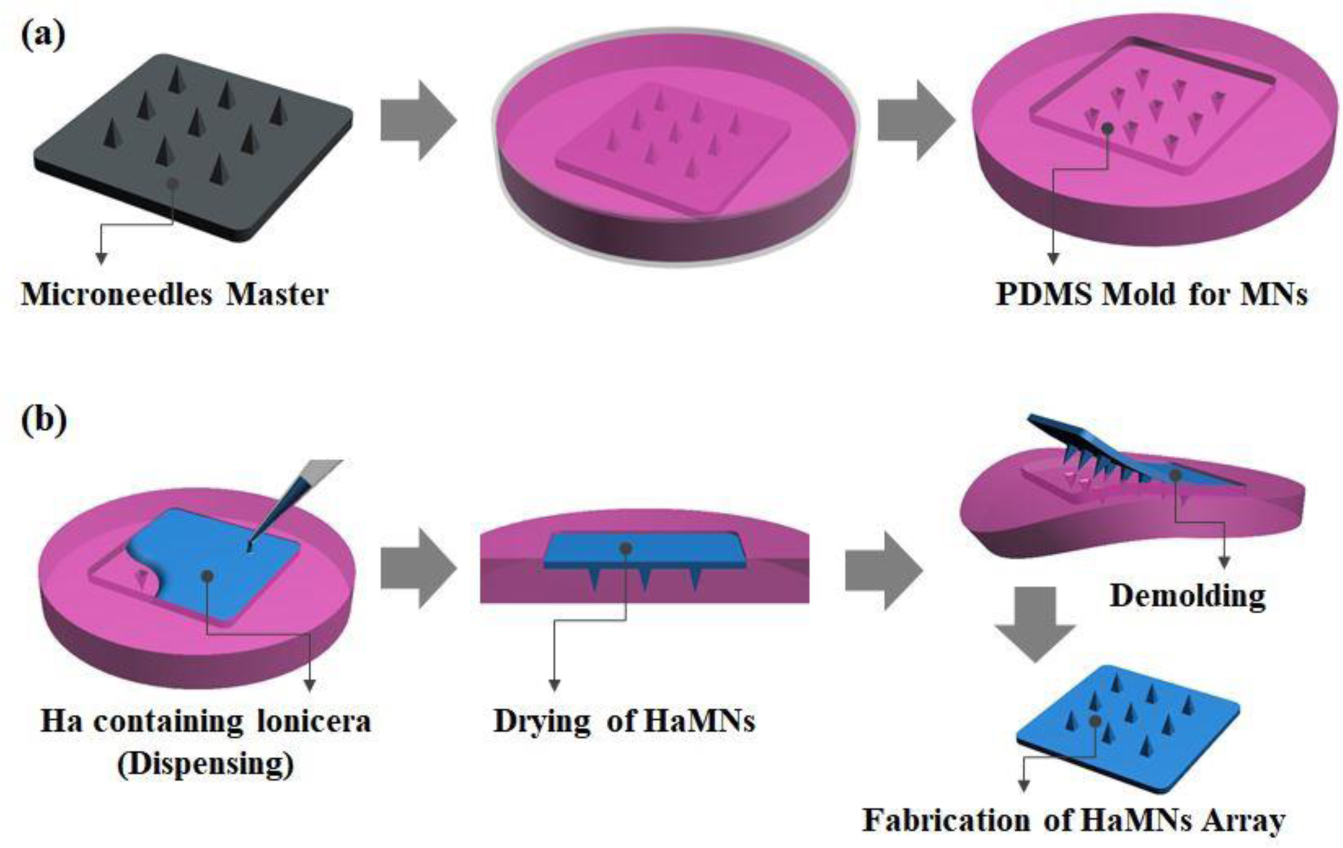
마스터 및 몰드 제작. MNs 탄성 몰드를 제작하기 위해 사각뿔 형상의 니들 원판(master, EHWA Diamond Ltd)을 너비 250 μm와 높이 250 μm의 Aspect Ratio 1 비율로 설계하여 제작하였고, 사각뿔 니들 원판(master)을 Φ90 페트리디쉬(petri dish)에 넣고 polydimethylsiloxane(PDMS) 탄성 몰드(mold)를 제작하기 위해 ELASTOSIL® RT 623 A와 ELASTOSIL® RT 623 B(Wacker chemicals Inc., Korea) 그리고 AK 35(C) 세가지 성분의 시약을 함량비에 따라 RT 623 A와 B의 성분 비율은 A:B=90:10으로 AK 35 C의 함량비를 A와 B의 전체 % 함량에 대하여 30% 함량비로 추가 첨가하여 용액을 제조하였다. RT 623 A와 B는 실리콘 고무 용액과 경화제이고 AK 35 C는 실리콘의 유연한 정도를 조절하는 오일 성분의 용액이다. Figure 1(a)에 나타내었듯이 니들 원판(master)을 Φ35 페트리디쉬에 고정시키고, 니들 원판이 잠길 때까지 제조된 PDMS 용액을 부운 후, 60 ℃의 오븐에서 4시간 이상의 고형화를 통해 제작을 진행한다. PDMS 고형화 이후 니들 원판에서 몰드를 이형하게 되면 유연한 탄성 몰드가 제작된다.
PDMS 몰드가 너무 hard하게 되면 이형 시 구부러짐 피로도(bending fatigue)에 의해 탄성 몰드가 손상될 수 있어 주의가 필요하다. 이전에 발표 논문에서 RT 623 A와 B의 성분 비율은 A:B=90:10으로 고정한 상태에서 AK 35 C의 함량비를 A와 B의 전체 % 함량에 대하여 5, 10, 15, 20, 30%의 함량비로 추가 첨가하여 AK 35(C)의 함량이 증가함으로써 유연제 역할을 통해 유연성이 증가하여 탄성율의 변화를 나타낸다는 결과를 기반으로 하여 MNs의 탄성 몰드를 제작하였다.1
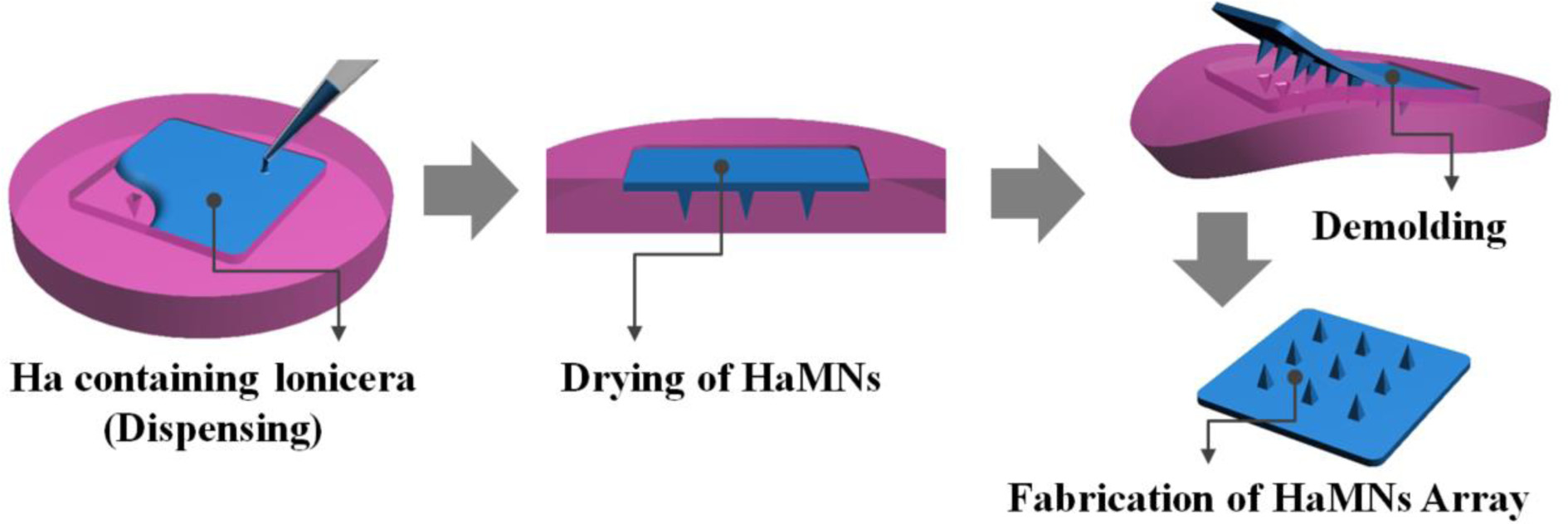
마이크로 니들(MNs) 어레이 제작. Lfs를 포함하는 Ha 용액을 제조하기 위해 Ha(bio sodium hyaluronate, SK Bioland, Korea) 3%(w/w)와 Lfs 0.9%(w/w) (Bonchomaru, Korea)를 3차 증류수에 용해시켜 준 후에 교반기(MTOPS MS280D, Korea)를 이용하여 20분간 교반하여 점성이 있는 Lfs를 포함한 Ha 용액을 제조하였다.
제조된 용액은 PDMS 몰드의 마이크로 니들 구조 안으로 도포될 수 있게 몰드 표면에 Ha 용액 2 g를 도포하고 spatula를 이용하여 골고루 접촉할 수 있도록 도포된 용액을 넓게 편 후, 원심분리기(2000 rpm/2 min, Labogene 1248R, Korea)를 이용하여 몰드에 완전히 채운다. 용액이 채워진 몰드를 35 ℃ 건조기(JSOF-150, JSR, Korea)에서 overnight 건조시킨 뒤 PDMS 몰드와 성형된 MNs 어레이를 분리하여 몰드의 형태와 동일한 형상을 가진 생분해성 Ha와 Lfs가 융합된 HaMNs를 제작하였다(Figure 1(b)). MNs의 제작은 이전에 발표된 논문을 참조하여 제작하였다.1,19
마이크로 니들(MNs) 어레이의 특성분석. 생분해성 Ha와 Lfs가 융합된 HaMNs의 특성 분석을 진행하였다. HaMNs의 형상을 분석하기 위해 전자주사현미경(Scanning Electron Microscopic, SEM, S-4800, Hitachi, Japan)을 이용하여 HaMNs의 이미지와 크기를 확인하였고, HaMNs를 체내에 전달하기 위하여 피부 각질층을 뚫고 삽입되어야 하기 때문에 본 연구에서는 HaMNs를 고분자 인조막(Strat-MTM Membrane, Millipore)과 Porcine back skin(Micropig® FCM, Medikinetics, Korea)에 대한 피부 투과도를 측정하여 기계적 강도를 확인하였다.
Lfs 성분 함유에 따른 HaMNs의 세포독성은 MTT-assay 방법인 HaCaT 세포를 통한 3-(4,5-dimethylthiazol-2-ly)-2,5-diphenyl tetrazolium bromide(MTT, SIGMA, St, Louis, MO, USA)를 이용하여 측정하였다. 세포독성을 확인하기 위해 이용한, HaCaT 세포는 dulbecco’s modified eagle medium (DMEM, Gibco)에서 10% fetal bovine serum(FBS, Gibco)과 1% penicillin-streptomycin(PS, Gibco)이 함유된 배지에서 배양하였으며 배양조건은 37 ℃, 5% CO2 조건이었다.
HaCaT 세포를 2×104/well 농도로 96 well plate에 seeding 한 후 24시간 동안 안정화시켰다. Serum-free media로 희석한 각각의 HaMNs(25, 50, 100, 200 μg/mL)를 처리하고 24시간 후에 배지를 제거하고 MTT(5 mg/mL) 20 μL를 넣고 세포 배양기(37 oC, 5% CO2)에서 2시간 배양하였다. MTT를 제거하고 dimethyl sulfoxide(DMSO) 100 μL를 넣었다. 교반기에서 결정이 용해된 것을 확인한 후에 540 nm에서 흡광도를 측정하였다. Vehicle control(0.1% DMSO)에 대한 흡광도와 비교하여 %로 생존율을 표시하였다.
HaMNs 제작 후에 Lfs 성분의 안정성을 확인하기 위해 폴리페놀 함량측정법을 사용하였다.
Lfs의 총 폴리페놀 함량은 Folin-Denis법으로 측정하였으며, 분쇄 후 적절한 배율로 희석한 Lfs 함유 HaMNs 시료 1 mL에 folin-reagent 1 mL를 가하여 3분간 실온에서 반응시킨 후 10% Na2CO3 1 mL를 혼합하고 1시간 실온에서 방치하여 725 nm에서 흡광도를 측정하였다. 검량을 위한 표준물질로는 tannic acid를 사용하였다.20-22
|
Figure 1 Schematic diagram for the fabrication process of micropatterned elastomeric PDMS mold (a); MNs arrays (b). |
용융성 HaMNs의 형상 분석. Figure 2에 SEM 측정을 통해 Lfs 성분을 포함하지 않은 HaMNs(a)와 Lfs 성분을 포함한 HaMNs(b)의 형상을 확인하였다. 또한 SEM 이미지 내의 삽인된 이미지는 각각의 HaMNs의 top 부분을 확대하여 형상 및 표면상태를 확인하였다. Figure 2에서 볼 수 있듯이 HaMNs 어레이가 우수한 sharpness를 가지고 형성되었으며 Lfs가 포함된 HaMNs의 표면 거칠기와 top sharpness의 R값(value)에서의 유의차를 확인하였다. 이는 Lfs 성분의 첨가로 인한 거칠기 변화 및 니들 성형시 발생하는 유동 효과로 인한 현상으로 추정될 수는 있으나, 유동 효과에 관한 연관성은 더 연구가 진행되어 해석될 필요가 있다.
Lfs를 포함한 HaMNs의 안정성 분석. HaMNs 성형 공정 시 용액의 flow effect 영향 또는 공정조건과 제조 환경조건이 Lfs 성분의 활성 안정성에 영향을 미치는지 평가하였다. 만약, Lfs 활성 안정성에 영향을 주어 활성이 떨어진다면 HaMNs가 피부 투과되어 경피 전달 흡수되어도 생체 이용률에 영향을 줄 수 있어 HaMNs 형성 후 Lfs 성분의 안정성은 중요한 부분이기 때문이다. 이러한 이유로 Lfs를 포함하는 HaMNs의 안정성 및 유효성을 판단하기 위한 방법으로 폴리페놀 함유량을 측정하였다.
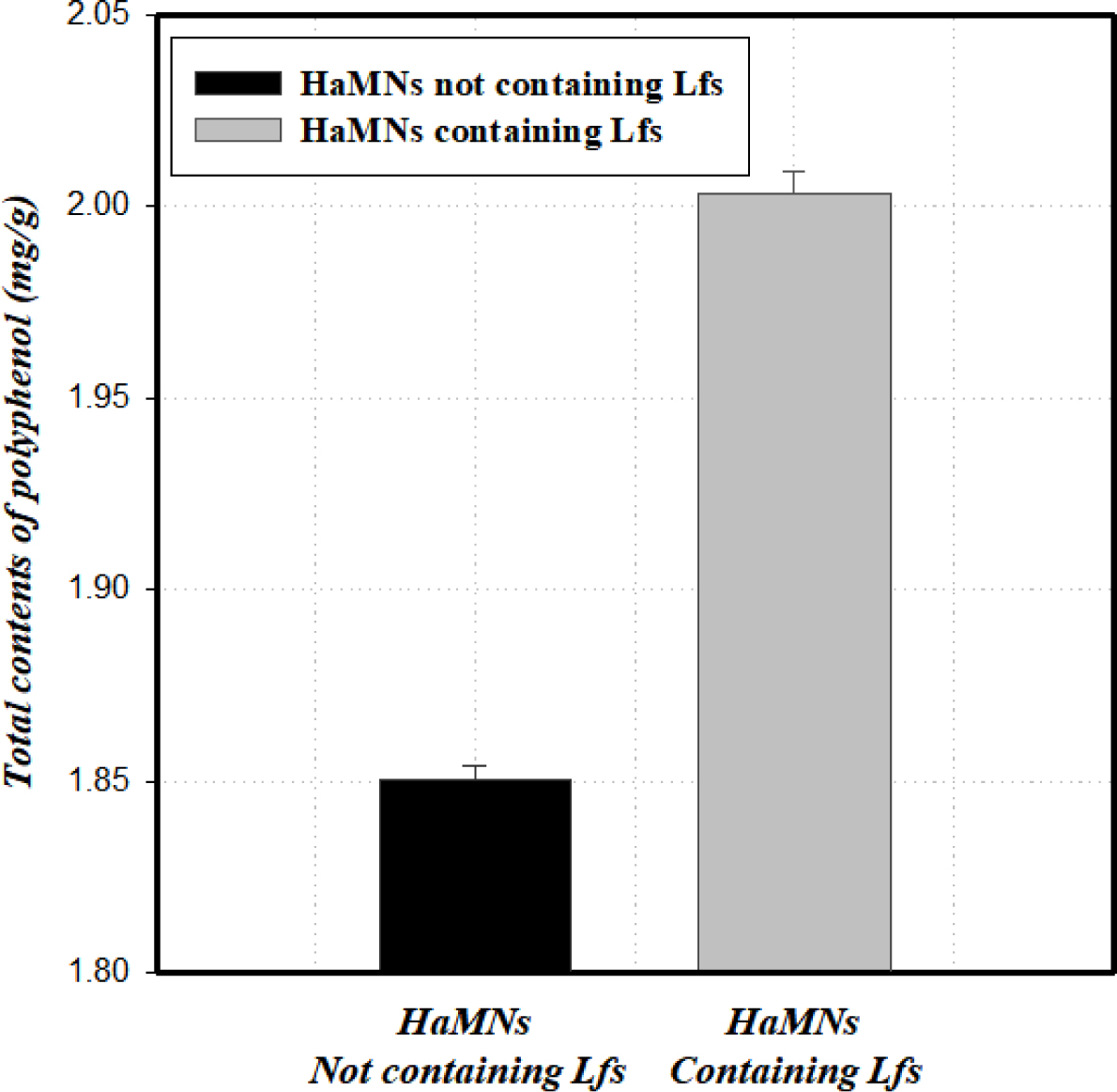
폴리페놀의 항산화 효과는 각종 염증관련 세포(비만세포, 혈소판, 호염기구 등)에서 히스타민을 비롯한 각종 염증매개불의 유리 억제작용과 아라키돈산 대사산물의 생성을 억제함으로써 발현되는 것으로 알려져 있다.18 폴리페놀은 복수의 페놀 단위를 함유하고 있는 화합물로 phenolic hydroxyl 기에 각종 효소 및 다양한 거대분자와 결합이 가능하고 특정 금속이온과의 결합을 형성함으로써 자유전자의 형성을 저해하는 특성을 가지고 있어 항산화 효과 및 염증 감소 등의 유효성을 예측하기 위한 지표로 사용되고 있다.22 Figure 3에서 볼 수 있듯이, 실험결과를 통하여 Lfs 추출물을 함유한 HaMNs에서 폴리페놀의 함량이 대조군과 비교하여 뚜렷하게 증가되는 것을 확인하였으며, 총 폴리페놀 함량은 Lfs 추출물을 함유한 HaMNs에서 2.003 TAE(tannic acid equivalent) mg/g으로 나타났으며, Lfs를 함유하지 않은 HaMNs(음성대조군)에서는 1.850 TAE mg/g으로 나타났다. Lfs가 함유되지 않은 HaMNs에서도 일부 흡광도 감소가 측정되었는데, 이는 Ha가 UV를 흡수할 수 있는 분자 구조인 D-glucuronic acid와 N-acetyl-D-glucosamine을 포함하고 있기 때문인 것으로 사료된다.23
이와 같은 결과를 통하여 HaMNs 내에 Lfs 추출물이 적절하게 함유되었을 뿐만 아니라 자유전자의 제거를 통한 항산화 및 염증 감소에 일정한 효과를 나타낼 수 있을 것이다.
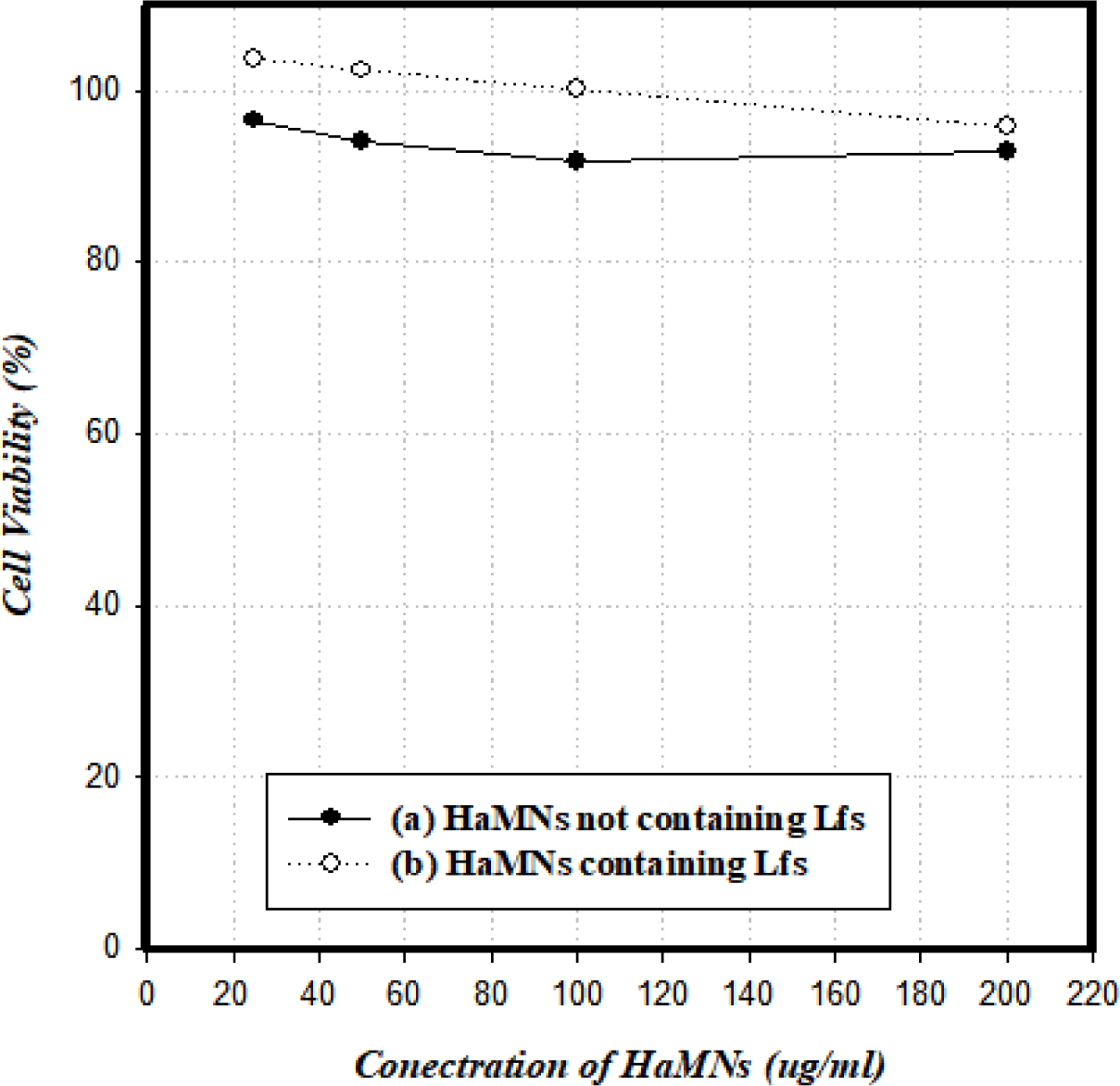
용융성 HaMNs의 세포독성 분석. Lfs 성분을 포함하지 않은 HaMNs와 Lfs 성분을 포함한 HaMNs의 세포독성을 확인하기 위하여 MTT-assay 분석을 수행하였다. 각각의 HaMNs 샘플을 25, 50, 100, 200 μg/mL로 처리한 범위에서 그 생존율을 각각 확인하였다. Figure 4에서 볼 수 있듯이, 각 농도별 생존율은 Lfs 성분을 포함하지 않은 HaMNs의 경우, 25 μg/mL에서 96.9%, 50 μg/mL에서 94.1%, 100 μg/mL에서 91.6%, 200 μg/mL에서 92.9%의 생존율이 확인되었으며, Lfs 성분을 포함한 HaMNs의 경우, 25 μg/mL에서 103.7%, 50 μg/mL에서 102.4%, 100 μg/mL에서 100.1%, 200 μg/mL에서 95.8%로 200 μg/mL의 농도에서 세포 생존율의 감소가 미세하게 확인되었으나 명확한 세포독성을 나타내지는 않았다. 이로써 Lfs 성분을 포함한 HaMNs이 일정한 농도에서 세포에 대한 독성 작용을 나타내지 않아 세포독성에 대하여 비교적 안전한 물질임을 확인하였고, 효능 평가 및 제품을 위한 제형화 공정개발에 있어서 Ha와의 배합 비율을 결정하는데 유용한 자료로 활용될 것이다.
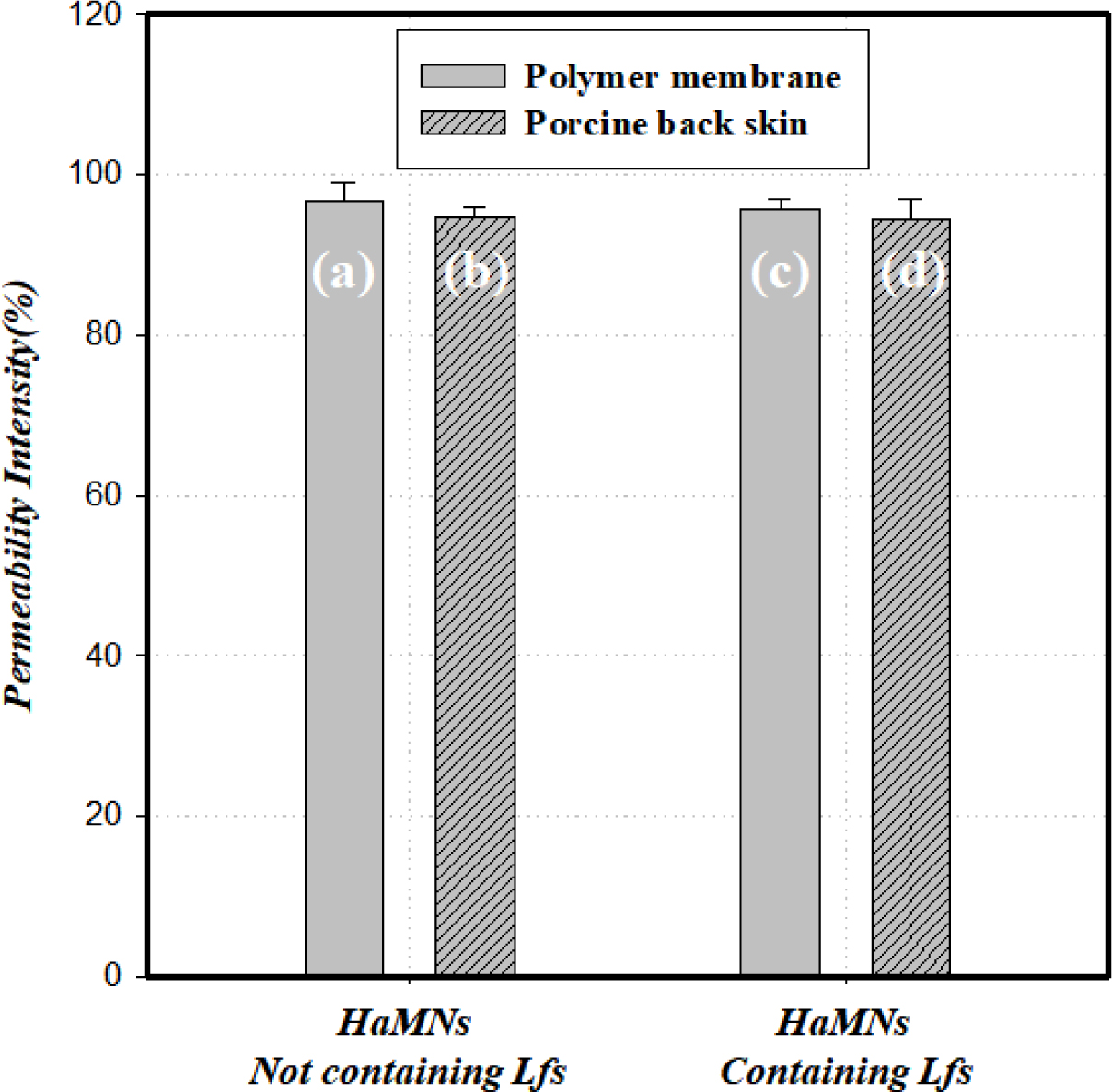
용융선 HaMNs의 피부투과도 분석. 제조한 HaMNs 어레이의 피부 침투 강성을 확인하기 위해 10×10 배열을 지닌 100개의 니들을 이용하여 피부를 투과한 니들수를 비교하여 Lfs 포함에 따른 HaMNS 니들의 기계적 강도를 비교하여 피부 투과성(skin permeability) 평가를 수행하였다. 1차적으로 고분자 인조막(polymer membrane)에 대한 HaMNs의 투과율(permeability intensity)을 측정하고, 2차적으로 -25 ℃에서 보관된 멸균 처리되어진 돼지 등 피부(porcine back skin, 1200 μm 두께, 20 mm×20 mm 면적)를 녹인 후 약 2시간 동안 상온에서 건조시켜 표면의 수분함량을 최소화하고, 각 모서리를 최대한 잡아당겨 피부의 팽팽함을 유지하여 실제 사람 피부 모델과 가장 유사한 형태로 준비하여 피부 투과성을 평가하였다. 1차적으로는 적용한 고분자 막은 현재 franz cell membrane(FCM)을 이용한 경피 약물 전달 분야에서 동물의 피부를 대체하여 인조막으로 활용되고 있어 HaMNs의 최소한의 강성을 확인하기 위한 모델로 사용하였다.24 또한 실제 피부층에 대한 투과성 예측을 위해 실제 동물 피부층을 상용화하여 FCM 용도로 제공되고 있는 Micropig® FCM의 porcine back skin을 이용하여 2차적으로 확대 평가를 수행하여 피부 투과성을 예측하였다.
우선, 고분자 인조막과 돼지 등 피부를 멸균부직포 위에 놓고 수분과 이물을 제거하고 Lfs가 포함되지 않은 HaMNs 어레이와 Lfs를 포함한 HaMNs 어레이를 각각의 막 위에 올려 5 kgf의 힘으로 10초 동안 가압하고 막과 피부 내 구멍을 뚫고 HaMNs를 제거한 후, 각각의 염색시약 20 μL을 10분간 표면에 도포하여 표면에 뚫린 구멍을 통해 표피층에 염색된 구멍의 개수를 측정하여 기계적 강도를 비교하였다. 세부적으로 고분자 인조막 위에는 calcein(100 mM in PBS, pH8.0) 염색시약으로 염색하여 투과된 HaMNs hole을 확인하였고, 돼지 등 피부의 경우는 고분자 인조막 평가와 동일한 방법으로 평가하고 0.4% trypan blue 용액 염색시약으로 염색하여 투과된 HaMNs hole을 확인하여 Lfs 포함 여부에 대한 각각의 투과성을 분석하였다. 모든 투과성 분석은 이전에 발표된 논문을 참조하여 수행되었으며, 분석에 사용된 시료는 각각 HaMNs 5개의 시료에 대하여 측정되었고, 평균값을 적용하여 그래프로 표기하였다.25-27
Figure 5에서 볼 수 있듯이, Lfs를 포함하지 않은 HaMNs 제형이 Lfs를 포함한 HaMNs보다 평균 투과성이 높은 유의차를 보임을 확인할 수 있다. 이는 Figure 2의 HaMNs top sharpness 형상분석에서 Lfs를 포함하지 않은 HaMNs의 top sharpness R값(value)인 곡률 값이 더 작아 투과성이 더 높은 것으로 판단된다. 또한 막에 거의 수분이 없는 고분자 인조막과 표면에 수분을 제거하여도 피부층 내에 소량의 수분을 함유하고 있는 돼지 등 피부층에 대한 투과성의 미세한 유의차 발생은 표면 건조 상태에 따라 HaMNs 어레이가 단위 표면당 접촉되어 가해지는 초기 가압력의 차이로 나타난 현상으로 판단되며 표면 수분 정도에 따른 단위 면적당 가해지는 니들 압력의 영향에 영향에 대한 연구는 실험적으로 측정 가능한 모델을 설계 구현하여 계속적으로 연구될 필요가 있어 계속 이 부분에 대하여 진행할 것이다.
HaMNs 니들 내의 Lfs가 가장 안정한 상태의 조건을 이용하여 Lfs를 포함한 HaMNs의 기계적 강도가 피부를 투여하기에 충분한지 확인하고자 하였다. 이를 위하여 Ha만을 사용하여 제조한 HaMNs 용융 니들과의 외형적 형태의 차이와 피부 투과도의 차이를 확인하여 피부 투과에 효과적인 기계적 강도를 확인하고자 하였다. Figure 6에 각각의 HaMNs 어레이가 고분자 인조막과 돼지 등 피부에 대하여 투과된 광학현미경 이미지를 나타내었다.
HaMNs 니들 내의 Lfs가 가장 안정한 상태의 조건을 이용하여 Lfs를 포함한 HaMNs의 기계적 강도가 피부를 투여하기에 충분한지 확인하고자 하였다. 이를 위하여 Ha만을 사용하여 제조한 HaMNs 용융 니들과의 외형적 형태의 차이와 피부 투과도의 차이를 확인하여 피부 투과에 효과적인 기계적 강도를 확인하고자 하였다. Figure 6에 각각의 HaMNs 어레이가 고분자 인조막과 돼지 등 피부에 대하여 투과된 광학현미경 이미지를 나타내었다.
막과 피부 내 염색된 구멍의 개수와 측정한 이미지를 비교하여 각각의 두 HaMNs 샘플간의 투과성 차이를 확인한 결과 Lfs를 포함하지 않은 HaMNs와 Lfs를 포함한 HaMNs의 top sharpness 곡률 정도는 다르나 실제 투과에 있어서는 거의 유사하게 니들 대부분이 막과 피부를 투과한 것으로 보여진다. 이는 Lfs 함유 여부와는 상관없이 유사한 투과성을 나타냄을 확인였으며, 본 연구에서 사용되는 HaMNs의 니들이 피부 투과에 충분한 기계적 강도와 구조를 지녔다. 위의 결과를 통해 HaMNs 니들 내에 포함된 현재의 Lfs 함량은 니들의 top sharpness 형상에는 영향을 줄 수는 있으나, 기계적 강도에는 영향을 주는 요소가 아니다.

|
Figure 2 SEM images of morphology of HaMNs: (a) HaMNs not containing Lfs; (b) HaMNs containing Lfs. The inset shows top view of HaMNs, respectively. |
|
Figure 3 Total polyphenol contents of HaMNs containing Lfs. |
|
Figure 4 Effect of HaMNs on cell viability using MTT-assay. (a) HaMNs not containing Lfs; (b) HaMNs containing Lfs. |
|
Figure 5 Effects of permeability on the polymer membrane and on the porcine back skin permeability with HaMNs. (a) polymer membrane permeability; (b) porcine back skin with HaMNs not containing Lfs; (c) polymer membrane permeability; (d) porcine back skin with HaMNs containing Lfs, respectively. |

|
Figure 6 The optical images of (a) polymer membrane permeability; (b) porcine back skin with HaMNs not containing Lfs; (c) polymer membrane permeability; (d) porcine back skin with HaMNs |
본 연구에서는 용융성 마이크로 니들(MNs) 제형으로 설계하여 피부 투과 시 수분에 의해 MNs이 용해될 수 있도록 생분해성 히알루론산(Ha)과 한약 성분인 금은화(Lfs)를 융합하여 생분해성 히알루론산 마이크로 니들(HaMNs) 어레이를 제작하고, HaMNs의 형상 분석, 피부 투과를 위한 기계적 물성 분석, MTT-assay를 통한 세포독성 및 금은화의 제형 안정성을 확인하였다.
HaMNs top sharpness 형상분석에서 Lfs를 포함한 HaMNs top sharpness의 곡률 값이 배합된 용액의 흐름성의 영향으로 미세한 유의차가 확인되지만, 고분자 인조막 및 돼지 등 피부층에 대한 투과도 평가를 통해 Lfs를 포함하지 않은 HaMNs와 Lfs를 포함한 HaMNs의 top sharpness 곡률 정도는 다르나 실제 투과에 있어서는 거의 유사하게 니들 대부분이 막과 피부를 투과한 것으로 보이며, 본 연구에서 사용되는 HaMNs의 니들이 피부 투과에 충분한 기계적 강도와 구조를 지녔다.
또한 HaMNs의 세포독성과 Lfs의 안정성을 분석하여 Lfs 성분을 포함한 HaMNs이 일정한 농도에서 세포에 대한 독성 작용을 나타내지 않아 세포독성에 대하여 비교적 안전한 물질임을 확인하였고, HaMNs 내에 Lfs 추출물이 적절하게 함유되었을 뿐만 아니라 자유전자의 제거를 통한 항산화 및 염증 감소에 일정한 효과를 나타낼 수 있을 것으로 기대된다.
- 1. S. J. Lee, J. Adv. Eng. Technol., 20, 335 (2017).
- 2. S. J. Kim, Korean Soc. Biotechnol. Bioeng. J., 26, 277 (2011).
- 3. Y. C. Kim, J. H. Park, and M. R. Prausnitz, Adv. Drug Deliv. Rev., 64, 1574 (2012).
-

- 4. M. R. Han, E. Y. Kim, Y. H. Jung, M. S. Kim, and J. H. Park, Polym. Korea, 37, 393 (2013).
-

- 5. J. H. Park, S. O. Choi, S. Seo, Y. B. Choy, and M. R. Prausnitz, Eur. J. Pharmaceut. Biopharmaceut., 76, 282 (2010).
-

- 6. J. W. Lee, S. O. Choi, E. I. Felner, and M. R. Prausnitz, Small, 7, 531 (2011).
-

- 7. Y. S. Chung and H. Y. Ha, J. Invest. Cosmetol., 11, 309 (2015).
- 8. K. T. Kim, Y. H. Kim, J. G. Kim, C. S. Han, S. H. Park, B. Y. Lee, and K. H. Kim, J. Soc. Cosmet. Sci. Korea, 33, 189 (2007).
- 9. P. J. Lee, H. T. Kim, K. S. Yoon, H. C. Park, and H. Y. Ha, J. Kor. Med. Ophthalmol. Otolaryngol. Dermatol., 26, 75 (2013).
- 10. J. H. Shin, K. H. Kim, Y. W. Shin, and H. Y. Kim, Polym. Korea, 41, 90 (2017).
-

- 11. J. Necas, L. Bartosikova, P. Braunder, and J. Kolar, Vet. Med., 53, 397 (2008).
-

- 12. H. J. Song, H. J. Mu, and S. H. Lee, J. Soc. Cosmet. Sci. Korea, 39, 281 (2013).
-

- 13. P. J. Lee and H. Y. Ha, J. Invest. Cosmetol., 14, 441 (2018).
-

- 14. T. K. Ha and Y. C. Lee, Korea J. Herbology, 26, 1 (2011).
- 15. S. H. Park, M. J. Kwang, Y. C. Lee, and J. K. Lee, J. Kor. Soc. People Plants Environ., 14, 207 (2011).
- 16. S. H. Baek and H. T. Young, J. Nat. Sci., 12, 44 (1993).
- 17. P. Y. Yu, H. H. Kim, Y. L. Lee, S. Y. Park, and J. H. Choi, J. Korean Med. Ophthalmol. Otolaryngol. Dermatol., 30, 38 (2017).
- 18. T. C. Moon, J. O. Park, K. W. Chung, K. H. Son, H. P. Kim, S. S. Kang, H. W. Chang, and K. C. Chung, Yakhak Hoeji, 43, 117 (1999).
- 19. J. H. Ryu, H. Y. Shin, J. G. Lee, K. S. Tae, and M. S. Kim, J. Biomed. Eng. Res., 39, 30 (2018).
- 20. O. Folin and W. Denis, J. Biol. Chem., 13, 469 (1912).
- 21. A. Blainski, G. C. Lopes, and J. C. P. Mello, Molecules, 18, 6852 (2013).
-

- 22. H. F. Al-Azzawie and M. S. S. Alhamdani, Life Sci., 78, 1371 (2006).
-

- 23. C. I. Hong, E. G. Jung, K. I. Han, Y. H. Kim, S. H. Lee, H. S. Lee, and M. D. Han, J. Life Sci., 26, 545 (2016).
-

- 24. C. H. Salamanca, A. B. Ocampo, J. C. Lasso, and N. Camacho, Pharmaceutics, 10, 148 (2018).
- 25. H. S. Lee and J. H. Park, Polym. Korea, 38, 391 (2014).
-

- 26. J. Yu, Y. Zhang, Y. Ye, R. D. Santo, W. Sun, D. Ranson, F. S. Ligler, J. B. Buse, and Z. Gu, PANS, 112, 8260 (2015).
-

- 27. S. G. Lee, J. H. Jeong, K. M. Lee, K. H. Heong, H. S. Yang, M. R. Kim, H. I. Jung, S. K. Lee, and Y. W. Choi, Int. J. Nanomed., 9, 289 (2014).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(4): 540-546
Published online Jul 25, 2019
- 10.7317/pk.2019.43.4.540
- Received on Feb 11, 2019
- Revised on Apr 8, 2019
- Accepted on Apr 14, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Seung-Jun Lee, Hun-Yong Ha
-
Department of Pharmaceutical Science and Engineering, Seowon University, Chungju 28674, Korea
- E-mail: finedaddy@seowon.ac.kr, hahunyong@seowon.ac.kr
- ORCID:
0000-0001-8677-7053, 0000-0002-1064-4200










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.