- Fabrication of Three-dimensional Flexible Conductive Scaffold Using Spherical Sugar Particles as Porogen
Division of Advanced Materials Engineering, Kongju National University 1223-24 Cheoandaero, Cheonan, Chungnam 31080, Korea
- 구형설탕입자를 기공형성물질로 이용한 3차원 유연 전도성 스케폴드 제조
공주대학교 공과대학 신소재공학부
Herein, we use in situ vapor phase polymerization (VPP) of pyrrole (Py) on an oxidant-impregnated thermoplastic polyurethane (TPU) matrix comprising a three dimensional eco-friendly sugar particle assembly to produce a soft, flexible, and conductive polypyrrole (PPy)-TPU hybrid scaffold. The selective removal of sugar assembly yielded a highly porous skeletal structure, with the effective penetration, diffusion, and polymerization of Py resulting in uniform PPy formation both on the surface and the inner side of the TPU matrix. The mechanical and electrical properties of the obtained scaffold were investigated by bending and stress–strain and electrical measurements. The electrical resistance of the scaffold prepared by 12 h polymerization, equaled 1 MΩ and did not significantly change after 100 fold bending. In vitro biocompatibility was investigated by MC3T3-E1 cell culturing with cell viability evaluated using the WST assay. Thus, the soft and flexible PPy-TPU hybrid scaffold produced by VPP might be practically useful, implying that this preliminary investigation needs to be extended to study the behavior of muscle and nerve cells under electrical stimulation.
본 연구는 환경 친화적인 구형 설탕입자 어셈블리에 산화제 함침 열가소성 폴리우레탄(thermoplastic poly-urethane, TPU) 매트릭스를 코팅하고 피롤 단량체의 in situ 기상 중합(vapor phase polymerization; VPP)을 사용하여 부드럽고 유연한 3차원 전도성 폴리피롤(polypyrrole, PPy)-TPU 하이브리드 스케폴드를 제조하는 공정에 관한 것이다. TPU 매트릭스의 표면과 내부 모두에서 균일한 PPy 형성을 가져오는 Py의 효과적인 침투, 확산 및 중합과 함께 설탕 입자 어셈블리의 선택적인 제거로 유연한 다공성 스케폴드를 구현하였다. 얻어진 스케폴드의 기계적 및 전기적 특성은 굽힘, 응력-변형 및 전기적 측정에 의해 조사되었다. 12시간 동안 VPP 중합한 PPy-TPU 스케폴드의 전기 저항은 1 MΩ 정도를 보였으며, 100번의 굽힘 반복 실험에도 저항값이 크게 변화하지 않았다. 시험관 내 생체 적합성은 MC3T3-E1 세포 배양 및 WST 분석법을 사용하여 확인하였다. 따라서 VPP에 의해 제조된 부드럽고 유연한 다공성 PPy-TPU 하이브리드 지지체는 실제적으로 유용할 수 있으며, 이 예비 연구는 향후 전기 자극 하에서 근육 및 신경 세포의 행동 연구를 위한 기초 데이터로 활용 가능할 것이라 기대한다.
Herein, we report in situ vapor phase polymerization of pyrrole on an oxidant-impregnated thermoplastic polyurethane matrix comprising a three dimensional eco-friendly sugar particle assembly to produce a soft, flexible, and conductive polypyrrole-TPU hybrid scaffold.
Keywords: conductive scaffold, polypyrrole, soft/flexible scaffold, thermoplastic polyurethane, vapor phase polymerization
이 논문은 공주대학교 연구년 사업에 의하여 연구되었음. 또한 이 논문은 2016년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(NRF-2016R1D1A3B03931831).
생체조직 기능을 모방하여 신체 기능을 유지 또는 복원하는 조직공학에서 스케폴드 설계는 다양하게 연구되어 왔다.1-3 스케폴드는 세포 부착, 증식 그리고 분화에 적합해야 하고, 분화하는 세포의 형태를 유지하기 위한 기계적 강도, 그리고 세포성장을 위한 영양물질이 잘 운반되어야 한다.3-6 최근 혈관의 형성에 있어 5~15 μm, 피부 재생에는 20~125 μm, 골 재생의 경우 100~350 μm의 기공크기를 가지는 3차원 환경의 배양에서 세포간 통신, 산소 및 영양 물질의 운반이 잘 이루어짐이 보고되었다.7,8 이러한 배경에서 스케폴드는 신체환경과 유사한 3차원의 다공성 형태로 기체발포,9 전기방사,10-11 3D 프린팅,12 lamination,13 porogen leaching과14-15 같은 다양한 프로토콜로 제작되어 왔다.16
기관 조직들은 매우 짧은 시간 동안 수축과 신장을 하기 때문에 스케폴드는 기관 조직의 형태와 기능을 유지할 수 있는 기계적 강도가 요구된다. 스케폴드의 기계적 강도를 충족하기 위하여 사용되는 소재는 주로 생체적합성을 가지는 유기 고분자인 열가소성 엘라스토머가 많이 활용되어 왔다.17,18 또한 세포의 분화 촉진 및 성숙을 위해 전도성을 가지면 효과적이라는 보고가 있었다. 심장근육세포 또는 뉴런의 성숙과 재생은 전기 자극에 의해 촉진된다.19 이는 스케폴드 소재가 상기 세포의 분화 및 세포 성장을 촉진시키기 위한 특정한 전기전도 특성을 가지면 다양한 세포배양에 유리한 요소가 있다는 것을 의미한다. 그러나 대부분의 스케폴드 소재는 전기적으로 절연물질이기 때문에, 전기적 자극을 필요로 하는 심장 근육 및 신경 세포의 재생을 위해서는 스케폴드 소재에 전도성을 부여하는 것이 필요하다. 이러한 요구특성을 만족시키기 위해 전도성 고분자 또는 탄소소재(그래핀, 탄소나노튜브)를 생체 적합 유기고분자와 복합화하여 전기적 특성을 부여하는 것이 제안되어 왔다.20-22 탄소복합재료의 경우, 전도도를 증가시킬수록 탄성과 생체 적합성이 떨어지고, 기계적 스트레스에 의해 전도도를 손실하는 장기 신뢰성에 관한 문제가 있었다.23,24 이러한 문제를 해결하기 위해 전도성 고분자 단량체와 기계적 물성에 필요한 금속산화물을 공증발-기상중합(simultaneous co-vaporization vapor phase polymerization; SC-VPP)을 통해 제조하는 프로토콜이 본 연구 그룹에 의해 제시되었다.25 이 공정은 (i) 3차원의 템플레이트 어셈블리 위에 코팅하고, (ii) 3차원의 템플레이트 어셈블리를 제거하는 두 단계로 제조하는 것이다. 상기 공정을 이용하여 제작된 다공성 poly(3,4-ethylenedioxythiophene)(PEDOT)-SiO2 스케폴드는 상업적으로 이용 가능한 도전성 용액(예를 들어, 탄소나노튜브 또는 그래핀)을 사용하여 제조된 것보다 우수한 전기적 특성을 나타내었다. 그러나 PEDOT-SiO2 스케폴드는 본질적으로 매우 brittle한 성질로 인하여 soft한 세포의 조직공학 연구에 적용하기에는 한계가 있었다. 이 문제를 극복하기 위해 본 연구그룹은 부드럽고 유연한 3차원 다공성 전도성 스케폴드를 제조하는 새로운 방법을 제안하였다.26 (i) 실리카 구형입자로 구성된 오팔형 어셈블리를 다공성 주형으로 사용하고, 이 주형에 산화제가 포함된 열가소성 폴리우레탄 (thermoplastic polyurethane; TPU)으로 코팅하고, (ii) 전도성 단량체를 VPP 공정을 이용하여 1단계에서 제조된 복합체와 반응시키면 전도성 고분자가 TPU에 균일하게 분산된 유연 탄성체를 얻는다. 마지막으로 실리카 어셈블리를 불산 공정으로 선택적으로 제거하면 우수한 전기적 및 기계적 성질을 나타내는 다공성 역 오팔 구조를 갖는 다공성 탄성 스케폴드를 얻었다. 하지만, 이 공정도 실리카를 제거하기 위해서는 환경친화적이지 않는 불산 공정을 사용하기 때문에 생체적합성 관점에서 좋지 않은 측면이 있었다.
따라서 본 연구에서는 체내에 잔류 시에도 안전하며, 수용성으로 유기용제를 제거해주는 공정이 필요없는 250~350 μm 구형설탕입자를 기공형성물질로 사용하여 3차원 어셈블리를 제작하고 산화제가 포함되어 있는 TPU를 코팅하여 유연성을 부여하고 전도성 단량체인 피롤을 VPP를 통해 중합하여 3차원 다공성 유연 전도성 스케폴드를 제조하는 방법을 제시한다. 생체적합성 평가를 위하여 MC3T3-E1 전조골 세포를 제조한 polypyrrole(PPy)-TPU 스케폴드에 배양하고, 세포 독성 및 세포 증식 능력 평가를 위해 water-soluble tetrazolium salt (WST) assay를 통하여 분석하였다.
시약 & 재료. Thermoplastic polyurethane(TPU, Dongsung Co., NEOTHANE 5285AP)와 산화제 겸 도판트인 Iron(III) p-toluenesulfonate(FTS, Sigma-Aldirich), 용매인 tetrahydro-furan(THF, Samchun Pure Chemical), PPy의 합성 단량체인 pyrrole(Py, Sigma-Aldirich)은 정제 없이 사용하였다. 구형의 설탕 입자는 SUGLETS®(Colorcon Co. Suglets 45/60)를 사용하였다.
전도성 PPy-TPU 유연 스케폴드 제조. TPU를 용매인 THF에 10 wt%로 완전히 용해시켜준 후, 그 용액에 10 wt%의 FTS를 교반을 통해 완전히 녹인다. 설탕입자들을 3차원의 몰드에 넣어 어셈블리를 제조하고 상기에서 제조된 TPU, FTS 혼합 용액을 부어 캐스팅한다. 상온에서 하루 동안 THF를 건조하여 설탕입자와 TPU의 어셈블리를 제조하였다. 기상중합 반응기는 닫힌계를 유지하고, 내부온도는 60 ℃를 유지시켰다. 중합의 단량체인 Py은 반응기 하단에 놓았으며, FTS-TPU 하이브리드 물질이 코팅된 설탕 어셈블리에 Py 단량체를 기상으로 노출시켰다. 기상중합은 대기압에서 2~24시간 범위로 진행되었으며 중합 후에 증류수와 에탄올을 이용하여 미반응된 산화제와 단량체를 세척하였다. 제조된 3차원 복합체를 60 ℃의 증류수를 이용하여 설탕입자들만 선택적으로 제거하여 다공성 PPy-TPU 유연 스케폴드를 제조하였다.
전도성 유연성을 가지는 스케폴드의 전기/기계적 특성분석 및 생체적합성 평가. 제조된 스케폴드 표면의 형태학적 특성과 화학성분 분석을 광학현미경(KI-2000, KOREALABTECH CORPORATION)과 전자주사현미경(SEM) (MIRA LMH, TESCAN) 및 SEM-EDS 분석(Bruker AXS XFlash detector 5010)을 통해 관찰하였다. 스케폴드의 초기 저항값과 스케폴드가 휘어졌을 때의 변화를 LCR meter(Gwinstek, LCR-6100)가 장착된 다목적 bending machine(Ipen CO.)을 통하여 관찰하고, probe station(Agilent Technologies, E5270A)의 direct current(DC) voltage sweep 모드를 통해 -80~80 V의 전압범위에서 전류-전압(I-V) 곡선을 얻었다. LED 벌브 및 전선을 사용하여 전원 공급 장치(EXSO®, DC power supply K6133A)에 연결하여 LED 전구의 점등까지 점진적으로 전압을 증가시켜 임계 전압을 확인하였다. 제조된 스케폴드의 기계적 물성을 길이 50 mm, 폭 10 mm, 두께 1 mm의 시편으로 만능 물성시험분석기(universal testing machine; UTM, Qmesys QM700)를 사용하여 인장속도 5 mm/min로 측정하였다. 기계적 물성 측정값은 시료당 6개의 시편을 만들어 평균을 낸 값으로 시험에 대한 신뢰성을 높였다. 전도성 스케폴드는 UV 및 70% 에탄올로 멸균 후 PBS 세척 후 a-MEM 배지에 담지한다. 세포 접종 전, 샘플을 10 μL/mL의 fibronectin에 담지하여 코팅 처리한다. 상기 샘플을 24 well 배양 플레이트에 이동시킨 뒤, 5×103 cells/well의 밀도로 MC3T3-E1 전조골 세포를 접종시킨다. 세포 독성 및 세포 증식능 평가를 위해 수용성 tetrazolim salts를 이용한 WST assay(EZ-CYTOX, Dogen, 한국)를 이용하였다. 배양 1, 3, 7일째 100 μL의 WST 용액을 샘플이 담지된 플레이트에 각각 분주 후 2시간 동안 배양시킨다. 배양된 용액은 96 well 플레이트에 이동시킨 후 450 nm(reference 파장 620 nm)에서 ELISA reader를 이용하여 흡광도를 측정하였다.
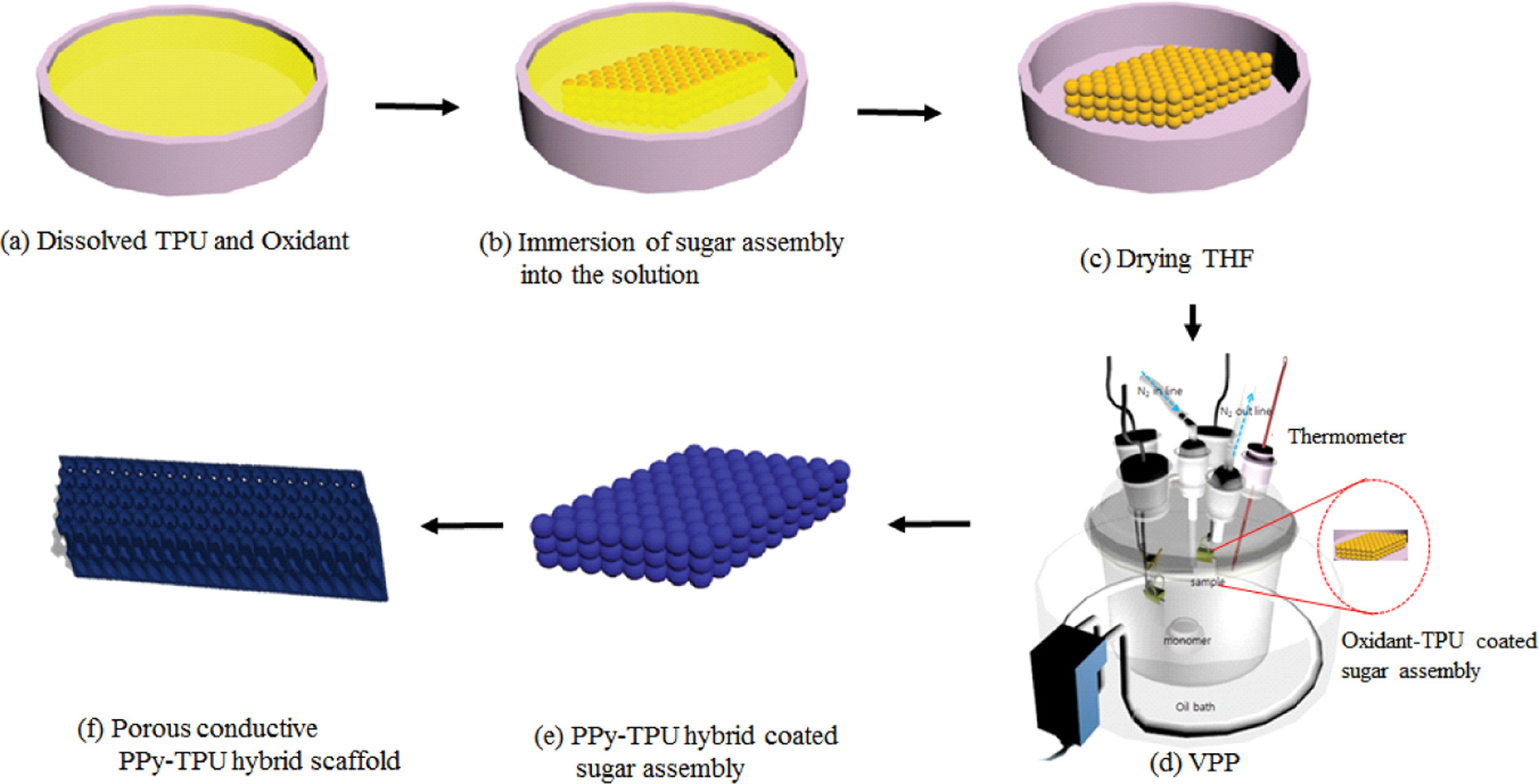
PPy-TPU 전도성 유연 스케폴드 제조. Scheme 1에 PPy-TPU 전도성 유연 스케폴드를 제조하는 절차를 나타내었다. 먼저, TPU와 FTS를 THF에 완전히 용해시킨 페트리디쉬에 250~350 μm 구형의 설탕입자로 제조된 3차원 어셈블리를 담근다. THF를 완전히 건조시키면 FTS-TPU 하이브리드가 코팅된 설탕입자 어셈블리를 얻게 되고, 이것을 VPP 챔버에서 Py을 증발시켜 기상중합하였다. 제조된 PPy-TPU 하이브리드가 코
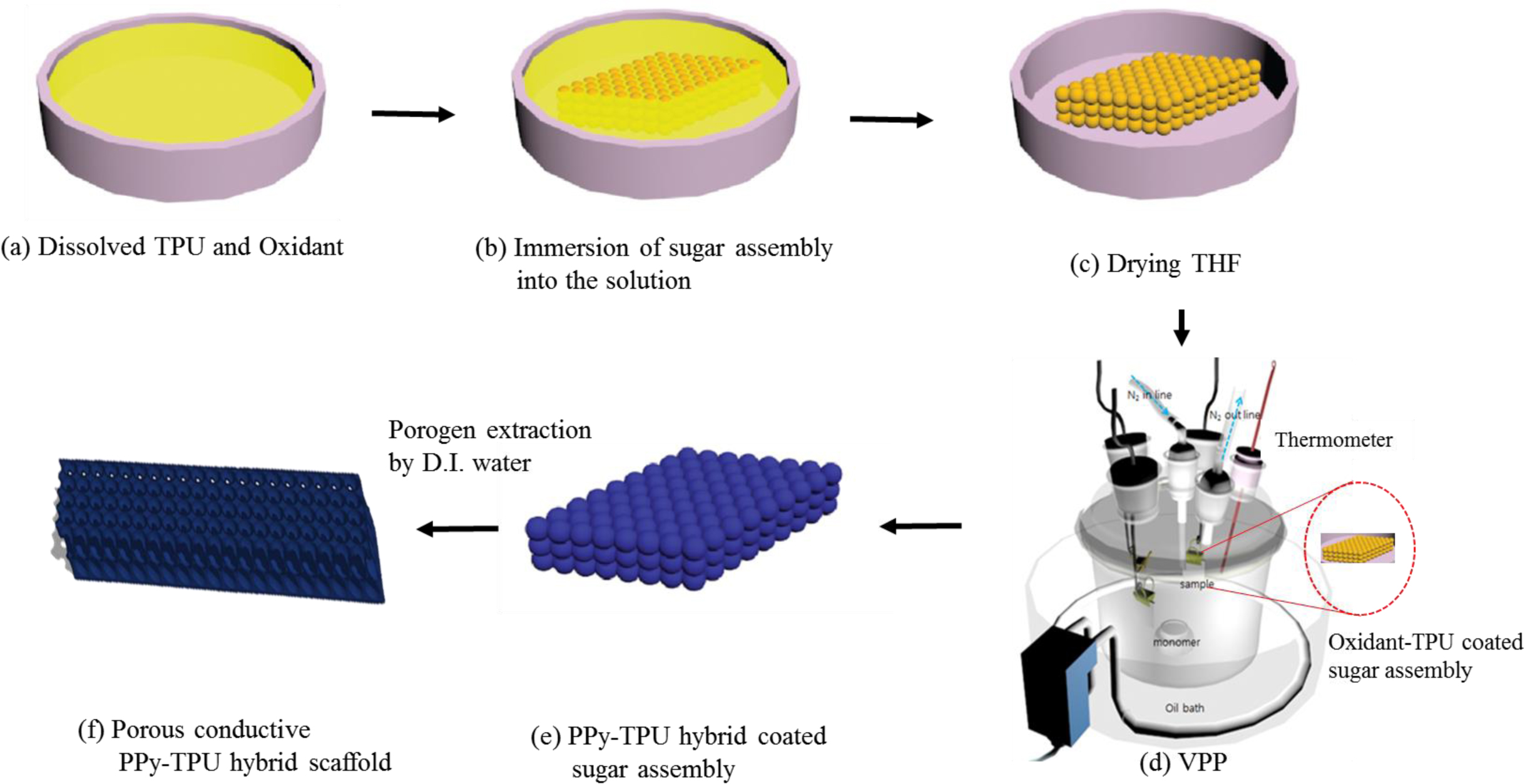
Scheme 1. Schematic illustration of fabricating a porous conductive PPy-TPU hybrid elastomer using VPP process.
팅된 설탕입자 어셈블리를 60 ℃의 증류수에 함침시켜 선택적으로 설탕 기반 기공형성물질을 제거함으로써 매크로 기공을 갖는 전도성 PPy-TPU 유연 스케폴드를 제조하였다. Figure 1(a)에서 본 연구에서 사용된 구형 설탕입자, Figure 1(b), (c)에서 각 제조 단계별 어셈블리와 최종 제조된 다공성 전도성 PPy-TPU 유연 스케폴드의 광학 현미경 사진(Figure 1(d))을 나타내었다. 본 연구에서 사용된 산화제가 포함된 FTS-TPU 하이브리드의 특징적인 색깔인 노란색이 설탕입자들의 계면에 고르게 분포하고 있고(Figure 1(b)), Py VPP 이후에는 PPy의 특징적인 색깔인 짙은 국방색을 띄게 된다. 설탕입자를 완전히 제거하면 매크로 기공구조가 잘 발달된 PPy-TPU 유연 스케폴드임을 확인할 수 있다(Figure 1(d)). Figure 2는 제조된 스케폴드의 제조 과정에서의 색깔변화를 보여주고 있다. 특히 제조된 전도성 스케폴드는 매우 유연하고 (Figure 2(d)), 스케폴드로 연결된 발광 다이오드의 빛이 켜져 있음으로 인하여 PPy-TPU hybrid 스케폴드는 전기 전도성을 가지고 있음을 정성적으로 확인할 수 있었다. Figure 3은 스케폴드 제조 단계별 어셈블리와 제조된 PPy-TPU 스케폴드의 SEM 이미지를 나타내었다. 다공성 스케폴드의 기공내부의 형상학적 모양은 설탕입자의 표면 모양이 반영되어 주름진 표면으로 관찰되어 세포증식을 위한 적합한 구조라는 것을 확인하였다(Figure 3(d)). TPU 매트릭스 안에서 PPy의 균일한 형성을 확인하기 위해 질소 및 황의 원소 분포를 EDS와 element mapping으로 조사하였다(Figure 4). 질소 원자의 존재로 PPy가 효과적으로 형성되었다는 것을 알 수 있고, 황원자의 존재는 산화제인 FTS에 있는 설포네이트 이온이 PPy에 도핑되어 있다는 의미한다. 또한 PPy-TPU 스케폴드의 단면부분에서의 질소/황 원자의 분포가 확인되어, Py 단량체가 VPP 공정을 통하여 TPU 매트릭스에 확산, 침투, 중합을 통하여 형성되었음을 확인하였고, 이는 본 연구 그룹의 선행 연구(PEDOT-TPU 스케폴드26 및 free standing film27)에서의 결과와 동일하였다.
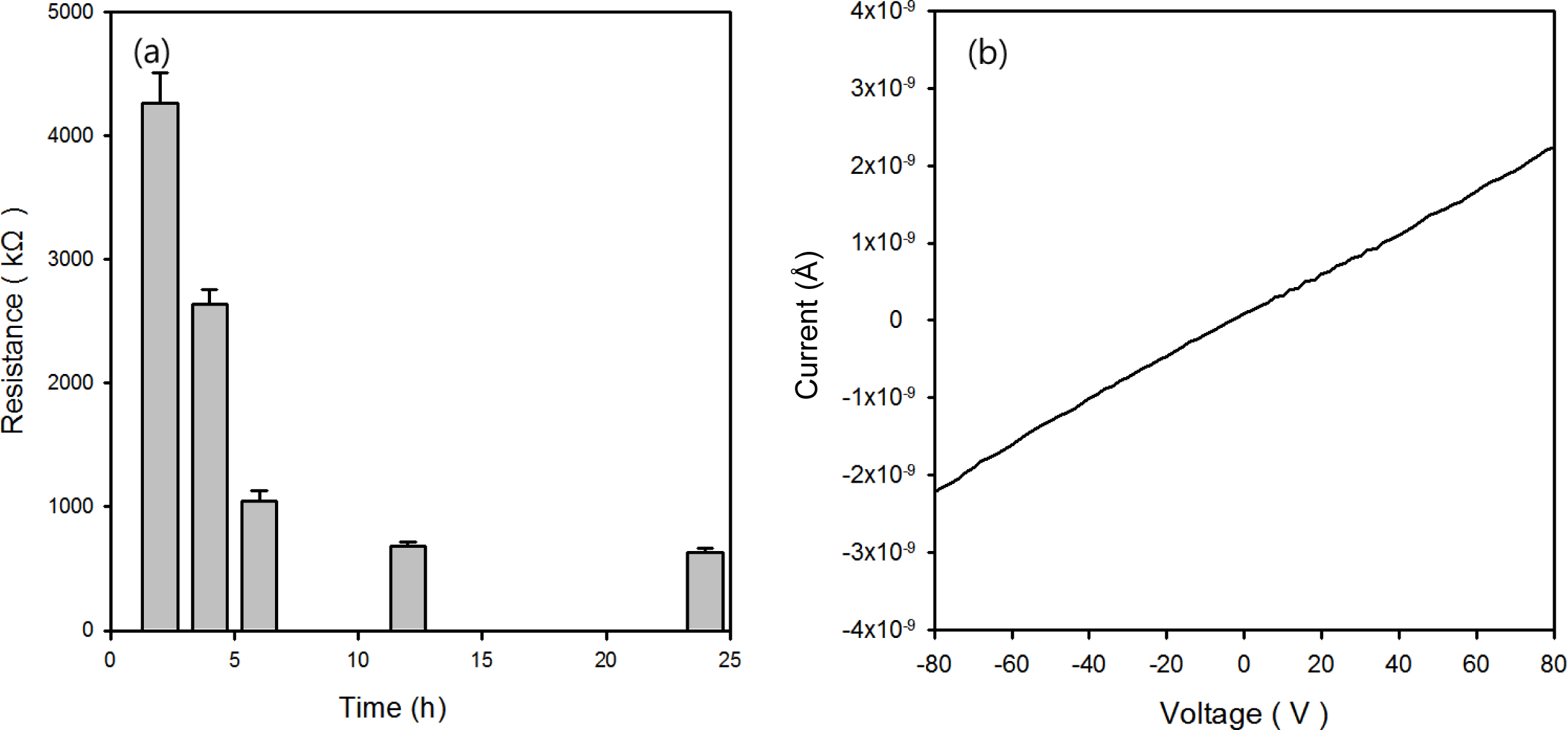
TPU-PPy Hybrid 스케폴드의 기계적/전기적 특성. VPP에 의해 제조된 스케폴드의 전기적 특성은 LCR meter를 통한 직류저항의 측정과 실온에서의 I-V 곡선의 거동으로 평가하였다(Figure 5). 전기저항은 VPP의 시간에 따라 감소함을 보였고, 이는 VPP 중합시간이 길어질수록 전도성 고분자인 PPy의 함량이 하이브리드 내에서 증가하기 때문이라고 생각된다. 하지만, 약 12시간 이후부터는 약 600 kΩ 정도로 전기저항의 감소가 크지 않았다. 따라서 본 연구에서는 중합시간 6, 12시간에서 제조한 PPy-TPU 스케폴드의 기계적 특성과 생체적합성 평가를 하였다. 또한 Figure 5(b)에서 보여주는 것처럼 I-V 곡선은 선형 특성을 보여주었고, 이는 전형적인 도체 특성을 제조된 스케폴드가 가지고 있음을 의미한다.
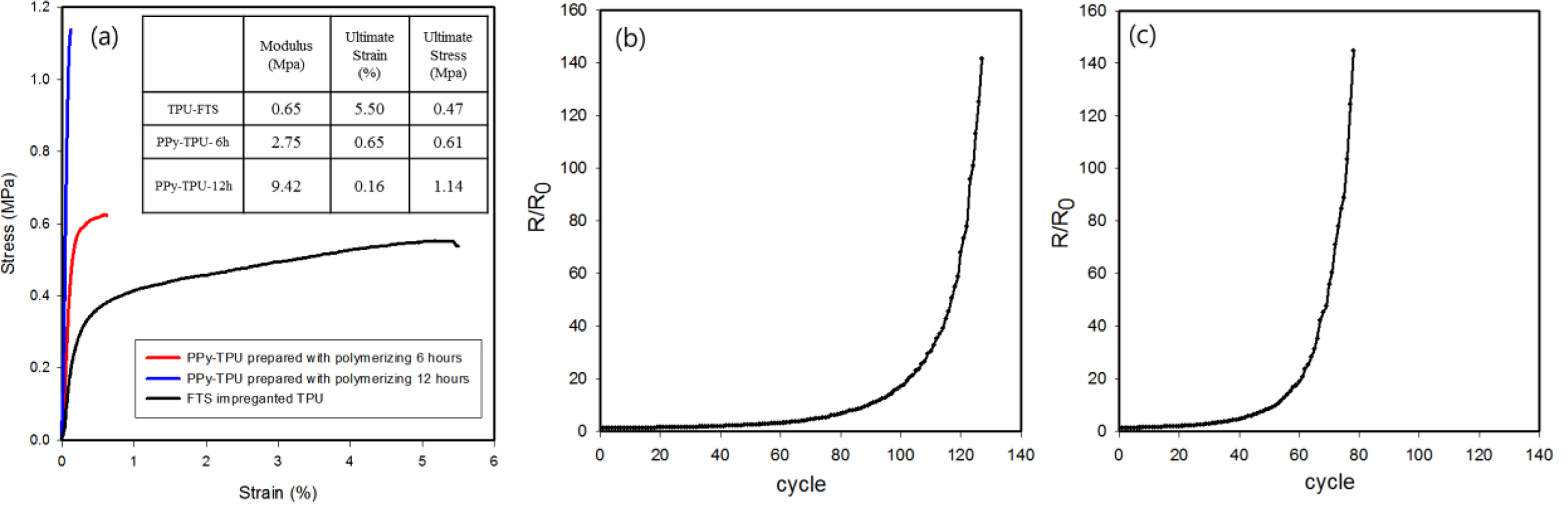
TPU-PPy hybrid 스케폴드의 기계적 특성은 UTM을 이용한 응력-변형 곡선으로 평가되었다(Figure 6(a). VPP를 하지 않은 TPU-FTS의 modulus는 650 kPa , TPU-PPy 스케폴드는 VPP 중합시간에 따라 6시간을 중합한 scffold는 2.75 MPa 그리고 12시간을 중합한 스케폴드는 9.42 MPa로 증가하였다. TPU 매트릭스에 PPy가 중합시간의 증가에 따라 함량이 많아지면서, PPy의 환형구조에 기인한 강직한 구조가 modulus를 증가시키는 경향이 있음을 나타냈다. Figure 6(b), (c)에서는 제조된 TPU-PPy hybrid 스케폴드에 bending test를 통하여 굽힘의 변형을 연속적으로 가하는 장기신뢰성 평가를 수행하였다. 전기 저항이 초기저항의 10배가 되는 시점이 Py를 6시간 노출시킨 스케폴드는 약 100번의 반복 이후였으며, 12시간 노출시킨 스케폴드는 60회의 반복 이후 나타났다. 중합시간이 증가함에 의해 PPy의 함량증가로 인한 탄성력의 약화가 PPy-TPU hybrid 스케폴드의 복원력을 감소시킨 것이라 판단된다.
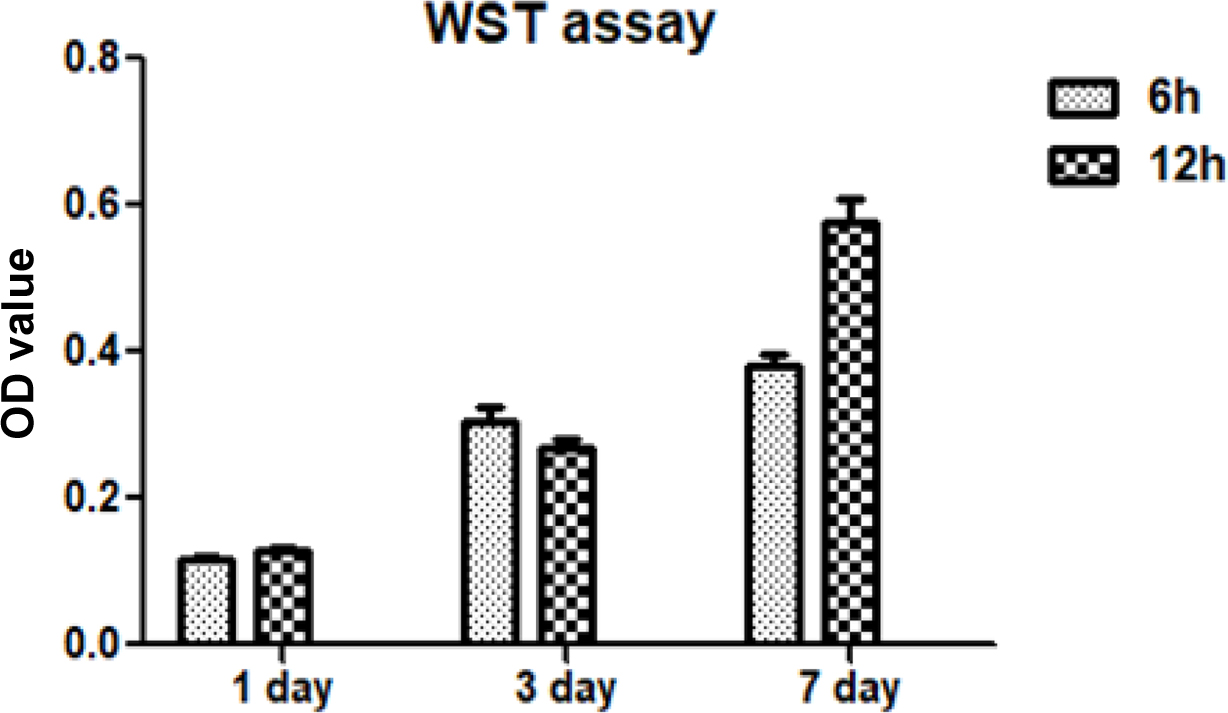
TPU-PEDOT Hybrid 스케폴드의 시험관 내 생체 적합성. WST 분석을 사용하여 PPy-TPU 스케폴드에서 1, 3, 7 일 동안 성장한 MC3T3 - E1 세포의 시험관 내 증식을 평가하였으며(Figure 7), 상기의 광학 밀도(optical density, OD)는 Py의 중합시간이 다른 두 조건의 스케폴드에서 꾸준히 7일까지 증가했다. 광학밀도의 증가는 스케폴드 매트릭스 내에 PPy의 함량이 증가하여도 광학 밀도가 증가하였다. 이는 PPy-TPU 스케폴드가 독성이 없고 7일 동안 세포가 증식할 수 있는 안정된 환경을 제공함을 확인하였다. 따라서 PPy-TPU 스케폴드는 3D 조직의 장기간 제조에 매우 적합하다고 판단된다.

|
Figure 1 Optical microscope images: (a) spherical sugar particle; (b) FTS-TPU coated sugar particle assembly; (c) PPy-TPU coated sugar particle assembly; (d) sugar extracted porous conductive PPy-TPU scaffold. |

|
Figure 2 Photography of (a) FTS-TPU coated embedded sugar particle assembly; (b) PPy-TPU coated sugar particle assembly; (c) porous conductive PPy-TPU scaffold; (d) bending of flexible porous conductive PPy-TPU scaffold; (e) LED lamp light on. |

|
Figure 3 SEM images: (a) spherical sugar particle; (b) PPy-TPU coated sugar particle assembly; (c, d) porous conductive PPy-TPU scaffold. |

|
Figure 4 SEM-EDS results: (a) EDS elemental mappings of nitrogen (red), and sulfur (yellow); (b) EDS spectra from PPy-TPU hybrid elastomers prepared with FTS oxidant. |
|
Figure 5 Electrical properties of PPy-TPU scaffold: (a) initial resistance variations as a function of VPP processing time; (b) I-V curve of PPy-TPU scaffold prepared with 6 h VPP. |
|
Figure 6 Mechanical properties of PPy-TPU scaffold: (a) S-S curves of various scaffold; (b) relative resistance variations of PPy-TPU-6h during repeated bending cycles; (c) relative resistance variations of PPy-TPU-12h during repeated bending cycles. |
|
Figure 7 WST assay of MC3T3-E1 cells grown in the TPU-PPy scaffold. |
본 연구에서는 3차원 구형 설탕입자 어셈블리를 주형으로 하여 부드럽고 유연하며 전도성이 있는 스케폴드를 두 단계 공정을 통하여 제조하였다. 먼저 VPP 공정으로 PPy와 TPU의 hybrid를 제조하고, 설탕입자 어셈블리 주형을 선택적으로 제거하여 다공성의 골격 구조를 만들었다. VPP 중합시간이 증가할수록 제조된 스케폴드의 탄성률은 감소하는 경향으로 이는 PPy의 brittle함에 기인한다. PPy-TPU 스케폴드는 중합시간에 따라 저항값을 조절할 수 있었고, 12시간 이후는 거의 저항값이 변하지 않았다. I-V 곡선으로 스케폴드가 도체 특성을 나타냄을 보여주었다. PPy-TPU 스케폴드의 in vitro 생체 적합성은 MC3T3-E1 전조골 세포의 배양에 의해 조사되었으며, 세포 생존력은 WST 분석에 의해 확인하였다. 따라서 유연한 PPy-TPU 스케폴드는 전기 자극에 통한 근육과 신경 세포의 시험관 내 세포배양 조직공학 연구에 적용될 수 있다고 판단된다.
- 1. G. Chen, T. Ushida, and T. Tateishi, Macromol. Biosci., 2, 67 (2002).
-

- 2. S. J. Hollister, Nat. Mater., 4, 518 (2005).
-

- 3. J. L. Drury and D. J. Mooney, Biomaterials, 24, 4337 (2003).
-

- 4. S. L. Ishaug, G. M. Crane, M. J. Miller, A. W. Yasko, M. J. Yaszemski, and A. G. Mikos, J. Biomed. Mater. Res., 36, 17 (1997).
-

- 5. G. Vunjak-Novakovic, B. Obradovic, I. Martin, P. M. Bursac, R. Langer, and L. E. Freed, Biotechnol. Prog., 14, 193 (1998).
-

- 6. S. F. Yang, K.-F. Leong, Z. H. Du, and C.-K. Chua, Tissue Eng., 7, 679 (2001).
-

- 7. S. A. Park, J.-H. Lee, and W. Kim, Elastomers Compos., 44, 106 (2009).
- 7. N. Annabi, J. W. Nichol, X. Zhong, C. Ji, S. Koshy, A. Khademhosseini, and F. Dehghani, Tissue Eng.: Part B, 16, 371 (2010).
-

- 9. C. Ji, N. Annabi, A. Khademhosseini, and F. Dehghani, Acta Biomater., 7, 1653 (2011).
-

- 9. H. Yoshimotoa, Y. M. Shina, H. Teraia, and J. P. Vacanti, Biomaterials, 24, 2077 (2003).
-

- 11. W.-J. Li, C. T. Laurencin, E. J. Caterson, R. S. Tuan, and F. K. Ko, J. Biomed. Mater. Res., 60, 613 (2002).
-

- 12. C. X. F. Lam, X. M. Moa, S. H. Teoh, and D. W. Hutmacher, Mater. Sci. Eng. C, 20, 49 (2002).
-

- 13. A. G. Mikes, G. Sarakinos, M. D. Lyman, D. E. Lngber, J. P. Vacantik, and R. Langer, Biotech. Bioeng., 42, 716 (1993).
-

- 14. Y. Yang, J. Zhao, Y. Zhao, L. Wen, X. Yuan, and Y. Fan, J. Appl. Polym. Sci., 109, 1232 (2008).
-

- 15. Y. S. Nam, J. J. Yoon, and T. G. Park, J. Biomed. Mater. Res., 52, 1 (2000).
-

- 16. V. Karageorgiou and D. Kaplan, Biomaterials, 26, 5474 (2005).
-

- 17. Y. Hong, J. Guan, K. L. Fujimoto, R. Hashizume, A. L. Pelinescu, and W. R. Wagner, Biomaterials, 31, 4249 (2010).
-

- 18. H. Park, B. L. Larson, M. D. Guillemette, S. R. Jain, C. Hua, G. C. Engelmayr Jr., and L. E. Freed, Biomaterials, 32, 1856 (2011).
-

- 19. L. Ghasemi-Mobarakeh, M. P. Prabhakaran, M. Morshed, M. H. Nasr-Esfahani, H. Baharvand, S. Kiani, S. S. Al-Deyab, and S. Ramakrishna, J. Tissue Eng. Regener. Med., 5, e17 (2011).
-

- 20. D. Mawad, E. Stewart, D. L. Officer, T. Romeo, P. Wagner, K. Wagner, and G. G. Wallace, Adv. Funct. Mater., 22, 2692 (2012).
-

- 21. J. G. Hardy, J. Y. Lee, and C. E. Schmidt, Curr. Opin. Biotechnol., 24, 847 (2013).
-

- 22. N. Li, Q. Zhang, S. Gao, Q. Song, R. Huang, L. Wang, L. Liu, J. Dai, M. Tang, and G. Cheng, Sci. Rep., 3, 1604 (2013).
-

- 23. S. A. Guelcher, V. Patel, K. Gallagher, S. Connolly, J. E. Didier, J. Doctor, and J. O. Hollinger, Proc. AIChE, Anual Meeting, Austin, Texas, p. 6261 (2004).
-

- 24. C. J. Spaans, V. W. Belgraver, O. Rienstra, J. H. de Groot, R. P. H. Veth, and A. J. Pennings, Biomaterials, 21, 2453 (2000).
-

- 25. J. S. Choi, J. S. Park, B. Kim, B.-T. Lee, and J.-H. Yim, Polymer, 124, 95 (2017).
-

- 26. J. S. Park, B. Kim, B.-T. Lee, J. S. Cho, and J.-H. Yim, J. Mater. Chem. B, 6, 4082 (2018).
-

- 27. P. M. Losaria and J.-H. Yim, J. Ind. Eng. Chem., 74, 108 (2019).
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2019; 43(5): 735-740
Published online Sep 25, 2019
- 10.7317/pk.2019.43.5.735
- Received on May 4, 2019
- Revised on May 30, 2019
- Accepted on Jun 3, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Jin-Heong Yim
-
Division of Advanced Materials Engineering, Kongju National University 1223-24 Cheoandaero, Cheonan, Chungnam 31080, Korea
- E-mail: jhyim@kongju.ac.kr
- ORCID:
0000-0002-3557-9564










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.