- Elution Behavior of Nizatidine Immediate Release Tablets According to Lactose and Microcrystalline Cellulose Content
Jun Jae Jung, Jin Woo Kim, Pil Yun Kim, Won Kyung Kim, Jeong Eun Song, and Gilson Khang†

Department of BIN Convergence Technology, Department of Polymer Nano Science & Technology and Polymer Materials Fusion Research Center, Jeonbuk National University, 567 Baekje-daero, Jeonju 54896, Korea
- 젖당과 미결정 셀룰로오스 함량에 따른 니자티딘 속방정 방출 거동
전북대학교, BIN융합공학과, 고분자나노공학과, 고분자융합소재연구소
Recently, patients suffering
from unexpected chronic diseases such as gastric ulcer and reflux esophagitis
are increasing due to irregular eating habits, frequent stress, and excessive
drinking. Nizatidine is a histamine receptor antagonist that inhibits gastric
acid production by locally binding to the histamine H2 receptor and is mainly
used as a treatment for gastric ulcer and reflux esophagitis. Lactose can
increase drug volume and provide moderate water solubility, but it decreases
hardness. To confirm the increase of hardness and stability of drug when
lactose is blended with microcrystalline cellulose to make solid dispersion,
nizatidine, lactose and microcrystalline cellulose solid dispersion was
manufactured by rotary evaporator in methanol/dichloromethane cosolvent
condition. For characterization of the solid dispersion, SEM, DSC, XRD and FTIR
were performed, and then drug release was confirmed through an in vitro
dissolution test. A relatively good inclusion rate was confirmed in a solid
dispersion having a ratio of lactose and microcrystalline cellulose of 3:7, and
an ideal behavior of immediate release tablet was confirmed by this. As the
result of this, it can be confirmed that nizatidine and
lactose/microcrystalline cellulose can be used as immediate release tablet for
reflux esophagitis.
최근 불규칙한 식습관, 잦은
스트레스, 지나친 음주로 인해, 위궤양과 역류성 식도염같은
만성질환으로 고통받는 환자가 증가하고 있다. 니자티딘은 히스타민 수용체(histamine-2 receptor, H2)와 국소적으로 결합하여 위산 생성을 억제하는 히스타민 수용체 길항제로
주로 위궤양과 역류성 식도염 치료제로 사용된다. 젖당을 이용하여 제형 제조 시 제형의 부피를 증가시키고
우수한 수용성의 장점이 있지만 제형의 경도가 좋지 않아 쉽게 분해되는 단점이 있다. 젖당과 미결정 셀룰로오스를
적절한 비율로 혼합하여 고체분산체 제조 시 미결정 셀룰로오스에 의해 제형의 경도가 증가되고, 경도가
증가됨에 의해 제형의 안정성도 증가한다는 것을 확인하고자 니자티딘과 젖당/미결정 셀룰로오스를 메탄올/디클로로메탄 공용매 조건에서 회전증발기를 이용하여 고체분산체를 제조하였다. 고체분산체의
특성분석을 위해, SEM, DSC, XRD, FTIR을 실시하였고, 이
후 생체 외 용출거동을 통해 약물 방출을 확인하였다. 젖당과 미결정 셀룰로오스의 비율이 3:7인 고체분산체에서 상대적으로 우수한 포접률을 확인하였으며, 이를
이용한 속방정의 약물방출 거동으로 이상적인 속방정 약물방출 거동을 확인하였다. 이러한 결과로 니자티딘과
젖당/미결정 셀룰로오스를 이용한 속방정은 역류성 식도염 치료제로 사용 가능함을 확인할 수 있다.
The dissolution test was performed as the first
dissolution test method in the Korean pharmacopoeia. Dissolution test
conditions was set to 100 rpm, 900 mL, 37± 0.5 oC, pH 1.2 solution. The
sample taken was filtered using 0.45 ㎛
PTFE filter and analyzed by HPLC.
Keywords: nizatidine, immediate release, rotary evaporation, solid dispersion
본 연구는 과학기술정보통신부의
재원으로 한국연구재단의 지원(NRF-2017K1A3A7A03089427)을 받아 수행된 국제화기반조성사업이다.
위궤양, 역류성 식도염은
위산과다 등의 원인으로 발생된다. 위산은 위 벽세포에서 주로 히스타민에 의해 히스타민 수용체가 활성화되어 분비된다. 히스타민 수용체가 활성화되면
세포 내 고리형 아데노신 1인산(cyclic adenosine monopho-sphate, cAMP)과 칼슘이온(calcium
ion, Ca2+) 농도가 증가하고 수소/칼륨 에이티피아제(hydrogen potassium adenosine
triphosphase, H+/K+ ATPase)가 활성화되어 최종적으로 염산(hydrochloric
acid, HCl)의 형태로 위산이 분비된다.1,2 니자티딘(nizatidine, NIZ)은 높은 용해도와
낮은 흡수도를 가지는 생물약제학적 분류체계(biophamaceutics classification system, BCS) class 3 약물로
위장과 소장 상부에서 발생하는 위궤양과 같은 위장 질환 치료제로 사용된다. 히스타민 수용체 길항제(histamin-2 receptor
antagonists)인 니자티딘은 히스타민 수용체(histamine-2 receptor, H2)와 결합하여 위에서 산 생성을 억제하고 산으로 인한 위 손상을 방지시키는 약물이다.3,4
니자티딘은 같은 히스타민 수용체 길항제로 사용되는 시메티딘, 라니티딘, 파모티딘과 비교하였을
때, 상대적으로 낮은 부작용을 가진다.5,6 그리고 다른 히스타민 수용체 길항제와 달리 간대사를 거치지
않아 90%에서 최대 100%까지 높은 생체 이용률을 가지며, 대부분 소변으로 배출되어 간부전에 영향을 받지 않는다. 니자티딘은 성인 기준 1일 최대
300 mg을 경구 투여하여 복용하며, 다량 투여할 경우 두통,
구토, 설사 등의 부작용을 일으킬 수 있으며 14일 이상 장기적으로 복용할 경우 내성으로 인한 위산 억제 효과가 감소할 수 있다.7
고체분산체 제조방법은
크게 용융법, 분무건조법, 동결건조법, 회전증발법 등이 있으며 이번 연구에서는 회전증발법을 이용하여 고체분산체를 제작하였다. 회전증발법은 물, 에탄올, 메탄올과 같이 전달체와 약물을 용해시킬 수 있는 공용매와
용매의 끓는점을 이용하여 회전증발을 통해 용매만을 증발시키는 방법으로 고체분산체를 얻어내는 방법이다.8
고체분산체 제조에
사용되는 젖당은 1분자의 갈락토오스와 1분자의 글루코오스가 베타 1-4 글리코사이드 결합으로 연결된 이당류로 우수한 수용해성을 가지며 냄새가 없고
자체로 단맛을 가지고 있어 고미차단이 필요한 속방제형, 필름제형 제작 시 유용하게 사용된다.9
이와 같은 특성 이외에도 젖당은 제제연구 분야에서 제형의 부피를 증가시키는 목적의 부형제로도
널리 사용되며 미결정 셀룰로오스와 적절한 비율로 혼합하여 사용하면 미결정 셀룰로오스에 의해 제형의 경도가 증가하여 약물의 안정성을 증가시키는 효과가
있다.10
미결정 셀룰로오스(microcrystalline
cellulose, MCC)는 400미만의 중합도를 가지며, 입자의 크기는 5 μm 미만의 직경을 갖는 백색의 미세분말로 결정성 고분자이다.11 미결정 셀룰로오스는 여러 무기산에 의해 주로 표면에서 산화되어
황산염기(sulfate
group)나 카복실기(carboxyl group)로 치환된다. 이러한 과정으로 인해 높은 음이온성을 가지는 미결정 셀룰오로스는 제제연구 분야에서 부형제, 유화제, 안정제,
분산제, 고화방지제 등으로 널리
활용되고 있다.12
이번 연구는 젖당과
미결정 셀룰로오스가 약물의 안정성에 미치는 영향을 확인하기 위해 회전증발법을 이용하여 젖당, 미결정 셀룰로오스를 니자티딘과 적절한 비율로 혼합하여
고체분산체를 제작하였고, FTIR, DSC, SEM, XRD, HPLC, 용출시험을 통해 제작된 니자티딘 속방정의 특성분석과 용출거동을 확인하고자
한다.
시약 및 재료. 본 실험의 모델약물은 니자티딘(NIE, SHASUN
Pharma, 인도)을 사용하였으며, 젖당(lactose monohydrate) (Junsei Chem Co, Ltd, 일본), 미결정 셀룰로오스(micro-crystalline
cellulose, MCC) (JRS Pharma, 독일)를 사용하여 고체분산체를 제조하였다. 붕해제로 Crosporvidone (Polyplasdone XL-10) (ISP
Tech, 미국), Kollidon CL(BASF, 독일), 카복시메틸셀룰로스(carboxy methyl cellulose, CMC)
(Sigma-Aldrich, 미국), 전분 글리콜산 나트륨(sodium starch glycolate, SSG) (JRS Pharma, 독일),
PVP K-30(SHOWA, 일본)을 사용하였으며, 쓴맛 차폐를 위한 감미제로 소르비톨(sorbitol) (Sigma-Aldrich, 미국)과
니자티딘 속방정 제조 시 타정기와 타정용 기구에 분체의 부착 방지를 위한 활택제로 스테아린산 마그네슘(magnesium stearate,
MgSt) (Nitika Chemical, 일본), 계면활성제로 소듐라우릴황산염(sodium lauryl sulfate, SLS)
(Sigma-Aldrich, 미국)을 사용하였다. 실험에 사용된 모든 유기 용매는 HPLC 등급을 사용하였다.
니자티딘 고체분산체 및 니자티딘 속방정 제조. 니자티딘 고체분산체는 니자티틴 150 mg과 젖당, 미결정 셀룰로오스를 Table 1과 같이 메탄올(MeOH)/디클로로메탄(dichloromethane,
DCM) 공용매에 용해시켜 회전증발기(N-1110, Eyelar, Japan)를 사용하여 제조하였고, 니자티딘 속방정은 Table 2와 같이 여러
첨가제를 이용하여 제조하였다. 고체분산체 제조를 위한 회전증발은 60±5 oC에서 수행되었다. 니자티딘과 젖당, 미결정 셀룰로오스는 MeOH/DCM 공용매에 용해시킨
후 균일한 혼합을 위해 초음파 분쇄를 충분한 시간 동안 실시하였다. 제작된 고체분산체는 데시케이터에서 사용 전까지 보관하였다.
고체분산체의 약물함량 측정. 고체분산체의 약물 함량을 측정하기 위하여 고체분산체를 공용매에 용해시킨 후 1 mL씩 취하여
0.45 μm의 PTFE 필터로 여과한 후 고성능액체 크로마토그래피(high performance
liquid chromatography, HPLC)를 이용하여 320 nm의 파장에서 측정하였다. 이후 사용된 약물의 비를
식 (1)을 이용하여 약물 함량을 측정하였다.13

고체분산체의 구조학적 분석. 니자티딘, 젖당, 미결정 셀룰로오스의 함량 및 제조과정에
따른 화학적 변화를 관찰하기 위하여 FTIR(fourier transform infrared, GX, Perkin Elmer, 미국)을 이용하여
측정하였다. 브롬화 칼륨(potassium bromide, KBr)과 시료의 비를 100:1의 비율로 혼합하여 박판을 제조하였으며
4000~450 nm-1 파장에서 분석하였다.
고체분산체의 결정화도 분석. 제조된 니자티딘 고체분산체의 결정화도 분석을 위해
PXRD(powder X ray diffraction, MAX 2500 X-Ray Diffractometer, 일본)와 시차주사 열량계(differential
scanning calorimetry, DSC, DSC 4000, Perkin Elmar Inc., 미국)를 이용하였다. PXRD는 4°/min의
속도로 10~90° 범위 내에서 30 mA, 40 kV 조건으로 투명한 유리기판에 일정량의 시료를 충분히 고정하여 배향이 발생하지 않도록 측정하였다.
DSC는 10~200 oC 범위에서 10 oC/min의 속도로
온도를 증가시키면서 결정성을 확인하였다.
고체분산체의 형태학적 분석. 제조된 니자티딘 고체분산체의 입자상태와 표면을 확인하기
위해 주사전자현미경(LV-SEM, S-3000N, Hitachi Co, Tokyo, 일본)을 이용하여 관찰하였다. SEM 분석을 위한 샘플 준비과정은
시료를 탄소테이프 위에 고정시켜 아르곤 가스 환경에서 백금-팔라듐 코팅을 120초간 2회 실시하였다. 시료는 20.0 kV에서 관찰하였다.
니자티딘 속방정의 생체 외 용출 거동. 용출실험은 대한 약전에 기제된 용출시험법 제1회전검체통법을
사용하였고, 용출액은 인공위액(pH 1.2)으로 대한 약전에 기제되어 있는 방법을 통하여 제조하였다. 용출기는 DST-610(Labfine
Sci Instr., 한국)을 사용하였다. 패들회전속도는 100 rpm, 용출액 온도는 37±0.5 oC, 용출액은 900 mL로 설정하였다. 정해진 시간마다 1 mL의 시료를 취하였고 취한 만큼의 인공위액을 다시 주입하였다.
취한 시료는 0.45 μm PTFE 필터로 여과한 후 HPLC분석을 실시하였다.
HPLC 조건. 제조된 니자티딘 속방정제의 방출거동을 확인하기 위한
HPLC 분석은 HPLC 시스템(NS-4000, Futecs, 한국), 오토샘플러(NS-6000, Futecs, 한국)를 사용하였다. 분석에 사용한
컬럼은 ProntoSIL 120-5 C18 SH(4.6×250 mm, 5 μm, Knauer, 독일)을 이용하였고 유속은
1.0 mL/min, 검출파장은 320 nm, 시료 주입량은 20 μL로 설정하였다. 이동상은 아세토나이트릴(acetonitrile,
ACN)과 증류수(distilled water, DW)를 1:1(v/v %)의 비율로 혼합하여 사용하였고, 사용하기 전 충분한 시간 동안 초음파 분쇄를 실시하여 잔존가스와 기포를 제거 후
사용하였다.14
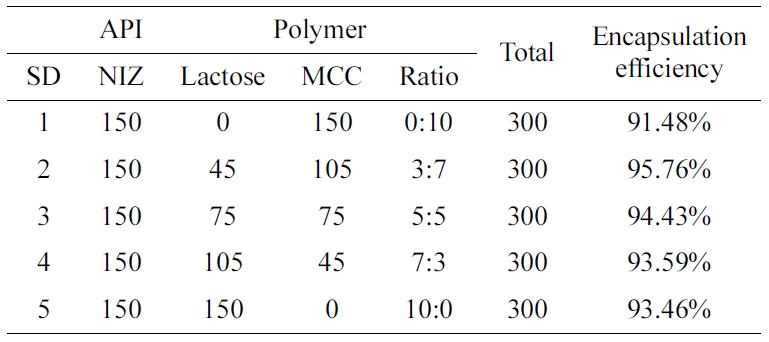
제작된 니자티딘 고체분산체 약물 포접. Table 1에서 볼 수 있듯이 제조된 니자티딘 고체분산체는
젖당과 미결정 셀룰로오스의 함량에 따라 포접률이 달라지는 것을 확인할 수 있다. 제조된 니자티딘 고체분산체 중에서 SD 2는 약 95± 0.5%로 가장 높은 포접률이 나타났고, SD 1는 약
91±0.5%의 가장 낮은 포접률을 나타냈다. 이는 젖당과 미결정 셀룰로오스의 비율이 3:7인 SD 2가 니자티딘을 포접할 수 있는 최적의 조건이라는
것을 의미한다. 또한 SD 1과 SD 5의 경우 동일한 회전증발 조건에서 젖당과 미결정 셀룰로오스를 각각 사용한 고체분산체로 젖당과 미결정 셀룰로오스를
혼합하여 사용한 다른 고체분산체보다 상대적으로 약물이 포접되지 못하고, 외부 요인에 의한 약물의 분해가 진행된 것으로 사료된다.
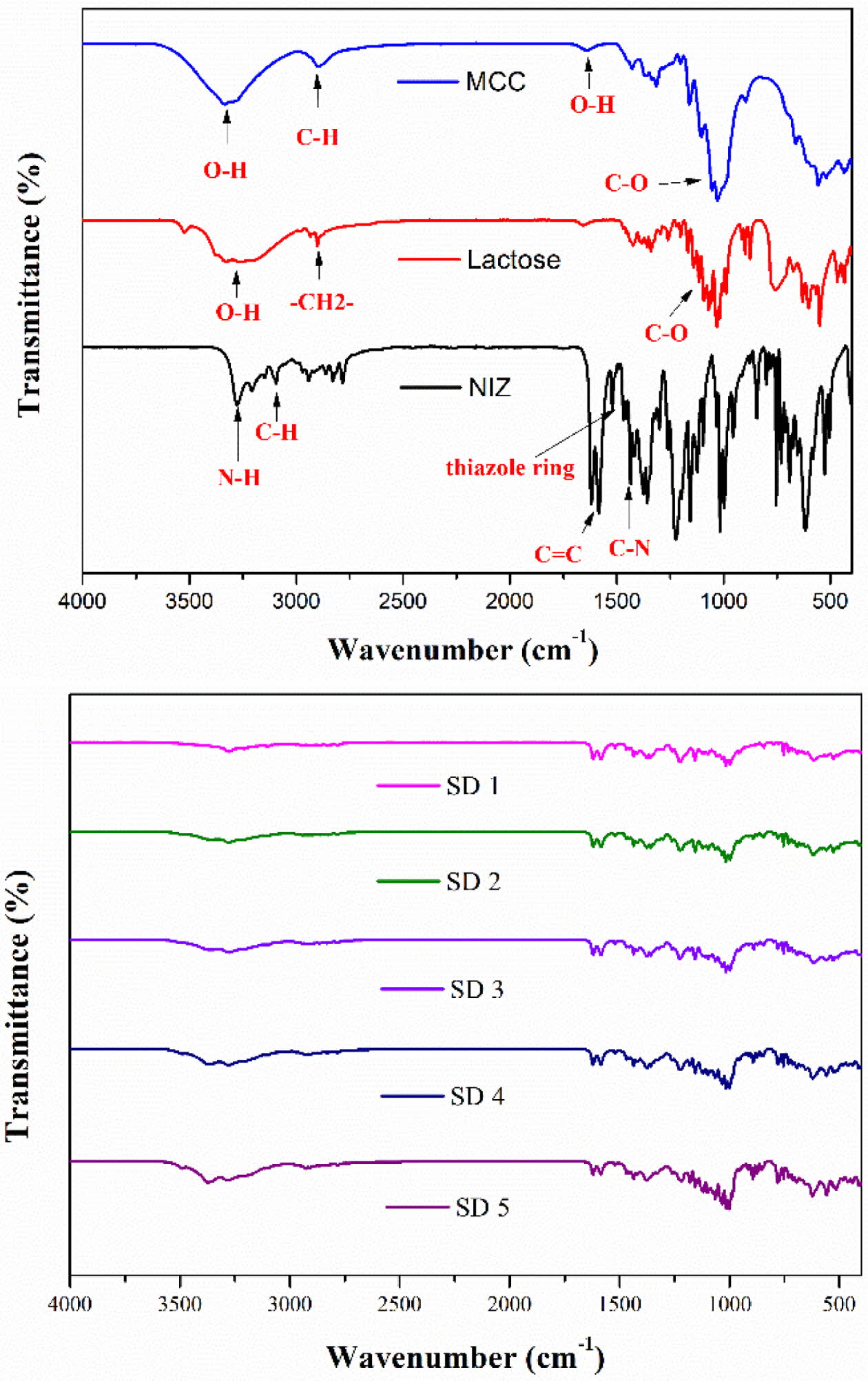
고체분산체의 구조학적 분석. Figure 1은 니자티딘과 젖당, 미결정 셀룰로오스로 제조된 고체분산체의 물리화학적 상호작용과
구조학적 특성분석을 위한 FTIR 그래프이다. 니자티딘의 주요 피크는 N-H 결합(3276 cm-1), 티아졸 고리의 C-H
결합(3094 cm-1), NO2의
C=C 공명(conjugation) (1618 cm-1), 티아졸 고리(1520 cm-1), C-H 결합(1469 cm-1), C-N 결합(1435 cm-1)으로 확인되어진다.15 미결정 셀룰로오스는 3334, 2869, 1640, 1053 cm-1에서 주요 피크가 확인되었으며,
각각 하이드록시 그룹, 피라노이드 고리의 C-H 결합, 하이드록시 그룹, 셀룰로오스의 C-O 결합을 나타낸다.16 젖당은 3262, 2900, 1000~1200 cm-1에서 주요 피크가 확인되었으며
각 하이드록시 그룹, 방향족 고리에 의한 -CH2- 결합으로 나타났다.17 고체분산체 제조에 사용된 니자티딘과 젖당, 미결정 셀룰로오스의
주요 피크가 모든 배합조건에서 나타났고, 새로운 피크는 확인되지 않았다. 이를 통해 고체분산체 제조 시 사용된 니자티딘과 젖당, 미결정 셀룰로오스가 상호작용하며,
니자티딘이 변성되지 않았다고 사료된다.
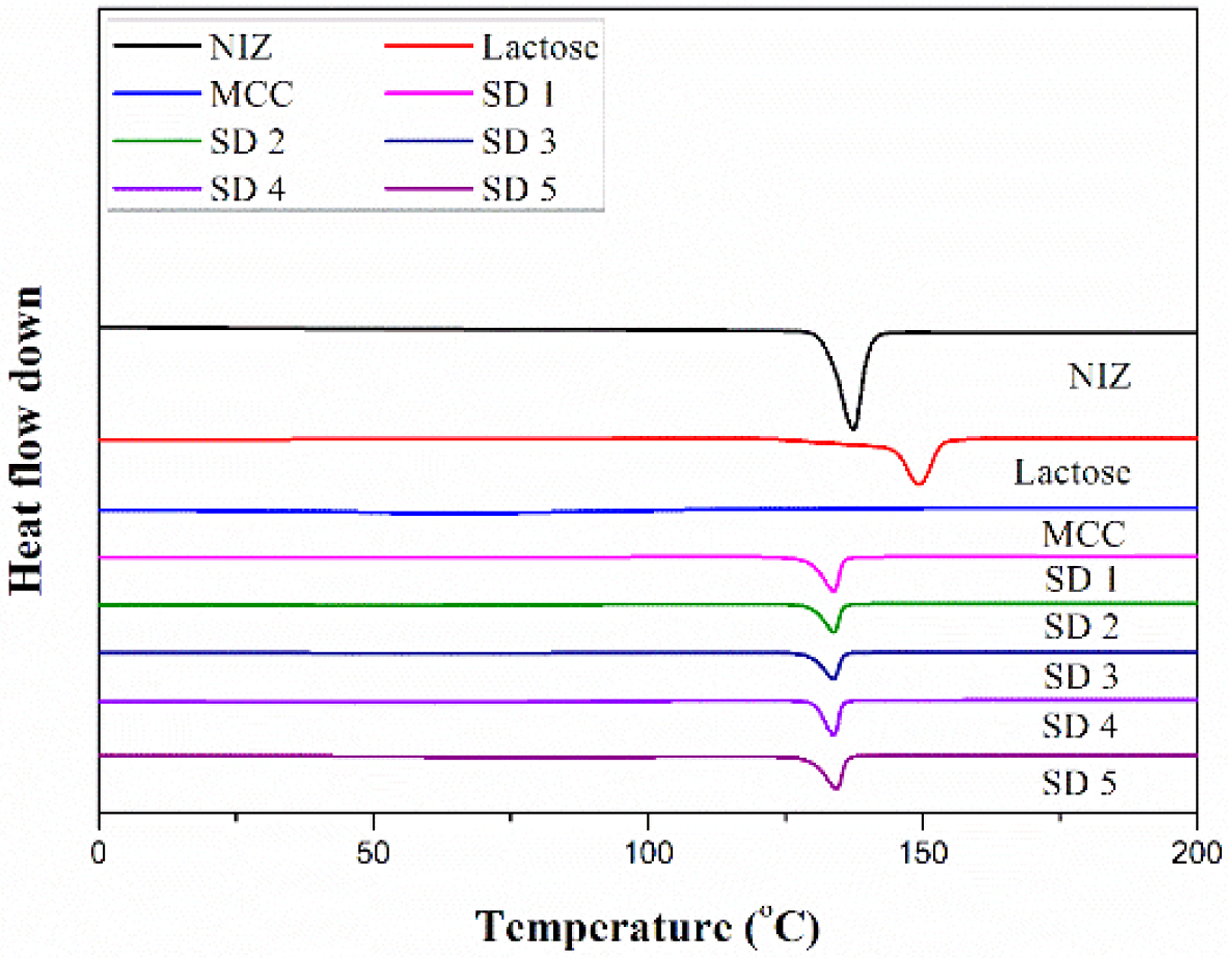
고체분산체의 열적, 결정학적 분석. Figure 2는 니자티딘과 젖당, 미결정 셀룰로오스의 열적 특성
분석을 위한 DSC 데이터이다. 니자티딘의 흡열피크는 130 oC 부분에서 나타났고,18
젖당의 흡열피크는 150 oC, 미결정 셀룰로오스의 흡열피크는 측정 범위 내에서 확인되지 않았다. 모든 고체분산체에서 니자티딘의 흡열
피크를 확인할 수 있었으며, 젖당의 흡열피크는 관찰되지 않았다. 이는 미결정 셀룰로오스와의 상호작용과 니자티딘의 영향으로 인해 나타난 것으로 사료된다.
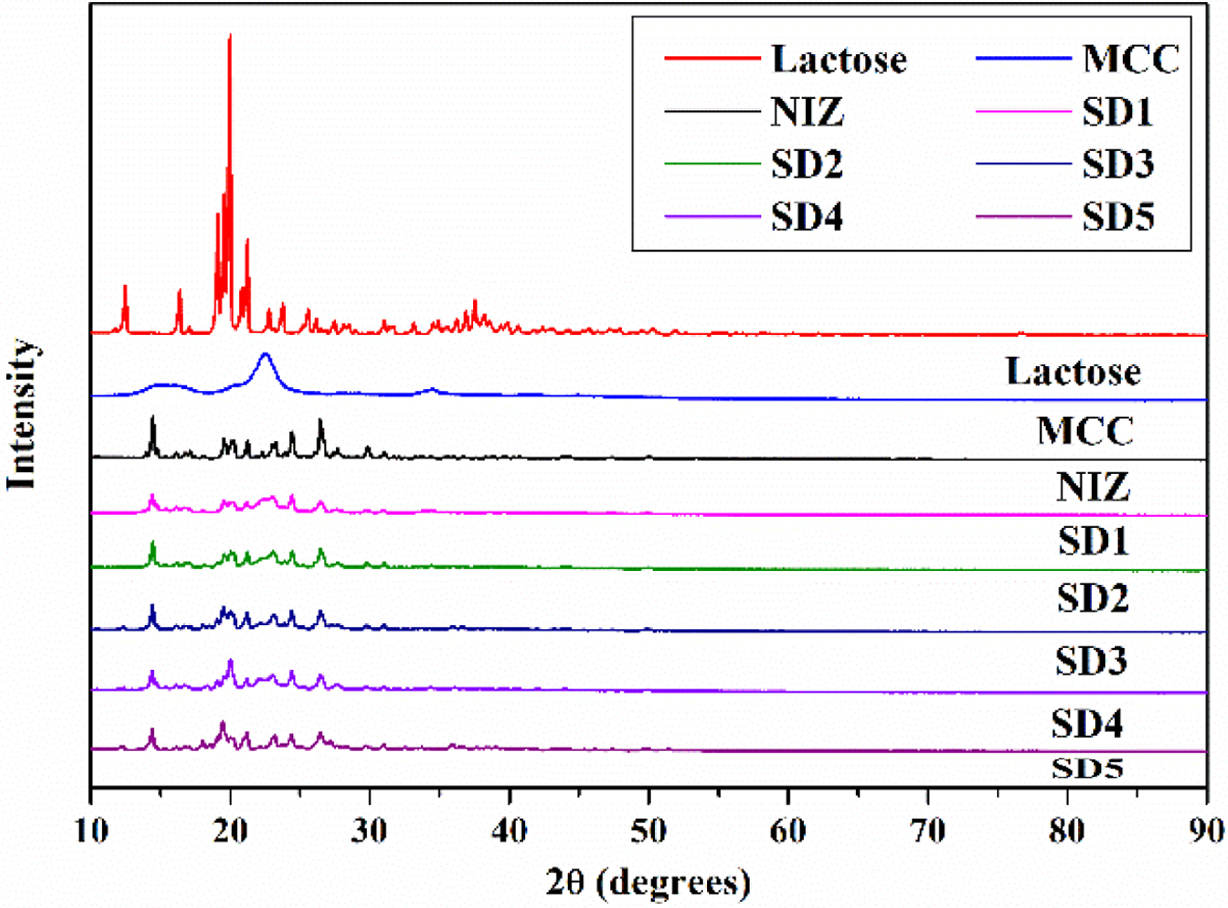
니자티딘과 젖당,
미결정 셀룰로오스를 이용하여 제조된 고체분산체의 결정학적 분석은 XRD로 확인하였다(Figure 3). 그 결과, 젖당은 상당히 높은 결정화 피크를 보였으며,
미결정 셀룰로오스는 무정형의 피크가 확인되었다. 니자티딘은 젖당과 비교했을 때 상대적으로 낮은 결정화 피크를 가졌고, 제조된 고체분산체는 니자티딘과
비슷한 결정화 피크를 확인할 수 있었다. 일반적으로 결정화 피크가 낮게 나타나게 되면, 수분과 접촉할 수 있는 표면적이 증가하게 되고 사슬간 수분의 침투가 용이하게 되어 쉽게 분해되는 성질을 가지게 된다. 이러한 성질을 가지는 고체분산체를 이용하여 속방정을
제조한다면 체내에서 쉽게 분해되고 약물방출 속도에 영향을 미쳐 빠른 약물방출 거동을 보일 것이라 사료된다.
고체분산체의 형태학적 분석. 니자티딘과 젖당, 미결정 셀룰로오스 및 제조된 고체분산체의
입자 표면을 확인하기 위한 형태학적 분석은 SEM을 이용하여 분석하였고 그 결과는 Figure 4에 나타냈다. 니자티딘과 젖당은 10~30 μm의 작은 결정크기를 가지고 있으며 불규칙한 형태와
크기 분포를 나타낸다. 미결정 셀룰로오스는 20 μm 이상의 막대형태를 가진다. 제조된 고체분산체에서는 니자티딘과 젖당, 미결정 셀룰로오스가 기존에 가지고
있던 형태가 나타나지 않고 전체적인 입자 크기가 작아진 것을 관찰할 수 있으며, 젖당 함량이 증가하고 미결정 셀룰로오스의 함량이 낮아짐에 따라
입자 크기가 증가하는 경향이 확인되었다. SD 2를 보면 입자의 크기가 상대적으로 균일한 것을 확인할 수 있는데 이를 통해 젖당과 미결정 셀룰로오스
질량 비율이 3:7일 때 가장 좋은 혼합 비율이라 사료된다.
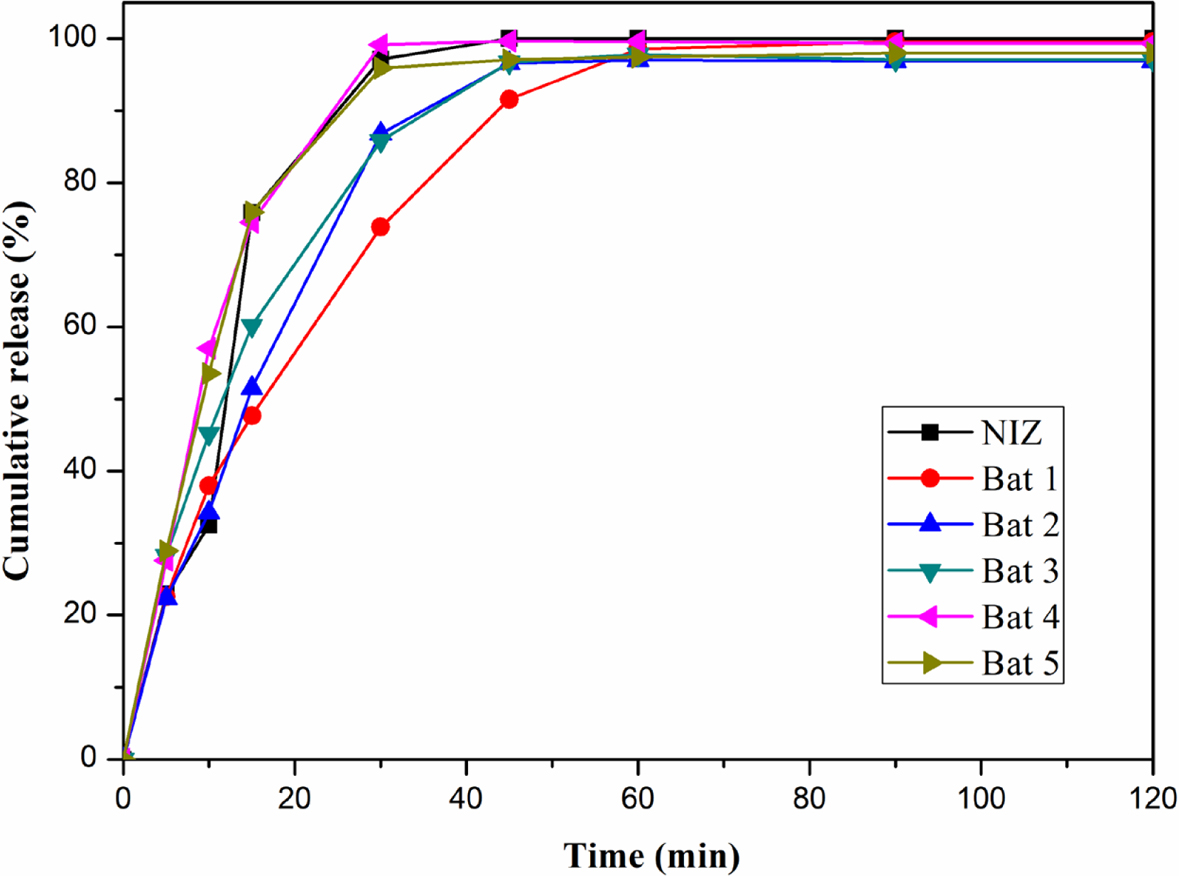
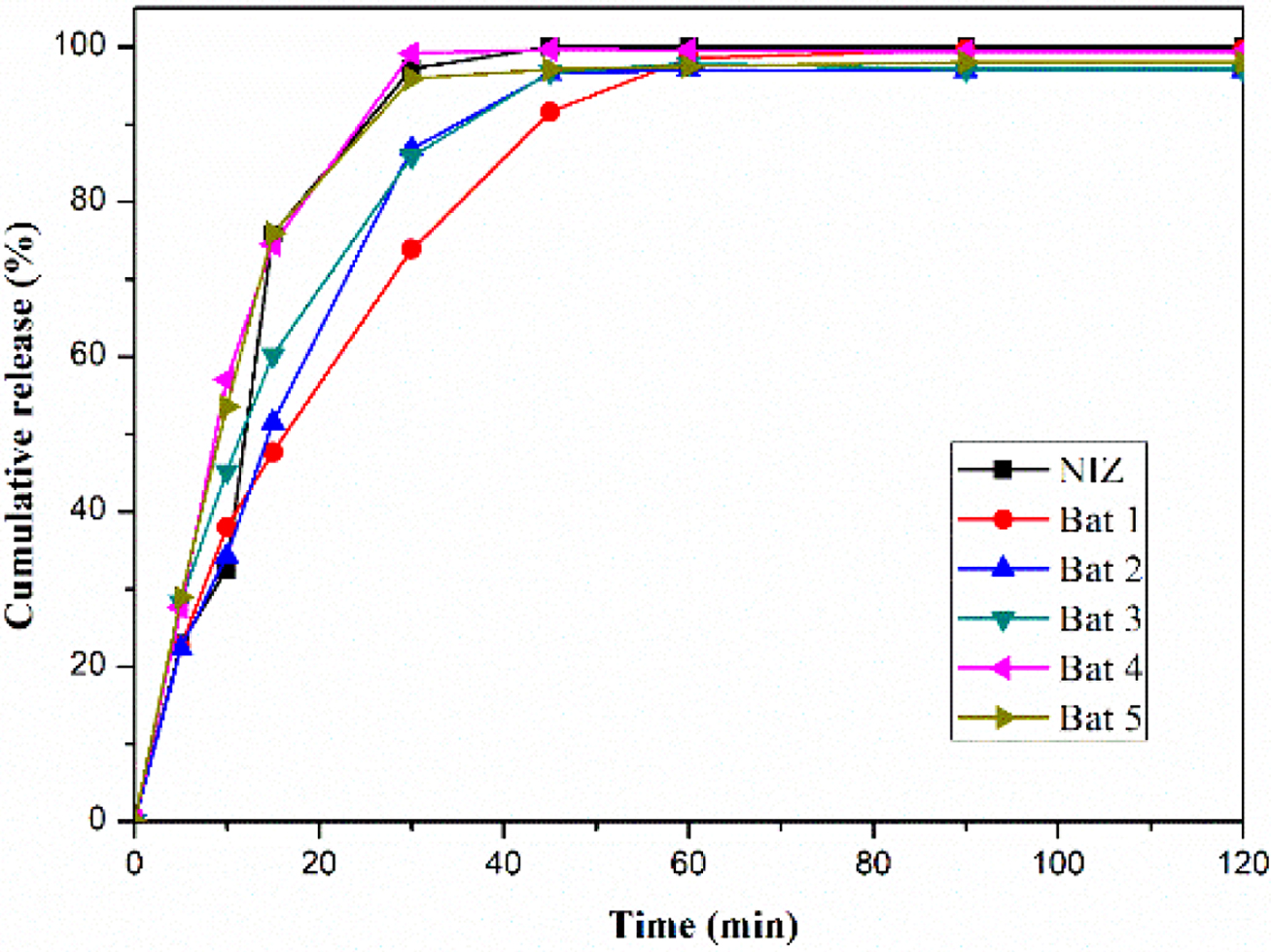
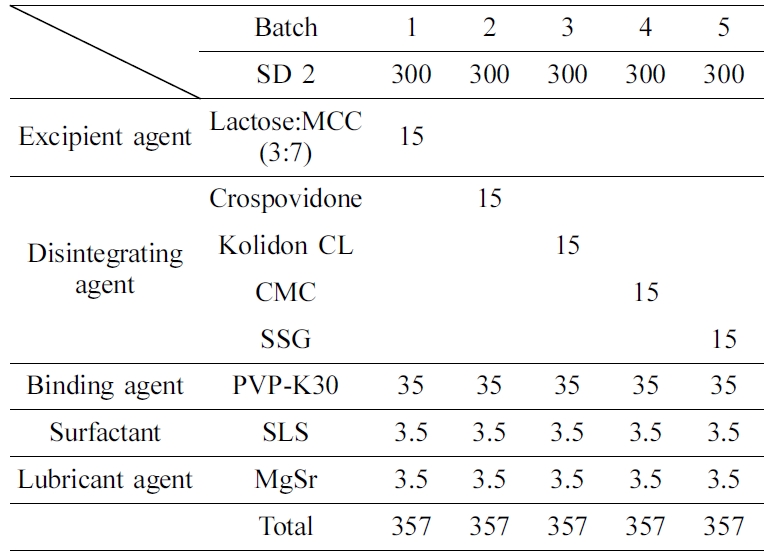
니자티딘 속방정의 생체 외 용출 거동. Figure 5는 니자티딘과 젖당, 미결정 셀룰로오스로 제조된 고체분산체와
여러가지 첨가제를 첨가하여 위장에서 빠른 약물방출을 목적으로 제조된 니자티딘 속방정의 용출 거동 결과이다. 각 배치는 젖당과 미결정 셀룰로오스의
질량 비율이 3:7인 고체분산체(SD 2)를 이용하여 제작하였고, 배치 1은 부형제로 젖당과 미결정 셀룰로오스를 사용하였고. 배치 2, 3,
4, 5는 crospovidone, kolidon CL, CMC, SSG를 붕해제로 첨가하여 제조하였다. 배치 1은 다른 배치들과 비교했을 때
상대적으로 늦은 시간에 최대 방출을 보였다. 배치 2, 3, 4, 5를 보면 약 15분에서 순서대로 51, 60, 75, 76%의 약물 방출을
확인할 수 있다. 배치 4, 5가 동일한 시간에 상대적으로 많은 약물 방출을 보였고, 이를 통하여 니자티딘 속방정 제조에 사용된 다른 붕해제들보다
CMC와 SSG가 빠른 붕해효과를 가진다는 것을 확인할 수 있다. 용출실험은 인공 위액에서 진행하였고, 0, 5, 10, 15, 30, 45,
60, 90, 120분째 인공 위액을 채취하였다. 회전증발법을 이용하지 않고 여러 첨가제가 함유되지 않은 니자티딘으로만 제작된 제형은 15분까지 약 30% 이상의 약물을 방출한 반면, 첨가제가
함유된 다른 제형들은 최대 60%까지 방출한 것을 확인할 수 있다. 이는 니자티딘 속방정 제조 시 함유된 붕해제에 의한 붕해로 인하여 순수 니자티딘으로만
제작된 제형보다 빠른 약물 방출 거동이 나타난 것으로 보이며 모든 배치의 최대 약물 방출률은 90% 이상에 이르렀다. 이 결과를 통해 고체분산체로
제조된 약물의 방출 거동뿐만 아니라 고체분산체와 각 붕해제들의 약물 방출 정도를 확인할 수 있었다.
|
Figure 1 FTIR spectra of NIZ, lactose, MCC, SD 1, SD 2, SD 3,
SD 4, and SD 5. |
|
Figure 2 DSC thermograms of NIZ, lactose, MCC, SD 1, SD 2, SD
3, SD 4, and SD 5 |
|
Figure 3 XRD patterns of NIZ, lactose, MCC, SD 1, SD 2, SD 3,
SD 4, and SD 5. |

|
Figure 4 SEM images of NIZ, lactose, MCC, SD 1, SD 2, SD 3,
SD 4, and SD 5. |
|
Figure 5 Release behaviors of NIZ, Bat 1, Bat 2, Bat 3, Bat 4, and
Bat 5. |
본 연구는 제형의
경도를 젖당과 미결정 셀룰로오스로 변화시켜 경도의 증가로 인해 약물인 니자티딘의 안정성 증가 효과를 확인하기 위해 고체분산체를 제조하였다. 그
결과, 젖당과 미결정 셀룰로오스의 비율이 3:7인 SD 2가 가장 좋은 비율임을 확인하였다. SD2를 이용하여 니자티딘 속방정을 제조하였고,
FTIR, DSC, XRD, SEM을 이용하여 고체분산체의 구조학적, 열적, 결정학적, 형태학적 특성분석을 확인하였다. HPLC와 생체 외 용출
거동으로 부형제와 붕해제에 따른 영향을 확인할 수 있었다. 젖당과 미결정 셀룰로오스를 3:7 비율로 혼합하여 사용 시 가장 우수한 약물의 안정성
증가 효과를 확인할 수 있었고, 이상적인 속방정의 약물 방출 그래프와 비슷한 약물 방출 거동을 보인 배치 4, 5를 통해 젖당과 미결정 셀룰로오스,
여러 붕해제를 이용하여 빠른 방출 거동을 가지는 속방정 제조가 가능함을 확인할 수 있었다.
- 1. N. D. Yeomans, Am. J. Med., 140, 56S (1998).
-

- 2. J. M. Shin and N. Kim, J. Neurogastroenterol. Motil., 19, 25 (2013).
-

- 3. T. Aihara, E. Nakamura, K. Amagase, K. Tomita, T. Fujishita, K. Furutani, and S. Okabe, Pharmacol. Ther., 98, 109 (2003).
-

- 4. C. H. Wilder-Smith, T. Ernst, M. Gennoni, B. Zeyen, F. Halter, and H. S. Merki, Dig. Dis. Sci., 35, 976 (1990).
-

- 5. S. B. Aglawe and A. U. Gayke, World J. Pharm. Pharm. Sci., 6, 1345 (2017).
-

- 6. Y. Shahzad, N. Ibrar, T. Hussain, A. M. Yousaf, I. U. Khan, and S. A. A. Rizvi, Sci., 1, 22 (2019).
-

- 7. W. J. Song, M. H. Kim, S. M. Lee, Y. E. Kwon, S. H. Kim, S. H. Cho, K. U. Min, Y. Y. Kim, and Y. S. Chang, Allergy Asthma Immunol. Res., 3, 128 (2011).
-

- 8. M. J. Kim, J. H. Lee, H. Yoon, S. J. Kim, D. Y. Jeon, J. E. Jang, D. Lee, and G. Khang, J. Pharm. Investig., 43, 107 (2013).
-

- 9. J. H. Kirk, S. E. Dann, and C. G. Blatchford, Int. J. Pharm., 334, 103 (2007).
-

- 10. T. M. Chitu, D. Oulahna, and M. Hemati, Powder Technol., 208, 441 (2011).
-

- 11. J. H. Park, J. Ku, S. Il. Ahn, J. H. Lee, Y. T. Kim, D. S. Kim, W. Kim, J. M. Rhee, and G. Khang, Tissue Eng. Regen. Med., 5, 729 (2008).
- 12. M. D. Xue, T. Kimura, J. F. Revol, and D. G. Gray, Langmuir, 12, 2076 (1996).
-

- 13. H. K. Jeong, J. Y. Park, S. Y. Kim, S. R. Cha, S. E. Lee, N. K. Jang, W. T. Lee, J. P. Lee, J. E. Song, and G. Khang, Polym., 40, 33 (2016).
-

- 14. D. A. I. Ashiru, R. Patel, and A. W. Basit, J. Chromatogr. B Anal. Technol. Biomed. Life Sci., 860, 235 (2007).
-

- 15. T. J. Wozniak, Anal. Profiles Drug Subst. Excip., 19, 397 (1990).
-

- 16. N. Jia, S.-M. Li, M.-G. Ma, J.-F. Zhu, and R.-C. Sun, BioRes., 6, 1186 (2011).
- 17. A. L. Balieiro, R. A. Santos, M. M. Pereira, R. T. Figueiredo, L. S. Freitas, O. L. S. de Alsina, A. S. Lima, and C. M. F. Soares, Braz. J. Chem. Eng., 33, 361 (2016).
-

- 18. R. A. Reddy, B. Ramesh, and V. Kishan, Int. J. Pharm. Sci. Nanotech., 6, 2281 (2013).
- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2022 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2020; 44(4): 566-571
Published online Jul 25, 2020
- 10.7317/pk.2020.44.4.566
- Received on Apr 11, 2020
- Revised on Apr 27, 2020
- Accepted on Apr 28, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Gilson Khang
-
Department of BIN Convergence Technology, Department of Polymer Nano Science & Technology and Polymer Materials Fusion Research Center, Jeonbuk National University, 567 Baekje-daero, Jeonju 54896, Korea
- E-mail: gskhang@jbnu.ac.kr
- ORCID:
0000-0002-6452-5653









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.