- Effects of Solubility Parameter of Solvents in Solvent-induced Crystallization of Polycarbonate
School of Chemical and Biological Engineering, Seoul National University, 1 Gwanak-ro, Seoul 08826, Korea
*Department of Chemical Engineering, Soongsil University, 369 Sangdo-ro, Seoul 06978, Korea- 폴리카보네이트의 용매 유도 결정화에 미치는용해도 파라미터의 영향 분석
서울대학교 화학생물공학부, *숭실대학교 화학공학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Solid-state polymerization of polycarbonate (PC) is a good way to improve the problems of existing polymerization methods. However, it requires the crystallization of PC pre-polymer as a pre-treatment step, and solvent-induced crystallization is mainly used in the pre-treatment process. In this work, the crystallinity of PC with different kinds of solvents was measured by DSC. Then, the correlation was analyzed by using the Hansen solubility parameter distance (Ra) and interaction parameter (χ). In addition, the morphology of crystals and depth of crystal region were analyzed by SEM
폴리카보네이트(PC)의 고상중합법은 기존의 중합법들의 문제를 개선하는 좋은 방법이지만, PC 프리폴리머를 결정화하는 전처리 과정을 필요로 한다. 전처리 과정에서는 용매 유도 결정화법이 주로 사용되고 있다. 본 연구에서는 다양한 용매를 이용하여 결정화한 PC의 결정화도를 DSC를 이용하여 측정하였고, Hansen 용해도 파라미터 거리(Ra)와 상호작용 파라미터(χ)를 이용하여 연관관계를 분석하였다. 또한 SEM을 이용하여 결정의 형태와 결정영역의 두께를 관찰하였다
The correlation between interaction parameter and crystallinity was analyzed. The more strongly interactive solvents were used, the more crystallized polycarbonates were obtained. Also, it was observed that bulky solvents are difficult to penetrate into the polymer chain by SEM images.
Keywords: polycarbonate, solvent-induced crystallization, crystallinity, Hansen solubility parameter distance, interaction parameter
이 연구는 롯데케미칼의 연구비 지원으로 수행되었으며, 연구비 지원에 감사드립니다.
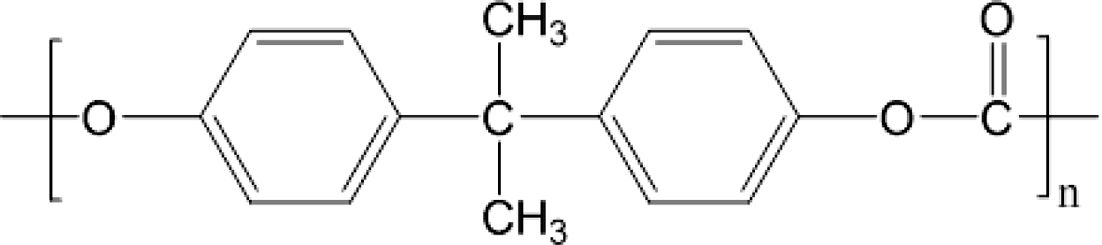
폴리카보네이트(polycarbonate, PC)는 Figure 1과 같은 반복구조로 이루어져 있으며, 우수한 열적/기계적 물성을 가지면서도 투명한 특성으로 인해 자동차, 전자부품, 의료용품 등의 소재로 많이 활용되고 있다.1,2 현재 사용되고 있는 PC 중합법은 계면중합법(interfacial polymerization)과 용융중합법(melting polymerization)이 있다. 계면중합법은 포스젠(phosgene)과 비스페놀-A(bisphenol-A)를 이용하여 PC를 중합하는 방법으로 투명하고 분자량이 큰 PC를 생산하기 적합한 공정이나, 유독성 물질인 포스젠을 사용하기 때문에 환경적인 규제가 심하다.3 용융중합법은 디페닐카보네이트(diphenyl carbonate)와 비스페놀-A를 고온에서 녹여 중합하는 방법으로, 계면중합법에 비해 환경적으로 유리하며 공정이 단순하다는 장점이 있다. 하지만, 고온 환경에서 반응이 진행되어 황변 현상, 순도 저하 등의 문제가 발생한다.4,5
두 중합법의 단점을 극복하기 위해 고상중합법(solid-state polymerization)이 도입되었다. 고상중합법은 분자량이 작은 프리폴리머(pre-polymer)를 먼저 중합한 다음, 유리전이온도(glass transition temperature)와 용융온도(melting temperature) 사이에서 고체상태로 중합하는 방법이다. 환경적으로 유리하며 황변 현상을 줄이고 고순도의 PC를 얻을 수 있다는 장점이 있지만, 높은 분자량을 가지는 PC를 얻기 위해서는 중합 전, 프리폴리머를 결정화하는 과정을 필요로 한다. 고분자를 결정화하는 일반적인 방법으로는 열적 결정화법(thermal crystallization)과 용매 유도 결정화법(solvent-induced crystal-lization)이 있다. PC와 같은 비결정성 고분자는 열적 결정화법을 통해서는 결정을 빠른 시간에 충분히 성장시키기 어렵다는 단점이 있기 때문에,6 상대적으로 결정화 속도가 빠른 용매 유도 결정화법이 적용되고 있다.
용매 유도 결정화법은 용매의 확산에 의해 고분자 사슬의 유동성을 증가시켜 결정화를 유도하는 방법으로, 용매의 특성이 결정화에 큰 영향을 미치는 것으로 알려져 있다.7,8 본 연구에서는 PC 프리폴리머를 다양한 용매를 통해 결정화하여, 각 용매의 특성이 PC의 결정화에 미치는 영향을 분석하였다. Heiss가 분류한 PC 용매 자료를 참고하여 PC의 비결정성 부분을 결정성으로 전환시키는 용매들을 사용하였으며,9 각 용매의 PC와의 상호작용을 계산하여 PC의 결정화도(crystallinity)에 미치는 영향을 분석하였다. PC와 용매의 상호작용은 Hansen 용해도 파라미터 거리(Hansen solubility parameter distance)를10 Flory-Huggins의 혼합 이론에 적용하여 계산된 상호작용 파라미터(interaction parameter)를 통해 나타내었다.11,12
|
Figure 1 Chemical structure of polycarbonate. |
시약. polycarbonate(PC, 롯데케미칼), acetone(대정, 99.5%), butanone(Kanto, 99.0%), 3-pentanone(Alfa, 99.0%), methyl isobutyl ketone(MIBK, Junsei, 99.5%), acetaldehyde (Sigma-aldrich, 99.0%), propionaldehyde(대정, 98.0%), buty-raldehyde(Junsei, 98.0%), methylacetate(Junsei, 99.5%), ethyl-acetate(Junsei, 99.5%), propylacetate(대정, 99.0%), isopro-pylacetate(Junsei, 99.0%), propylchloride(Sigma-aldrich, 98.0%), butylchloride(대정, 99%).
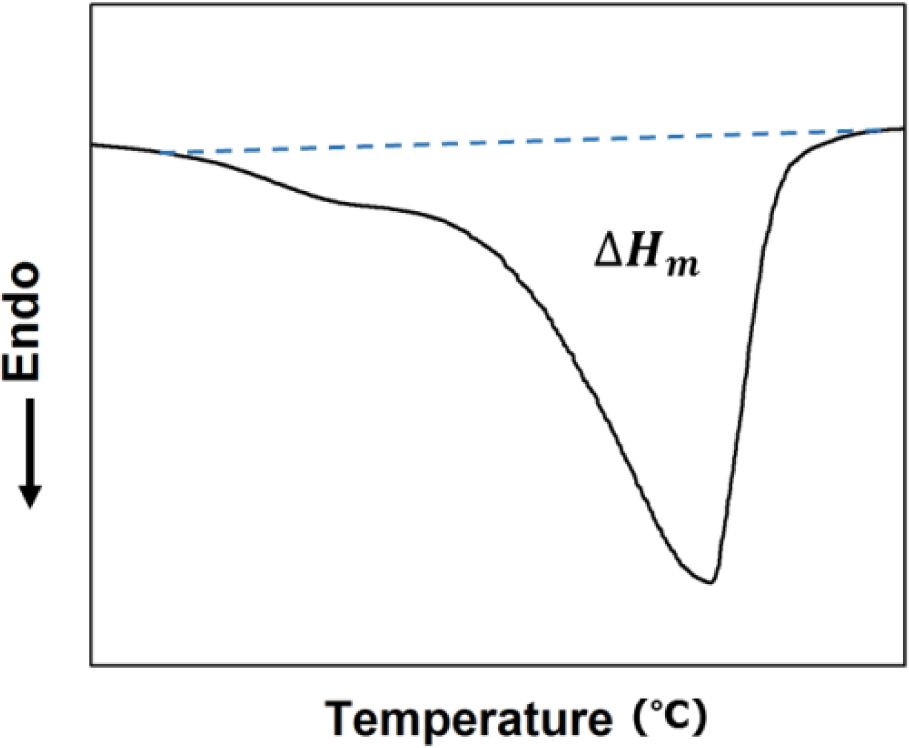
용매 유도 결정화.PC 프리폴리머를 각 용매에 녹여 용매 유도 결정화를 진행하였다. 사용된 PC의 수평균 분자량(number average molecular weight, Mn)은 2000, 중량평균 분자량(weight average molecular weight, Mw)은 4000이고, 결정화도는 무정형 수준인 1.1%이다. 펠렛 형태의 PC 5 g을 각각의 용매 10 g에 녹인 후, 25 oC에서 1시간 동안 120 rpm으로 교반시켜 결정화하였다. 0.25 mm의 체(sieve)를 이용하여 결과물을 걸러낸 후, 80 oC 진공 오븐에서 8시간 동안 남아있는 용매를 건조시켜 제거하였다. 시차주사열량계법(differential scanning calorimetry, DSC: Perkin elmer, DSC7)으로 각각의 용매에서 얻어진 PC의 결정화도를 측정하였다. 시료는 50 oC에서 260 oC까지 분당 10 oC의 속도로 승온하였다. Figure 2에 나타낸 그림과 같이 DSC 곡선의 피크를 적분하여 융해열(heat of fusion, ΔHm)을 구한 다음, 완전 결정성 PC의 융해열(134 J/g)과 비교하여 결정화도(Xc)를 계산하였다.13

주사전자현미경법(scanning electron microscopy, SEM: JEOL, JSM-6701F)으로 각 용매에서 얻어진 PC의 결정형태와 결정영역의 두께를 관찰하였다.
|
Figure 2 DSC curve of PC crystallized by acetone. |
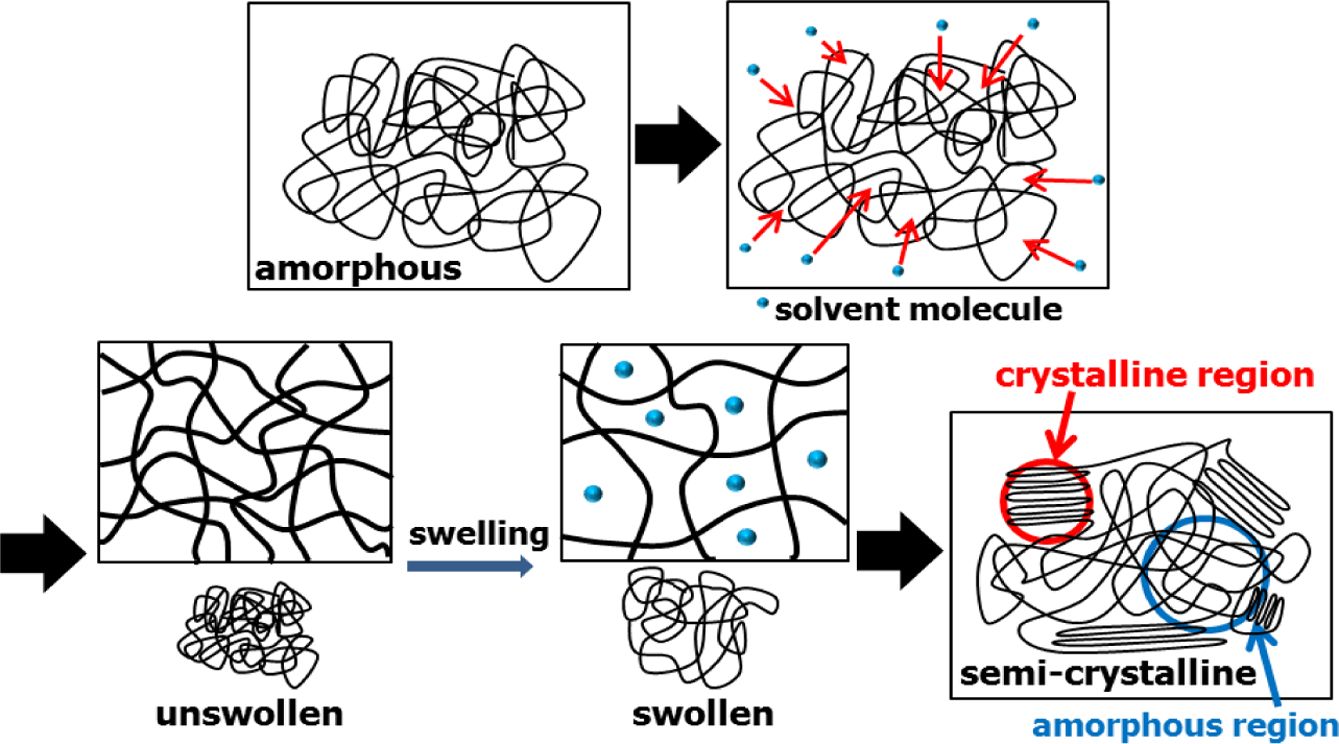
용매 유도 결정화법은 Figure 3의 모식도에서 나타낸 것과 같이, 내부로 침투한 용매의 영향으로 인해 유동성이 증가된 고분자 사슬이 열역학적으로 더 안정한 상태로 재배열되면서 결정을 형성하는 방법이다. 따라서 고분자와 용매의 상호작용의 세기가 결정화에 큰 영향을 미칠 것으로 판단된다. 이에 따라 Flory-Huggins의 혼합 이론을 도입하여 PC와 각 용매 사이의 상호작용과 결정화도의 연관관계를 분석하였다. 식 (2)에 나타난 혼합 깁스 자유에너지가 음의 값을 가질수록 혼합이 용이하다.

혼합 엔트로피는 혼합 과정에서 발생하는 무질서도의 변화로, 고분자의 용매와 혼합은 식 (3)과 같이 나타낼 수 있다. 혼합 엔트로피가 클수록 혼합이 용이하다.

중합도(x)가 높아질수록 혼합 엔트로피 값이 작아지기 때문에, 고분자와 용매의 혼합에서는 혼합 엔탈피의 영향에 비해 혼합 엔트로피의 영향은 상대적으로 무시할만 하다. 혼합 엔탈피는 식 (4)와 같으며, 혼합 엔탈피가 작을수록 혼합이 용이하다.

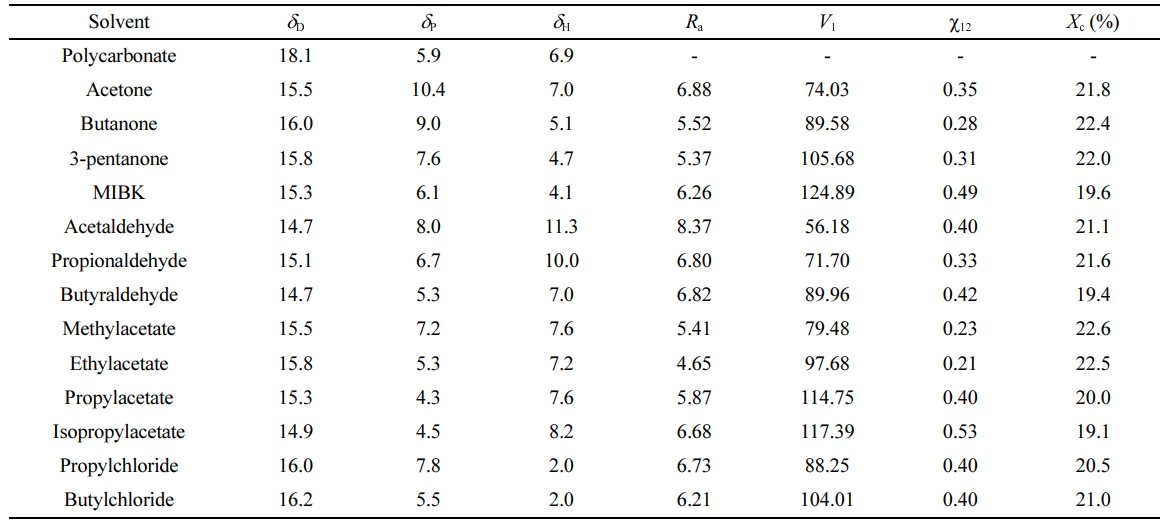
온도, 혼합 비율 등이 일정한 조건에서 혼합 엔탈피는 상호작용 파라미터에 비례하므로, 그 값이 작을수록 고분자 사슬 내부로 용매가 더 쉽게 침투하여 결정화를 돕게 된다. 용매의 용해도 파라미터를 이용하여 상호작용 파라미터를 구하는 대표적인 방법으로는 Hildebrand의 용해도 파라미터 차이를 이용하는 방법과14 Hansen의 용해도 파라미터 거리(Ra)를 이용하는 방법이 있다.10 Hildebrand의 용해도 파라미터 차이는 무극성 물질에 주로 적용되며 극성을 띠는 PC의 분석에는 다소 맞지 않는다. 따라서 Hansen의 용해도 파라미터 거리를 이용한 수식을 적용하였다. 각 물질의 용해도 파라미터 값들은 Hansen의 문헌에서 참고하였으며, Table 1에 나타내었다.15 Ra 값이 작을수록 혼합되는 두 물질의 친화력이 높음을 의미한다.

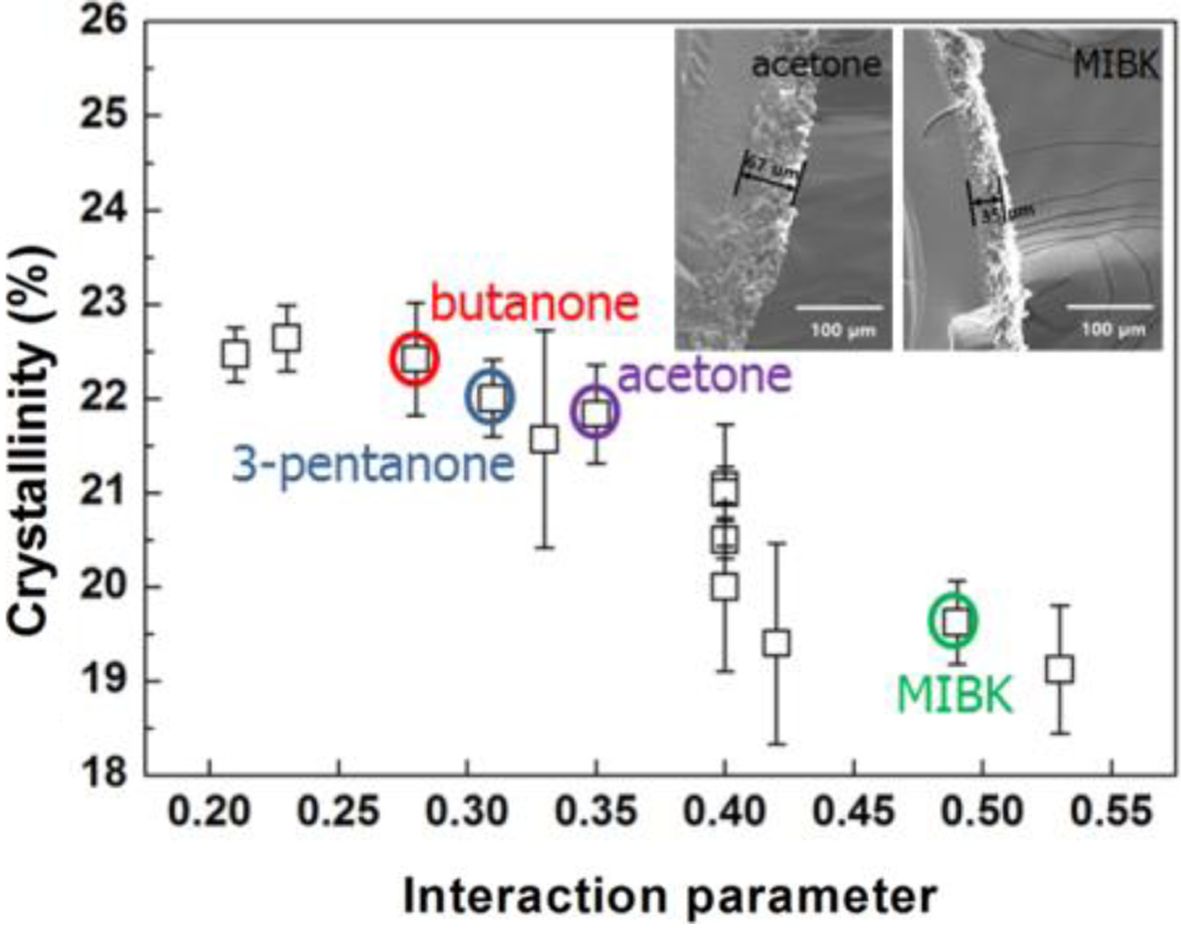
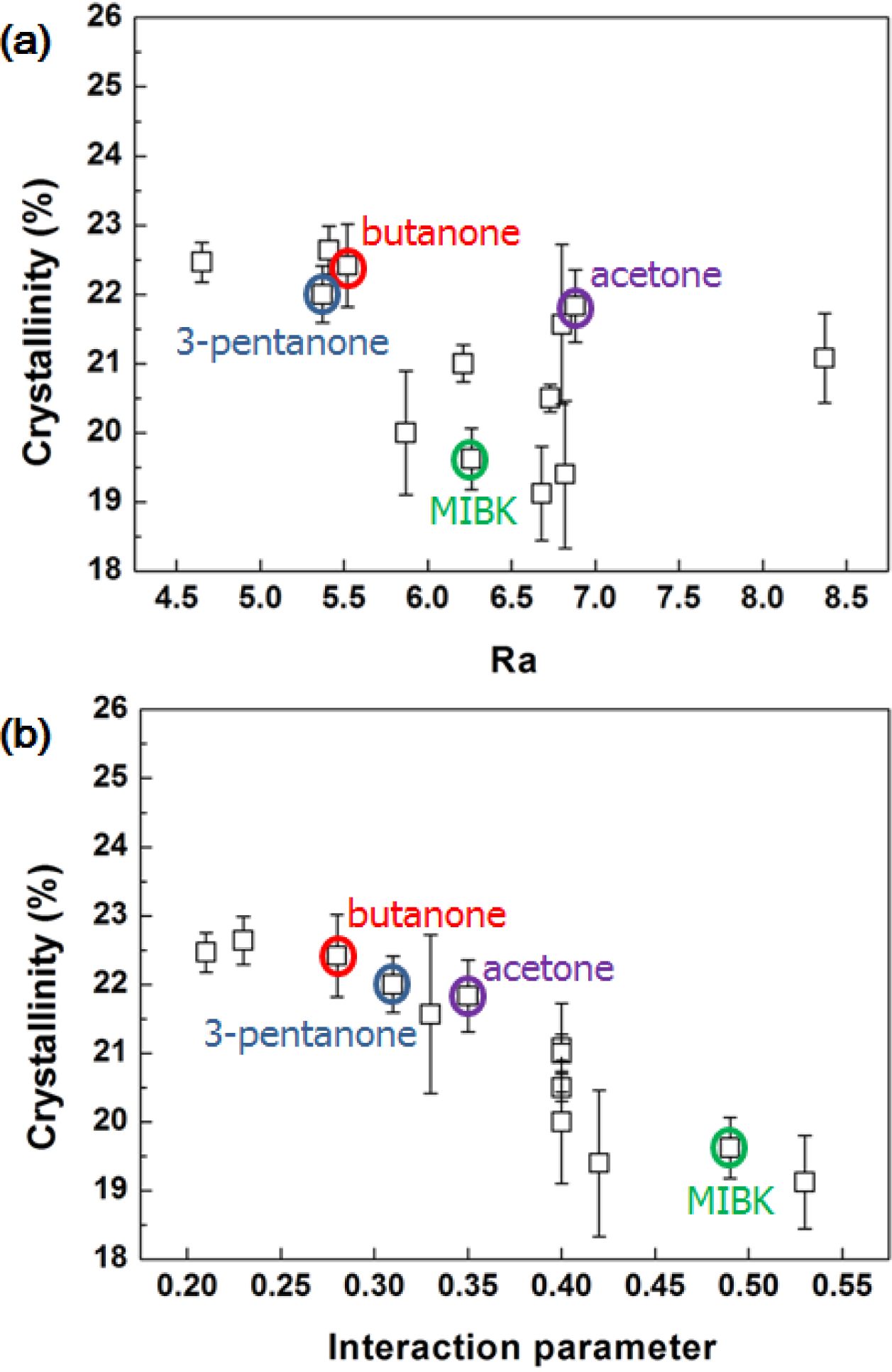
Table 1에 위의 식들에 따라 계산된 Ra, c12 값과 DSC 실험을 통해 측정된 결정화도를 정리하여 나타내었다. 도표로는 연관관계를 한눈에 파악하기 어렵기 때문에 Figure 4에 Ra 값과 결정화도의 연관관계(a)와 c12 값과 결정화도의 연관관계(b)를 그래프를 이용해서 나타내었다. Ra 값과 결정화도의 그래프에서는 별다른 연관관계를 보이지 않았으나, c12 값과 결정화도의 그래프에서는 c12 값이 커질수록 결정화도가 감소하는 경향을 볼 수 있었다. 이는 용매의 고분자 내부로의 침투 가능성은 둘 사이의 친화도의 영향 외에도 용매 분자의 크기에도 영향을 받기 때문으로 판단된다. 이에 따라 PC의 결정화도는 친화도만을 고려한 Ra 값보다는 용매의 몰 부피까지 같이 고려한 c12 값에 더 큰 연관성을 가지는 것으로 판단된다.
사용한 용매의 종류에 따른 결정화도는 19~23% 정도의 범위로 아주 큰 차이는 보이지 않았다. 이는 Heiss의 분류에 따라 PC에 비슷한 영향을 미치는 용매들을 선정하였기 때문으로 판단되며, 마찬가지의 이유로 용매의 작용기의 차이도 결정화도에 큰 영향을 주지 않는 것으로 보인다. 같은 작용기 내에서는 MIBK, butyraldehyde, isopropylacetate와 같이 크고 복잡한 구조를 가진 용매들을 사용하였을 때 다른 용매들을 사용하였을 때보다 상대적으로 낮은 결정화도를 보였다.
이를 좀 더 자세히 살펴보고자, PC의 결정형태와 결정영역의 두께를 SEM으로 관찰하였다. Figure 5에 케톤기의 용매들을 이용해 결정화한 PC의 표면과 파단면을 나타내었다. 결정화 전의 PC의 표면(Figure 5(a))은 매끈한 것을 볼 수 있으나, 아세톤에 노출된 PC의 표면(Figure 5(b))에는 지름이 대략 5 μm인 구형의 결정들이 생성되었음을 확인할 수 있었다. 결정이 구형의 형태를 가지는 것은 Figure 3의 모식도와 같이 용매의 침투에 의해 결정영역이 부분부분 생겨나기 때문으로 판단된다. 파단면을 살펴보았을 때 MIBK(Figure 5(d))를 이용하여 결정화한 PC의 결정영역의 두께는 35~40 μm로, 아세톤(Figure 5(e))이나 부탄온(Figure 5(f))을 이용했을 때의 결정영역의 두께인 65~70 μm에 비해 확연히 얇은 것을 볼 수 있었다. 이를 통해 같은 작용기의 용매에서 크기가 큰 용매를 사용하였을 때, 고분자 사슬 내부로 깊이 침투하기 어렵다는 것을 확인할 수 있었으며, 이로 인해 상대적으로 낮은 결정화도를 나타낸 것으로 판단된다.
|
Figure 3 Schematic diagram of solvent-induced crystallization. |
|
Figure 4 Relationship between (a) Hansen solubility parameter distance (Ra) and crystallinity; (b) interaction parameter (χ12) and crystallinity. |

|
Figure 5 SEM images of polycarbonates crystallized by solvents. Surface images are (a) amorphous; (b) acetone. Cross-sectional images are (c) amorphous; (d) MIBK; (e) acetone; (f) butanone. |
|
Table 1 Information of Hansen Solubility Parameters (dD, dP, dH,), Hansen Solubility Parameter Distance (Ra), Molar Volume (V1), Interaction Parameter (c12), and Crystallinity (Xc) |
용매 유도 결정화법으로 PC의 결정화 현상을 살펴보았다. 용매와 고분자의 친화도를 Hansen 용해도 파라미터 거리를 통해 나타내었고, Flory-Huggins 이론을 도입하여 용매의 크기까지 고려된 상호작용 파라미터와 결정화도의 연관관계를 살펴보았다. 강한 상호작용을 하는 용매를 사용할수록 높은 결정화도를 가지는 PC를 얻을 수 있었으며, 크기가 큰 용매를 사용했을 때 고분자 내부로 침투가 어려움을 SEM을 통해 확인하였다.
- 1. Schell, H. Chemistry and Physics of Polycarbonate; Interscience: New York, USA, 1964.
- 2. Allen, G.; Morley, D. C. W.; Williams, T. The Impact Strength of Polycarbonate. J. Mater. Sci. 1973, 8, 1449-1452.
-

- 3. Gu, J. T.; Wang, C. S. The Interfacial Polycarbonate Reactions. I. Defining The Critical Process Parameters. J. Appl. Polym. Sci. 1992, 44, 849-857.
-

- 4. Fukuoka, S.; Tojo, M.; Hachiya, H.; Aminaka, M.; Hasekawa, K. Green and Sustainable Chemistry in Practice: Development and Industrialization of a Novel Process for Polycarbonate Production from CO2 without Using Phosgene. Polym. J. 2007, 39, 91-114.
-

- 5. Davis, A.; Golden, J. H. Thermal Rearrangement of Diphenyl Carbonate. J. Chem. Soc. B 1968, 40-45.
-

- 6. Alizadeh, A.; Sohn, S.; Quinn, J.; Marand, H. Influence of Structural and Topological Constraints on the Crystallization and Melting Behavior of Polymers: 3. Bisphenol a Polycarbonate. Macromolecules 2001, 34, 4066-4078.
-

- 7. Miller, G. W.; Visser, S. A. D.; Morecroft, A. S. On The Solvent Stress‐cracking of Polycarbonate. Polym. Eng. Sci. 1971, 11, 73-82.
-

- 8. Turska, E.; Benecki, W. Studies of Liquid-induced Crystallization of Bisphenol a Polycarbonate. J. Appl. Polym. Sci. 1979, 23, 3489-3500.
-

- 9. Heiss, H. L. The Classification of Solvents for Bisphenol-A Polycarbonate. Polym. Eng. Sci. 1979, 19, 625-637.
-

- 10. Hansen, C. M. Dimensional Solubility Parameter and Solvent Diffusion Coefficient; Danish Technical Press: Copenhagen, Denmark, 1967.
- 11. Gedde, U. W. Polymer Physics; Chapman & Hall: London, UK, 1995.
- 12. Rubinstein, M.; Colby, R. H. Polymer Physics; Oxford: New York, USA, 2003.
- 13. Mercier, J. P.; Legras, R. Correlation between The Enthalpy of Fusion and The Specific Volume of Crystallized Polycarbonate of Bisphenol A. J Polym. Sci., Part B: Polym. Lett. 1970, 8, 645-650.
-

- 14. Hildebrand, J. H. A Critique of the Theory of Solubility of Non-Electrolytes. Chem. Rev. 1949, 44, 37-45.
- 15. Hansen, C. M. Hansen Solubility Parameters: A User’s Handbook; CRC Press LLC: New York, USA, 2002.
- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2021; 45(3): 476-480
Published online May 25, 2021
- 10.7317/pk.2021.45.3.476
- Received on Feb 19, 2021
- Revised on Feb 25, 2021
- Accepted on Feb 25, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Jae Young Jho and Tae Wook Yang*
-
School of Chemical and Biological Engineering, Seoul National University, 1 Gwanak-ro, Seoul 08826, Korea
*Department of Chemical Engineering, Soongsil University, 369 Sangdo-ro, Seoul 06978, Korea - E-mail: jyjho@snu.ac.kr, taugi@ssu.ac.kr
- ORCID:
0000-0003-4692-6362, 0000-0002-3776-3461










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.