- Development of PEGylated Rosmarinic acid Liposome for Anti-cancer and Anti-oxidant Effect
*Department of Biochemistry, Chungnam National University, 99 Daehak-ro, Daejeon 34134, Korea
**Institute of Biotechnology, Chungnam National University, 99 Daehak-ro, Daejeon 34134, Korea- 리포좀 개질화된 로즈마린산의 특성 분석과 항암∙항산화 효과
*충남대학교 생화학과, **충남대학교 생물공학연구소
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Apple mint (Mentha suaveolens) has been widely used in traditional herbal medicine since it shows hypotensive, analgesic, and anti-inflammatory effects. The active ingredient of apple mint is rosmarinic acid (RA), an ester of caffeic acid and 3,4-dihydroxyphenyl lactic acid. RA has many pharmacological effects, such as anti-oxidative, anti-apoptotic, anti-tumorigenic, and anti-inflammatory properties. In this study, RA is incorporated in PEGylated liposomes to enhance its pharmacological effects. The physical characteristics of RA liposomes were demonstrated by dynamic light scattering, zeta potential, and field emission scanning electron microscopy. The anti-oxidation and anti-cancer effects of RA liposomes were evaluated in HT22 and MDA-MB-231 cell lines, respectively.
애플 민트(Mentha suaveolens)는 전통적으로 사용된 허브의 한 종류로써 저혈압, 진통, 항염 효과를 갖고 있다. 로즈마린 산(rosmarinic acid, RA)은 그 활성 성분으로 알려져 있다. RA는 항산화, 항세포사멸, 항암, 항염증과 같은 약리학적 효과를 나타내는 것으로 알려져 있다. 본 연구에서는 RA를 폴리에틸렌 글리콜과 리피드를 이용하여 리포좀화시켜 기존의 RA 보다 더 높은 약리학적 효과를 나타내는 약물전달체를 개발하였다. 광적동산란(dynamic light scattering), 제트 전위(zeta potential), 전계 방사형 주사전자현미경(field emission scanning electron microscopy) 등을 이용한 입자의 물리화학적 물성을 분석하고, 마우스 해마 유래 세포주인 HT22에서 항산화 효과 및 사람 유방암 유래 세포주인 MDA-MB-231에서 확인하였다.
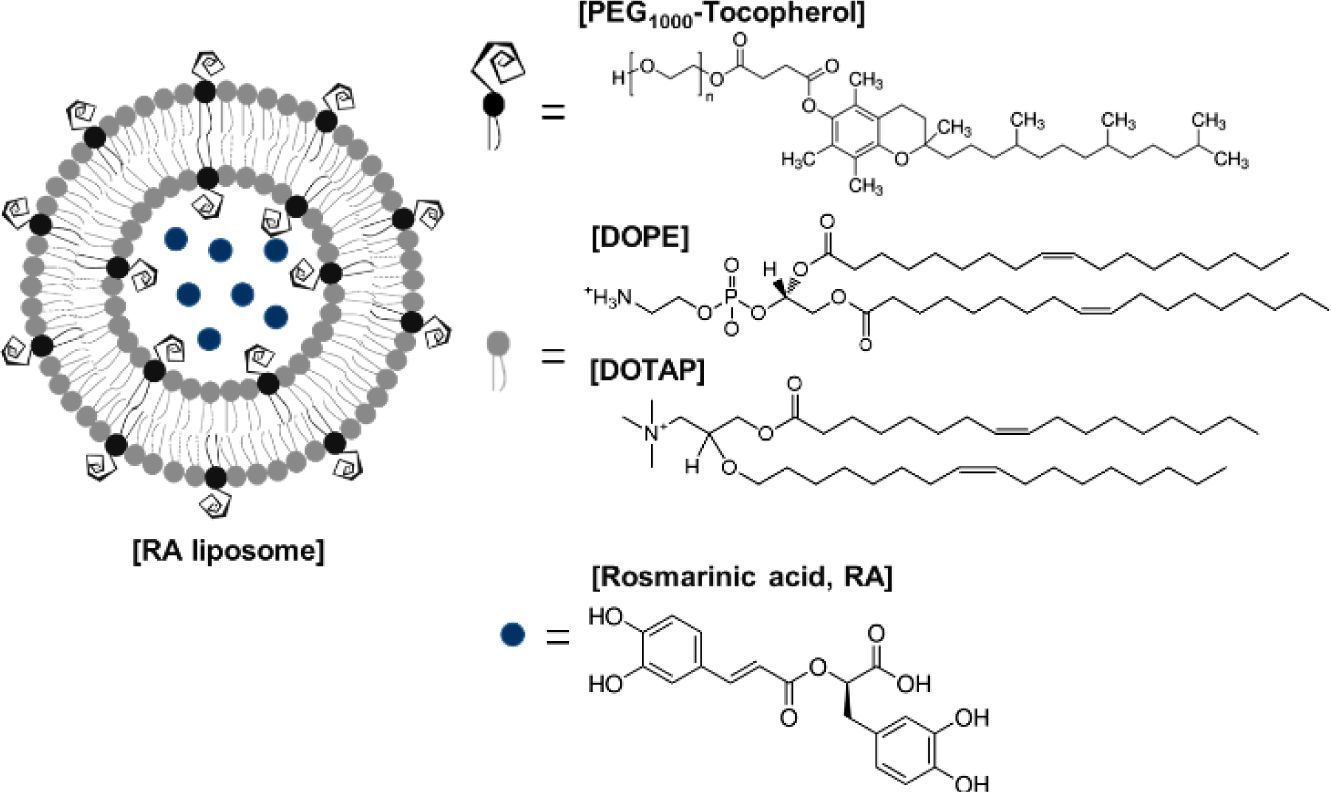
Rosmarinic acid (RA) has pharmaceutical effects such as anti-cancer, anti-inflammatory, and anti-oxidant effects. RA liposome was consist of PEG-tocopherol, 1,2-dioleoyl-3-trimethyl- ammonium-propane(chloride salt) (DOTAP), and 1,2-dioleoyl-sn-glycero-3-phosphoethanol-amine (DOPE), and RA was encapsulated inside the liposomes. RA liposomes showed stable nano-sized and effective anticancer and anti-oxidation in vitro.
Keywords: rosmarinic acid, liposome, anti-cancer, anti-oxidant, drug delivery.
이 성과는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(No. 2018 R1C1B6008653).
인구의 증가에 따른 질병의 증가로 이를 치료하기위한 항암, 항 염증, 항산화 효과를 갖는 다양한 천연 물질의 발굴과 약물들이 개발되어 사용되고 있다. 약물들의 개질화를 통한 효율 증대에 관한 연구는 다양한 방법으로 연구되고 있다. 그 중 약물 전달 시스템(drug delivery system)은 약물을 표적화하여 전달하는 것으로 고분자, 미셀, 리포좀, 하이드로젤, 에멀젼 등의 다양한 형태가 존재한다. 이러한 제형은 약물의 물리화학적 특성과 의학적 용도에 따라 형태의 변화가 가능하며, 생체 적합성 물질을 사용하여 인체 내 낮은 면역 반응과 독성을 갖게 개질화가 가능하다.
약물전달 시스템 중에서 리포좀은 세포막을 이루는 인지질이나 합성 지질구조를 이용하여 입자화
시킨 생체 모사 나노입자로써 이중막 구조를 갖고, 세포 함입 시 유동적으로 함입이 가능하다. 리포좀은 양이온, 음이온을 갖는 리피드와 다양한 탄소 길이를 갖는 리피드로 구성물질의 조정이 가능하다. 이러한 구성 물질에 따라 리포좀의 표면 전하와 입자의 사이즈 등의 물리화학적 성질을 조정이 가능하다.
따라서, 리포좀은 친수성, 소수성을 갖는 다양한 약물의 봉입이 가능하며 실제 개질화된 항암제 리포좀 의약품인 Doxil®, Depocyt®, Myocet® 등이 출시되어 항암제로 사용되고 있다.1-5
항암 이외에도 리포좀 개질화시킨 약물들은 곰팡이, 바이러스, 기능성 치료제로써 사용되고 있다.
스텔스 리포좀(Stealth liposome)은 약물전달 시스템에서 연구되고 있는 것으로 폴리에틸렌글리콜(polyethylene glycol, PEG)을 이용한 개질화를 말하는 것으로 페길화(PEGylation)라고 말한다. 페길화된 리포좀은 면역반응을 낮춰주고, 표적에서의 반감기 증가와 생체 내 독성을 낮추는 장점을 갖고 있다. 이러한 특성을 이용하여 페길화시킨 리포좀의 개질화는 약물의 투약량을 줄이고, 약물의 효과를 증대시킬 수 있다는 가능성을 갖고 있다.6,7 로즈마린산(rosmarinic acid, RA)은 Rosmarinus officinalis, Mentha suavelens에 함유된 페놀류 화합물로써 민트, 바질과 같은 허브 류에 다량 함유되어 있다. RA는 lithospermic acid, salvianolic acid, melitric acid, yunnaneic acid와 같이 다양한 구조의 파생 물질이 존재하며, 약리학적으로 항암, 항 염증, 항산화 그리고 항박테리아의 효과를 갖는다고 알려져 있다. 실제 연구에 따르면 RA는 알츠하이머, 심혈관 질환, 아토피, 알레르기 등에 효과를 보이는 것으로 보고되었다. 최근 보고에 따르면 RA가 MARK4를 저해하여 항암효과를 나타내는 결과와 알츠하이머병에서 나타나는 아밀로이드 β(Amyloid β)단백질의 응집을 저해시켜 병증을 완화시킨다는 연구가 보고되었다.
RA는 물에 소량 용해되지만, dimethyl sulfoxide(DMSO), dimethylformamide(DMF)와 같은 유기용매에 25 mg/mL까지 녹으며 용해도가 높다.8-10
본 실험에서는 RA를 폴리에틸렌 글리콜에 토코페롤이 결합되어 있는 폴리머와 1,2-dioleoyl-sn-glycero-3-phospho- ethanol-amine(DOPE), 1,2-dioleoyl-3-trimethylammonium-pro- pane(chloride salt)(DOTAP) 리피드 이용하여 리포좀화 시켜 수용액 상의 용해도를 높이고, 리포좀에 관한 물리화학적 물성 분석과 MDA-MB-231 유방암 유래 세포주에서의 항암효과와 HT22 마우스 해마 유래 세포주에서의 항산화 효과를 확인하여 암과 알츠하이머 병의 치료제로의 가능성을 확인하고자 한다.
재료. 2',7'-Dichlorofluorescin diacetate(DCFDA), dimethyl sulfoxide(DMSO), rosmarinic acid, 4-(2-Hydroxyethyl)pipe- razine-1-ethane-sulfonic acid(HEPES), hydrogen peroxide (H2O2), Thiazolyl Blue Tetrazolium Bromide(MTT), D-a-Tocopherol polyethylene glycol 1000 Succinate는 Sigma Aldrich(St. Louis, MO, USA)사에서 구매하였다. 1,2-dioleoyl-sn-glycero-3-phosphoethanol-amine(DOPE), 1,2-dioleoyl-3-trimethylammonium-propane(chloride salt)(DOTAP)은 Avanti polar lipid(Birmingham, AL, USA)사에서 구매하였다. Dulbecco’s modified Eagle’s medium(DMEM), Dulbecco’s phosphate-buffered saline(DPBS), fetal bovine serum(FBS)는 Welgene(Daegu, Korea)에서 구매하였다. Trypsin-EDTA는 Gibco(Gaithersburg, MD, USA)에서 구매하였다.
RA의 리포좀 개질화. 리포좀 개질화법은 이전 논문을 참고하여 진행하였다.11 에탄올/클로로포름(1:1,v/v)용매에 녹여져 있는 PEG-tocopherol과 DOPE, DOTAP을 각각 Table 1의 몰비(molar ratio)로 각각 계산하여 유리바이알에 4 mg의 리피드를 정량한다. RA은 에탄올에 녹여 1 mg을 증량하여 넣어준다. 질소 가스를 이용하여 리피드 필름 만든 후, 클로로포름으로 다시 리피드를 녹여 질소 가스로 용매를 제거해 준다. 진공에서 20분간 보관 후, HEPES 5 mM(pH 7.4) 수용액으로 녹여 미세초음파를 50 oC에서 30분간 처리해준다. 봉합되지 않은 RA를 Amincon 10 kD 컬럼을 이용하여 정제해준 후, 제작한 리포좀을 EtOH에 녹이고, 340 nm에서 RA의 흡광도를 측정하여 봉합률을 계산한다.
리포좀의 크기와 표면 전하 측정. 제작된 PEG 리포좀과 RA 리포좀의 사이즈와 표면 전하를 2 mg/mL 리포좀 농도로 수용액상에서 Zetasizer Nano ZS(Malvern, London, UK)를 이용하여 측정한다.
RA 리포좀의 전계 방사형 주사전자현미경(FE-SEM). RA 리포좀을 증류수에 희석하고, 실리콘 웨이퍼 위에 3 μL를 점적한다. 상온에서 건조시킨 후, Pt 코팅을 30 s 진행하고 FE-SEM(S-4800, Hitachi, Japan)을 이용하여 측정한다.
세포 독성과 항암효과 평가. MDA-MB-231, HT22 세포주는 DMEM, FBS 10%, Antibiotics 1%가 함유된 배양액에서 배양되었고, trypsin EDTA를 처리하여 재배양하였다.
MDA-MB-231, HT22 세포주에서 리포좀의 독성 실험을 위해 MTT assay를 진행하였다. 세포를 10000 cells/well을 96 well에 분주하였고, 24시간 후 각각 polyetherimide(PEI) 25 kD와 PEG 6% 리포좀을 처리하였다. 24시간 후, MTT(5 mg/mL) 시약을 10 μL 처리하고 4시간 후 배양액을 제거하였다. DMSO로 보라색 포르마잔을 녹여 570 nm에서 흡광도를 측정한다.
RA의 항암효과 평가는 위와 같이 세포를 96 well에 분주하고, 24시간 후 DMSO 0.1%에 녹인 RA과 RA 리포좀을 각각 6.25, 12.5, 25, 50, 100 μM로 처리하여 24시간 48시간 후에 MTT assay를 진행하였다.
항산화 효과 평가. HT22 세포주를 8 well에 20000 cells/well로 분주하고, 24시간 배양하였다. 각각 RA과 RA 리포좀을 10 μM을 각각 처리하여 24시간 배양하였다. 이 후 H2O2를 50 μM을 30 min간 처리하고, DCFDA 세포를 염색하고, 공초점 현미경 LSM 880(Zeiss, Oberkochen, Germany))을 이용하여 관찰하였다.
통계처리. Student’s t-test를 Graph Pad Prism5을 이용하여 통계처리 하였다.
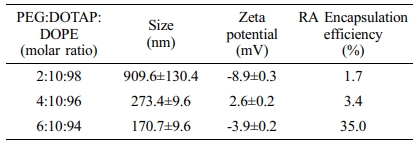
RA 리포좀의 물성 분석. 리포좀의 제작을 위해 각각의 PEG-tocopherol, DOTAP, DOPE를 몰비로 정량하여 리포좀을 제작하여 PEG 리포좀을 제작하였다. DOPE는 융해도가 높은 리피드로써 안정적인 이중층의 형성과 pH 변화에 따라 상변이를 일으켜 약물 방출에 용이하고, DOTAP의 양이온성은 음이온성 세포벽과 반발력 없이 융화될 수 있게 도와주기 때문에 안정적으로 리포좀을 형성할 수 있을 것으로 예상하였다. 준비된 리피드를 조성에 따라 리포좀을 제작하고, 입자의 크기를 DLS로 측정하였다(Figure 1). PEG 리포좀들은 모두 200 nm이하의 크기를 갖는 것을 확인하였으며, PEG의 몰비가 증가함에 따라 사이즈가 조밀 해지는 것을 확인 하였다(Table 1). 이는 PEG와 DOTAP, DOPE 리피드가 안정적으로 융화되어 리포좀화된 것을 알 수 있으며, 제타 전위를 측정한 결과 리포좀들의 표면 전하는 30 mV이상의 양이온을 나타내는 것을 확인할 수 있었다. 확인된 리포좀 조성에 각각 RA를 봉합하여 입자의 크기와 봉합률을 확인하였다(Table 2). PEG의 양에따라 입자의 크기 변화가 컸으며 PEG 2%의 리포좀은 약 900 nm의 입자 크기를 갖고, 1.9%의 RA 봉합률을 나타냈다. PEG 4%의 리포좀은 2%보다 균일한 크기로 약 300 nm를 나타내었으며 기존보다 높아진 3.4%의 RA의 봉합률을 나타내었다.
특히, PEG 6% 리포좀은 200 nm이하의 균일한 크기를 나타냈으며, RA가 35% 봉합률을 나타내어 기존의 리포좀 조성보다 안정적인 크기를 나타내었다. PEG에 함유된 토코페롤과 RA의 상호작용에 의해 안정적으로 리포좀의 형성시키는 것을 예상할 수 있다. 이후 세포 실험은 PEG 6%가 함유된 RA 리포좀을 이용하여 진행하였다.
RA 리포좀의 형태 분석. RA 리포좀의 형태를 FE-SEM을 이용하여 분석하였다. Figure 2의 사진에서 보이듯 구형의 균일한 나노 입자가 확인되었으며, Figure 2(a)와 같이 직경을 측정하였을 때 약 151 nm에서 171 nm까지의 사이즈로 DLS를 이용한 측정보다 약 20 nm가 줄어든 크기와 비슷한 크기를 보였다. 이는 건조된 환경에서의 변화로 예상된다.
위 결과를 통해 RA 리포좀이 나노 입자의 크기를 갖는 것을 확인할 수 있었다. 이러한 균일하고 작은 나노 입자는 세포 내로 함입되어 약물을 전달하는데 효율적으로 작용될 것으로 예상된다.
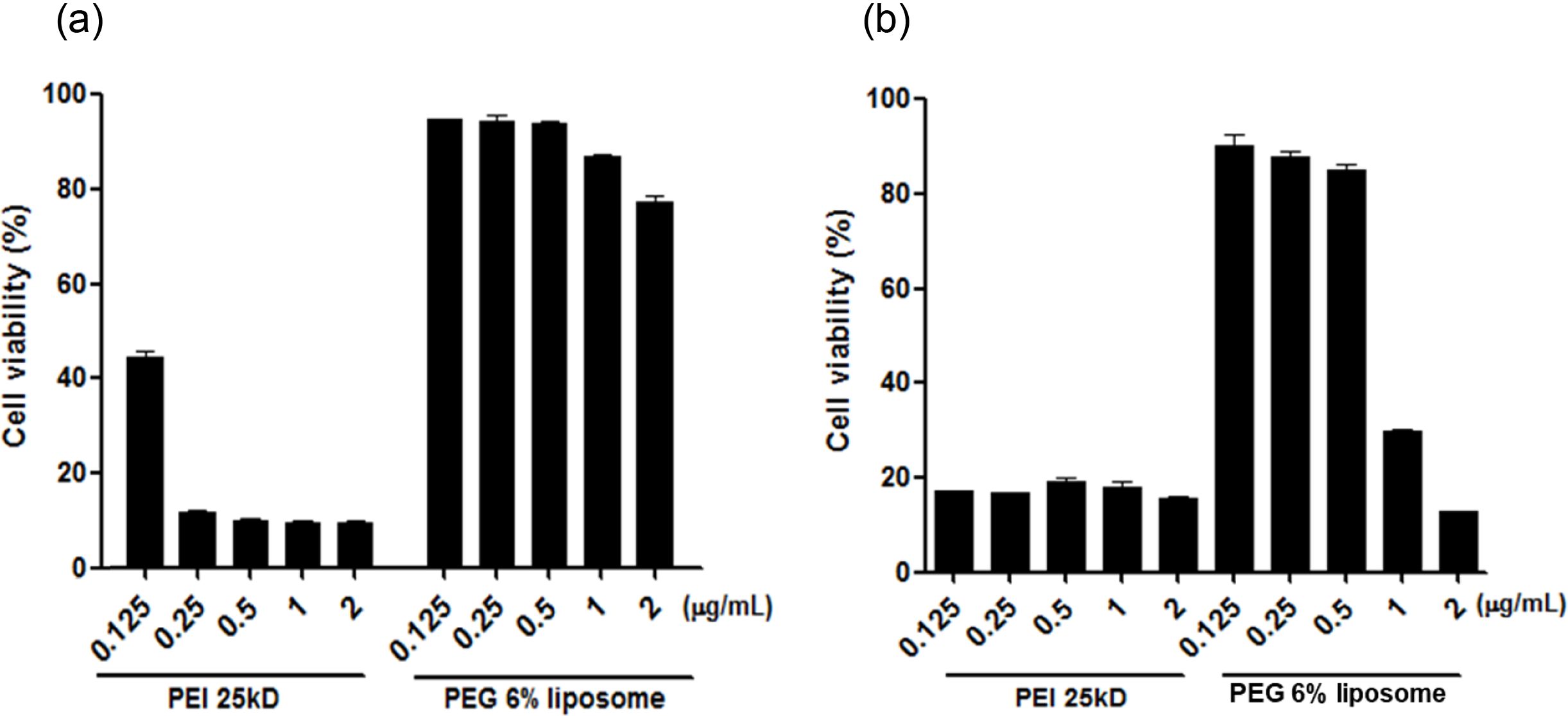
PEG 6% 리포좀의 세포 독성 평가. MDA-MB-231 유방암 세포주와 HT22 마우스 해마 세포주에서 MTT assay를 이용한 PEG 6% 리포좀의 세포독성 실험을 수행하였다. Figure 3(a)는 MDA-MB-231에서의 결과로 대조군으로는 양이온성 폴리머인 PEI 25 kD을 사용하였다. 대조군 PEI 25 kD의 경우 농도가 높아짐에 따라 50% 이하의 매우 낮은 생존율을 보이며, 0.25 μg/mL의 농도에서부터 매우 높은 독성을 나타냈다. 반면, PEG 6%의 리포좀은 2 μg/mL의 농도에서도 매우 80%이상의 높은 생존율을 보였으며, 대조군과 비교하였을 때 매우 낮은 독성을 보이는 것을 확인하였다. 암세포주에서의 항생제, 약물, 외부 물질에 대한 내성은 정상 세포와 비교하여 상대적으로 높기 때문에 PEG 6% 리포좀의 신경세포주에서의 독성을 추가로 확인하였다.12 Figure 3(b)는 HT22에서의 독성을 확인한 결과이다. 대조군인 PEI 25 kD의 결과는 모든 농도에서 20% 이하의 생존율을 보이며 높은 독성을 나타내었다. 반면, PEG 6% 리포좀은 0.5 μg/mL 농도에서도 80% 이상의 높은 생존율을 보였다. 고농도인 1-2 μg/mL의 농도에서는 30-20%의 생존율을 보였지만 PEI 25kD와 비교하였을 때 낮은 독성을 갖으며, 실제 RA의 봉합 후 처리되는 리포좀의 양은 0.5 μg/mL 이하이기 때문에 독성에 영향을 미치지 않을 것으로 예상할 수 있다.
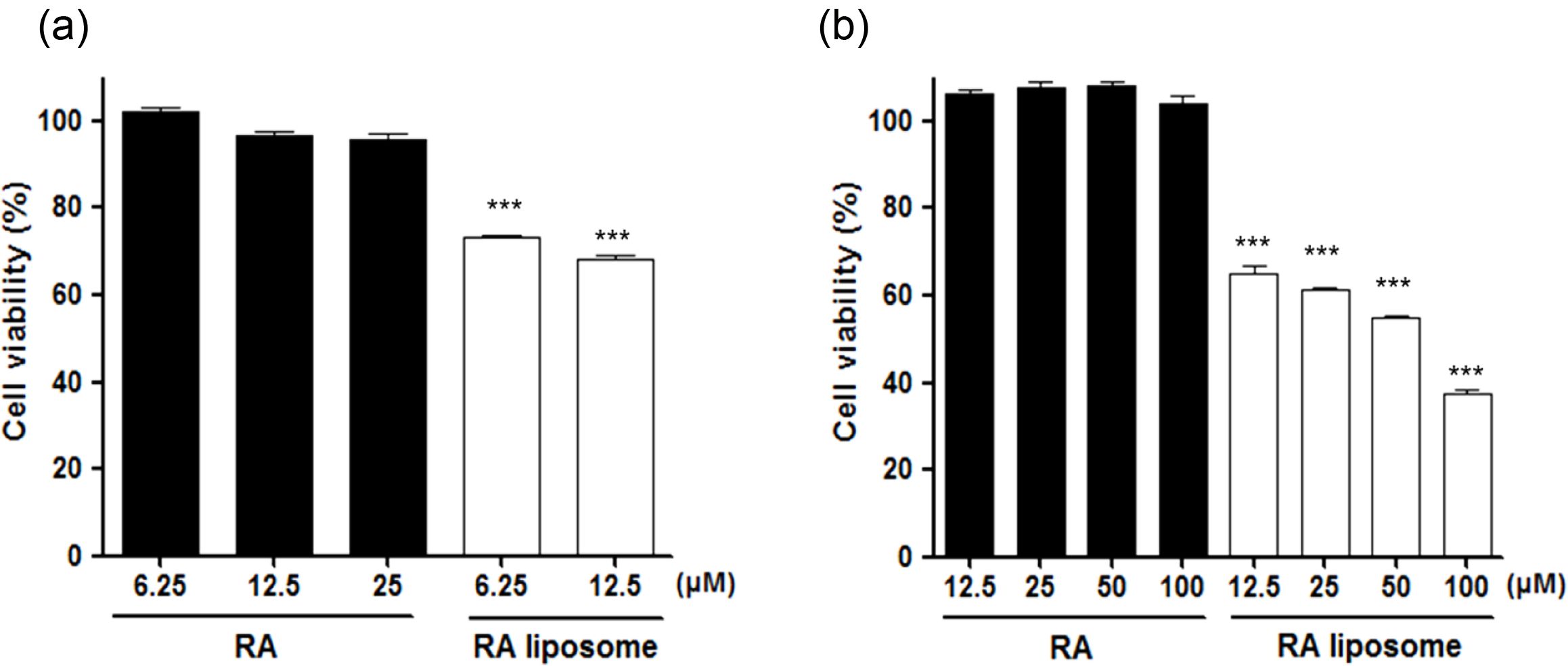
RA 리포좀의 항암 효과. RA의 항암 효과를 확인하기 위해 MTT assay를 MDA-MB-231 세포주에서 수행하였다. RA와 RA 리포좀을 농도별로 처리하고 24시간, 48시간 동안 배양하여 진행하였다.13 Figure 4(a)는 24시간의 배양 결과로써 RA는 12.5 μM에서 90% 이상의 생존율을 보이며 저해 효과가 낮게 나타났고, RA 리포좀은12.5 μM에서 30% 이상 생존율이 저해된 것을 확인할 수 있었다. 이후, 12.5 μM보다 높은 농도의 RA와 RA 리포좀을 처리하고, 48시간 배양하였다. Figure 4(b)의 결과에서 DMSO에 녹인 RA는 100 μM을 처리하였을 때, 암세포의 저해효과를 보이지 않았다. 반면, RA 리포좀은 12.5 μM의 농도에서 약 30% 이상 저해되었고, 100 μM에서는 60% 이상 저해된 결과를 나타내었다.
이러한 결과를 종합하였을 때, 기존의 RA를 처리하였을 때는 수용액 상의 용해도와 세포 내 함입률이 매우 낮아 항암효과를 나타내기 어려운 것을 간접적으로 확인하였다.
반면, RA 리포좀은 낮은 농도에서도 항암효과를 나타내었고, 암세포의 생장을 저해시키는 것을 확인하였다. 이러한 결과는 RA 리포좀이 높은 용해도와 나노 사이즈를 갖기 때문에 세포 내 함입률을 높여 저용량에서도 높은 항암 효과를 나타내는 것으로 보인다.8,9
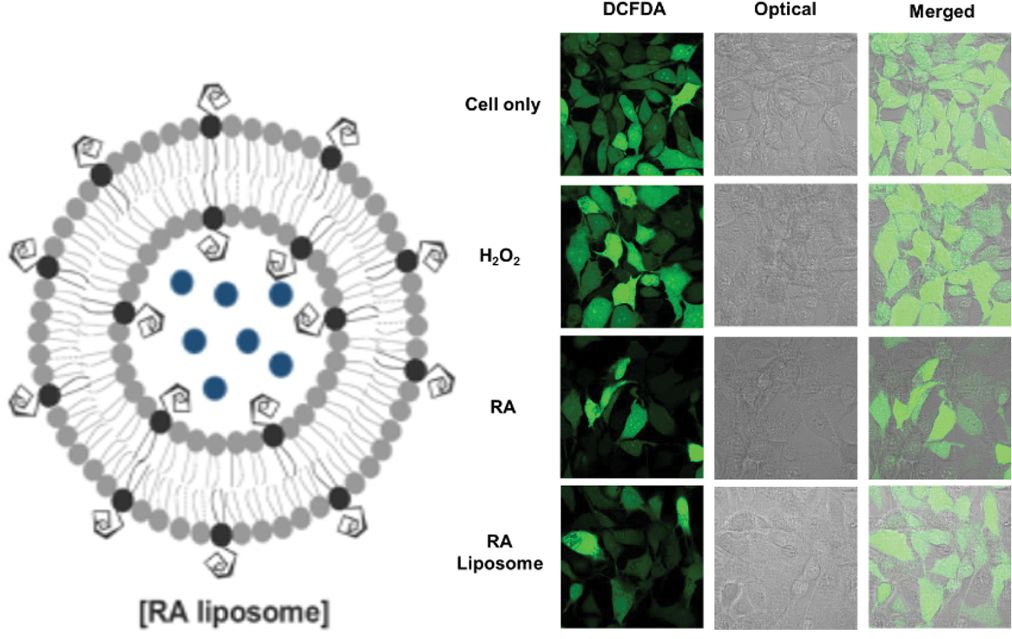
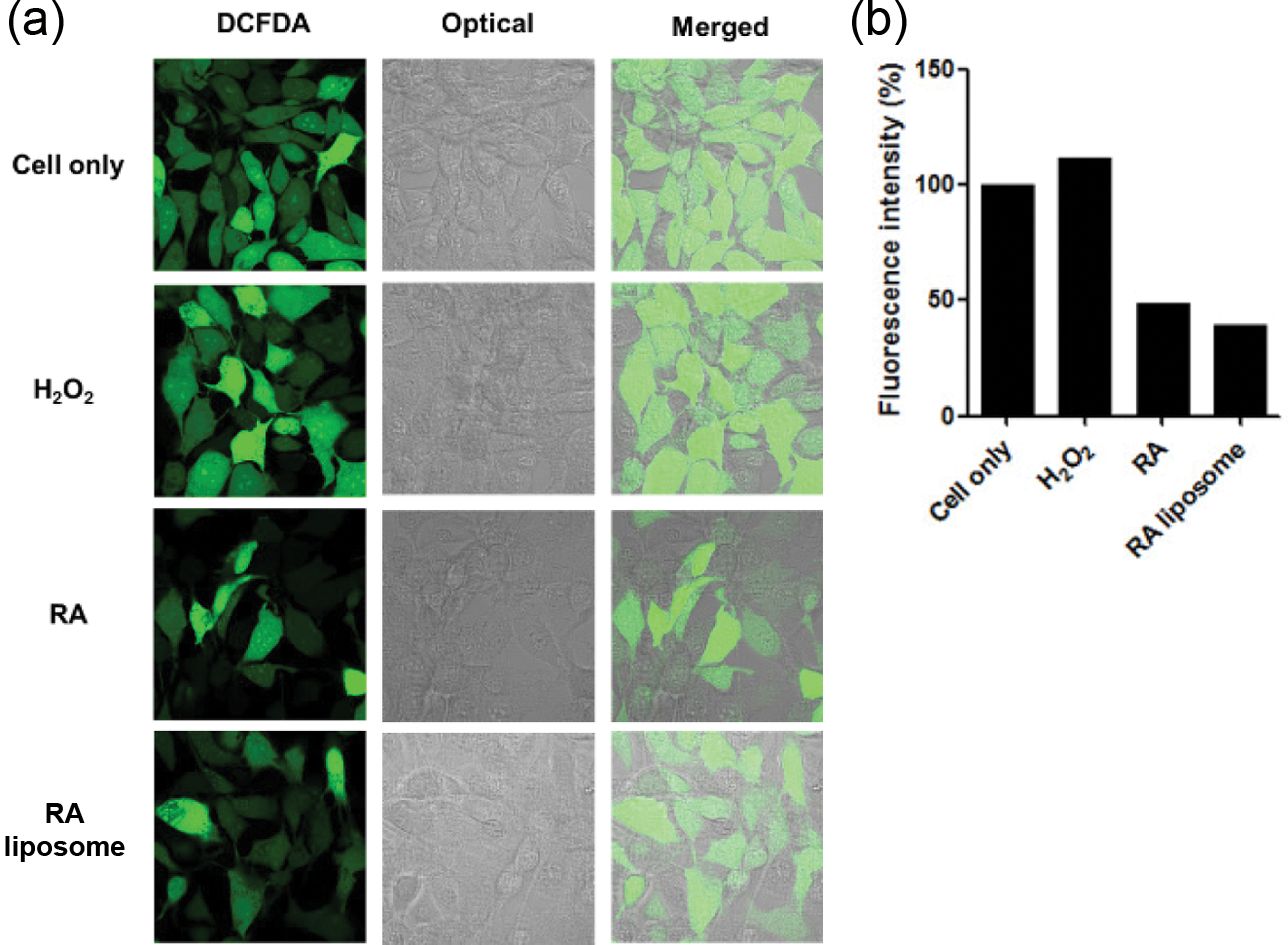
항산화 효과 평가. RA 리포좀의 항산화 효과를 평가하기 위해 HT22 세포주에서 DCFDA 염색을 이용하여 세포 내의 활성산소(reactive oxygen species)를 확인하였다. 대조군으로는 H2O2를 처리한 것과 처리하지 않은 군을 사용하였다.
결과를 확인하였을 때, H2O2를 처리한 군의 형광의 세기가 높게 나타나는 것을 확인하였다(Figure 5(a)). 반면, 각각 RA와 RA 리포좀을 처리하고 H2O2를 처리한 군의 경우 낮은 형광 세기를 나타내는 것을 확인할 수 있었다. Figure 5(b)에 결과로 Image J를 이용하여 형광 세기를 정량화하였을 때, RA와 RA 리포좀이 50% 이하로 매우 낮게 활성산소의 형광이 나타남을 확인하였다. 이는 DCFDA에 의해 염색되는 활성산소의 양이 현저히 낮음을 확인할 수 있었다. 따라서, RA 리포좀은 해마 뇌세포에서의 효과적인 활성산소 제거 효과를 보이는 것으로 알츠하이머 치매와 같은 뇌 세포 손상에 의해 발생하는 질환에서도 효과를 보일 수 있을 것을 예상할 수 있다.14,15
|
Figure 1 Illustration of RA liposome and chemical structure. |

|
Figure 2 Morphology of RA liposomes (PEG 6%) measured using FE-SEM: (a) with diameter; (b), (c), and (d) RA liposome image. Scar bar=500 nm. |
|
Figure 3 Evaluation of cytotoxicity PEG 6% liposome using MTT assay for 24 h: (a) MDA-MB-231; (b) HT22 cells. |
|
Figure 4 Anticancer effect of RA liposome in MDA-MB-231cells: (a) for 24 h; (b) for 48 h. Each sample was compared with the same concentration by the unpaired Student’s t test (ns, not significant; ***p<0.001). |
|
Figure 5 Anti-oxidant effect of RA liposome in HT22 cells. Sample was incubated for 24 h and cells were dyed using DCFDA: (a) confocal microscopy image; (b) fluorescence intensity value |
본 실험에서는 물에 난용성인 RA를 PEG-tocopherol과 DOTAP, DOPE를 이용하여 리포좀화시키고 200 nm 이하의 균일한 구형의 입자를 형성의 조건을 확인하였다. 본 실험에서 사용한 RA 리포좀은 매우 낮은 독성을 갖으며 효과적으로 MDA-MB-231 유방암세포에 RA를 방출하여 생장을 저해하는 효과를 확인하였고, HT22 해마세포주에서 항산화 효과를 나타내는 것을 확인하였다. 이러한 결과들로 RA 리포좀은 기존의 RA 보다 높은 항암효과를 갖으며, 항산화 효과도 갖고 있는 것을 확인할 수 있다. 본 실험을 통해 RA 리포좀의 알츠하이머, 항암, 항박테리아 등의 질병과 항균성에 응용할 수 있는 천연 약물로써 가능성을 확인하였다.16,17
- 1. Bulbake, U.; Doppalapudi, S. Liposomal Formulations in Clinical Use: An Updated Review. Pharmaceutics 2017, 9, 12.
-

- 2. Pattni, B. S.; Chupin, V. V. New Developments in Liposomal Drug Delivery. Chem. Rev. 2015, 115, 0938-10966.
-

- 3. Daraee, H.; Etemadi, A. Application of Liposomes in Medicine and Drug Delivery. Artif. Cell Nanomed. B 2016, 44, 381-391.
-

- 4. Akhtar, A., Andleeb, A. Neurodegenerative Diseases and Effective Drug Delivery: A Review of Challenges and Novel Therapeutics. J. Control. Release 2020, 330, 1152-1167.
-

- 5. Li, Z.; Tan, S. Cancer Drug Delivery in the Nano Era: An Overview and Perspectives (Review). Oncol. Rep. 2017, 38, 611-624.
-

- 6. Bonifacio, B. V.; Silva, P. B. Nanotechnology-based Drug Delivery Systems and Herbal Medicines: A Review. Int. J. Nanomed. 2014, 9, 1-15.
-

- 7. Immordino, M. L.; Dosio, F. Stealth Liposomes: Review of the Basic Science, Rationale, and Clinical Applications, Existing and Potential. Int. J. Nanomed. 2006, 1, 297-315.
- 8. Swamy, M. K.; Sinniah, U. R. Anticancer Potential of Rosmarinic Acid and its Improved Production Through Biotechnological Interventions and Functional Genomics. Appl. Microbiol. Biotechnol. 2018, 102, 7775-7793.
-

- 9. Anwar, S.; Shamsi, A. Rosmarinic Acid Exhibits Anticancer Effects via MARK4 Inhibition. Sci. Rep. 2020, 10, 10300.
-

- 10. Hase, T.; Shishido, S. Rosmarinic Acid Suppresses Alzheimer's Disease Development by Reducing Amyloid Beta Aggregation by Increasing Monoamine Secretion. Sci. Rep. 2019, 9, 8711.
-

- 11. Lee, S.; Song, S. J. Cathepsin B-Responsive Liposomes for Controlled Anticancer Drug Delivery in Hep G2 Cells. Pharmaceutics 2020, 12, 876.
-

- 12. Bukowski, K.; Kciuk, M. Mechanisms of Multidrug Resistance in Cancer Chemotherapy. Int. J. Molecular Sci. 2020, 21, 3233.
-

- 13. Messeha, S. S.; Zarmouh, N. O. Rosmarinic Acid-induced Apoptosis and Cell Cycle Arrest in Triple-negative Breast Cancer Cells. Eur. J. Pharmacol. 2020, 885, 173419.
-

- 14. Cao, W.; Hu, C. Rosmarinic Acid Inhibits Inflammation and Angiogenesis of Hepatocellular Carcinoma by Suppression of NF-kappaB Signaling in H22 Tumor-bearing Mice. J. Pharmacol. Sci. 2016, 132, 131-137.
-

- 15. Taguchi, R.; Hatayama, K. Structure-activity Relations of Rosmarinic Acid Derivatives for the Amyloid Beta Aggregation Inhibition and Antioxidant Properties. Eur. J. Med. Chem. 2017, 138, 1066-1075.
-

- 16. Ge, L. M.; Zhu, M. J. Development of Active Rosmarinic Acid-gelatin Biodegradable Films with Antioxidant and Long-term Antibacterial Activities. Food Hydrocoll. 2018, 83, 308-316.
-

- 17. Zhang, Y.; Hu, M. Anticancer Effects of Rosmarinic Acid in OVCAR-3 Ovarian Cancer Cells are Mediated Via Induction of Apoptosis, Suppression of Cell Migration and Modulation of lncRNA MALAT-1 Expression. J. Buon. 2018, 23, 763-768.
- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2021; 45(4): 520-524
Published online Jul 25, 2021
- 10.7317/pk.2021.45.4.520
- Received on Jan 20, 2021
- Revised on Feb 22, 2021
- Accepted on Mar 12, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Ju-Ye Ro
-
Department of Biochemistry, Chungnam National University, 99 Daehak-ro, Daejeon 34134, Korea
- E-mail: chamas89@o.cnu.ac.kr
- ORCID:
0000-0003-2815-109X









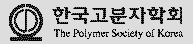 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.