- Lithium Manganese Oxides Cathodes Functionalized by Ionic Monomer Additive as a Surface Modifier for Lithium-ion Batteries
Min Ji Seong, So Young Park*, Tae-Hyun Kim**, Yeong Don Park*,†
 , and Taeeun Yim†
, and Taeeun Yim† 
Advanced Batteries Laboratory, Department of Chemistry, Incheon National University, 119 Academy-ro, Yeonsu-gu, Incheon 22012, Korea
*Organic Optoelectronics Laboratory, Department of Energy and Chemical Engineering, Incheon National University, 119 Academy-ro, Yeonsu-gu, Incheon 22012, Korea
**Organic Material Synthesis Laboratory, Department of Chemistry, Incheon National University, 119 Academy-ro, Yeonsu-gu, Incheon 22012, Korea- 기능성 이온 단량체의 가교를 통하여 표면 개질된 고율 충전용 리튬 망간 산화물 양극 소재
인천대학교 화학과 이차전지연구실, *인천대학교 에너지화학공학과 유기광전자 연구실, **인천대학교 화학과 유기재료합성연구실
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
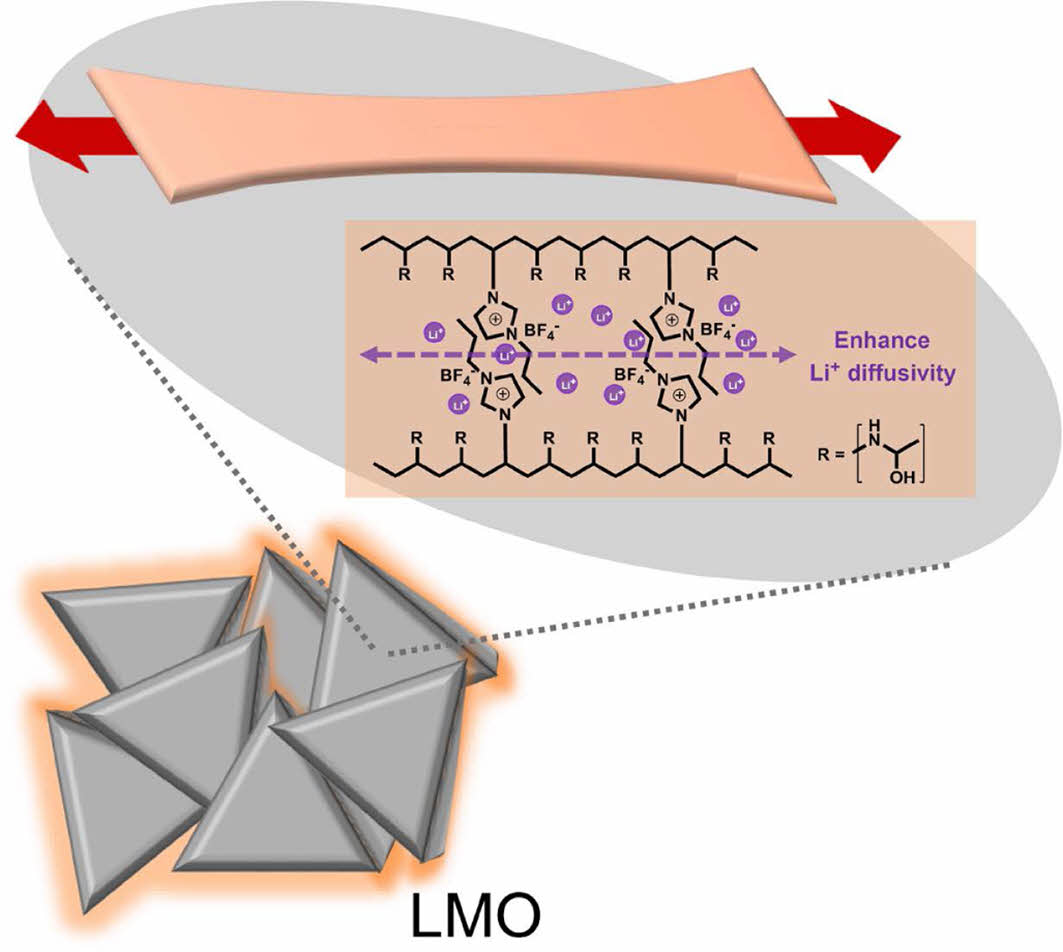
In this study, 3-propyl-1-vinylimidazolium tetrafluoroborate (VPI BF4) as an ionic crosslinker is designed and synthesized to improve the high rate capability of lithium manganese oxide (LMO) cathode material. The synthesis of ionic crosslinker is confirmed by 1H nuclear magnectic resonance and 19F nuclear magnectic resonance spectroscopies. It is confirmed that the VPI BF4 is successfully crosslinked through Fourier-transform infrared spectroscopy. The use of VPI BF4 does not compromise with the electrochemical performance of the cell even at high temperature and enhances the rate capability. The analysis of electrodes after electrochemical evaluation proves that VPI BF4 contributes to the improvement of LMO interphase properties.
본 연구에서는 리튬이온전지 양극 소재로 각광받고 있는 lithium manganese oxide(LMO)의 고율 충/방전 특성을 개선하고자 3-propyl-1-vinylimidazolium tetrafluoroborate(VPI BF4)의 구조를 갖는 이온성 가교제를 설계하고 이를 LMO 양극 소재 표면에서 가교하여 표면 특성이 개선된 LMO 양극을 개발하였다. 이온성 가교제는 핵 자기 공명 분광법을 통하여 합성을 확인하였으며 LMO 양극 표면에서의 가교 반응 전후의 푸리에 변환 적외선 분광기 분석을 통해 LMO 양극 소재 표면의 개질이 성공적으로 진행되었음을 확인하였다. 그 결과 VPI BF4으로 개질된 LMO 양극 소재는 안정적인 전기화학적 수명 특성 및 개선된 고율 특성을 나타내었으며, 충/방전이 완료된 전극의 분석을 진행하여 VPI BF4가 계면 특성의 개선에 기여하고 있음을 확인하였다.
The surface of lithium manganese oxide (LMO) cathode is modified by 3-Propyl-1-vinylimidazolium tetrafluoroborate (VPI BF4) to improve uniformity and Li+ diffusivity. The rate capability is enhanced using by VPI BF4 because of physical crosslinking.
Keywords: lithium ion batteries, lithium manganese oxide, uniformity, crosslinking agent, electrochemical performance.
이 논문은 인천대학교 2017년도 융합과학기술원 지원에 의하여 연구되었음.
저자들은 이해상충이 없음을 선언합니다.
최근 환경 친화적인 전기자동차에 대한 수요가 급격하게 증가하면서 전기자동차의 동력원인 리튬이차전지에 대해서 관심이 많아지고 있다.1-3 리튬이차전지는 양극, 음극, 전해액, 분리막의 핵심 소재로 구성되어 있다. 전기자동차를 비롯하여 리튬이차전지를 활용하는 디바이스의 성능은 각각의 핵심 소재의 성능에 많은 영향을 받고 있기 때문에 전기자동차 및 에너지 저장 시스템 등을 포함하는 디바이스의 적용 범위에 따라 특성에 맞는 이차전지 소재를 선택하는 것은 매우 중요하다.
전기자동차에 사용되는 리튬이차전지가 상용화됨에 따라 급속 충전이 가능한 양극 소재에 대한 중요성이 크게 증가하고 있어, 이에 lithium manganese oxide(LMO) 양극 소재가 주목받고 있다. LMO 양극 소재는 스피넬 구조를 가지고 약 4.0 V(vs. Li/Li+)에서 리튬의 삽입/탈리 반응을 통하여 가역적 전기화학적 반응이 가능한 소재로 현재 중대형 이차전지에 많이 쓰이고 있는 층상계 리튬 산화물보다는 낮은 용량을 지니고 있지만 급속 충전이 가능하다는 장점을 가지고 있다.4-7 LMO 소재를 활용하여 전극을 제조하는 과정에서는 LMO 소재와 바인더 및 도전재를 유기 용매에 분산시켜 양극 슬러리를 만들고, 이를 집전체에 도포 및 건조시키는 과정을 거쳐 LMO 양극을 확보하게 된다.8,9 그런데 이 때 제조되는 전극의 표면이 균일하지 않으면 전극 표면에서의 전류 밀도가 일정하지 않게 되고 초기 수십 회 충/방전에서는 큰 문제를 일으키지 않던 전지 특성이 장기 충/방전 과정을 거치면서 전반적인 전지 특성 저하를 야기하게 된다.10,11 이러한 측면에서 LMO 양극의 표면 균일성을 확보하는 것은 전지의 성능 측면에서 매우 중요하다.
본 연구에서는 리튬이차전지 양극 소재로 활용 가능한 LMO 양극 표면 균일성을 확보하기 위하여 기존 전기화학적 특성 저하를 유발하지 않으면서 전극의 표면 특성을 개선하고자 하였다. LMO 양극을 물리적으로 보호함과 동시에 충/방전 시 이온 이동성을 확보하고자 C=C 작용기 및 이온성 물질로 설계된 3-propyl-1-vinylimidazolium tetrafluoroborate(VPI BF4)를 합성하고, 이를 LMO 양극 표면에서 poly(N-vinylacetamide) (PNVA)로 가교하여 표면 특성이 개선된 LMO 양극 소재를 개발하였다. 푸리에 변환 적외선 분광기(FTIR) 분석을 진행한 결과 LMO 양극 소재 표면에서 VPI BF4를 이용하여 poly(N-vinylacetamide)가 성공적으로 가교 진행되었음을 확인하였으며 전지 특성평가 및 전지 해체 분석을 진행한 결과 VPI BF4로 가교된 LMO 양극은 고율 충전에서의 전지 특성 성능 향상 및 균일한 표면을 형성함을 확인하였다.
본 실험에서 합성을 위해 사용된 1-vinylimidazole 및 1-bromopropane, sodium tetrafluoroborate은 모두 Sigma-Aldrich (한국)에서 구입해 정제 없이 사용하였다. 이때, 용매 및 정제로 사용한 acetonitrile, acetone, ethyl acetate(EA), ethyl ether (ether), dichloromethane(DCM)은 대정화금에서 구입했으며 aluminium oxide(alumina)는 Sigma-Aldrich(한국)에서 구입해 사용하였다. 고분자 막의 인장 시험을 위해 monomer로 사용한 N-vinylacetamide은 세진시아이(TCI, 한국)에서, 열 개시제로 사용한 azobisisobutyronitrile(AIBN)은 Sigma-Aldrich(미국)에서 구입해 사용하였다.
500 mL 둥근바닥 플라스크에 1-vinylimidazole과 1-bromopropane을 넣고 용매로 acetonitrile을 사용해 25 oC에서 교반하며 72시간 반응을 진행하였다. 반응이 완료된 후, 층 분리된 용액을 분별깔때기로 생성물만 수득해 EA 및 ether로 여러 차례 정제하고 회전 증발 농축기(rotary evaporator, BUCHI, R-100, 스위스)와 진공 펌프를 이용해 용매 제거 후 중간체를 수득하였다(step 1, Scheme 1).
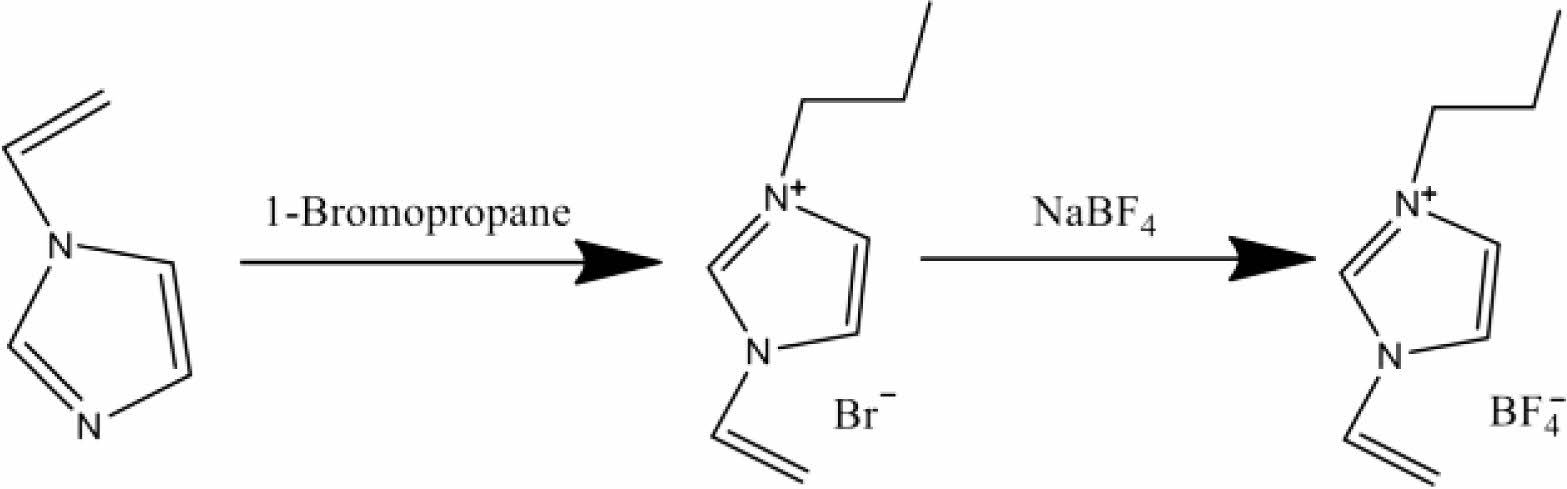
Scheme 1. Synthesis mechanism of VPI BF4
500 mL 둥근바닥 플라스크에 중간체와 sodium tetrafluoro- borate을 넣고 용매로 acetone을 사용해 25 oC에서 교반하며 48시간 반응을 진행하였다. 반응이 완료된 후, 교반을 멈추고 부산물인 NaBr을 가라앉혀 감압 여과로 걸러 여액을 수득하였다. 수득한 여액의 용매를 회전 증발 농축기로 제거하고 alumina와 DCM으로 유리 필터 퓨넬에 감압 여과한 후 회전 증발 농축기와 진공 펌프로 DCM을 제거해 최종 생성물을 수득하였다(step 2, Scheme 1).
1H 핵 자기 공명(NMR, 400 Hz, Agilent 400-MR, 미국) 분광법으로 구조를 분석해 VPI BF4를 최종 생성물로 얻었음을 확인했다(1H NMR(DMSO-d6, 400 MHz) of VPI BF4: δ 9.46(s, 1H), 8.19(d, 1H, J=3.2 Hz), 7.92(d, 1H, J=1.6 Hz), 7.25(q, 1H, J=8.1 Hz), 5.98(d, 1H, J=15.6 Hz), 5.44(d, 1H, J=8.4 Hz), 4.18(t, 2H, J=7.2 Hz), 1.83(m, 2H, J=7.3 Hz), 0.88(s, 3H); 19F NMR(DMSO-d6, 400 MHz): 148.3). VPI BF4의 열적 안정성을 확인하기 위해 열 중량 분석기(TGA, SCINCO TGA N-1000, 한국)를 이용해 열분해 온도를 측정하였다.
Polyvinylidene fluoride(PVdF, Kureha, 일본)와 단량체인 N-vinylacetamide를 포함한 바인더(B1 바인더)와, PVdF와 N-vinylacetamide, 가교제인 VPI BF4를 포함하고 있는 바인더(B2 바인더)를 사용한 두 종류의 막을 형성하여 기초 물성 분석을 진행하였다. 이때 용매로 1-methyl-2-pyrrolidinone(NMP, Sigma-Aldrich)를 사용해 LMO 양극 소재와 바인더를 섞어 슬러리를 만들고 마지막 단계에서 열 개시제인 AIBN을 따로 NMP에 녹인 용액을 물리적으로 섞어주었다. 이를 Al 쉬트 위에 캐스팅 해주었고, 120 oC 오븐에서 열 개시해 PVdF와 PNVA 혼합 고분자막을 형성하였다. 형성된 혼합 고분자 막을 푸리에 변환 적외선 분광기/전반사 모드(FTIR/ATR, Spectrum Two)를 이용해 화학 성분에 대한 분석을 진행하였다. 40 mm×10 mm(전체), 20 mm×10 mm(test area) 크기로 시편을 준비한 다음 5 mm/min 속도로 인장 시험(benchtop tensile tester, Shimadzu EZ-TEST E2-L instrument, 일본)을 진행하였고 응력-변형률 선도를 그려 초반 기울기로 stiffness을 계산하고 시료가 끊어지는 시점을 파괴점으로 지정하였다.
전지 특성 평가를 진행하기위해 LMO, 바인더 및 도전재가 혼합된 슬러리를 제조하였으며 이를 Al 쉬트 위에 캐스팅한 다음 12시간 동안 120 oC 진공 오븐에서 말려주어 양극을 제조하였다. 제조된 LMO 양극과 Li 금속 음극, poly(propyl- ene)/poly(ethylene)/poly(propylene) 분리막(Celgard, 미국), 1.0 M lithium hexafluorophosphate(LiPF6)을 ethylene carbonate (EC)와 ethyl methyl carbonate(EMC)(1:2 v/v%)에 녹인 전해액(Dongwha electrolyte, 한국)을 사용해 2032 코인셀을 제작하였다. 이 cell을 25 oC에서 3.0 V(vs. Li/Li+)에서 4.3 V(vs. Li/Li+)까지 0.1 C(1.0 C=106 mA g–1)로 2회 충/방전(formation step)하고 45 oC에서 같은 전압 범위에서 1.0 C로 100회 충/방전을 반복해 전기 화학적 평가를 진행하였다. 100번째의 용량 유지율은 1.0 C에서 첫번째 방전 용량을 100번째 방전용량으로 나눈 값에 100을 곱한 값으로 정하였다. 또한, 고율에서의 거동을 확인하기 위해 율특성 평가를 진행하였다. 앞서 진행한 전기화학적 평가와 같은 조건에서 0.1, 0.2, 0.5, 1.0, 2.0, 3.0, 5.0, 10.0 C로 각 4회씩 충/방전을 진행하였다. LMO 전극에서의 리튬 확산 거동 분석을 진행하고자 B1 및 B2 바인더로 제조한 LMO를 각각 작업 전극으로, Li 금속을 상대 전극, 기준 전극으로 사용하여 삼전극 전기화학셀을 만들고, 0.1-0.8 mV s-1의 scan-rate으로 순환 전압전류법(cyclic voltammetry, CV)을 측정하였다. 측정한 scan-rate 별 CV로 ip vs. v1/2 linear plot을 그리고 Randles-sevcik식(식 (1))을 이용하여 Li+ 확산 계수를 구하여 비교하였다.
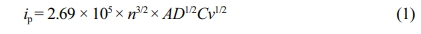
ip = Current maximum (A)
n = Number of electrons transferred in the redox event
A = Electrode area (cm-2)
D = Diffusion coefficient (cm2 s-1)
C = Concentration (mol cm-3)
v = Scan rate (V s-1)
전기 화학적 평가를 진행한 전지를 Ar 환경에 있는 글러브 박스 안에서 해체해 LMO 전극을 취하고 순수한 dimethyl carbonate(DMC)으로 세척한 다음 주사 전자 현미경(FE-SEM-7800F, JEOL, 일본)으로 표면을 관찰하였다.
1-Vinylimidazole에 propylation 후 BF4 음이온
치환을 하는 2 steps 합성법을 통해 3-propyl-1-vinylimidazol-3-ium tetra- fluoroborate(VPI BF4)을 합성하였다. Figure 1(a)에 나와있는 VPI BF4 1H NMR chemical shift를 보면, vinyl기의 말단 (CH2) 피크가 5.44, 5.96 ppm에 cis-, trans- 형으로 특징적으로 나타났으며 (CH)는 7.25 ppm에서, imidazole 고리의 H는 7.50-9.50 ppm 사이에서 나타났다. 1-Vinylimidazole과 비교해서 step 1에서 imidazole에 결합되어 있는 propyl기 말단의 (CH3) 피크가 0.88 ppm 부근에서, (CH2) 피크가 각각 1.83, 4.16 ppm에 새롭게 나타났다. 이는 step 1에서 propylation되었다는 것을 의미한다. Figure 1(b)에 나와있는 VPI BF4 19F NMR을 보면 NaBF4 피크가 -148.44 ppm에서 나오는 것과 같은 위치인 -148.34 ppm에서 나타났다. 이는 step 2에서 BF4 음이온 치환이 되었다는 것을 의미한다. 이로써 1H NMR 및 19F NMR을 통해 VPI BF4 합성을 확인하였다.
TGA를 통하여 합성된 VPI BF4의 열분해 특성을 분석하였다. Figure 1(c)에서 보는 바와 같이 VPI BF4는 약 230 oC부터 열분해로 인한 무게 감소가 시작되었다. 리튬이온전지가 급격하게 열 폭주를 시작하는 125 oC 근처에서는 전극 표면을 보호하는 층인 SEI가 분해되어 유기 전해질과 반응하는데12 열적 안정성이 뛰어난 이온성 액체인13,14 VPI BF4는 그보다 높은 고온에서 열분해 되므로 이 반응에 참여하지 않아 다른 전해질에 비해 열적 안전성을 확보할 수 있다.
LMO에 기능성 첨가제인 VPI BF4 첨가 유무에 따라서 두가지 형태인 B1 바인더, B2 바인더 고분자 막을 형성하였으며 이에 대한 화학적 성분 분석을 진행하였다(Figure 2). 그림에 나와있는 FTIR 결과에서 기존의 N-vinylacetamide에 있는 1650 cm-1 부근에서 나오는 C=C 피크가15,16 중합 과정을 거치면서 B1 바인더와 B2 바인더에서는 없어진 것을 확인하였다. 이는 AIBN을 이용해 열 개시 후 N-vinylacetamide이 중합되었다는 것을 의미하며 VPI BF4 첨가 시에는 가교가 일어나면서 C=C 이중 결합이 사라져 피크가 나오지 않는 것을 확인하였다.
두 종류의 고분자 바인더에 대한 기계적 특성평가 결과를 살펴보면 N-vinylacetamide:VPI BF4의 비율에서 VPI BF4의 양이 많아질수록 stiffness가 0.199 MPa에서 0.036 MPa로 감소하지만 파괴점은 1.26 mm에서 7.85 mm로 증가한다(Figure 3). 특히 VPI BF4를 첨가하지 않은 경우 보다 첨가한 경우 약 3배의 증가율을 보였으며 N-vinylacetamide보다 VPI BF4 양이 많아진 경우에는 약 7배의 증가를 보였다. 이는 이온성 액체인 VPI BF4이 염의 형태로 정전기적 특성을 가지면서 수분을 많이 함유하고17,18 유기용매에는 잘 녹지 않게 되기 때문에 일종의 소프트너의 역할을 하면서19,20 파괴점이 증가하기 때문이다.
Figure 4(a)에 나와있는 전기화학적 평가 결과를 살펴보면 B1 바인더를 사용한 전지는 1.0 C 1번째 사이클의 방전 용량이 109.5 mA h g-1, B2 바인더를 사용한 전지는 106.5 mA h g-1로 나타났으며 이는 넣어준 VPI BF4가 저항으로 작용한 것으로 보이지만 전기화학적 특성에 영향을 줄 정도로 유의미한 차이가 아니다.21,22 각 전지의 100번째 사이클 용량 유지율(%)은 B1 바인더, B2 바인더를 사용한 전지의 경우 96.37%, 96.81% 값을 보여 두 전지 모두 비슷하므로 VPI BF4을 넣어주는 것이 실제 전지 구동 시 수명 특성 저하에 영향을 미치지 않는 것을 확인하였다. 또한, Figure 4(b)처럼 최대 10.0 C까지 율특성 평가를 진행한 결과, 비교적 저율에서는 비슷한 용량 유지율을 보이나 2.0 C 이후에는 B2 바인더를 사용한 LMO 전지의 고율 용량 유지율이 향상되는 것을 확인하였다.
Figure 5에서 볼 수 있듯이 N-vinylacetamide는 중합되면서 PNVA를 형성하고 내부의 채널을 통해 Li+이 이동한다. N-vinylacetamide만 중합한 B1 바인더와 다르게 단량체와 기능성 가교제인 VPI BF4를 같이 사용한 B2 바인더의 경우 개시에 의해 PNVA가 형성될 때 vinyl기를 가진 VPI BF4도 고분자 형성 반응에 참여할 수 있다. 이때, 두 주사슬 사이에 이온성 성질을 지닌 이온 종들끼리 정전기적 인력으로 인한 이온 집합 현상(ionic aggregation)이 일어나 물리적인 가교가 일어날 수 있다. 이 과정에서 imidazolium의 양전하 배열에 의해 음이온의 전자 구름이 재배열된다. 이렇게 이온이 발달된 채널 내부에서는 Li+의 이동성이 높아지고 결과적으로 이온 전도도가 증가한다.23-26 이를 확인하기 위해 scan-rate별 CV 및 Randles-sevcik 식을 이용하여 Li+ 확산 계수를 구하였다. 그 결과(Figures 6(a)-(d)), DLi+(B1 바인더)=3.00×10-8 cm2 s-1인 반면에 DLi+(B2 바인더)=3.33×10-8 cm2 s-1의 값을 가져 리튬 확산 계수가 증가하였음을 확인하였다. 이는 추가로 첨가한 VPI BF4가 N-vinylacetamide 주사슬 사이에서 물리적인 가교를 통해 Li+의 이동 채널을 제공하고, 이에 리튬 확산 계수가 증가하여 고율에서의 전기화학적 성능을 향상시킬 수 있음을 의미한다.
Figure 7(a), 7(b)에 나와있는 SEM 이미지를 살펴보면 B1 바인더를 사용한 전지를 100회 충/방전한 후에 LMO에는 미세한 크랙 발생 및 분해 산물이 덮여 있는 것을 볼 수 있다.27,28 하지만 B2 바인더를 사용한 전지를 100회 충/방전한 후의 LMO의 표면에는 VPI BF4로 가교된 물질이 균일하게 덮여있는 것을 확인하였고, 전극 표면 균일성을 확보하여 분해 산물과 크랙 발생을 줄여 효과적으로 LMO 양극 소재의 표면 특성을 개선할 수 있었다.

|
Figure 1 The characters of VPI BF4: (a) 1H NMR; (b) 19F NMR; (c) TGA. |

|
Figure 2 FTIR of LMO polymer films with B1 binder (red), B2 binder (blue), and N-vinylacetamide powder (black) |

|
Figure 3 The result of tensile test with different ratio of N-vinylacetamide and VPI BF4: (a) stiffness; (b) fracture point |

|
Figure 4 Electrochemical performance of LMO half cells cycled with B1 binder (red), and B2 binder (blue): (a) cycling performance; (b) rate capability at 45 ℃. |

|
Figure 5 Estimated mechanism of Li+ migration in the LMO cathode depending on binders. |

|
Figure 6 Cyclic voltammetry profile at various scan rates (0.1-0.8 mV s-1) of LMO modified (a) B1 binder; (c) B2 binder. Linear slope of the peak density as a function of the square root of scan rates for LMO modified (b) B1 binder; (d) B2 binder |

|
Figure 7 SEM images of (a) LMO after 100 cycles with B1 binder (inset: LMO pristine); (b) B2 binder. |
본 연구에서는 1-vinylimidazole에 propyl기를 결합하고 (step 1) 분자의 전기화학적 안정성을 확보하고자 Br -을 BF4-으로 치환해(step 2) 기능성 가교제인 VPI BF4를 합성하였다. 합성된 VPI BF4를 1H NMR 및 19F NMR로 구조를 확인하였고, TGA 분석을 통해 열 안정성이 뛰어남을 알 수 있었다. 고속 충/방전이 가능한 리튬이온전지 LMO 양극 소재에 AIBN으로 열 개시하여 PVDF/PNVA 바인더를 제조하였는데, FTIR를 통해 PNVA에 VPI BF4가 가교되어 중합 반응이 진행되었음을 확인하였다. 기계적 물성 평가를 진행한 결과 VPI BF4 기능성 가교제를 첨가하였을 때 바인더의 파괴점이 최대 7배 증가하였으며 이를 통해 소프트너의 역할을 하는 것을 확인하였다. 이를 활용하여 LMO 양극 소재에 각 바인더를 이용해 만든 전극의 전기화학적 특성 및 수명 특성을 관찰하였는데, 초기 방전 용량 및 100회 충/방전 후 용량 유지율을 비교했을 때 유의미한 차이를 보이지 않았지만 고율에서는 VPI BF4로 개질한 LMO 전지의 용량 유지율이 향상되는 것을 확인하였다. 이는 VPI BF4의 가교를 통하여 LMO 전극의 표면 균일성 및 Li+ 확산이 개선되어 Li+의 이동이 촉진되기 때문이다. 본 연구는 급속충전이 가능한 LMO 양극 개발에 유용한 가이드 라인이 될 것으로 기대한다.
- 1. Jeong, C.-Y.; Kim, K. J. Analysis of Moisture Penetration Mechanism into the Al-Pouch Type Lithium Ion Batteries. Polym. Korea 2018, 42, 1035-1039.
-

- 2. Fergus, J. W. Recent Developments in Cathode Materials for Lithium Ion Batteries. J. Power Sources 2010,195, 939-954.
-

- 3. Hou, J.; Jang, W.; Byun, H. Synthesis and Evaluation of PVA-CN Additive for High Thermal Stability of Lithium Secondary Battery Electrolyte. Polym. Korea 2018, 42, 882-887.
-

- 4. Jung, K. H.; Kim, H. G.; Park, Y. J. Effects of Protecting Layer [Li,La]TiO3 on Electrochemical Properties of LiMn2O4 for Lithium Batteries. J. Alloys Comp. 2011, 509, 4426-4432.
-

- 5. Belharouak, I.; Sun, Y.-K.; Lu, W.; Amine, K. On the Safety of the Li4Ti5O12/LiMn2O4 Lithium-Ion Battery System. J. Electrochem Soc. 2007, 154, A1083-A1087.
-

- 6. Kim, D. K.; Muralidharan, P.; Lee, H.-W.; Ruffo, R.; Yang, Y.; Chan, C. K.; Peng, H.; Huggins, R. A.; Cui, Y. Spinel LiMn2O4 Nanorods as Lithium Ion Battery Cathodes. Nano Lett. 2008, 8, 3948-3952.
-

- 7. Wang, R.; Xiao, S.; Li, X.; Wang, J.; Guo, H.; Zhong, F. Structural and Electrochemical Performance of Na-doped Li3V2(PO4)3/C Cathode Materials for Lithium-ion Batteries via Rheological Phase Reaction. J. Alloys Comp. 2013, 575, 268-272.
-

- 8. Chae, C.; Park, H.; Kim, D.; Kim, J.; Oh, E.-S.; Lee, J. K. A Li-ion Battery Using LiMn2O4 Cathode and MnOx/C Anode. J. Power Sources 2013, 214, 214-221.
-

- 9. Ding, Y. L.; Xie, J.; Cao, G. S.; Zhu, T. J.; Yu, H. M.; Zhao, X. B. Enhanced Elevated-Temperature Performance of Al-Doped Single-Crystalline LiMn2O4 Nanotubes as Cathodes for Lithium Ion Batteries. J. Phys. Chem. C 2011, 115, 9821-9825.
-

- 10. K. M. Kim, Polymer Binder for Lithium-ion Secondary Battery. Polym. Sci. Technol. 1998, 9, 117-124.
- 11. Park, H. The Research and Development Trend of Cathode Materials in Lithium Ion Battery. J. Korean Electrochem. Soc. 2008, 11, 197-210.
-

- 12. Fu, Y.; Lu, S.; Li, K.; Liu, C.; Cheng, X.; Zhang, H. An Experimental Study on Burning Behaviors of 18650 Lithium Ion Batteries Using a Cone Calorimeter. J. Power Sources 2015, 273, 216-222.
-

- 13. Lee, S.; Yim, T.; Park, Y. D.; Mun, J. Room Temperature Ionic Liquid-Activated Nafion Polymer Electrolyte for High Temperature Operation. Polym. Korea 2018, 42, 682-686.
-

- 14. Ryu, S.-W.; Song, E.-H. Characterization of Ionic Liquid Contained Polymer Gel Electrolyte. Polym. Korea 2008, 32, 85-89.
- 15. Zhong, L.; Yun, K. Graphene Oxide-modified ZnO Particles: Synthesis, Characterization, and Antibacterial Properties. Int. J. Nanomed. 2015,10,79-92.
-

- 16. Serrano, V. G.; Villegas, J. P.; Florindo, A. P.; Valle, C. D.; Calahorro, C. V. FT-IR Study of Rockrose and of Char and Activated Carbon. J. Anal. Appl. Pyrolysis 1996, 36, 71-80.
-

- 17. Huddleston, J. G.; Visser, A. E.; Reichert, W. M.; Willauer, H. D.; Broker, G. A.; Rogers, R. D. Characterization and Comparison of Hydrophilic and Hydrophobic Room Temperature Ionic Liquids Incorporating the Imidazolium Cation. Green Chem. 2001, 3, 156-164.
-

- 18. Takamuku, T.; Kyoshoin, Y.; Shimomura, T.; Kittaka, S.; Yamaguchi, T. Effect of Water on cture of Hydrophilic Imidazolium-Based Ionic Liquid. J. Phys. Chem. B 2009, 113, 10817-10824.
-

- 19. Zheng, M. S.; Zha, J. W.; Yang, Y.; Li, C. Q.; Han, P.; Hu, C. H.; Wen, Y. Q.; Dang, Z. M. Ductile Polymer-based Films with Ultrahigh Permittivity and Low Dielectric Loss. Polymer 2017, 130, 258-266.
-

- 20. Olsson, C.; Westman, G. Wet Spinning of Cellulose from Ionic Liquid Solutions-viscometry and Mechanical Performance. J. Appl. Polym. Sci. 2018, 127, 4542-4548.
-

- 21. Xia, J.; Sinha, N. N.; Chen, L. P.; Kim, G. Y.; Xiong, D. J.; Dahn, J. R. Study of Methylene Methanedisulfonate as an Additive for Li-Ion Cells. J. Electrochem. Soc. 2014, 161, A84-A88.
-

- 22. Huang, W.; Xing, L.; Wang, Y.; Xu, M.; Li, W.; Xie, F.; Xi, S. 4-(Trifluoromethyl)-benzonitrile: A Novel Electrolyte Additive for Lithium Nickel Manganese Oxide Cathode of High Voltage Lithium Ion Battery. J. Power Sources 2014, 267, 560-565.
-

- 23. Yang, Y.; Fu, N.; Dong, Q.; Li, M.; Li, J.; Wei, Z. Self-Aggregation to Construct Hydroxide Highways in Anion Exchange Membranes. Adv. Mater. Interfaces 2020, 4, 1902143.
-

- 24. Staffeld, P.; Kaller, M.; Ehni, P.; Ebert, M.; Laschat, S.; Giesselmann, F. Improved Electronic Transport in Ion Complexes of Crown Ether Based Columnar Liquid Crystals. Crystals 2019, 9, 74.
-

- 25. Mogurampelly, S.; Keith, J. R.; Ganesan, V. Mechanisms Underlying Ion Transport in Polymerized Ionic Liquids. J. Am. Chem. Soc. 2017, 139, 9511-9514.
-

- 26. Keith, J. R.; Ganesan, V. Ion Transport In Backbone-embedded Polymerized Ionic Liquids. J. Chem. Phys. 2019, 151, 124902.
-

- 27. Liao, B.; Li, H.; Wang, X.; Xu, M.; Xing, L.; Liao, Y.; Liu, X.; Li, W. RSC Adv. 2017, 7, 46594-46603.
-

- 28. Rashid, M.; Gupta, A. Experimental Assessment and Model Development of Cycling Behavior in Li-ion Coin Cells. Electrochim. Acta 2017, 231, 171-184.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2024 Impact Factor : 0.6
- Indexed in SCIE
 This Article
This Article
-
2022; 46(1): 88-93
Published online Jan 25, 2022
- 10.7317/pk.2022.46.1.88
- Received on Sep 23, 2021
- Revised on Nov 12, 2021
- Accepted on Nov 13, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Yeong Don Park*, and Taeeun Yim
-
Advanced Batteries Laboratory, Department of Chemistry, Incheon National University, 119 Academy-ro, Yeonsu-gu, Incheon 22012, Korea
*Organic Optoelectronics Laboratory, Department of Energy and Chemical Engineering, Incheon National University, 119 Academy-ro, Yeonsu-gu, Incheon 22012, Korea - E-mail: ydpark@inu.ac.kr, yte0102@inu.ac.kr
- ORCID:
0000-0002-1615-689X, 0000-0002-7057-9308








 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.