- Sweat-based Glucose Biosensor Using a Disc Paper Immobilized with Glucose Oxidase
Department of Polymer Science & Engineering, Polymeric Nanomaterials Laboratory, School of Applied Chemical Engineering, Kyungpook University, 80 Daehak-ro, Buk-gu, Daegu 41566, Korea
- GOx 종이 디스크 전극을 사용한 땀 기반 글루코스 센서
경북대학교 응용화학공학부 고분자공학전공
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
A non-invasive glucose biosensor based on a paper disc immobilized with glucose oxidase (2.25 U disc-1) was developed to be used as a disposable patch on the commercially-available electrode (DS-710, Metrohm DropSens, Spain). The developed glucose biosensor system showed 0.01 mM of limit of detection in the linear range of 0.0 to 4.0 mM when the 20 μL sweat was used to measure a current at applied -0.155 V with a chronoamperometric (CA) method. Thus, this cost-effective and disposable glucose biosensor system can be expandable to other enzyme systems.
본 연구에서는 상업용으로 판매하는 DS-710 전극(Metrohm DropSens, Spain) 위에 산화 글루코스 효소 (glucose oxidase, 2.25 U disc-1) 를 고정화한 종이 디스크를 덮어 일회용 비침습 글루코스 센서를 제조하였다. 제조한 종이 글루코스 센서는 전기화학적 chronoamperometric(CA) 방법으로 약 20 μL의 땀에 포함된 글루코스의 양을 -0.155 V에서 선형구간 0.0-4.0 mM과 민감도 0.01 mM로 측정할 수 있었다. 따라서 본 연구에서 개발한 종이 글루코스 센서는 가격 경쟁력이 있고, 다른 효소에도 적용할 수 있는 확장력이 있는 비침습 바이오 센서이다.
A non-invasive glucose biosensor based on a paper disc immobilized with glucose oxidase was developed to be used as a disposable patch on the commercially-available electrode. The developed glucose biosensor system showed high sensitivity and wide linear range when the small amount of sweat was used. Thus, this cost-effective and disposable glucose biosensor system can be expandable to other enzyme systems.
Keywords: glucose, non-invasive, biosensor, sweat, disposable.
이 논문은 2021학년도 경북대학교 연구년 교수 연구비에 의하여 연구되었음.
당뇨병은 수 억 명의 사람들에게 영향을 미치는 가장 널리 퍼진 현대 생활 습관 질환 중 하나이며 전 세계적으로 사망 주요 원인 중 하나이다.1,2 국내의 경우 국민 약 7명 중 1명은 당뇨 환자이고, 당뇨병은 8년 사이 2.1% 증가하여 2019년 기준으로 500만 명을 넘고 있는 상황이며 당뇨병과 공복혈당장애를 포함한 인구는 1,440만 명에 이르고 있다. 당뇨병 환자는 혈당량을 주기적으로 모니터함으로써 자신의 혈당량을 관리하는 것이 권장된다. 그러나, 이 중 혈당이 잘 조절되는 환자는 2020년도 발표자료에서 26% 수준으로 관리가 잘 되지 않고 있는 현실이다. 기존의 개발된 측정 방식은 주로 직접 채혈하여 측정하는 침습 방식으로 환자 스스로 혈액을 미세량 뽑아 혈당을 측정하는 방법이다. 하지만, 하루 네 번 이상 혈당 측정을 위해 매번 피를 뽑는 것은 당뇨병 환자에게는 큰 스트레스와 고통이 따르는 쉽지 않은 일이다.
이 때문에 혈액의 채취량을 줄이거나 침습하는 범위를 줄여 혈액 대신에 간질액을 채취하는 방법 등이 연구되고 있으며, 고통을 최소화하면서 더 정확하고 빠르게 혈당을 측정할 수 있는 기술을 중심으로 혈당센서 및 측정기 개발이 활발히 이루어지고 있다. 그러나, 침습형 방식은 여전히 고통으로부터 자유로울 수 없으며, 혈관과 함께 피부 표면 손상을 줄 수 있다는 문제점이 여전히 존재한다.3 따라서, 이러한 문제점을 해결하고자 광학, 분광학, 초음파, 열, 전기, 전기화학 등의 기법에 의존하는 비침습형 방식의 센서를 개발하기 위해 노력해왔다. 이 중 전기화학적 방식이 가장 큰 가능성을 보여주고 있다.4,5 전기화학 센서는 전해액에 녹아 있는 글루코스와 전극 사이에서 발생하는 전류나 전위차, 임피던스와 같은 신호를 이용한다. 검출하는 데 사용되는 물질은 비생물학적 혹은 효소와 같은 생물학적 성분을 이용한다. 실제 진단하는데 있어서 민감도와 선택성이 높은 이유로 효소를 기반으로 한 센서가 많이 활용되고 있다.6 이러한 효소를 이용한 센서는 혈액,7 간질액,8 소변,9 땀,10 침,11 눈물과12 같은 체액에서 글루코스를 검출할 수 있다.
특히 소변, 땀, 침, 눈물 등의 바이오 플루이드를 이용하여 비침습 방법으로 글루코스를 검출 및 측정할 수 있다. 소변은 주기적인 관리를 위해 식사 전, 식후 2시간 내에 혈당을 측정하여 관리해야 하는 방식에 적합하지 않다. 침은 분석물질을 쉽게 채취하는 장점이 있으나 불순물이 많아 글루코스의 고유 농도를 측정하기 어렵다는 문제가 있으며, 눈물은 불순물은 적지만 채집이 어렵고 채집할 수 있는 양이 적다는 것이 문제이다. 이에 비하여 땀은 땀샘이 온몸에 분포하기 때문에 비침습성 글루코스 모니터링에 사용하는 다른 바이오 플루이드에 비해 큰 장점이 있고 신체 내부의 생리학적 상태를 빠르게 반영한다. 땀은 땀샘의 분비 코일에서 전해액이 분비되고 재흡수관을 통과하며 염분을 재흡수 한 뒤 피부 표면으로 분비된다. 이 단계에서는 땀 내부의 글루코스가 흡수되지 않은 상태로 남아 있기 때문에 센서로 쉽게 측정할 수 있다. 따라서 운동 중 땀에 있는 글루코스를 편리하게 감시할 수 있도록 한 다양한 형태의 센서가 개발되고 있다. 하지만 땀을 이용한 웨어러블, 패치형 형태의 센서가 존재하나 정교함이 필요한 형태이며 비용이 다소 들 수 있다. 또, 장시간 착용이나 부착해야 하는 번거로움이 있으며, 잔류 글루코스나 외부에서의 오염물질이 측정에 영향을 미칠 수 있어 땀이 채취되는 부위를 주기적으로 청소해야 할 필요성이 있다.13
본 연구에서는 이러한 기존의 혈당측정기기의 불편한 점과 문제점, 비용적인 문제를 해결하기 위해 종이를 바이오센서 전극을 기능화 하는데 사용했다. 종이는 비교적 저렴하고 풍부하기 때문에 분석 화학에서 바이오센서의 잠재적인 재료로서 많이 사용되고 있다.14 종이는 용도에 따라 가볍고 유연하게 만들 수 있는 장점이 있으며, 종이의 주요 성분인 셀룰로오스 섬유는 친수성이기 때문에 펌프나 외부 전원 없이 섬유 구조 사이로 빠르게 바이오 플루이드를 흡수한다. 종이의 저렴한 가격은 저비용 기기에 적용할 수 있기 때문에 취약 계층의 혈당관리에 손쉽게 적용할 수 있다. 본 연구는 기존의 측정 방식의 고통과 불편함을 해소하기 위한 간편하게 땀을 닦아내는 것만으로 혈당을 측정하는 바이오센서 개발에 관한 것이다.
시약 및 재료. 글루코스 검출용 시약을 제작하기 위해 D+(-) glucose(글루코스, Sigma-Aldrich, USA), 0.1 M phosphate buffer saline(PBS, Bioneer, Korea)을 사용했다. 검출용 전극은 기준전극으로 은(silver), 상대전극으로 카본(carbon), 작업 전극으로 카본과 매개체(mediator)로 프러시안 블루(Prussian blue, PB)가 도입된 DS-710(전극, Metrohm DropSens, Spain)을 사용했다.
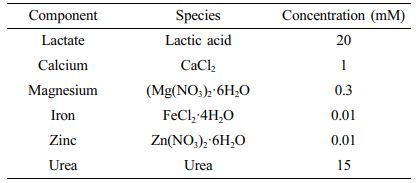
인공 땀의 제조. 인공 땀을 제조하기 위해 uric acid(UA, Sigma-aldrich, USA), L-ascorbic acid(AA, Duksan, Korea), L-lactic acid(LA, TCI, Japan), urea(urea, Sigma-Aldrich, USA), calcium chloride(CaCl2, Yakuri, Japan), iron(II) chloride tetrahydrate(FeCl2·4H2O, Junsei, Japan), zinc nitrate hexahydrate(Zn(NO3)2·6H2O, Alfa Aesar, USA), magnesium nitrate hexahydrate(Mg(NO3)2·6H2O, Sigma-Aldrich, USA)를 Table 1과 같은 농도로 PBS 200 mL에 녹여 베이스 용액으로 사용하였다.15 제작된 용액(100 mL)에 글루코스(10 mM) 용액을 희석하여 글루코스 농도가 0-4 mM(0.5 mM 단위)되도록 제작했다.
GOx 종이디스크 제작. 효소로 기능화한 종이 디스크 제작을 위해 종이 여과지(Advantec, 125 mm)와 glucose oxidase (GOx, Sigma-Aldrich, USA)를 사용했다. 디스크(disc, 지름 9 mm) 형태의 거름 종이를 타공기를 이용하여 제작하였다. PBS(1 mL)을 사용하여 GOx(1.5 g mL-1, 150 U mL-1)용액을 제조하였다. 제작된 GOx 용액(15 μL)을 각 종이 디스크에 떨어뜨린 후 상온에서 30분 동안 건조했다. 제작된 GOx 종이 디스크(2.25 U disc-1)는 각각 냉장, 상온 보관하여 안정성 평가에 사용했다.
전기화학적 특성 평가. 글루코스 검출 시험을 위해 WizEQCM-1001(Potentiostat, Wizmac, Korea)에 screen-print 전극용 커넥터(CAC, Metrohm DropSens, Spain)를 이용하여 전기 화학적 특성평가를 진행했다. Scheme 1에서와 같이 DS-710 전극 위에 GOx 종이 디스크(2.25 U disc-1)를 기준, 상대, 작업전극을 완전히 덮어 시험 용액(20 μL)를 떨어뜨리는 방식으로 실험하였다. Cyclic voltametric(CV) 측정은 0.0 V에서 -0.3 V까지 스캔 속도 10 mV/s로 스캔하였다. 사용된 전극은 증류수를 이용하여 세척 및 건조 후 재사용하였다. Chrono amperometric(CA)은 -0.15 V에서 측정하였다. CA 측정시 전극을 0.1 V에서 5초간 안정화를 거친 후 본 측정을 진행했다. 각 CA 측정의 결과는 5회 반복 테스트한 평균 값과 표준편차를 이용했다.
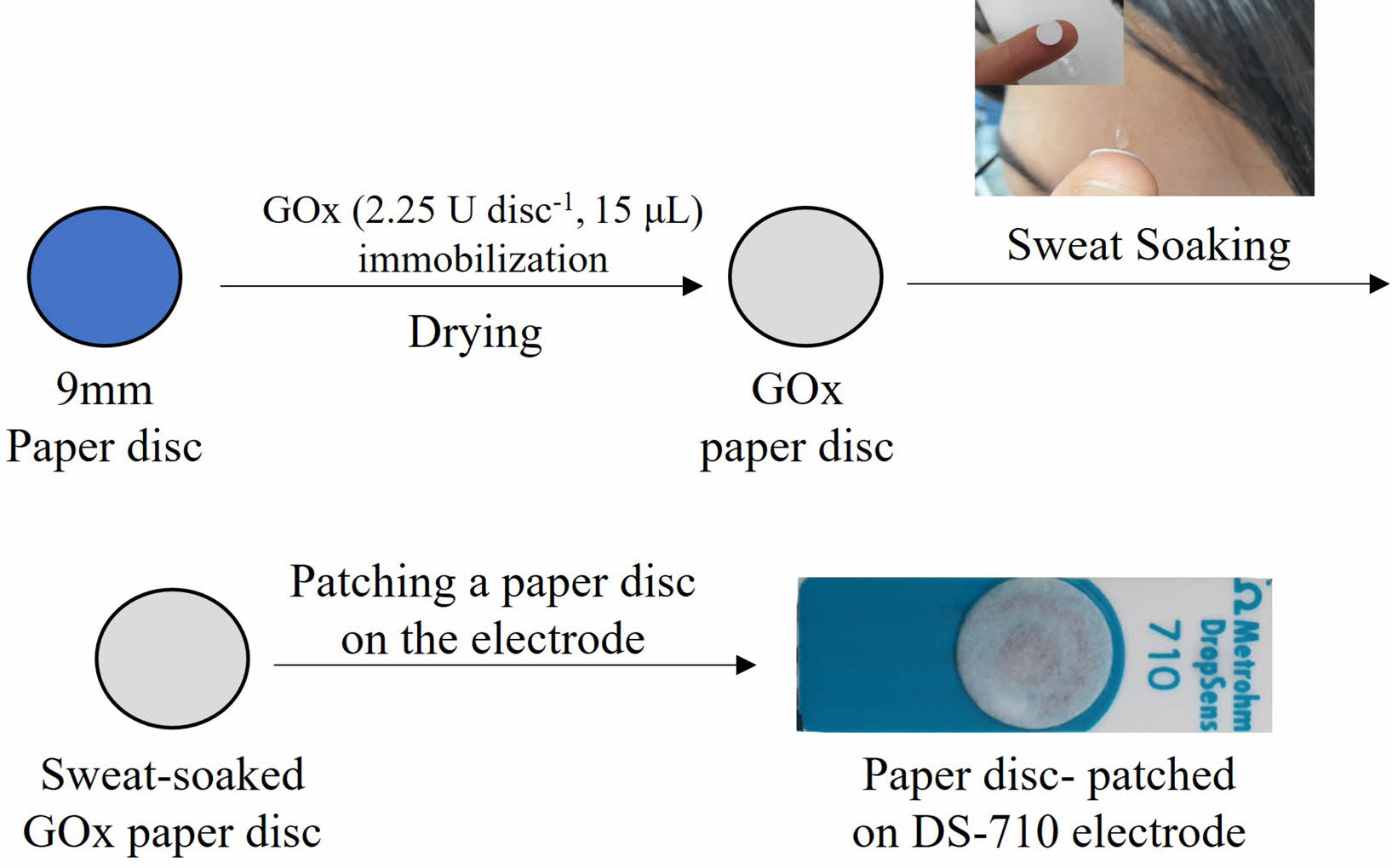
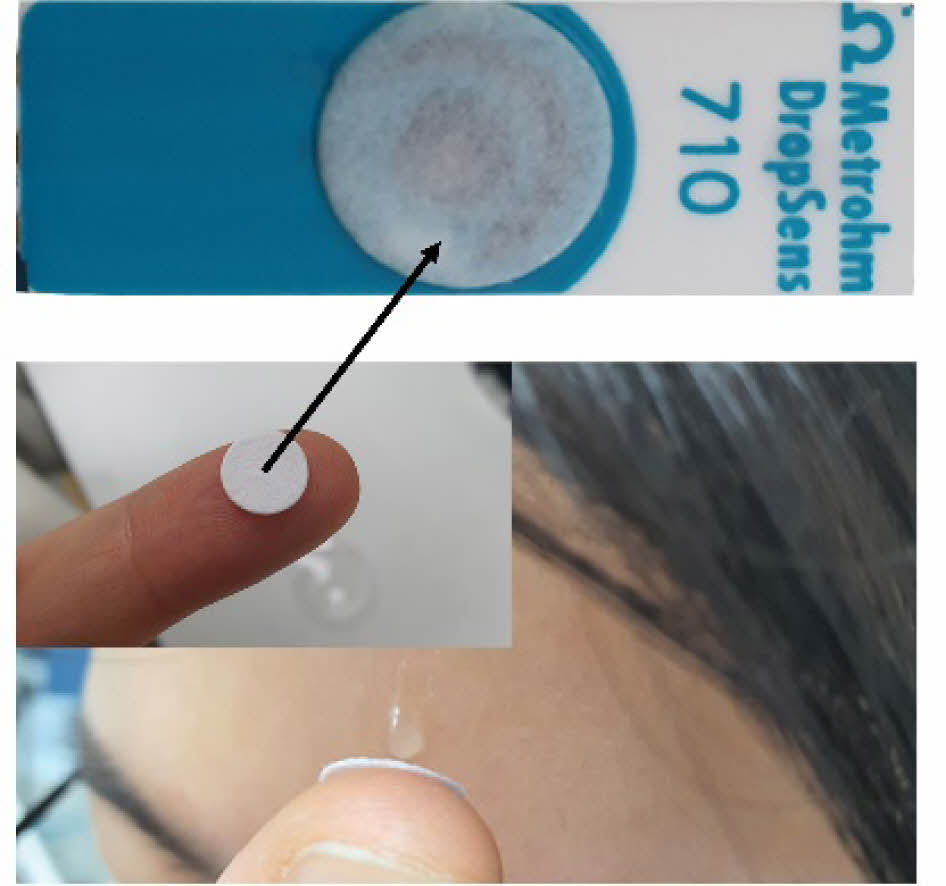
Scheme 1. Schematics of preparation of the glucose oxidase (GOx) paper disc patched on the Prussian-blue (PB)-doped electrode with the photographic image of collecting sweat.
실제 땀 채취 및 분석. 임의의 시험자를 대상으로 운동 중 발생하는 땀을 4 mL vial에 약 1 mL 정도씩 채집하였다. 냉장 보관한 채취된 땀의 글루코스 양은 측정 전에 상온에서 녹인 뒤 20 μL를 GOx 종이 디스크(2.25 U disc-1)에 떨어뜨려 CA 방법으로 측정한 전류를 검량선과 대조하여 계산했다.
|
Table 1 Components of the Artificial Sweat Sample and Their Respective Concentrations |
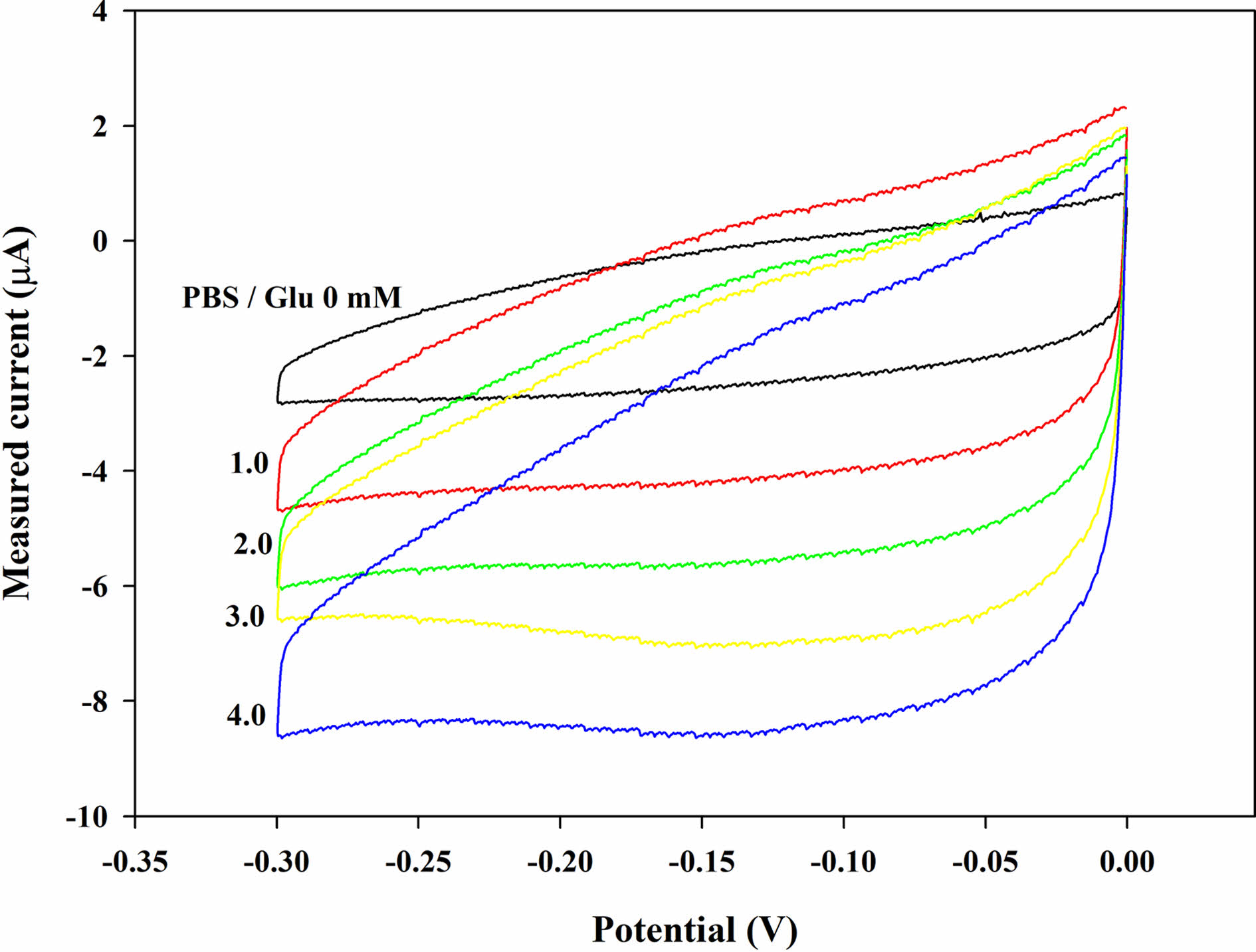
전기화학적 특성 평가. Figure 1은 글루코스 검출 전극에서 글루코스 농도(Cg)에 따른 CV 측정 결과이다. Cg가 증가함에 따라 환원전류는 아래쪽으로 내려가는 것을 관찰할 수 있었지만, 산화 전류는 미세하게 증가하였다. 이는 H2O2에 의한 프러시안 화이트/프러시안 블루의 산화/환원반응의 특징으로 알려져 있다.16,17 순수 PBS(Cg=0)와 글루코스 용액(Cg=4 mM)을 비교하면 환원에 의해 감소전류가 더욱 뚜렷하게 증가하는 것을 확인할 수 있다. 따라서, Cg가 증가함에 따라 GOx에 의해서 H2O2가 더 많이 생성되어 감소 전류가 증가하는 것으로 추정할 수 있다. 이 분석을 통해 글루코스와 GOx의 효소 반응에 의해 생성된 H2O2가 PB와의 효율적인 촉매 반응을 하여 감소전류를 생성하는 것을 보여주며, 전극이 효율적인 전기 촉매 역할을 하고 있음을 보여준다.
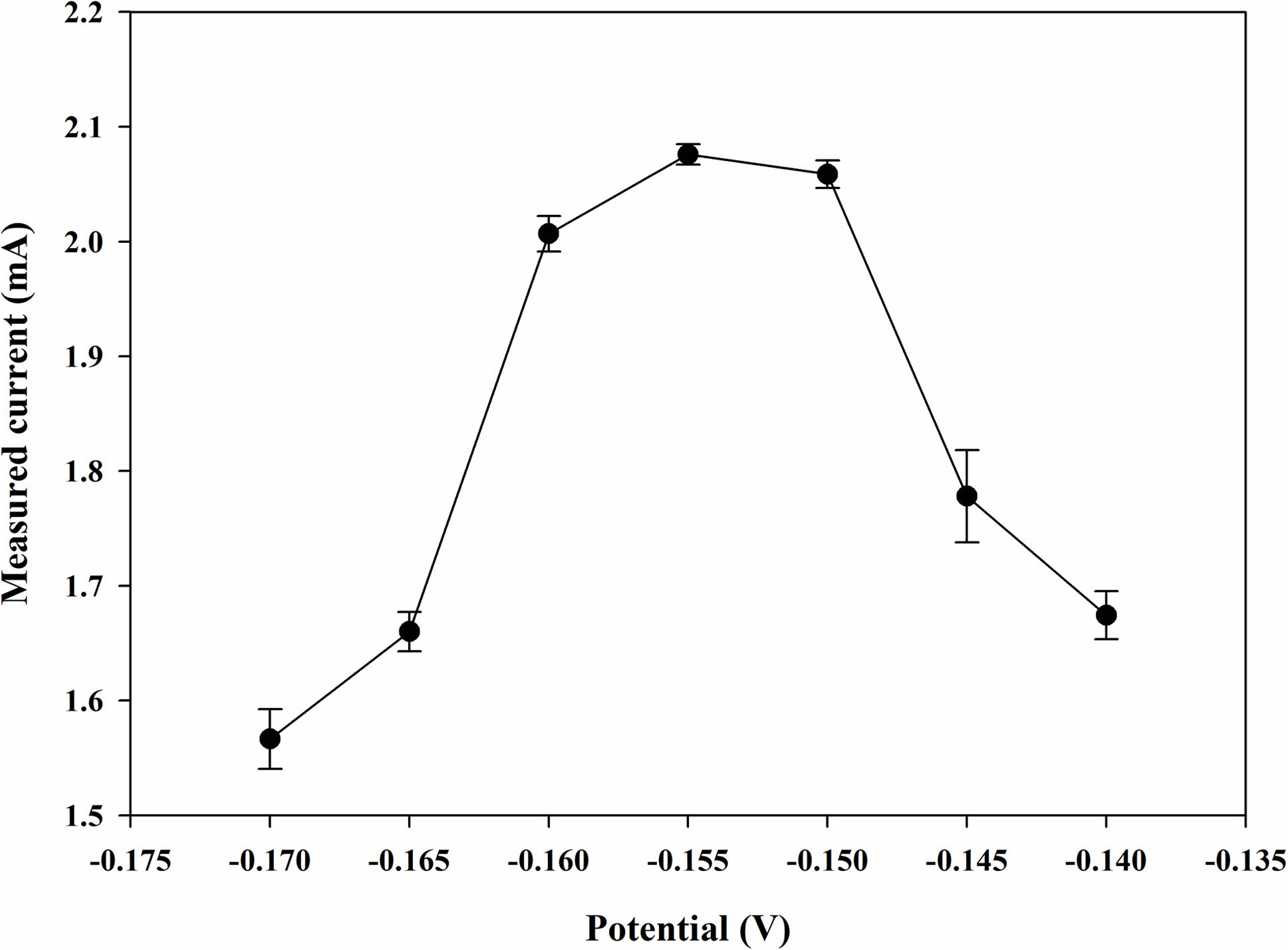
작업 전극에 적용될 전위는 바이오 센서에서 중요한 역할을 한다. CA 분석에서의 최적 전위는 Figure 2와 같이 -0.17 ~ -0.14 V까지의 전위 범위에서 최대 전류를 나타내는 -0.155 V로 결정하였다. 또한, 각 전위에서 5회 반복 테스트를 진행하는 동안 표준편차는 2% 내외로 재현성이 양호한 것을 알 수 있다. 따라서, 이후 진행되는 CA 분석에서 -0.155 V를 이용하여 실험을 진행했다.
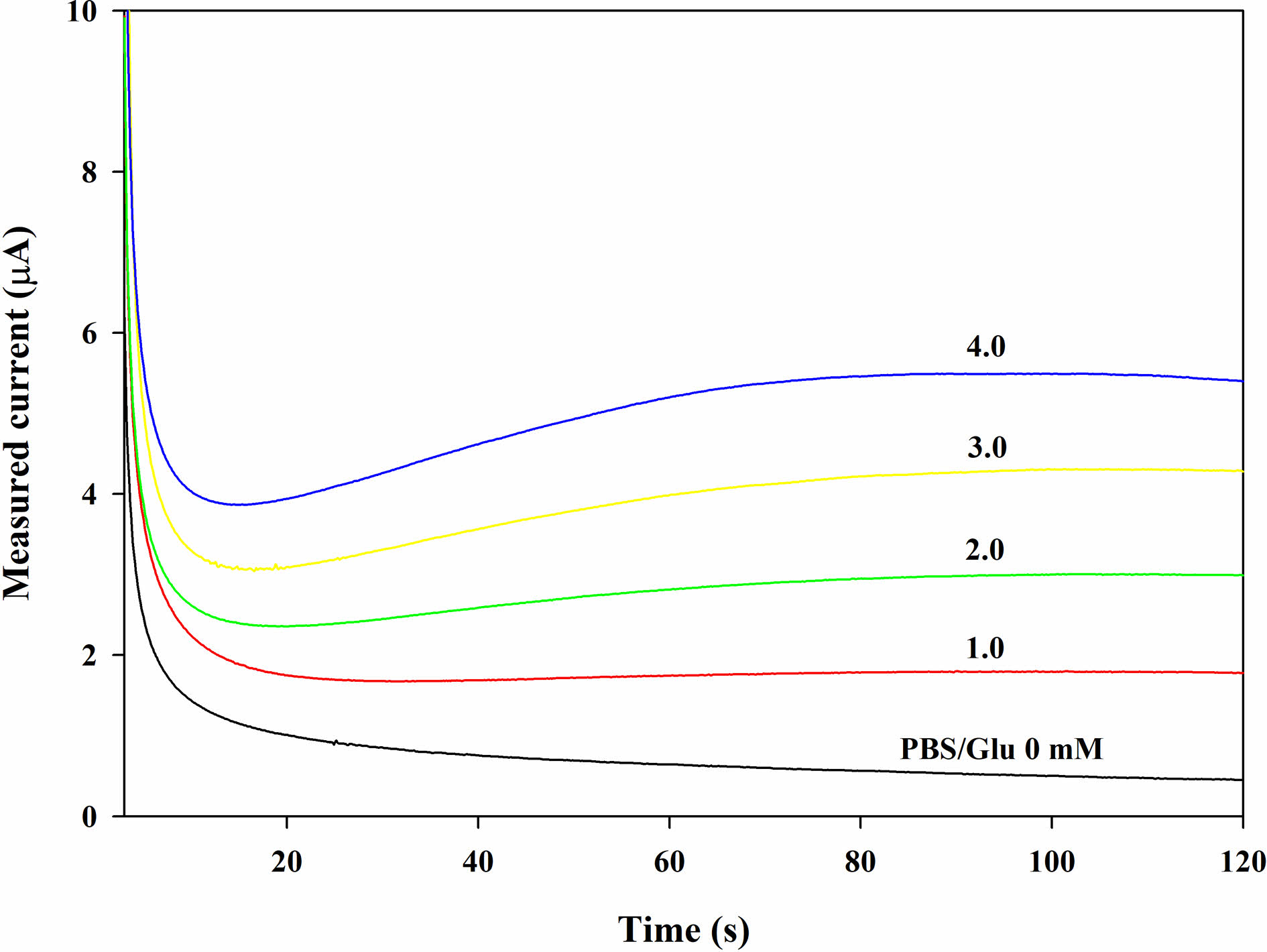
Figure 3은 글루코스 검출 전극에서 글루코스 농도에 따른 CA 결과이다. 120초 동안 각 농도에서의 감소 전류는 일정한 값에 수렴하며, 글루코스의 농도가 증가하는 것에 따라 일정한 간격으로 증가하는 것을 알 수 있다. 따라서, Cg를 달리하여 CA 분석을 하여 -0.155 V에서 120초간 측정한 값을 이용해 Figure 5에서와 같이 검량선으로 만들 수 있다.
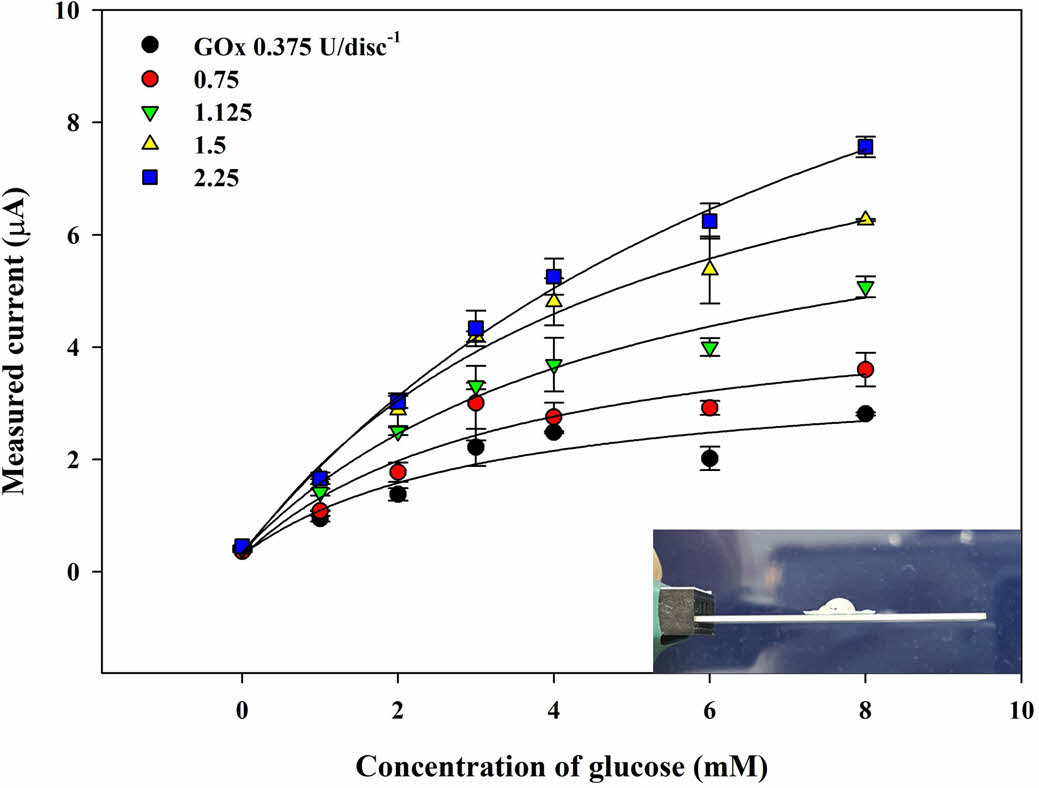
GOx 디스크 종이의 제조. 일반적으로 효소의 충전량은 CA 반응에서 큰 영향을 미친다. 이를 비롯하여 바이오센서의 성능을 향상시키기 위해 GOx의 양이 충분해야 더 큰 범위의 선형 범위를 가질 수 있다. GOx의 충전량의 증가는 더 많은 H2O2를 생성하게 하여 감소전류의 증가로 이어지게 한다. 종이 디스크에 충전된 GOx의 양은 0.375-2.25 U disc-1까지 사용하여 바이오센서에 대한 최적의 GOx 충전량을 결정했다.
Figure 4는 GOx의 농도(CGOx)를 달리하여 제작한 GOx종이 디스크를 사용하여 측정한 Cg에 따른 감소 전류의 변화를 나타낸 것이다. CGOx에 상관없이 Cg가 낮은 구간에서는 빠르고 선형적으로 전류가 증가하는 것을 보이나, 높은 구간에서는 점차 수렴되는 것을 알 수 있다. CGOx가 증가함에 따라 바이오센서의 기울기가 꾸준히 증가하며 1.5-2.25 U disc-1 부근에서 수렴하기 시작하는 것을 보인다. 이후 CGOx가 늘어나게 되면 감소 전류는 소량 증폭되는 것이 확인했으나 Figure 4의 삽입 사진과 같이 GOx 종이디스크의 흡수성이 급격히 낮아져 땀의 흡수가 잘 되지 않고 물방울이 맺힌 것을 확인할 수 있다. 따라서, 2.25 U disc-1의 CGOx를 이용하여 이후 실험에 사용되었다.
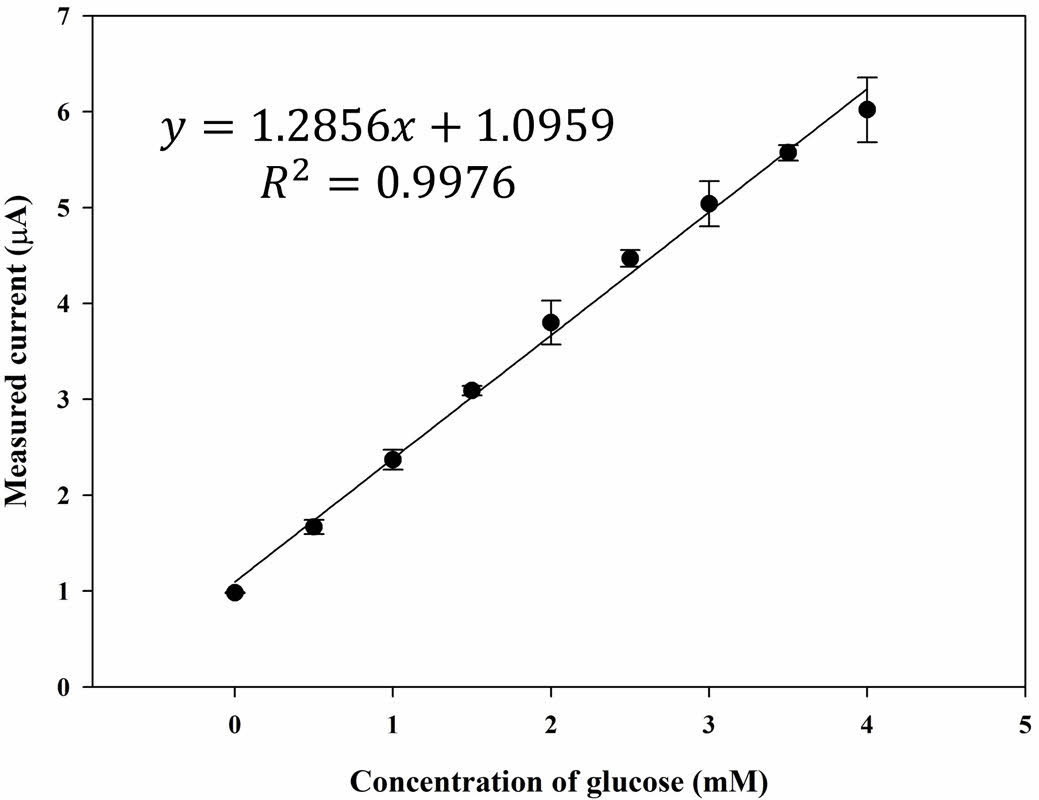
민감성, 선택성, 안정성 특성 평가. 앞서 언급한 최적의 전위 조건(-0.155 V vs. Ag/AgCl) 및 GOx 충전량(2.25 U disc-1)으로 글루코스 바이오센서의 검량선을 Figure 5와 같이 얻었다. 글루코스 바이오센서의 검량선은 0-4 mM의 범위에서 선형 방정식 y=1.2856x+1.0959로 나타났으며, 여기서 y는 μA 단위의 전류, x는 mM 단위의 글루코스 농도를 나타낸다. R2 값은 0.998로 나타났다. 또, 글루코스 1 mM 농도에서의 감소전류 표준편차는 2.02%(n=5)로 재현성이 양호했으며, IUPAC 기준에 기초하여 계산한 검출한계(LOD)는 0.01 mM이었다.
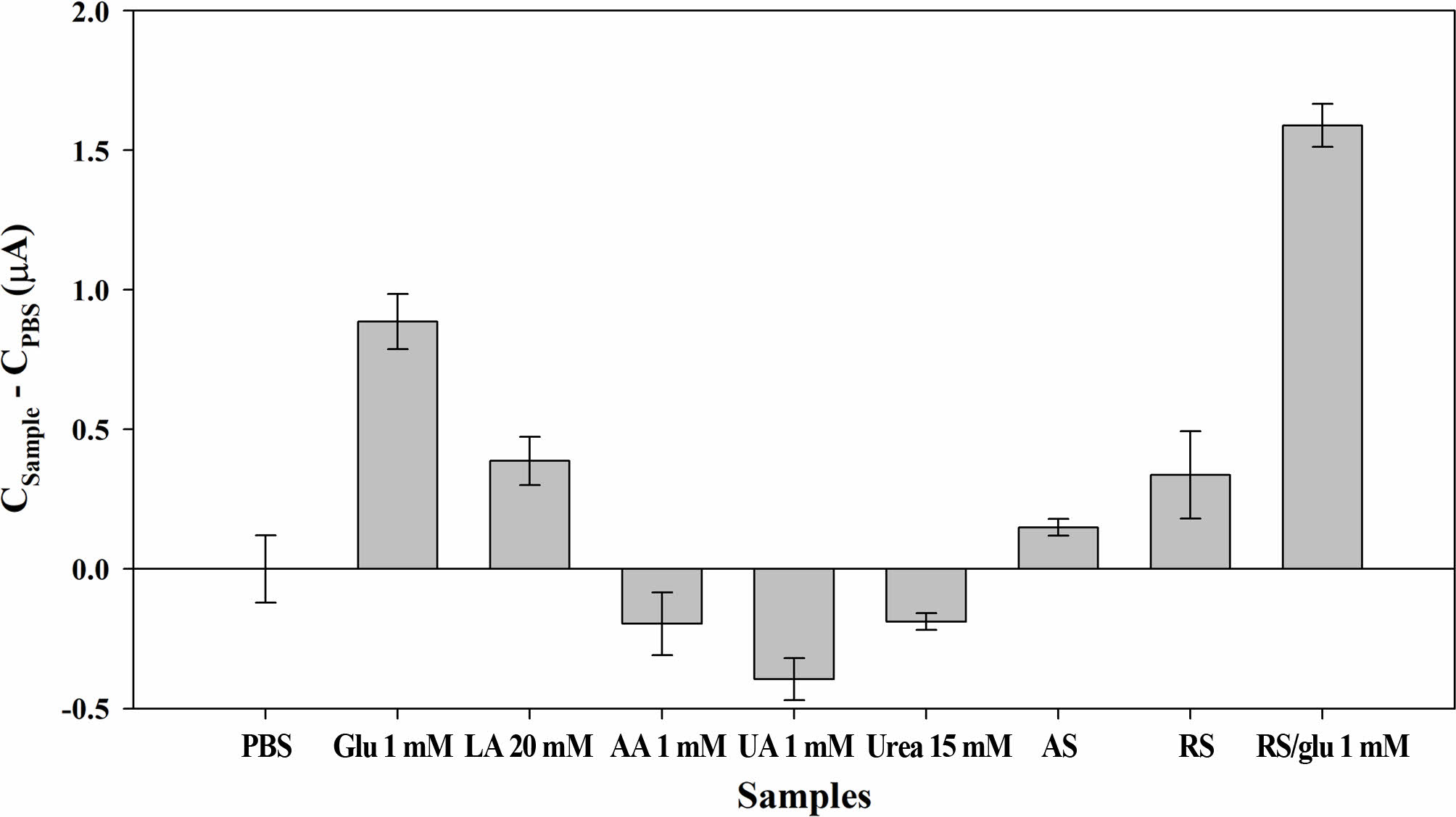
바이오센서에 있어서 CA방식으로 분석할 때 다른 화학물질에 의해 발생하는 전기적 간섭은 가장 큰 문제로 작용할 수 있다. 땀에 존재하는 다양한 불순물이 바이오센서의 반응에 영향을 미칠 수 있는지 각 불순물별 영향을 조사했다. 땀의 주성분인 LA(20 mM), AA(1 mM), UA(1 mM), Urea (15 mM)를 PBS에 녹여 각 감소전류를 Figure 6과 같이 측정하였다. 이 때 적용한 농도는 실제 땀에 들어 있는 양에 비해 높은 수준으로 준비하였다. 또한 채집된 실제 땀과 인공 땀을 측정하여 서로 비교하였다. LA(20 mM), AA(1 mM), UA(1 mM), Urea(15 mM), 글루코스 PBS 용액의 측정한 전류는 PBS만을 이용한 경우를 베이스로 하여 증가분으로 표시하였다. 글루코스 용액(Cg=1 mM)과 비교하면 AA, UA, Urea 용액은 감소 전류의 증가는 거의 없고 실제 PBS 용액보다 낮은 감소 전류를 나타났다. LA만이 감소전류가 0.4 μA 증가하는 것을 보이고 있다. 인공 땀에서도 미약하게 증가하며, 이는 LA의 영향으로 볼 수 있다. 글루코스 1 mM를 포함한 인공 땀의 감소전류는 1.5 μA의 높은 신호를 보여 글루코스에 대한 선택성이 매우 높음을 알 수 있다. 실제 사람의 땀을 검량선에서 측정한 결과 약 0.4 mM의 글루코스가 검출되었으며, 여기에 1 mM의 글루코스를 추가하여 측정했을 때 1.4 mM 수준으로 나타났다. 이는 실제 땀에서도 다른 불순물의 영향을 크게 받지 않으며, 충분히 실제 땀에도 적용하여 사용이 가능하다는 것이다.
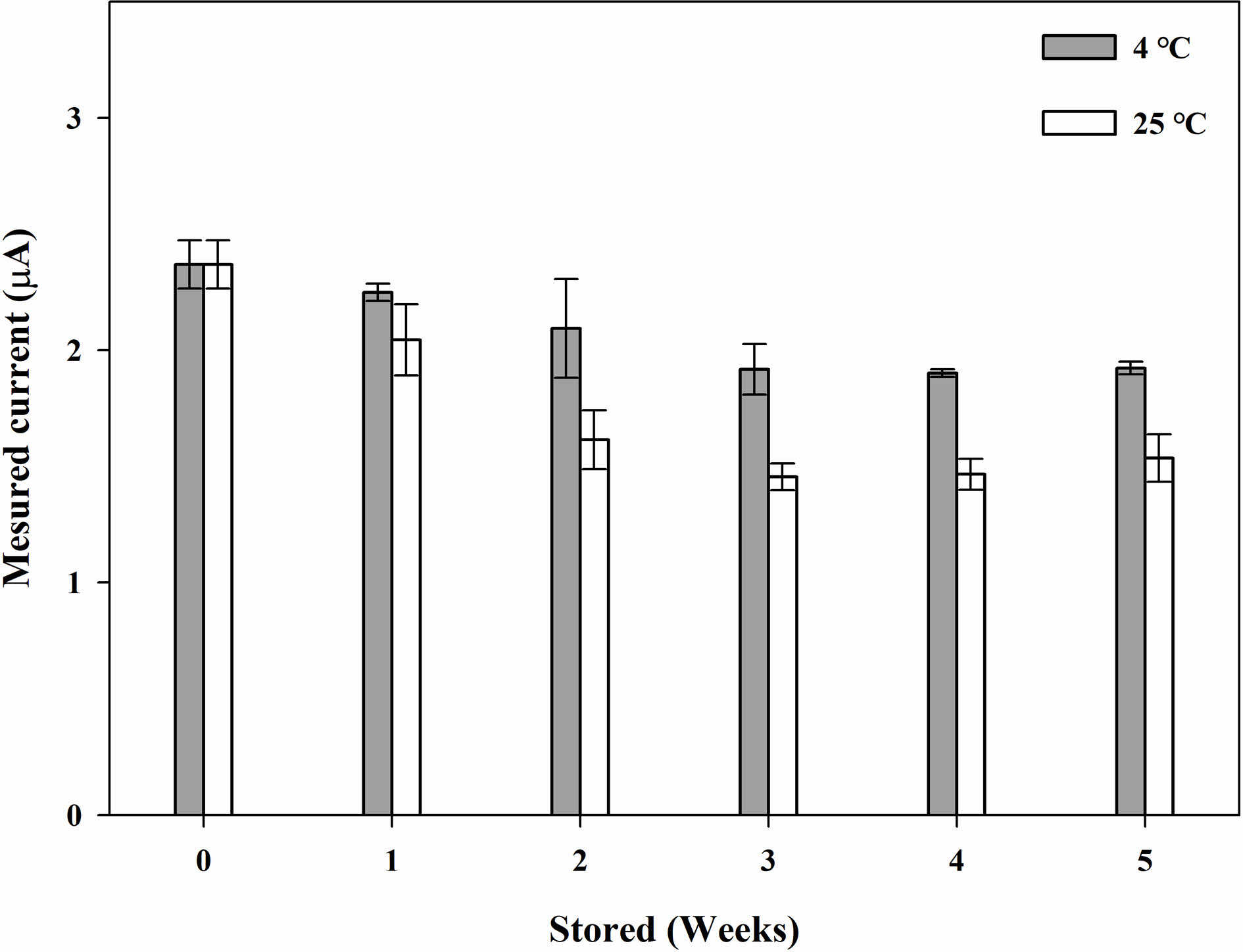
바이오센서는 GOx 종이 디스크의 상태가 가장 중요하게 작용한다. 따라서, 저장 안정성을 조사하기 위해 GOx 디스크를 4 °C와 상온에 보관하며 일정 기간마다 감소 전류를 측정하였다. 저장 시간에 따른 종이 기반 글루코스 바이오센서의 감소 전류의 신호는 Figure 7과 같다. GOx 종이디스크의 글루코스 용액(Cg=1 mM)에 대한 감소전류는 4 °C에 보관하여 35일 동안 시험한 후에도 초기 전류 값의 80%를 유지했다. 상온에서 보관된 경우 14일 경과 후 급격히 감소하여 35일 동안 초기 전류 값의 60%까지 감소했다. 따라서 본 연구에서 제조한 GOx 종이 디스크 바이오센서는 매우 안정하여 장기간 사용할 수 있었다.
|
Figure 1 Cyclic voltammograms (CV, 0 to -0.3 V at 10 mV s-1) with the GOx paper disc (2.25 U disc-1) on the electrode after dropping the PBS samples (20 μL) containing glucose at different glucose concentration (Cg). |
|
Figure 2 Measured currents of the chronoamperometric (CA) curves with the GOx paper disc (2.25 U disc-1) on the electrode after dropping the PBS samples (20 μL) containing glucose (Cg=1 mM) at different applied potentials (vs. Ag/AgCl). |
|
Figure 3 Chronoamperometric (CA) curves (-0.155 V vs. Ag/ AgCl) with the GOx disc (2.25 U disc-1) on the electrode after dropping the PBS samples (20 μL) containing glucose at different glucose concentration (Cg). |
|
Figure 5 Calibration curve of the measured current vs. concentration of glucose (Cg) plot from the chronoamperometric (CA) curves (-0.155 V vs. Ag/AgCl) with the PBS samples (20 μL) using the GOx paper disc on electrode prepared at GOx concentration (CGOx) of 2.25 U disc-1 |
|
Figure 4 Measured current of the chronoamperometric (CA) curves (-0.155 V vs. Ag/AgCl) as a function of glucose concentration (Cg) of the PBS samples (20 μL) with the GOx paper disc on electrode prepared at different GOx concentration (CGOx); inset is the photographic image of the electrode with water droplet on the disc at CGOx > 2.25 U. |
|
Figure 6 Measured currents of the chronoamperometric (CA) curves (-0.155 V vs. Ag/AgCl) with the PBS samples (20 μL) containing glucose (Glu, 1 mM), lactic acid (LA, 20 mM), uric acid (UA, 1 mM), ascorbic acid (AA, 1 mM), urea (1 mM), artificial sweat (AS), and real sweat (RS) using the GOx paper disc on electrode. |
|
Figure 7 Measured currents of the chronoamperometric (CA) curves (-0.155 V vs. Ag/AgCl) with the PBS samples (20 μL) containing glucose (1 mM) using the GOx paper disc on electrode at different storage time at 4 oC and 25 oC. |
본 연구에서 시판되는 PB 기반의 전극을 기능화할 수 있는 GOx 종이 디스크 바이오센서를 개발하였다. 종이에 화학적 방법이 아닌 물리적 흡착 방법으로 GOx를 고정하여 효소의 역할을 극대화할 수 있도록 제작되었다. GOx 종이 디스크는 일회용으로 사용할 수 있도록 전극과 분리된 형태로 제작하였다. GOx 종이 디스크는 저온에 보관이 가능하여 효소의 성능저하 없이 간편히 보관할 수 있다. 이 연구에서는 땀을 닦아 내어 측정하는 것을 목적으로 실험이 진행되었으나 본 방법은 종이 디스크 바이오센서를 땀을 포집할 수 있는 밴드에 부착하여 패치방식으로 적용될 수 있다. 이러한 방법으로 실제 땀의 포집을 종이 디스크 바이오센서가 포화될 정도로 땀을 수집하면 되기 때문에 간단히 패치 방법으로 적용될 수 있고 관련 연구를 수행 중이다. 또한, 이러한 방법은 다른 효소를 사용하거나 양을 조절하여 사용 목적에 따라 다양화하게 사용할 수 있다. 따라서 이 새로운 종이 기반 글루코스 바이오센서는 생산성, 다양성, 소형화, 고감도 및 선택성의 이점을 갖고 있으며, 무엇보다도 쉽게 얻을 수 있는 종이의 저 비용적인 장점은 취약 계층에서도 부담 없이 혈당을 관리할 수 있도록 제공할 것이다.
- 1. Whiting, D. R.; Guariguata, L.; Weil, C.; Shaw, IDF Diabetes Atlas: Global Estimates of the Prevalence of Diabetes for 2011 and 2030. J. Diabetes Res. Clin. Pract. 2011, 94, 311-321.
-

- 2. Amos, A. F.; McCarty, D. J.; Zimme, P. The Rising Global Burden of Diabetes and its Complications: Estimates and Projections to the Year 2010. Diabetic Med. 1997, 14, S7-S85.
-

- 3. Tierney, M. J.; Kim, H. L.; Burns, M. D.; Tamada, J. A.; Potts, R. O. Electroanalysis of Glucose in Transcutaneously Extracted Samples. Electroanalysis 2000, 12, 666-671.
-

- 4. Vashist, S. K. Non-invasive Glucose Monitoring Technology in Diabetes Management: A Review. Anal. Chim. Acta 2012, 750, 16-27.
-

- 5. Oliver, N. S.; Toumazou, C.; Cass, A. E. G.; Johnston, D. G. Glucose Sensors: A Review of Current and Emerging Technology. Diabet. Med. 2009, 26, 197-210.
-

- 6. Lipinska, W.; Siuzdak, K.; Karczewski, J.; Dolega, A.; Grochowska. K. Electrochemical Glucose Sensor Based on the Glucose Oxidase Entrapped in Chitosan Immobilized Onto Laser-processed Au-Ti Electrode Sens. Actuators B-Chem. 2021, 330, 129409.
-

- 7. Slaughter, G.; Kulkarni, T. Detection of Human Plasma Glucose Using a Self-Powered Glucose Biosensor. Energies 2019, 12, 825.
-

- 8. Bollella, P.; Sharma, S.; Cass, A. E. G.; Antiochia, R. Minimally-Invasive Microneedle-based Biosensor Array for Simultaneous Lactate and Glucose Monitoring in Artificial Interstitial Fluid. Electroanalysis 2019, 31, 374-382.
-

- 9. Hossain, M. F.; Park, J. Y. Plain to Point Network Reduced Graphene Oxide-activated Carbon Composites Decorated with Platinum Nanoparticles for Urine Glucose Detection. Sci. Rep. 2016, 6, 21009.
-

- 10. Karpova, E. V.; Shcherbacheva, E. V.; Galushin, A. A.; Vokhmyanina, D. V.; Karyakina, E. E.; Karyakin, A. A. Noninvasive Diabetes Monitoring Through Continuous Analysis of Sweat Using Flow-through Glucose Biosensor. Anal. Chem. 2019, 91, 3778-3783.
-

- 11. Bollella, P.; Gorton, L.; Ludwig, R.; Antiochia, R. A Third Generation Glucose Biosensor Based on Cellobiose Dehydrogenase Immobilized on a Glassy Carbon Electrode Decorated with Electrodeposited Gold Nanoparticles: Characterization and Application in Human Saliva. Sensors 2017, 17, 1912.
-

- 12. Sabu, C.; Henna, T. K.; Raphey, V. R.; Nivitha, K. P.; Pramod, K. Advanced Biosensors for Glucose and Insulin. Biosens. Bioelectron. 2019, 141, 111201.
-

- 13. Lee, H.; Hong, Y. J.; Baik, S.; Hyeon, T.; Kim, D. H. Enzyme-Based Glucose Sensor: From Invasive to Wearable Device. Adv. Healthc. Mater. 2018, 7, 1701150.
-

- 14. Zhao, W. A.; Van Den Berg, A. Lab on Paper. Lab Chip 2008, 8, 1988-1991.
- 15. Hussain, S.; Park, S. Y. Sweat-Based Noninvasive Skin-Patchable Urea Biosensors with Photonic Interpenetrating Polymer Network Films Integrated into PDMS Chips. ACS Sens. 2020, 5, 3988-3998.
-

- 16. Chi, Q.; Dong, S. Amperometric Biosensors Based on the Immobilization of Oxi-dases in a Prussian Blue Film by Electrochemical Codeposition. Anal. Chim. 1995, 310, 429-436.
-

- 17. Karyakin, A. A.; Karyakina, E. E.; Gorton, L. On the Mechanism of H2O2 Reduction at Prussian Blue Modified Electrodes. Electrochem. Commun. 1999, 1, 78-82.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(3): 342-347
Published online May 25, 2022
- 10.7317/pk.2022.46.3.342
- Received on Dec 28, 2021
- Revised on Feb 15, 2022
- Accepted on Feb 15, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Soo-Young Park
-
Department of Polymer Science & Engineering, Polymeric Nanomaterials Laboratory, School of Applied Chemical Engineering, Kyungpook University, 80 Daehak-ro, Buk-gu, Daegu 41566, Korea
- E-mail: psy@knu.ac.kr
- ORCID:
0000-0001-6796-4929










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.