- Preparation and Characterization of Magnetized Microneedles for Magnetic Resonance Molecular Imaging
Process Development Lab., Department of Pharmaceutical Science and Engineering, Seowon University, Chungju, Chungbuk 28674, Korea
*Department of Biomedical Science & Institute of Bioscience and Biotechnology, Kangwon National University, Chuncheon, Kangwon 24341, Korea
**Radiology, College of Medicine, Yonsei University, 50-1, Yonsei-Ro, Seodaemun-gu, Seoul 03722, Korea- 자기공명분자영상 응용을 위한 자성 마이크로 니들의 제조와 특성분석
서원대학교 바이오융합대학 제약공학과 공정개발연구실, *강원대학교 의생명과학대학 생물의소재공학과,
**연세대학교 의과대학 영상의학교실Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
In this study, magnetized microneedles (MMNs) that contain herceptin conjugated to iron oxide nanoparticles were manufactured by low temperature process technology and its effects on magnetic resonance (MR) molecular imaging were investigated. The results showed that after the MMNs were manufactured, changes in morphology and magnetic properties were not observed and more than 90% of the skin permeability and cell viability were confirmed and dramatic signal intensity changes of MMNs containing herceptin were confirmed more than 30% on magnetic resonance imaging measurements. In conclusion, it is expected that MMNs containing herceptin have an essential role as a base technology in the field of MR molecular imaging, which can diagnose and therapeutic through transdermal drug delivery system.
본 연구에서는 허셉틴이 결합된 산화철 나노입자를 함유하는 magnetized microneedles(MMNs)를 저온공정기술을 통해 제조하여 magnetic resonance imaging 분자조영제로의 용용에 관한 연구를 수행하였다. 그 결과 MMNs 제조후에 표면 및 자성특성변화는 관찰되지 않았으며, 90% 이상의 피부투과도와 세포생존율이 확인되었고, 허셉틴을 결합한 MMNs에서 30% 이상의 급격한 signal intensity 변화가 확인되었다. 결론적으로, 허셉틴이 결합된 MMNs가 자기공명분자영상 분야의 경피전달시스템을 통한 진단 동시 치료를 위한 기반 기술로서 중요한 역할을 할 것으로 기대된다.
In this study, magnetized microneedles (MMNs) that contain herceptin conjugated to iron oxide nanoparticles were manufactured by low temperature process technology and its effects on magnetic resonance (MR) molecular imaging were investigated. In conclusion, it is expected that MMNs containing herceptin have a higher targeting property for tumor cells, and have an important role as a base technology in the field of MR molecular imaging, which can diagnostic and therapeutic through transdermal drug delivery system.
Keywords: heceptin, microneedles, magnetic microneedle, magnetic resonance imaging, molecular imaging.
본 논문 연구의 분석을 위해 도움을 주신 연세대학교 의과대학 양승현 연구원님, 손혜영 박사님과 강원대학교 의생명과학대학 김진아 연구원님과 건양대학교병원 의료기기융합센터 이수정 박사님 및 서원대학교 제약공학과 공정개발연구실 연구원(민현규, 정민희, 구민지, 조수진, 최다혜, 황의주, 김소연, 김범기)님들에게 감사를 드립니다.
저자(들)는 이해상충이 없음을 선언합니다.
영상의학분야의 대표적인 단층 촬영 영상 의료기기인 자기공명영상(magnetic resonance imaging, MRI)이란 비침습적으로 다양한 3차원의 영상을 얻을 수 있는 기기로 자기장속에 있는 원자핵에 외부로부터 전자기파 형태의 에너지를 주어 교란시킨 후 핵에서 발생하는 핵자기공명신호를 공간적인 정보를 포함하여 영상화하는 기술로 공간해상도(spatial resolution) 및 대조도(contrast)가 뛰어나 병원에서 질병진단을 위해 주로 사용되고 있는 진단의료기기이다.1-3 특히, 인체의 특정부위나 장기에서 일어난 질병을 높은 정확도로 감별할 수 있으며, X-ray를 사용하는 다른 영상 진단 의료기기에 비해 인체에 무해성이 높아 진단의료현장에서 널리 사용 되어 지고 있다.4 자기공명영상의 민감도 증폭을 통한 해상도 향상을 위해 투여되어지는 조영제의 종류도 T1 조영제와 T2 조영제로 구분된다. T1 조영제의 경우 물과 비교하여 상대적인 밝은(bright or positive) 신호효과(contrast effect)를 나타내고, T2 조영제는 어두운(dark or negative) 신호 효과(contrast effect)를 나타내어 각각 양성 조영제(positive contrast agent)와 음성 조영제(negative contrast agent)로 불리기도 한다. 현재 사용되는 조영제는 Gd-DOTA(macrocyclic gadoteric acid)와 Gd-DTPA(gadolinium(III) diethylenetriamine pentaacetic acid) 등 착화합물성의 T1 조영제와 산화철 나노 입자와 같은 초상자성을 띄는 물질인 T2 조영제가 주로 사용되고 있다.5-7 최근 연구동향은 조영제 물질의 독성완화, 조영효과상승과 더불어 다중기능화를 위한 나노 크기의 바이오-무기물질을 기반으로한 나노하이브리드타입의 조영제 및 조영제를 경피로 투과하여 전달하려는 특수제형화에 관한 다양한 연구가 활발히 진행중이며, 긍정적인 연구결과들을 보이고 있다.8-16
특히, 진단 조영제의 한계를 극복하고자 질병부위를 스스로 찾아 갈 수 있는 탐침(probe)인자를 기존의 조영제에 결합하는 분자조영제 기술도 활발히 연구되고 있다. 예를들어 자기공명영상 조영제인 산화철 나노입자나 산화철을 함유한 나노캡술제형 표면에 결합된 항체 또는 분자단이 체내의 혈관에 주입된 후, 혈액을 따라서 순환하다가 표적 질병세포의 특정 수용체에 결합하게 되면 질병부위에서 조영제의 국소적인 농도가 상승하게 되어 조영제에 의해 질병부위의 대조도가 증가하여 영상에서 질병을 검출할 수 있게 되어, 종양 표적 자기공명 분자영상에 적용하면 종양을 특이적으로 생체 내에서 MRI을 통해 진단할 수 있게 되고, 탐침인자를 종양 표적 시스템으로 항원 항체 반응을 이용하게 되면, 진단동시 치료 효과를 기대 할 수도 있다.13,17,18
종양표적인 항체 및 항원의 하나의 예로 현재 임상에서 사용되고 있는 치료용 항체인 허셉틴(Herceptin, Trastuzumab)은 침윤성 유방암에서 발현되는 HER2/neu receptor를 특이적으로 표적할 수 있는 단일클론항체이다. 지난 연구결과에서 초상자성 산화철 나노입자를 합성하고 생분해성고분자로 나노 캡술화한 후, 치료용 항체인 허셉틴을 나노 캡슐 표면에 결합(conjugation)하여 혈관에 직접 주입하는 주사제형으로 제조한 후, 분자조영제로의 가능성을 확인하였다.13 이전의 연구 결과들을 기반으로 본 연구에서는 유방암에서 발현되는 HER2/neu 수용체(receptor)를 특이적으로 표적화하는 단일클론항체인 허셉틴(mAb, Herceptin)을 탐침인자로 결합한 초상자성의 산화철 나노입자(mAb-SIONs)를 함유하는 마이크로 니들(microneedles, MNs) 패치 제형을 제조하였고, 경피흡수시스템을 통해 종양세포 부위로 전달하여 영상신호의 변화를 확인하였다.
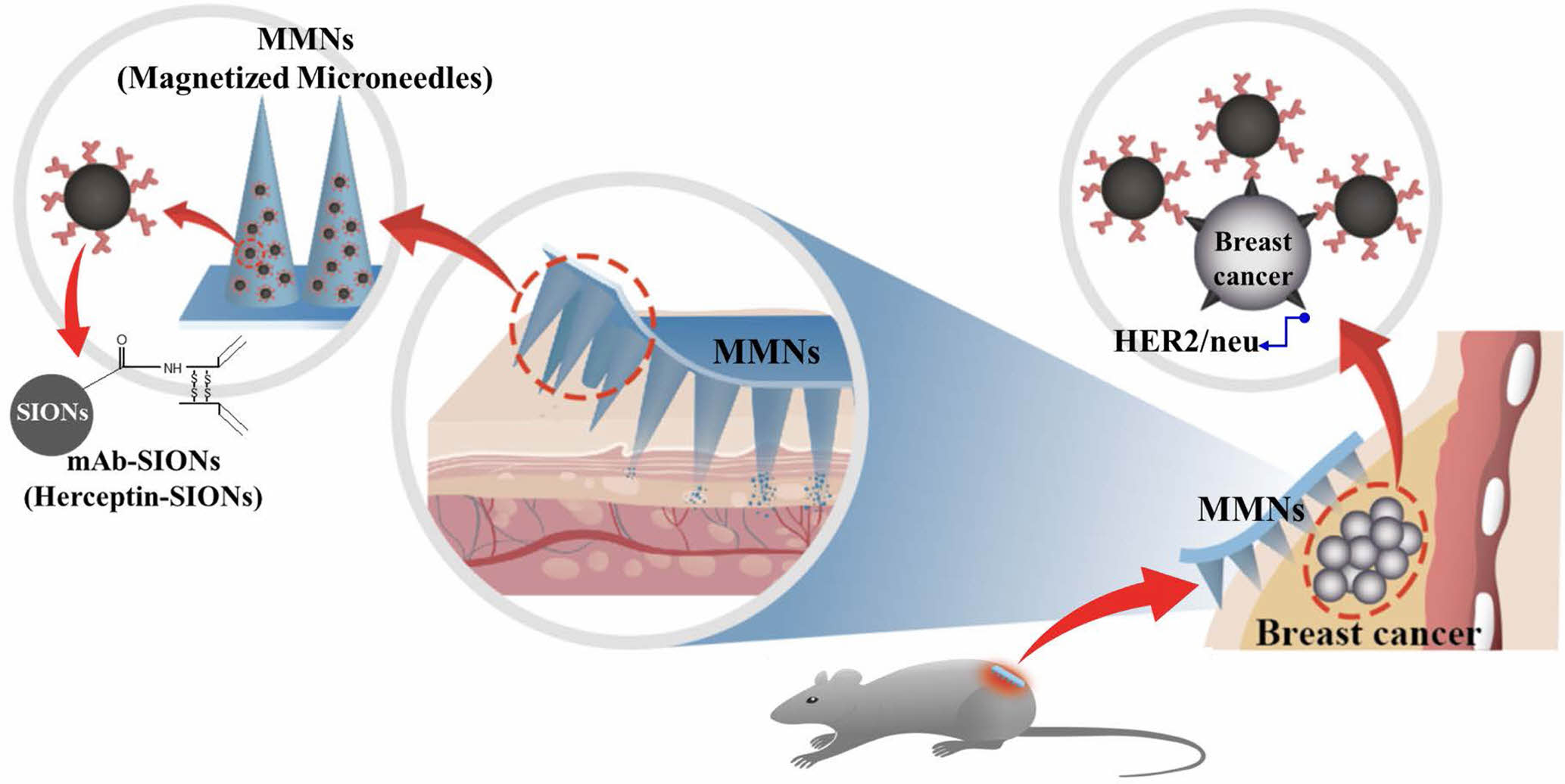
MNs는 피부 각질층의 부위에 마이크로 크기의 미세 바늘로 물리적인 미세한 구멍들을 뚫어 그 미세한 통로를 이용하여 활성약물을 효과적으로 전달하는 방식으로 기존의 경피약물전달시스템(transdermal drug delivery system, TDDS)의 문제점인 각질층에 의한 활성물질전달 한계를 보완하여 극복할 수 있는 방식으로 최근 MNs 기술을 활용한 활성성분 전달에 관한 다양한 연구들이 수행되어 지고 있다.19-24 주사 전달 방식의 경우에는 활성약물의 전달효율은 우수하지만 전문적인 의료기술이 필요하여 자가투여가 힘들고 활성약물 투여 시 바늘의 통증과 감염의 위험성이 존재한다는 문제점을 가지고 있다.25-28 이러한 방법과 비교할 때 MNs 제형기술을 이용한 전달 방식은 활성약물이 피부를 통해 전달되어 상대적으로 바늘에 대한 고통없이 최소한의 침습적 방법으로 전달할 수 있는 기술이다. 지난 연구결과논문에서 생분해성 고분자 히알루론산(hyaluronic acid, HA)과 카르복시메틸셀룰로우즈(carboxy methyl cellulose, CMC)를 부형제로 사용하여 초상자성의 산화철 나노입자(SIONs, Superparamagnetic Iron Oxide Nanoparticles)를 함량비에 따라 함유한 초상자성 마이크로 니들 hyaluronic-acid superparamagnetic microneedles (HA-SMNs)와 carboxy methyl cellulose-superparamagnetic microneedles(CMC-SMNs)를 각각 제조하고 SIONs가 MNs 제형 안에 안정하게 분산되어 SMNs의 특성이 유지되는 것을 확인하였다. 이러한 제형화 기술을 기반으로 본 연구에서는 N-succinimidyl ester functionalized 초상자성의 산화철 나노입자(SIONs)에 허셉틴을 결합하여 mAb-SIONs를 제조하고, HA를 부형제로 사용하여 mAb-SIONs를 함유하는 자성 마이크로 니들 (magnetized microneedles, MMNs)를 제조하여 MMNs의 표면 모폴로지와 자성의 특성을 분석하였고, 기계적 특성을 확인하기 위해 고분자인조막과 돼지등피부(porcine back skin)을 통해 MMNs의 피부 투과도(permeability intensity)를 측정하여 분석하였다. 또한, 자기공명분자영상(magnetic resonane(MR) molecular imaging)으로의 접근을 위해 MRI를 통한 MMNs 제형의 in vitro 및 in vivo 신호변화 분석평가를 통해 분자조영제로의 적용 가능성에 관한 연구를 수행하였으며, 본 연구를 통해 구현하려는 MMNs 패치에 대한 개념을 Scheme 1에 나타내었다.
Scheme 1. MMNs patch concept containing mAb-SIONs to application as the MR molecular imaging contrast agent.
재료 및 시약. MNs의 polydimethylsiloxane(PDMS) 탄성몰드의 제조를 위해 ELASTOSIL® RT 623 A, ELASTOSIL® RT 623 B 그리고 AK 35(C)는 Wacker Chemicals Inc. (Wacker Chemicals Korea, Korea)에서 구입하여 사용하였고, MRI 조영제 역할을 위한 N-succinimidyl ester functionalized 초상자성 산화철 나노입자 (900041, avg. part. size 15 nm)와 투과도 분석을 위한 trypan blue(0.4% solution)은 Sigma-Aldrich사에서 구입한 그대로 별도의 정제과정 없이 사용하였으며, 생분해성 고분자인 히알루론산(bio sodium hyaluronate, MMW, molecular weight 1.3-1.8 Mda)은 SK 바이오랜드에서 구입하여 별도의 정제과정 없이 그대로 사용하였다.
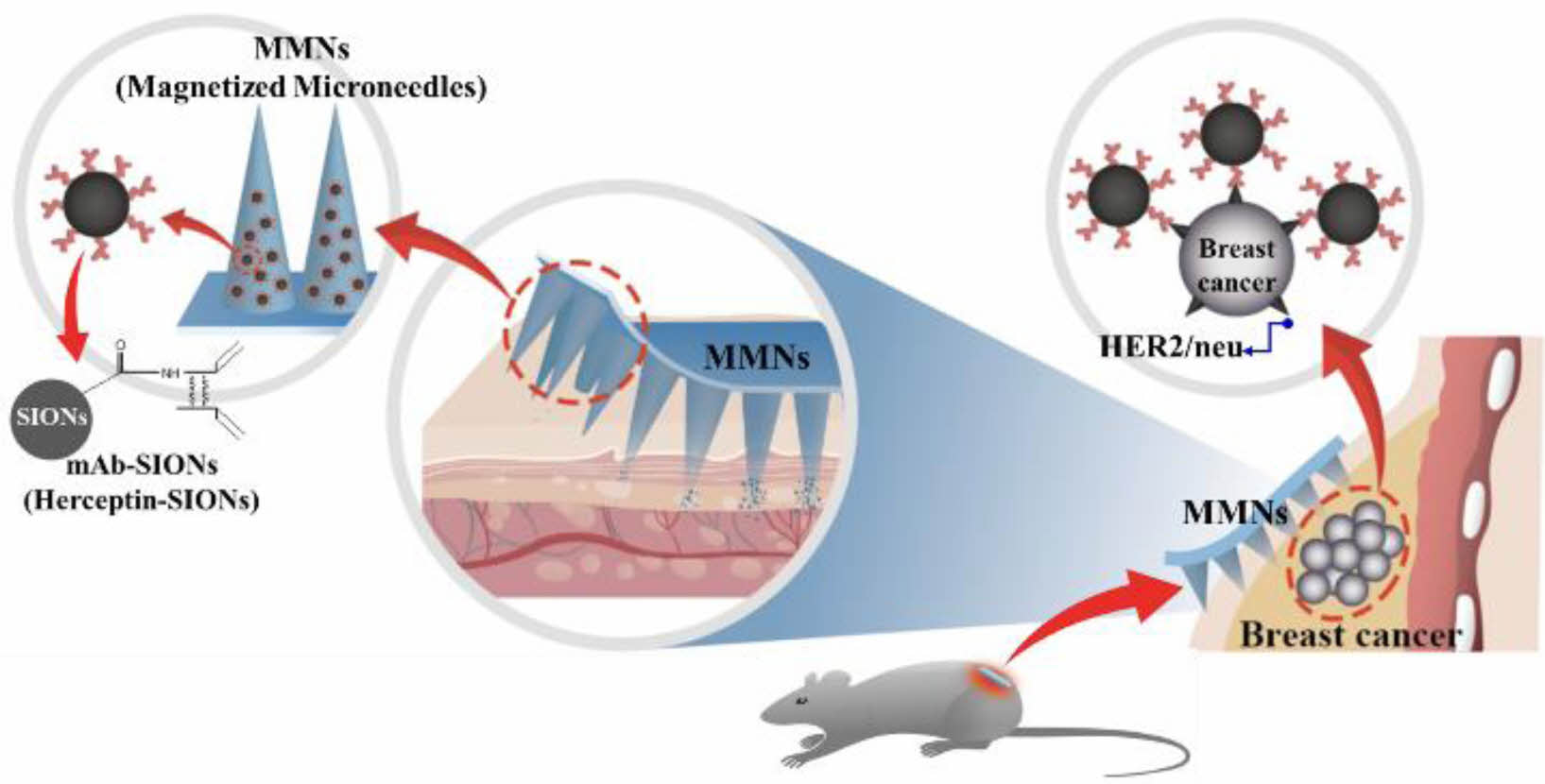
또한, mAb로 사용한 허셉틴(Herceptin)은 연세대학교 의과대학(영상의학과 허용민 교수 연구실)에서 공여받아 사용하였고, 인산염 완충 식염수(Phosphate-buffered saline, PBS: 10 mM, pH 7.4), RPMI-1640 medium, 소 태아 혈청(fetal bovine serum) 및 항생제-항균(antibiotic-antimycotic) 용액을 Gibco로부터 구입하여 사용하였으며, HCC1954 세포는 ATCC (American Type Culture Collection)에서 구입하였다. 다른 모든 화학 물질과 시약은 분석등급(analytical grade)을 사용하였다. 원판(master) MNs 모폴로지는 높이(height) 750 mm: 폭(width) 250 mm의 Aspect Ratio 3(3:1) 비율로 설계하였고, 원판 원형 외경은 f15로, 니들 영역 외경은 f12로, MNs pitch 750 mm로 하여 EHWA Diamond Ltd.(Korea)에서 제작하여 사용하였으며 MNs 원판의 3D 모폴로지와 이미지는 Figure 1에 나타내었다.
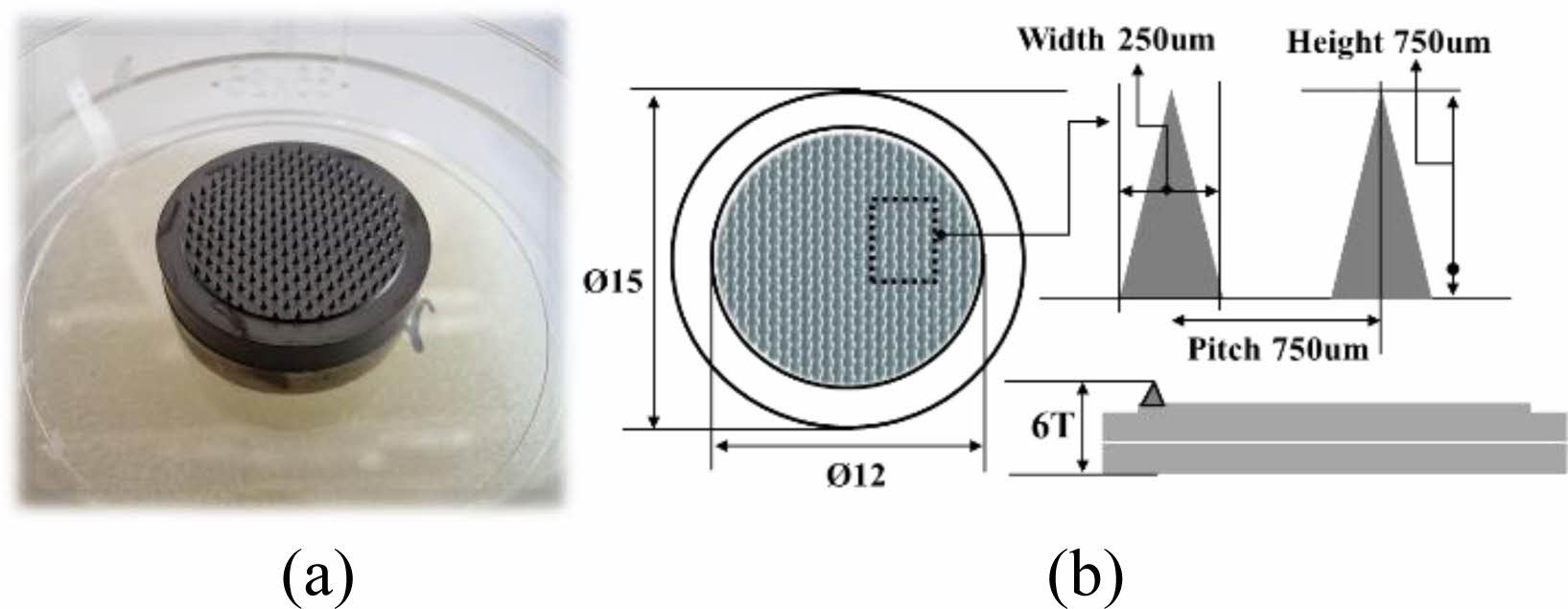
마스터 및 몰드의 제작. MNs 탄성 몰드의 제작을 위해 MNs 원판(master)을 원형의 페트리디쉬(f35, petri dish)에 넣어 고정시킨 후, ELASTOSIL® RT 623 A, ELASTOSIL® RT 623 B 그리고 AK 35(C)의 시약을 함량비에 따라 RT 623 A와 B의 성분 비율을 A:B=90:10으로 배합하고, AK 35 C 함량비를 A와 B의 전체 % 함량에 대하여 30%로 첨가하여 탄성몰드 용액을 제조하였다.
MNs 원판(master)이 잠길 때까지 제조된 탄성몰드 용액을 넣어 채운 후, 진공챔버(550 mmHg/30분)에서 기포제거(degassing) 공정을 진행한 후, 60 oC의 오븐하에서 6시간 이상 고형화 공정을 진행한다. 탄성몰드 고형화 이후 MNs 원판(master)에서 몰드를 최종적으로 이형하여 유연한 탄성몰드를 제작한다. MNs 탄성몰드가 너무 hard하게 된다면 이형시에 구부러짐 피로도(bending fatigue)의 영향으로 탄성몰드가 손상될 수도 있어 제조시 주의가 필요하다. 탄성몰드 제작은 발표된 이전의 논문을 참조하여 제작하였다.24 제조된 탄성 몰드의 모폴로지와 단면은 Figure 2에 나타내었다.
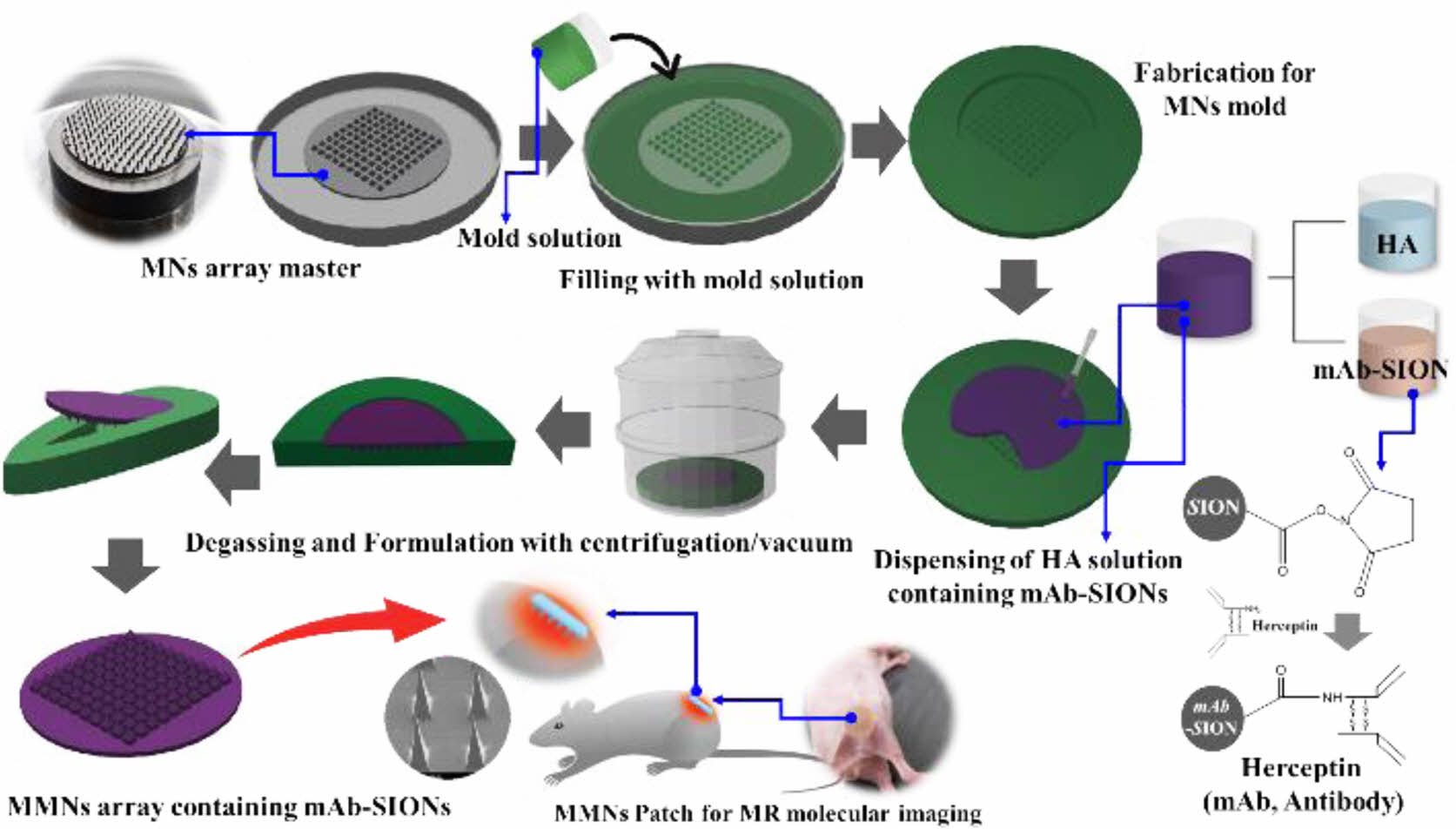
mAb-SIONs를 함유하는 MMNs 제조. mAb-SIONs를 함유하는 MMNs를 제조하기 위하여 3차 증류수에 SIONs 1%를 첨가 초음파 분산기기(sonicator, 360 W/60 Hz/5 min, POWERSONIC405, HWASHIN, Korea)로 분산시킨 후, mAb 허셉틴 0.2%을 첨가하여 4±2 oC 저온공정 하에서 교반(200 rpm, Digital Electronic Overhead Stirrer, ALo728, Korea)하고, 그 용액에 HA를 5% 농도로 첨가하여 mAb-SIONs를 함유한 용액을 제조한다. 제조된 용액은 MNs 탄성몰드 안으로 0.7 g를 도포하고, 도포된 용액을 넓게 편 후, 도포된 용액의 기포제거와 용액을 완전히 MNs 패턴에 채우기 위해 진공챔버(550 mmHg/20 min)와 원심분리기(1000 rpm/1 min under 4-8 oC, Labogene 1248R, Korea)을 이용하여 저온도포공정을 진행한다. 용액이 도포된 탄성몰드를 desiccator (RH20% 이하) 챔버에 넣어 overnight 건조공정을 진행하여 성형하고, 성형된 mAb-MMNs를 탄성몰드로부터 분리하여 mAb-SIONs 1%를 함유한 MMNs를 제조한다. 또한, in-vitro를 통한 MRI에 대한 자성의 특성과 자성 MNs의 세포독성을 분석하기 위해 상기의 공정방법과 동일한 공정으로 mAb가 결합되지 않은 SIONs 0, 0.25, 0.5, 1% 만을 포함한 HA-SMNs를 제조하여 비교 분석하였고, MMNs의 제작 공정도와 MMNs의 이미지를 Figure 3에 나타내었다. 모든 MNs의 제작은 이전에 발표된 논문을 참조하여 제작하였다.13-15,20,24
모폴로지 및 기계적 특성 분석. 제조한 MMNs의 모폴로지와 표면상태를 분석하기위해 MMNs array를 5 mm × 5 mm 시편으로 제작하여 45° tilt된 Jig에 부착한 후, 전자주사현미경(scanning electron microscopic, SEM, S-4800, Hitachi, Japan)를 이용하여 측정 확인하였다. 또한, 피부투과성 확인을 위한 MMNs의 기계적물성을 분석하기 위해 고분자인조막(Strat-MTM Membrane, Millipore)과 돼지 등 피부(porcine back skin, Micropig® FCM, APURES Co., LTD)에 MMNs array를 접촉 가압하여 제거하고, 고분자인조막과 porcine back skin에 대한 투과도를 측정하여 기계적특성을 확인하였다. 분석을 위한 시편제조 및 측정방법은 이전 발표된 논문을 참조하여 진행하였다.15,20
세포독성 및 자성 특성 분석. MMNs는 피부에 접촉 투과되어 피부층을 통해 구성성분이 전달되므로 세포독성 평가분석을 통해 생체적합성을 확인하였다. 본 연구의 세포독성 평가는 MTT-assay법과 WST-1 assay법을 통해 확인하였으며, 허셉틴의 경우, 세포독성 및 생체적합성의 안전성이 알려져 있어 허셉틴이 결합되지 않은 SIONs 0%, 0.25%, 1%만을 포함한 HA-SMNs를 제조하여 세포독성 평가를 수행하였다. MTT-assay법을 통한 세포독성 평가의 경우, 실험에 사용된 세포는 RAW264.7(한국 세포주은행) 세포를 사용하였으며 RAW264.7 세포는 마우스의 대식세포이다. 세포는 5% CO2, 37 oC 배양기(nb-203XL, N-BIOTEK, Korea)에서 배양하고, 배지로는 10% fetal bovine serum(FBS), 1% penicillin-streptomycin을 함유한 DMEM 배지를 사용하였다. 배지는 3일에 한 번씩 갈아주었으며, 페트리디쉬에 세포가 80% 이상 자라면 phosphate buffered saline(PBS)로 세척하여 계대 배양을 세포를 배양하였다. 세포독성 측정은 200 μL(1×104 cells/well)의 세포 배양액을 96 well plate의 각 well에 분주 후, CO2 배양기에서 24시간 동안 세포를 부착시켰다. 이후, 0, 25, 50, 75, 100, 200 μg/mL 농도의 SMNs 용액 20 μL와 FBS가 함유되지 않은 DMEM 배지 180 μL를 함께 24시간 배양하였다. 배양 후 각 well에 20 μL의 MTT용액(5 mg/mL)을 첨가했다. 알루미늄 호일로 96 well plate를 감싸고 4시간 동안 CO2 배양 기 안에서 반응시켰다. 반응 후, DMSO 200 μL를 첨가하여 10분간 충분히 MTT formazan을 녹여내어 microplate reader(N10588, Thermo Fisher Scientific, USA)의 파장 570 nm에서 흡광도를 측정하여 분석하였다. 또한, WST-1 assay법을 통한 세포독성 평가의 경우, 세포는 NIH/3T3(mouse fibroblast cell line)를 사용하였고, SIONs 1%를 함유한 HA-SMNs를 실험군으로 하여 용매대조군 DMEM +10% FBS+1% A.A(Cell culture medium(배지)), 양성대조군 Polyurethane film containing 0.25% zinc dibuthyldithio- carbamate, 음성대조군 High density polyethylene film를 직접접촉법을 통해 비교 분석하였다. NIH/3T3 cell을 2×105 cells density에 맞춰 Seeding하여, 24시간 후에 배양 배지를 교체하고 Well 중앙의 세포층에 양성대조군, 음성대조군, 실험군(SMNs) 시편을 배치하여, 24시간 배양 후에 Paraform- aldehyde로 고정한 후, crystal violet 용액으로 염색하여 Dry 후 현미경(BX53MRF, OLYMPUS)을 통해 관찰하였다. 시편 처리 전과 배양 24시간 후 현미경으로 세포 형태를 확인하였으며, crystal violet staining 후에 SDS elution 진행 Multi-reader(VARIOSKAN LUX, Thermo Scientific)기기를 통해 흡광도 590 nm에서 측정하였다. WST-1 assay법은 ISO10993-5 시험기준을 기반으로 시험분석을 수행하기 위해 건양대학교병원 의료기기융합센터(대전)에 SMNs 시편을 의뢰하여 진행하였다.
MMNs 제조후에도 초기 SIONs의 초상자성 거동특성이 유지되는지를 확인하기 위해 SIONs, HA-SMNs, MMNs에 대하여 각각의 자화율(magnetic susceptibility)을 superconducting quantum interference device-vibrating sample magnetometer (SQUID-VSM, 300 K, MPMS3 in KBSI)를 가지고 측정하여 자성의 특성을 비교 분석하였다.
MRI를 통한 In-vitro 특성 분석. MMNs의 자기공명분자영상 분석을 위해 mAb가 결합되는 않은 SIONs 0, 0.25, 0.5, 1%만을 포함한 HA-SMNs를 각각 제조하여 Figure 4에 나타낸 것처럼 agarose gel 기반의 in vitro 평가를 통해 MRI 신호반응에 대한 feasibility 평가를 수행하였다. 우선, 0.6% agarose gel를 4 cell culture slide에서 굳히고 그 위에 SIONs 농도(0, 0.25, 0.5, 1%)에 따라 제조한 HA-SMNs array를 올려 놓은 후, 0분에서 120분까지 15분 간격으로 시간에 따른 1 mm depth와 2 mm depth에서의 MRI 신호반응을 측정하여 SIONs가 시간에 따라 release되는 현상을 평가 분석하였고, MRI측정시 Coronal은 RARE, TR: 2000 ms, TE: 22.0 ms, FA: 180 deg, SI: 1.00 mm, FOV: 5.00 cm 조건으로, Sagittal은 RARE, TR: 2600.4 ms, TE: 22.0 ms, FA: 180.0 deg, SI: 1.00 mm, FOV: 7.00/2.00 cm 조건으로 진행되었으며, MRI는 9.4 T Bruker 20 cm 보어(Biospec 94/20 USR; Bruker Medical Systems, Germany) 동물 MRI 시스템으로 40 mm 내경 사각형 RF 코일(RF SUC 400 1H M-BR-LIN ROAD, Bruker Medical Systems, Germany)이 장착된 것으로 조사 진행하여 측정하였다.
MMNs의 자기공명분자영상 특성 분석. MMNs의 tumor bearing mice modeling을 통한 in vivo 실험분석을 위해 5주 된 수컷 누드마우스(male athymic Balb/c nude mice, Orient Bio, Korea)를 종양 이종이식(tumor xenograft) 실험에 사용되었다. 마우스는 멸균된 상태에서 micro-isolator cages에 보관되었으며 적절한 건강을 보장하기 위해 연구를 시작하기 전에 최소 1주일 동안 관찰되었다. 온도, 조명, 습도는 중앙에서 관리되었고, 마우스를 2% isoflurane으로 마취한 후, 29-gauge needle을 사용하여 6×106 HCC1954 세포를 오른쪽 허벅지에 이식했다. 모든 실험절차는 연세대학교 의과대학 동물보호 및 사용위원회(Institutional Animal Care and Use Committee, IACUC 승인번호: 2019-0072)의 승인을 받은 가이드라인에 따라 진행되었다. 마우스 피부에 mAb-MMNs 패치를 부착한 후, 0분에서 120분까지 15분 간격으로 MRI를 측정하여 종양 부분의 신호의 변화를 확인하였다. 세부적으로, T2-weighted MRI 실험은 9.4 T Bruker 20 cm 보어(Biospec 94/20 USR; Bruker Medical Systems, Germany) 동물 MRI 시스템으로 40 mm 내경 사각형 RF 코일(RF SUC 400 1H M-BR-LIN ROAD, Bruker Medical Systems, Germany)이 장착된 것으로 조사되었으며, 동물 MRI의 경우 마취가 3%로 유도되었고 70% N2O와 30% O2 혼합물에서 2% 이소플루란으로 유지되었다. 호흡수는 소형 동물 호흡기(모델 1025 소형 동물 모니터링 및 게이팅 시스템; SA Instruments, Inc., Stony Brook, NY, USA)로 모니터링하였으며, 체온은 동물침대에 통합된 온수관으로 지원되어 진행되었다. (MR images: Coronal T2-weighted Rapid Acquisition with Relaxation Enhancement(RARE, repetition time[TR]= 1800.0 ms, echo time[TE]=22.2 ms, slice thickness=0.30 mm, acquisition matrix=274×200, FOV=2.50×1.80 cm, FA=180.0 deg.), T2 relaxation time: Coronal T2-weighted Rapid Acquisition with Relaxation Enhancement(RARE, repetition time[TR]=1800.0 ms, echo time[TE]=22.2 ms, slice thickness =0.30 mm, acquisition matrix=274×200, FOV=2.50×1.80 cm, FA=180.0 deg.)). MRI를 통한 모든 동물 실험절차는 연세대학교 의과대학 동물보호 및 사용위원회(IACUC 승인번호: 2019-0072)가 승인한 지침인 동물보호 및 사용위원회(IACUC)의 가이드라인에 따라 진행되었다.
|
Figure 1 (a) Photomicrograph; (b) dimension of microneedles (MNs) master. |

|
Figure 2 Photograph of (a) regular shape; (b) top view; (c) crosssectional view (750 ㎛ height) of microneedles (MNs) mold. |
|
Figure 3 Process flow for the fabrication of MMNs containing mAb-SIONs |

|
Figure 4 SEM images of MMNs |
MMNs의 모폴로지 및 기계적 특성 평가. 제형제조공정중 SIONs의 뭉침현상과 탈리현상으로 인한 MMNs 표면과 Top sharpness의 손상이 발생할 수도 있어, mAb-SIONs를 함유하는 MMNs의 표면과 모폴로지를 SEM으로 확인한 결과 제조공정 중 활성성분으로 인한 제형의 모폴로지 변화나 표면상태의 변화없이 제조되었음을 확인할 수 있었다. mAb-SIONs의 함유가 형상의 변화에 영향을 주지 않는 것으로 판단된다. 제조된 MMNs의 배율에 따른 SEM image를 Figure 4에 나타내었다.
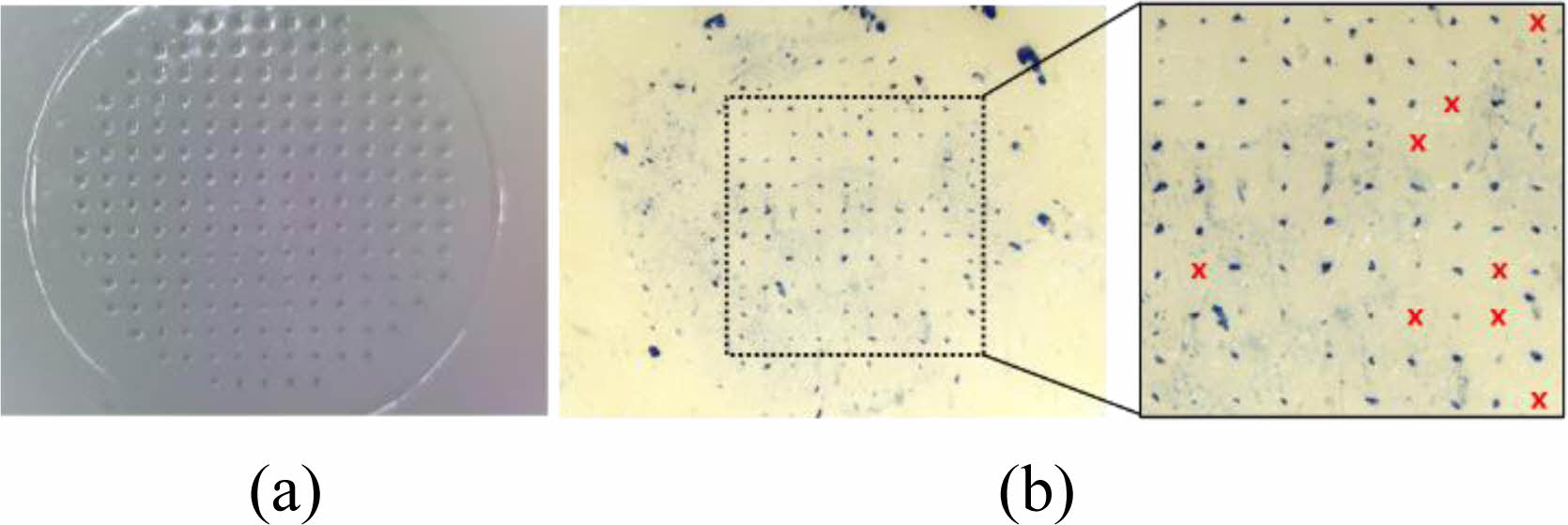
또한, 고분자인조막과 Porcine back skin에 대한 피부 투과도를 측정하여 MMNs의 피부 침투 강성을 평가하여 기계적 강도를 확인하였다. 고분자인조막에 대한 투과성을 먼저 확인한 후, 냉동고(-25 oC)에서 보관된 porcine back skin(1.2T/20 mm×20 mm)를 상온하에서 녹인 후, 건조하여 표면 수분함량을 최소화하고, 각 모서리를 잡아당겨 피부의 팽팽한 정도를 최대한 유지하여 실제 피부 모델과 유사한 형태로 준비하였다. MMNs array를 각각의 막과 피부위에 접촉하여 5 kgf의 힘으로 10초 동안 가압하고 MMNs를 제거한 후, 전체 니들 수 대비하여 투과된 수를 확인하여 분석하였다. 고분자인조막에 대한 투과성은 Figure 5(a)에서처럼 100%의 투과성을 보인다. 이는 고분자 막의 표면과 다공성의 내부 구조에 대한 MMNs이 막투과를 위한 충분한 기계적 강도를 가지고 있다고 할 수 있다. 피부의 표면과 내부구조가 유사한 생체막에 대한 투과성을 확인하기 위해 porcine back skin에도 동일한 방법으로 MMNs를 가압하여 제거한 후, 염색시약 trypan blue 0.4%(w/w)를 통해 투과된 hole부를 염색하고 투과된 수를 확인하여 분석하였다. Figure 5(b)에서처럼 90% 이상의 투과율을 보여 in vivo 평가를 위한 MMNs의 기계적강성은 충분 할 것으로 판단된다. 고분자인조막과 porcine back skin에서의 투과성에 대한 차이는 각각의 막 소재 특성으로 인한 막 표면의 수분 상태와 막 내부 구조층에 대한 미세한 유의차로 MMNs가 단위 표면당 가해지는 초기 가압력 차이로 나타난 현상으로 판단된다. 이러한 표면수분상태 및 내부 구조층의 영향에 대한 물성 연구는 더 많은 연구가 진행되어 해석 보완될 필요가 있어 이 부분에 대한 상관성 연구를 계속 수행할 것이다.
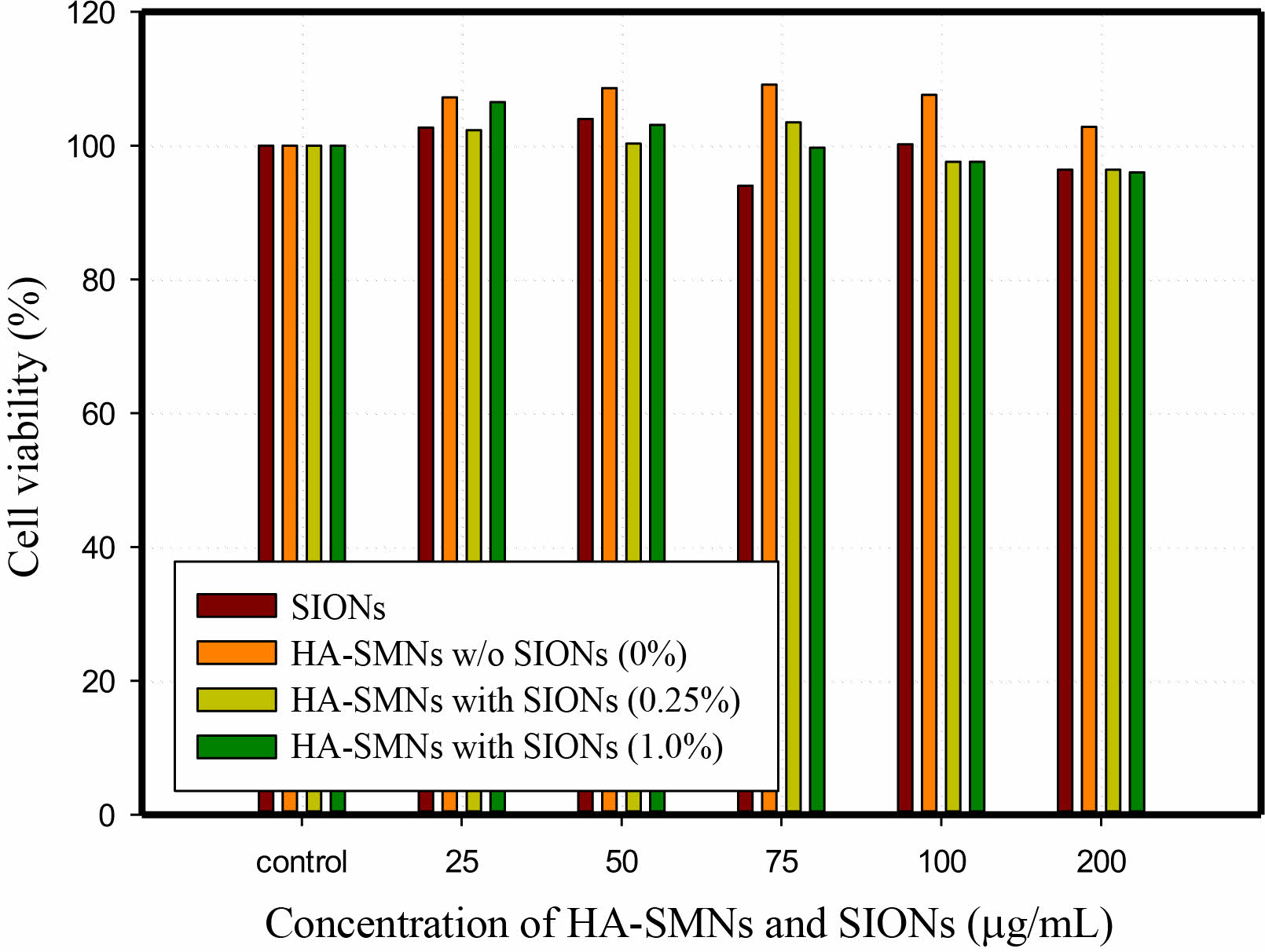
세포독성 및 자성 특성 분석. SIONs와 HA-SMNs에 대한 MTT-assay법을 통한 세포독성에 대한 평가에서 25 mg/mL에서 200 mg/mL 농도까지 대조군(control) 대비 결과 cell viability 가 90% 이상인 것이 확인되었으며, Figure 6에서 확인 할 수 있듯이, SIONs를 포함하지 않은 경우, 25 mg/mL에서 107.2%, 50 mg/mL에서 108.6%, 75 mg/mL에서 109.1%, 100 mg/mL에서 107.6%, 200 mg/mL에서 102.8%의 생존율이 확인되었으며, SIONs 0.25%를 함유한 경우, 25 mg/mL에서 102.3%, 50 mg/mL에서 100.3%, 75 mg/mL에서 103.5%, 100 mg/mL에서 97.6%, 200 mg/mL에서 96.4%의 생존율이 확인 되었으며, SIONs 1.0%를 함유한 경우, 25 mg/mL에서 106.5%, 50 mg/mL에서 103.1%, 75 mg/mL에서 99.7%, 100 mg/mL에서 97.6%, 200 mg/mL에서 96.0%의 생존율이 확인되어, SIONs의 함량비의 증가로 인하여 세포 생존율의 미세한 변화는 관찰되나 명확한 세포독성을 나타내지는 않는 것으로 판단된다.
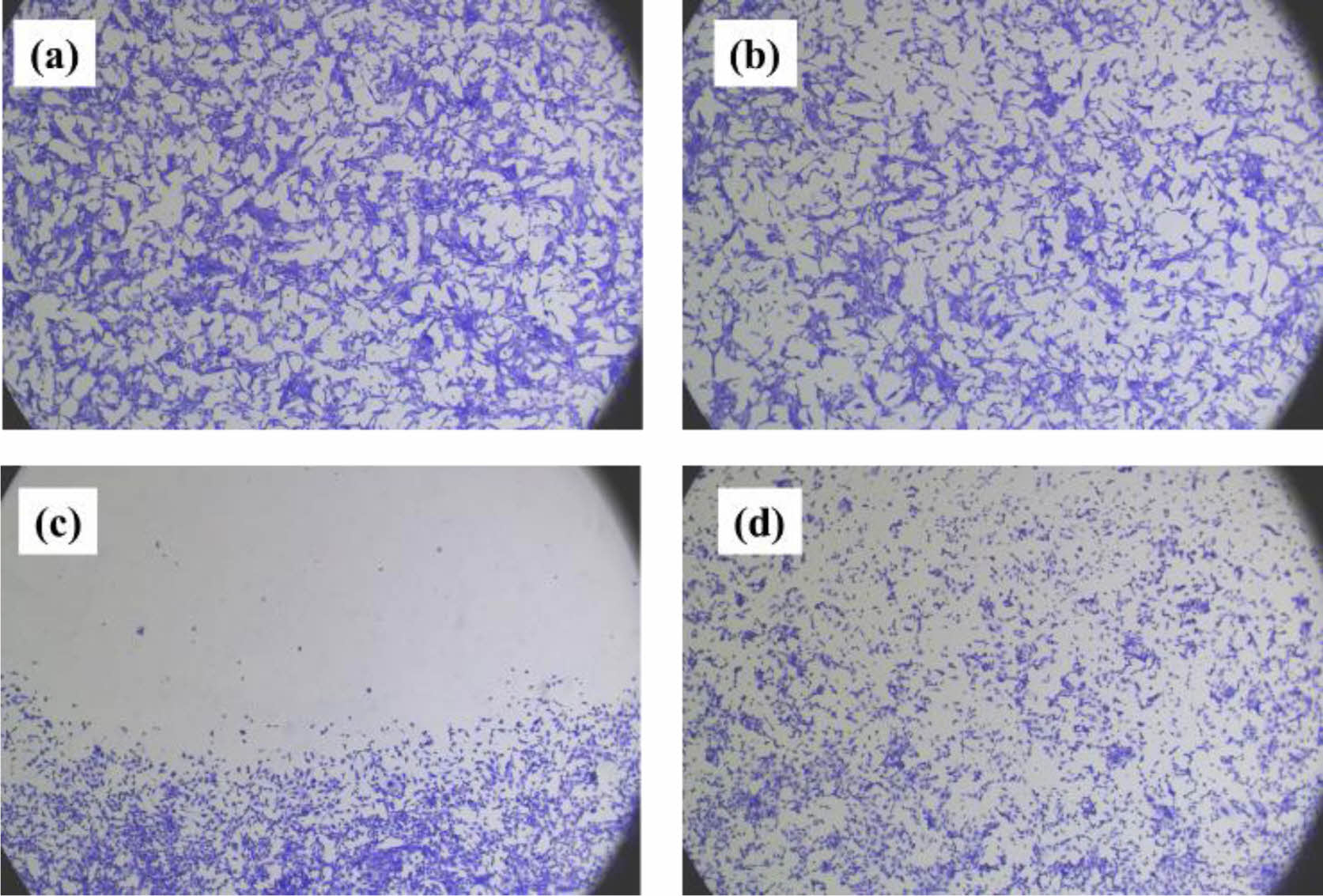
또한, WST-1 assay법을 통한 결과에서는 용매(배지)대조군, 양성대조군, 음성대조군, 실험군(HA-SMNs 1%)으로 시험을 진행하였으며, 시료 도포 24시간 배양 후 관찰 시, 실험군의 시료가 녹아서 없어진 것을 육안으로 관찰하였고, 현미경으로 관찰 시, 실험군의 시료가 녹으면서 방출된 SIONs의 입자들이 관찰되어 실험군 내 세포에서 약간의 성장 저해 양상을 보이나, 용매대조군과 음성대조군에서의 세포 모양과 큰 차이가 없고, 세포 용해가 일어나지 않음을 확인하였다. Crystal violet 염색법을 이용하여 각 배양 플레이트를 염색한 후 용매(배지)대조군, 양성대조군, 음성대조군, 실험군의 세포 형태를 현미경으로 관찰하고 이를 ISO 10993-5 국제규격에서 제시한 직접 접촉시험에 대한 반응 등급을 기준으로 반응도 등급을 확인하였다. 반응 등급표는 Table 1에 나태내었고, 결과는 Figure 7에 나타내었다.
음성대조군의 경우 세포 이상 및 탈색이나 성장 저해 양상이 보이지 않았으며, 양성대조군의 경우 재료가 도포되어 있던 바로 밑 부분에서 주변까지 확장되어 세포가 사멸되었고, 실험군의 경우 재료 도포 바로 밑 부분과 주변 일부의 세포 성장이 약간 저하되었고, 약한 탈색이 일어난 것으로 보아 반응도는 아주미약(slight)에서 미약(mild)에 해당되는 것을 관찰할 수 있었다. 이는 시료가 분해되면서 나온 성분인 SIONs의 영향일 것으로 예측된다. Table 1에 나타낸 국제규격 기준에29 따라 반응도가 2등급보다 큰 경우(>2) 세포독성이 있는 것으로 간주하므로 실험군은 세포독성이 없을 것으로 판단할 수 있다.
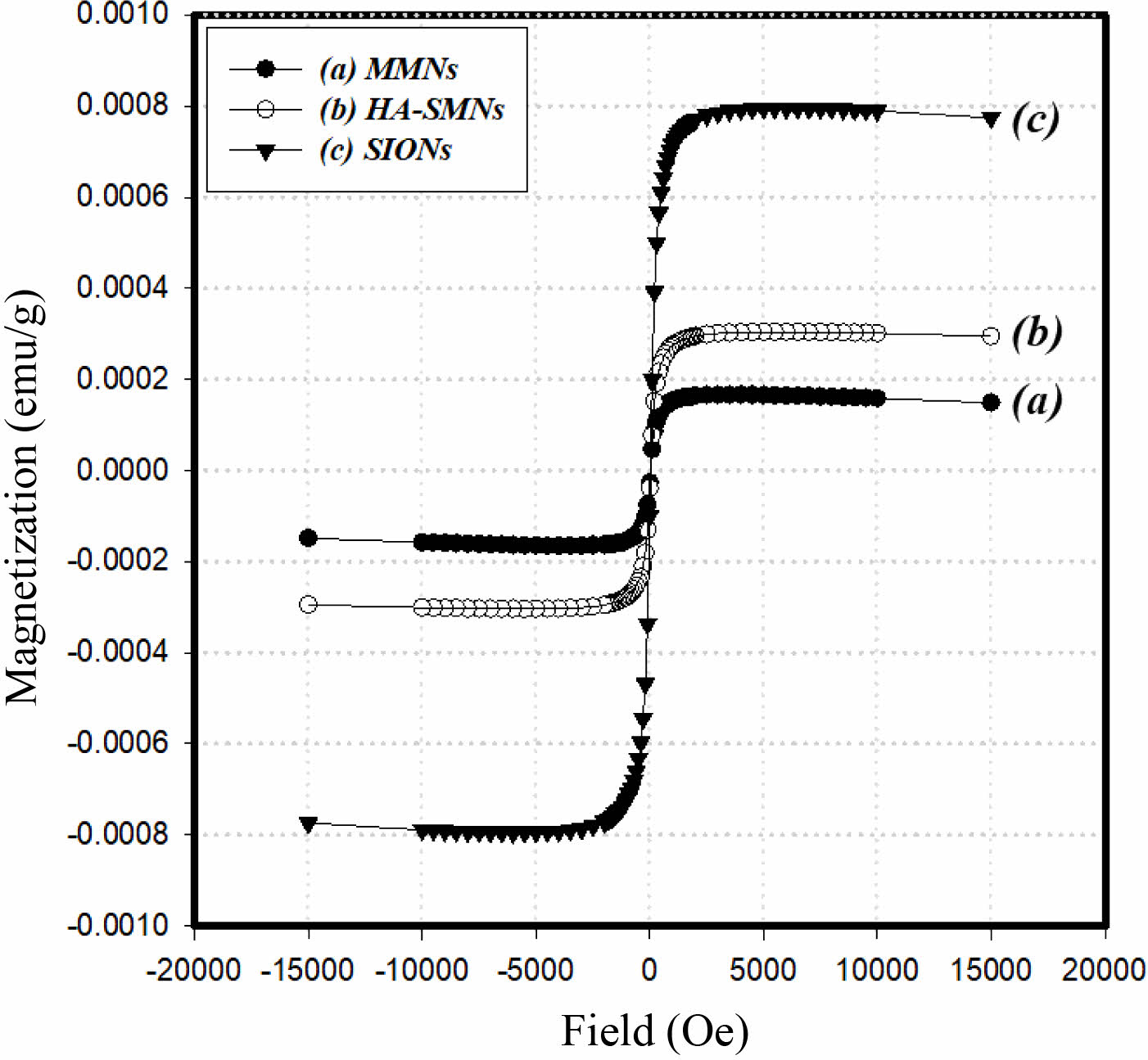
MMNs 제조후에도 초기 SIONs의 초상자성 거동특성이 유지되는지를 확인하기 위해 SIONs, HA-SMNs, MMNs에 대하여 각각의 자화율(magnetic susceptibility)을 측정하여 비교하였다.
Figure 8에서 볼 수 있듯이 SIONs, HA-SMNs, MMNs의 자화율의 변화가 관찰되었으며, 이는 동일한 측정 샘플에 대하여 SIONs를 함유하는 비율의 차이로 나타난 현상으로 판단된다. 또한, SIONs의 초상자성의 hysteresis 특성이 MMNs 제조 후에도 초상자성의 hysteresis 특성이 유지됨을 알 수 있다. 결론적으로, SIONs를 포함한 HA-SMNs이 일정한 농도에서 세포에 대한 독성 작용을 나타내지 않아 세포독성에 대하여 비교적 안전한 물질임을 확인하였고, 제조하는 공정 과정에서 자성의 특성이 변형되지 않고 초상자성이 유지됨을 알 수 있어, 효능 평가 및 제품을 위한 제형화 공정개발에 있어서 산화철 및 히알루론산과의 배합 비율을 결정하는데 유용한 자료로 활용될 것이며, 이는 MMNs가 생체 내에서의 안정한 물질임을 알 수 있었으며 생체 내 적용이 가능할 것으로 기대된다.
MRI를 통한 in-vitro 특성 분석. HA-SMNs의 MRI 분자영상 분석을 위해 Figure 9(a)에서와 같이 agarose gel 기반의 4 well cell culture plate Jig를 제작하여 SIONs 함량비 0%, 0.25%, 0.5%, 1.0 %를 함유한 HA-SMNs의 in vitro 평가를 수행하였다. Figure 9(b)와 (c)에서 확인할 수 있듯이, HA-SMNs를 agarose gel에 부착 후, 시간에 따라 1 mm depth와 2 mm depth에서의 MRI를 확인한 결과, HA가 용해 됨에따라 내부의 SIONs가 HA로부터 release 되어 MRI 측정시 신호감도의 변화가 관찰됨으로써 HA-SMNs의 제형을 통한 MMNs의 MRI 측정이 가능할 것으로 판단되었다.
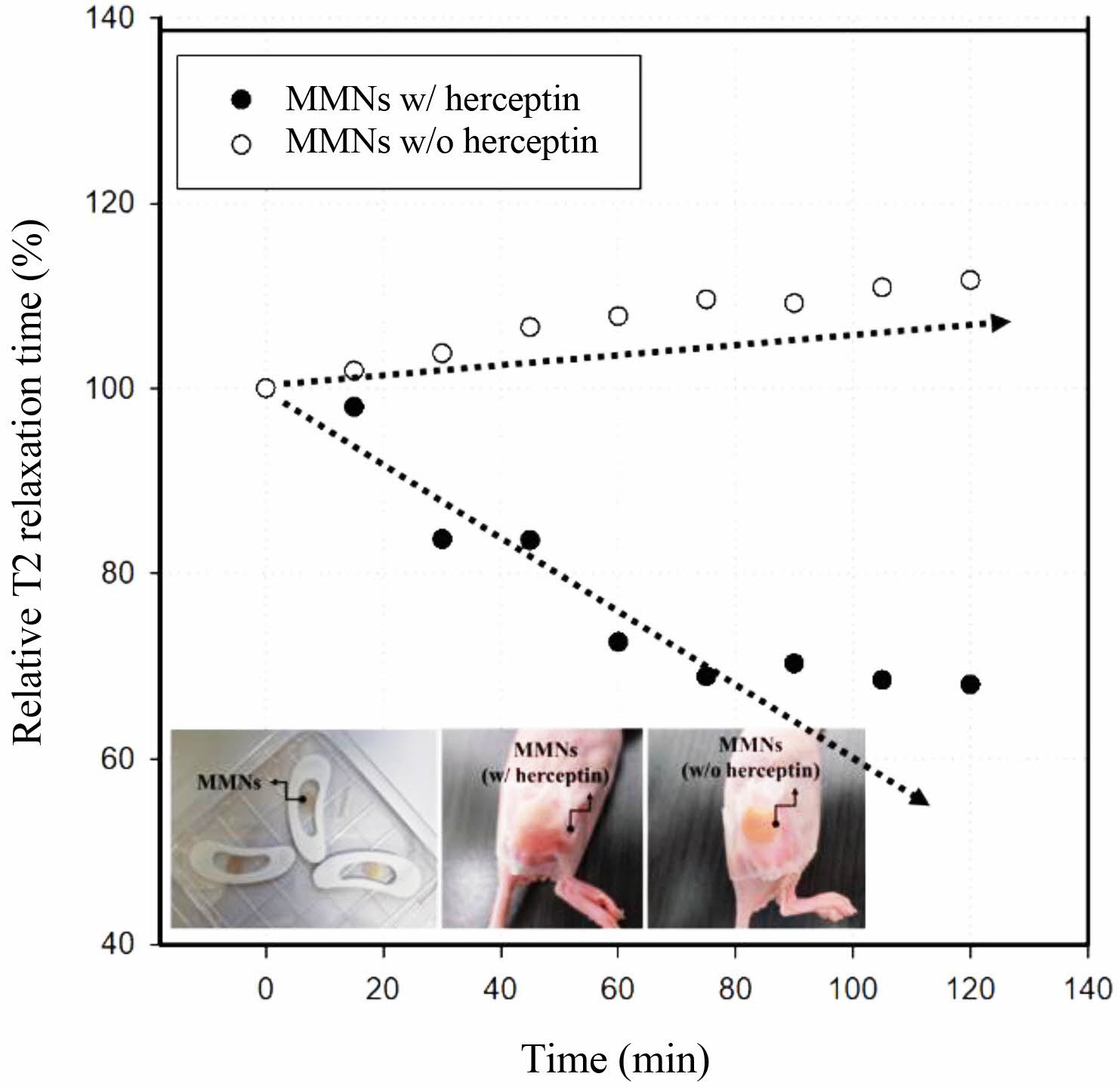
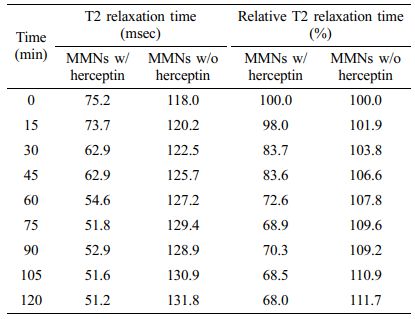
MMNs의 자기공명분자영상 특성 분석. Table 2와 Figure 10에 나타낸 결과와 같이 HCC1954 tumor model에 MMNs을 적용한 패치부착 후 15분 간격으로 120분(2시간) 동안 자기공명분자영상을 측정하여 시간에 따른 변화를 분석하였고, 분석 결과를 기반으로 외샵 추세를 예측하여 시간에 따른 T2 relaxation time의 변화를 확인하였다. 또한, 허셉틴을 결합한 MMNs(w/ herceptin)와 허셉틴을 결합하지 않은 MMNs(w/o herceptin)의 제형에 대한 MRI의 변화를 측정하여 비교 분석하였다. 측정한 결과 허셉틴을 결합한 MMNs에서는 시간에 따라 T2 relaxation time(msec)이 초기(0분) 75.2에서 120분후 51.2로 극격한 감소 변화를 확인할 수 있었으며, 초기 값을 백분율로 환산하여 Relative T2 relaxation time(%)를 비교하면 120분 후 68%로 30% 이상 감소변화의 특성을 의미한다. 반면에 허셉틴을 결합하지 않은 MMNs의 경우, T2 relaxation time(msec)이 초기(0분) 118에서 120분 후 131.8의 낮은 변화량을 확인할 수 있어 허셉틴을 결합한 MMNs의 signal intensity 변화가 큰 것으로 판단된다.
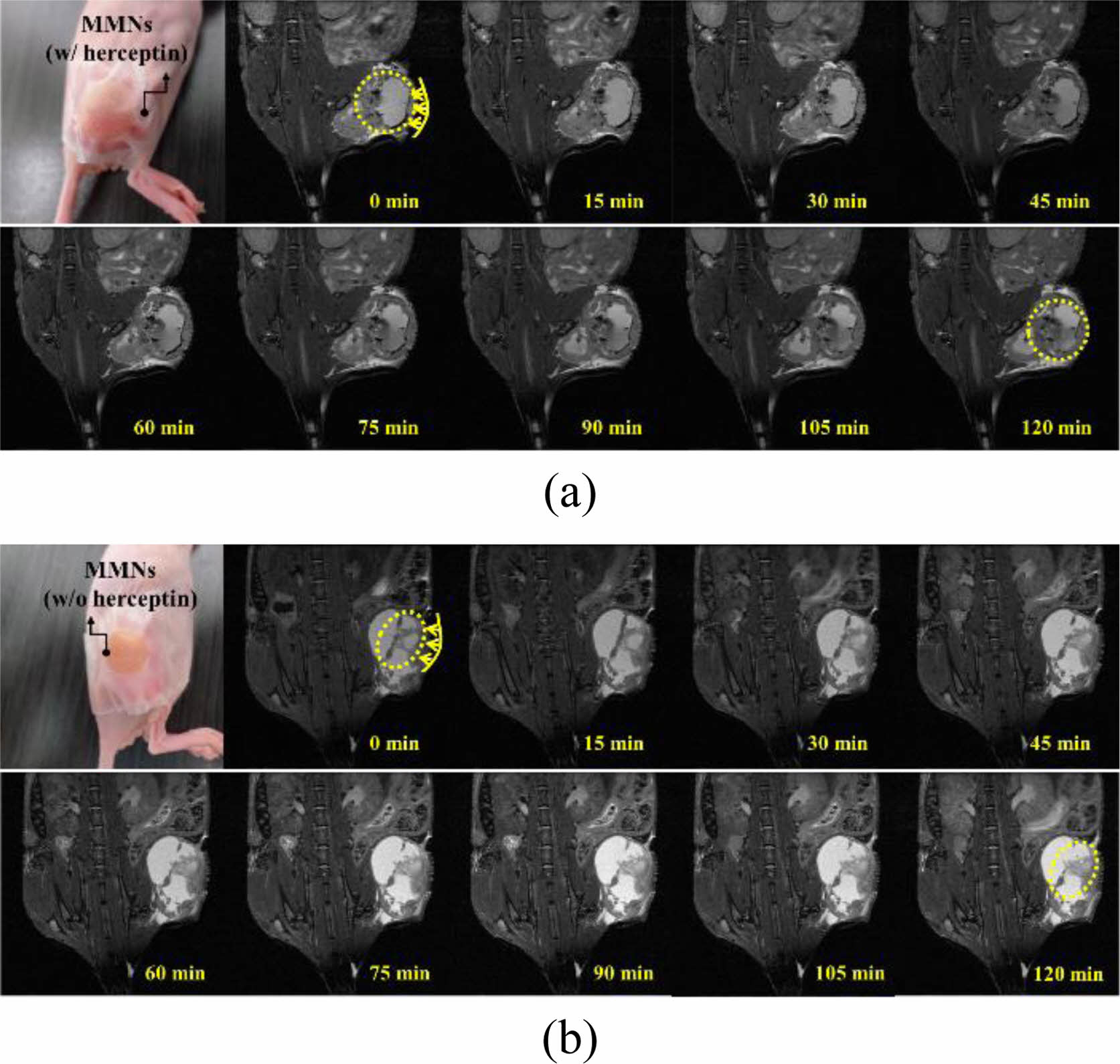
허셉틴의 결합에 따른 자기공명분자영상에 대한 MMNs의 in vivo 평가 결과를 Figure 11(a)와 (b)에 나타내었고, 이러한 결과를 통해 T2 relaxation time의 변화가 상이함을 확인할 수 있었다. 주사제형을 통한 분자조영제로의 가능성을 확인한 지난 연구결과와13 같이, MNs 기술을 적용한 MNs 경피패치제형도 활성약물이 종양세포부위에 전달되어 분자영상의 변화를 확인할 수 있었으며, 이러한 결과는 MNs 제형이 특정 활성물질을 피부로 전달하는 기술로 활용될 수 있을 것으로 기대된다. 특히, 직접 정맥을 통한 주사전달 방식은 약물이 빠르게 전달되어 빠른 효과를 볼 수 있어 전달효율은 우수하지만 투여 시 전문적인 의료기술이 필요하여 자가투여가 힘들고 바늘의 통증과 감염의 위험성이 존재한다. 이러한 방법과 비교할 때 MNs 기술을 이용한 피부 전달 방식은 니들의 길이가 기존 정맥 주사보다 훨씬 작아 상대적으로 바늘에 대한 통증과 고통이 감소한 침습적 방법으로 전달 목적에 따라 전달 방법을 다양하게 선택할 수도 있어 보다 효과적으로 보다 넓은 범위의 진단 및 치료에 적용될 수 있는 기술이라 생각된다. 결론적으로 허셉틴이 결합된 MMNs은 종양세포에 대한 표적지향성이 높을 것으로 기대되며, 이는 진단 동시에 허센틴에 의한 면역치료 효과를 기대 할 수 있어 진단 동시 치료를 위한 마이크로 니들 패치의 역할을 기대할 수 있을 것으로 예측된다.
|
Figure 5 Optical microscope images of (a) permeability on the polymer membrane permeability; (b) porcine back skin with MMNs. |
|
Figure 6 Effect of HA-SMNs and SIONs on cell viability using MTT-assay cytotoxicity test. |
|
Figure 7 Optical microscope photography of (a) medium control; (b) negative control; (c) positive control; (d) experiment sample after staining through WST-1 assay |
|
Figure 8 The magnetic susceptibility of (a) MMNs; (b) HA-SMNs; (c) SIONs. |

|
Figure 9 (a) Photograph of concept and model system by agarose gel and the T2-weighted MR imgages of HA-SMNs under (b) the 1 mm depth; (c) the 2 mm depth on the agarose gel model. |
|
Figure 10 The T2 relaxation time of MMNs (w/ herceptin and w/ o herceptin) by MRI on Tumor-bearing mice modeling (insert photos are MMNs patch model). |
|
Figure 11 The T2-weighted MR imgages of MMNs ((a) w/ herceptin; (b) w/o herceptin) through Tumor-bearing mice modeling. |
|
Table 1 Reactivity Grades for Agar and Filter Diffusion Test and Direct Contact Test |

*ISO 10993-5:2009(E), Part 5: Tests for in vitro cytotoxicity, 8.5 Determination of cytotoxicity, Third edition (2009) |
|
Table 2 The T2 Relaxation Time of MMNs (w/ herceptin and w/o herceptin) by MRI on Tumor-bearing Mice Modeling |
본 연구에서는 유방암에서 발현되는 HER2/neu 수용체를 특이적으로 표적화하는 단일클론항체인 허셉틴을 탐침인자로 결합한 초상자성의 산화철 나노입자(mAb-SIONs)를 함유하는 MMNs, 마이크로니들 패치 제형을 제조하였고, 경피흡수시스템을 통해 종양세포 부위로 전달하여 영상신호의 변화를 확인하였다. MMNs를 제조하여 표면 모폴로지와 자성의 특성을 분석하였고, 고분자인조막과 porcine back skin를 통해 MMNs의 피부 투과도를 측정하여 분석하였다. 또한, 자기공명분자영상으로의 접근을 위해 MMNs 제형의 in vitro 및 in vivo 신호변화 평가를 수행하여 진단동시 치료를 위한 조영제로의 응용 가능성에 관한 연구를 수행하였다. 결론적으로 MMNs은 제조공정후 제형의 모폴로지변화나 표면상태 변화 없이 제조되었으며, 투과도 평가에서 최소 90%이상의 투과도 특성이 확인되어 MMNs이 피부 투과를 위한 충분한 기계적 강도를 가지고 있을 것으로 판단된다. 또한, 세포독성 평가에서도 세포생존율이 90% 이상으로 확인되어 세포독성에 대하여 비교적 안전한 물질임을 확인하였고, 자성특성 분석을 통해 MMNs를 제조하는 공정 과정에서 변형되지 않고 초상자성이 유지됨을 알 수 있다. 마지막으로 in vitro 및 in vivo에서의 자기공명분자영상 측정 분석을 통해 허셉틴을 결합한 MMNs에서 30% 이상의 signal intensity 변화가 확인되어 허셉틴이 결합된 MMNs가 종양세포에 대한 표적지향성이 더 높을 것으로 판단된다. 본 연구수행을 통해 얻은 결과를 기반으로 진단 동시 치료를 위한 자성 마이크로 니들 패치의 효능 효과에 대한 추가 검증과 완성도 향상을 위해 MMNs의 전달 후, 종양세포의 크기 변화나 활성물질의 분포도 등에 대한 추가적인 연구수행은 계속 지속할 것이다. 이러한 결과들은 MRI을 이용한 질병을 진단하고 동시에 치료 가능한 분자영상(molecular image)분야의 기반기술 연구로서 중요한 역할을 할 것이라 생각된다.
- 1. Wang, Y.; Hussain, S.; Krestin, G. Superparamagnetic Iron Oxide Contrast Agents: Physicochemical Characteristics and Applications in MR Imaging. Eur. Radiol. 2001, 11, 2319-2331.
-

- 2. Lee, S. J.; Jeong, J. R.; Shin, S. C.; Chang, Y. H.; Kim, J. D. Nanoparticles of Magnetic Ferric Oxides Encapsulated with PLGA and Their Application as MRI Contrast Agent. J. Magn. Magn. Mater. 2004, 272-276, 2432-2433.
-

- 3. Li, Z.; Chen, H.; Bao, H.; Gao, M. One-Pot Reaction to Synthesize Water-Soluble Magnetite Nanocrystals. J. Am. Chem. Soc. 2004, 16, 1391-1393.
-

- 4. Kim, S. Y.; Oh, J. M.; Lee, J. S.; Kim, T. J.; Choy, J. H. Gadolinium(III) Diethylenetriamine Pentaacetic Acid/Layered Double Hydroxide Nanohybrid as Novel T1-Magnetic Resonant Nanoparticles. J. Nanosci. 2008, 8, 5181-5184.
-

- 5. Sun, G.; Feng, J.; Jing, F.; Pei, F.; Liu, M. Synthesis and Evaluation of Novel Polysaccharide-Gd-DTPA Compounds as Contrast Agent for MRI. J. Magn. Magn. Mater. 2003, 265, 123-129.
-

- 6. Taylor, R. M.; Huber, D. L.; Monson, T. C.; Ali, A. S.; Bisoffi, M.; Sillerud, L. O. Multifunctional Iron Platinum Stealth Immunomicelles: Targeted Detection of Human Prostate Cancer Cells Using Both Fluorescence and Magnetic Resonance Imaging. J. Nanopart. Res. 2011, 13, 4717-4729.
-

- 7. Lee, H. Y.; Lim, N. H.; Seo, J. A.; Khang, G. S.; Kim, J. A.; Lee, H. B.; Cho, S. H. Preparation of Poly(vinylpyrrolidone) Coated Iron Oxide Nanoparticles for Contrast Agent. Polym. Korea 2005, 29, 266-270.
- 8. Oh, J. M.; Park, M.; Kim, S. T.; Jung, J. Y.; Kang, Y. G.; Choy, J. H. Efficient Delivery of Anticancer Drug MTX Through MTX-LDH Nanohybrid System. J. Phys. Chem. Solids 2006, 67, 1024-1027.
-

- 9. Kim, J. Y.; Choi, S. J.; Oh, J. M.; Park, T.; Choy, J. H. Anticancer Drug-Inorganic Nanohybrid and Its Cellular Interaction. J. Nanosci. Nanotechnol. 2007, 7, 3700-3705.
-

- 10. Wang, L.; Xing, H.; Zhang, S.; Ren, Q.; Pan, L.; Zhang, K.; Bu, W.; Zheng, X.; Zhou, L.; Peng, W.; Hua, Y.; Shi, J. A Gd-doped Mg-Al-LDH/Au Nanocomposite for CT/MR Bimodal Imagings and Simultaneous Drug Delivery. Biomaterials 2013, 34, 3390-3401.
-

- 11. Lee, S. J.; Jeong, J. R.; Shin, S. C.; Chang, Y. H.; Kim, J. D. Magnetic Enhancement of Iron Oxide Nanoparticles Encapsulated with Poly(d,l-latide-co-glycolide). Colloids Surf., A 2005, 225, 19-25.
-

- 12. Lee, S. J.; Jeong, J. R.; Shin, S. C.; Kim, J. D. Synthesis and Characterization of Superparamagnetic Maghemite Nanoparticles Prepared by Coprecipitation Technique. J. Magn. Magn. Mater. 2004, 282, 147-150.
-

- 13. Lee, S. J.; Kim, H. J.; Huh, Y. M.; Kim, I. W.; Jeong, J. H.; Kim, J. C.; Kim, J. D. Functionalized Magnetic PLGA Nanospheres for Targeting and Bioimaging of Breast Cancer. J. Nanosci. Nanotechnol. 2018, 18, 1542-1547.
-

- 14. Min, H. K.; Kim, J. A.; Kim, J. C.; Lee, S. J. Preparation and Characterization of Superparamagnetic Microneedles (SMMNs) containing Magnetic Cubosome Nanoparticles (MCNs). J. Adv. Eng. Technol. 2019, 12, 103-108.
- 15. Lee, S. J. Study of Superparamagnetic Microneedles Containing Iron Oxide Nanoparticles. Appl. Chem. Eng. 2021, 32, 556-561.
- 16. Kim, Y. G.; Lee, S. M.; Kim, D. B.; Noh, K. M.; Oh, K. S.; Cho, S. H.; Choi, E. P.; Kim, K. P.; Huh, K. M. Preparation and Characterization of Poly(ethylene glycol)-Doxorubicin/SPION Magnetic Nanoparticles for Cancer Therapy. Polym. Korea 2018, 42, 1059-1067.
-

- 17. Lee, J. H.; Huh, Y. M.; Jun, Y. W.; Seo, J. W.; Jang, J. T.; Song, H. T.; Kim, S.; Cho, E. J.; Yoon, H. G.; Suh, J. S.; Cheon, J. Artificially Engineered Magnetic Nanoparticles for Ultra-Sensitive Molecular Imaging. Nat. Med. 2007, 13, 95-99.
-

- 18. Jun, Y. W.; Huh, Y. M.; Choi, J. S.; Lee, J. H.; Song, H. T.; Kim, S.; Yoon, S.; Kim, K. S.; Shin, J. S.; Suh, J. S.; Cheon, J. Nanoscale Size Effect of Magnetic Nanocrystals and Their Utilization for Cancer Diagnosis via Magnetic Resonance Imaging. J. Am. Chem. Soc. 2005, 127, 5732-5733.
-

- 19. Lee, J. W.; Choi, S. O.; Felner, E. I.; Prausnitz, M. R. Dissolving Microneedle Patch for Transdermal Delivery of Human Growth Hormone. Small 2011, 7, 531-539.
-

- 20. Han, S. K.; Ha, H. Y.; Lee, S. J. Fabrication of Microneedles Array Combining Biodegradable Hyaluronic Acid and Herbal Medicine Lonicera Flos. Polym. Korea 2019, 43, 540-546.
-

- 21. Han, S. K.; Lee, S. J.; Ha, H. Y. Skin Moisturizing Effects of a Microneedle Patch Containing Hyaluronic Acid and Lonicerae flos. Processes 2021, 9, 321.
-

- 22. Kim, J. A.; Park, S. C.; Alle, M.; Lee, S. J.; Kim; J. C. Magnesium Ascorbyl Phosphate Loaded in Dissolving Stiff Microneedles Containing Cellulose Nanofiber. J. Drug. Deliv. Sci. Technol. 2021, 63, 102439.
-

- 23. Yun, S. K.; Lee, S. J.; Giri, S. S.; Kim, H. J.; Kim, S. G.; Kim, S. W.; Han, S. J.; Kwon, J.; Oh, W. T.; Park, S. C. Vaccination of Fish Against Aeromonas Hydrophila Infections Using the Novel Approach of Transcutaneous Immunization with Dissolving Microneedle Patches in Aquaculture. Fish Shellfish Immunol. 2020, 97, 34-40.
-

- 24. Lee, S. J. Fabrication and Characterization of Micropatterned Elastomeric PDMS Mold. J. Adv. Eng. Technol. 2017, 10, 335-339.
-

- 25. Choi, W. H.; Kim, B. S. Fabrication and Characterization of Dissolving Microneedles Containing Lecithin for Transdermal Drug Delivery. Korean Chem. Eng. Res. 2021, 59, 429-434.
- 26. Giudice, E. L.; Campbell, J. D. Needle-Free Vaccine Delivery. Adv. Drug Deliv. Rev. 2006, 58, 68-89.
-

- 27. Ito, Y.; Yoshimura, M.; Tanaka, T.; Takada, K. Effect of Lipophilicity on the Bioavailability of Drugs After Percutaneous Administration by Dissolving Microneedles. J. Pharm. Sci. 2012, 101, 1145-1156.
-

- 28. Sunkavalli, S.; Eedara, B B.; Janga, K. Y.; Velpula, A.; Jukanti, R.; Bandari, S. Preparation and Characterization of Docetaxel Self-Nanoemulsifying Powders (SNEPs): A Strategy for Improved Oral Delivery. Korean J. Chem. Eng. 2016, 33, 1115-1124.
-

- 29. ISO 10993-5:2009(E), Part 5: Tests for In Vitro Cytotoxicity, 8.5 Determination of Cytotoxicity, 3rd ed., 2009.
- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(6): 783-792
Published online Nov 25, 2022
- 10.7317/pk.2022.46.6.783
- Received on Jul 11, 2022
- Revised on Aug 29, 2022
- Accepted on Aug 29, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Seung-Jun Lee
-
Process Development Lab., Department of Pharmaceutical Science and Engineering, Seowon University, Chungju, Chungbuk 28674, Korea
- E-mail: finedaddy@seowon.ac.kr
- ORCID:
0000-0001-8677-7053










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.