- Selective Fluorescence Staining of Microplastic in Water Utilizing Nile Red/surfactant Combination
Department of Nanotechnology and Advanced Materials Engineering, Sejong University, Seoul 05006, Korea
- Nile red/계면활성제 조합을 이용한 미세플라스틱의 수계 내 선택적 형광 염색
세종대학교 나노신소재공학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
To observe and quantify microplastics (MPs) in an aqueous environment, separation of MPs from water (e.g., filtration), drying, and staining them with a fluorescent dye by using a solvent is a common procedure. In this study, the tedious procedures were tried to be avoided, through selectively and in situ fluorescence staining of MPs in water by the combination of a dye and a surfactant. A non-polar fluorescent dye such as Nile red was adsorbed to MPs in the presence of Tergitol MIN FOAM 1x and penetrated the polymer matrix by thermal treatment, exhibiting stable fluorescence behavior. The effect of different staining parameters, including temperature, time, dye/surfactant ratio, dye/MP ratio, and MP concentration, were investigated to find better staining conditions. Fluorescence quenching of non-adsorbed dyes in aqueous solution was successfully achieved by the addition of aniline, which allowed selective fluorescence staining of MPs in water possibly for rapid detection and monitoring of MPs.
본 연구에서는 염료와 계면활성제의 조합을 통해 미세플라스틱(microplastic, MP)을 수계 내에서 바로 선택적으로 형광 염색하는 방법을 도출하고자 하였다. 계면활성제의 존재 하에서 Nile red로 대표되는 비극성 형광 염료는 MP에 흡착되고 열처리에 의하여 고분자 매트릭스에 침투되어, MP의 안정적인 형광 거동을 제공하였다. 온도, 시간, 염료/계면활성제 비율, 염료/MP 비율, 그리고 MP 농도를 포함한 다양한 염색 변수의 영향을 조사하여 보다 바람직한 염색 조건을 찾고자 하였다. 또한, 아닐린의 투입에 의하여 수용액 내 비흡착 염료에 대한 형광 소광이 가능하였으며, 이를 통하여 MP의 수계 내 선택적 형광 염색을 성공적으로 달성하였다. 이 방법을 통하여, MP의 물로부터의 분리/여과 등 통상적인 절차를 생략하고, MP의 신속한 검출 및 모니터링을 위한 형광 염색이 가능해질 수 있을 것으로 기대된다.
A selectively fluorescence staining of microplastics in aqueous environment was successfully achieved by the introduction of a non-polar fluorescent dye such as Nile red and a surfactant, followed by a fluorescence quenching of non-adsorbed dyes in solution by the addition of quenching agent, aniline.
Keywords: microplastics, staining, Nile red, surfactant, quenching.
본 결과물은 환경부의 재원으로 한국환경산업기술원의 미세플라스틱 측정 및 위해성평가 기술개발사업의 지원을 받아 연구되었습니다(과제번호 2020003110003).
저자들은 이해상충이 없음을 선언합니다.
플라스틱은 낮은 밀도, 낮은 열/전기 전도도 및 부식 저항성 등으로 인해 식품 포장 등의 일상생활로부터 첨단 소재까지 다양한 용도로 사용되고 있다.1,2 비록 플라스틱이 비용과 편리함에서 우리의 삶에 많은 도움을 주고 있지만 전 세계에서 생산되는 연간 3억 2천만 톤의 플라스틱 중 40% 이상이 폐기되고 있다.2,3 일반적으로 폐기된 플라스틱은 점차 분해되어 더 작은 조각들로 작아지기 때문에 미세플라스틱(micro- plastic, MP)이라고 알려진 환경 문제를 야기하게 된다.2-5 The Joint Group of Experts on the Scientific Aspects of Marine Environmental Protection은 MP를 직경이 5 mm 미만인 플라스틱 입자로 정의하고 있다.6 최근 Hartmann 등은 MP의 크기를 1-1000 μm로 제안하였으나,7 1-20 μm의 MP는 샘플링, 처리 및 관찰 등의 측면에서의 난이도가 높다.1,8 이에 따라, MP를 크기에 따라 1-100 μm, 100-350 μm, 350 μm-5 mm의 세 범주로 분류하고, 대체로 100 μm 이상의 MP 모니터링을 목표로 하고자 하는 시도가 일반적이다.1 MP는 환경 내에 존재하면서 먼 거리에 걸쳐 운반되고, 먹이 사슬에 영향을 끼치며, 인간을 포함한 유기체의 건강을 위태롭게 할 수 있다.3,9-11 MP는 특히 수중 환경에서 부정적인 영향을 미치는 오염 물질일 수 있다.5,12
MP를 탐지, 관찰 및 모니터링하려는 노력은 그러한 위협에 대응하기 위해 반드시 필요한 단계일 것이다. MP의 관찰 절차는 일반적으로 물로부터 MP의 분리(예를 들어, 여과 등의 방법으로), MP의 크기에 따른 분류, 유기 잔류물 제거, MP 식별 및 정량 등으로 구성된다.13-17 예를 들어, 여과는 지표수, 지하수, 해양수 및 폐수와 같은 수계 샘플에서 MP를 분리하는 단계이다.14,15,18-20 일반적으로 산화적 방법에 의해 유기 잔류물을 제거한 후,15 MP는 광학 관찰, 푸리에 변환 적외선 분광법 및 라만 분광법4,8,21-27을 포함한 분광학적 관찰을 통해 검출 및 정량한다. 이 때 형광 염료를 사용한 MP의 염색은 분광학적 관찰 과정에서 MP를 식별할 수 있도록 하는 필수적인 과정이다.28,29 MP의 형광 염색을 위하여, MP를 구성하는 비극성 고분자 매트릭스에 흡착이 용이한 비극성 형광 염료가 일반적으로 사용된다. Nile red는 광화학적으로 안정된 heterocyclic 화합물로서 MP의 형광 염색에 가장 많이 사용되는 대표적인 소수성 유기 형광 염료이다.8,21,24-27 Nile red는 비극성 매질에 용해되며, 높은 quantum yield를 가지고 있고 염색 후 양호한 형광 강도를 나타낸다.
Nile red는 물에 대한 용해도가 낮기 때문에, 기존 문헌에선 Nile red를 유기 용매에 녹인 염색 용액을 사용하여 MP를 염색한 경우가 대부분이다. 아세톤,26,30,31 클로로포름,25,32 헥산,27,30,31 메탄올,8,29,33 에탄올34은 Nile red 염색 용액의 제조에 사용되는 대표적 용매들이다. 그러나, 염색 과정에서 유기 용매를 사용하는 것은 MP자체나 MP를 물로부터 여과할 때 필요한 필터 재료를 손상시켜 변성시킬 수 있는 가능성이 있다. 예를 들어, 아세톤은 폴리스타이렌(PS)의 용매이기 때문에, 아세톤을 염색 용매로 사용할 경우 PS MP의 크기, 형태 및 갯수 등이 변화할 가능성은 명백하다. 또한, 유기 용매의 끓는점은 일반적으로 높지 않아(예를 들어, 아세톤의 경우 56 oC) 염색 온도도 제한될 수 있다. 더 나아가, 유기 용매를 이용한 염색 방법은 먼저 MP를 물로부터 분리하고 건조하는 과정을 거치는 것이 일반적인데,8,27,35 최근 높아지고 있는 MP의 빠른 검출 및 현장 실시간 모니터링 등에는 다단계 과정 및 시간 소모 등의 측면에서 적용하기가 쉽지 않다.36-38
본 연구에서는 이러한 문제점들을 해결하기 위하여 계면활성제를 이용한 MP의 수계 내 형광 염색을 제안한다. 계면활성제는 소수성 꼬리와 친수성 머리로 구성된 양친매성 유기 화합물이다.39 계면활성제가 일정량 존재하는 경우, 비극성 염료는 계면활성제 분자에 의해 물속에 안정하게 분산될 수 있다.39-41 계면활성제의 미셀은 일반적으로 크기가 마이크론 이하여서 MP와 혼동될 우려가 낮다.7,42 또한 미셀의 표면적은 매우 넓으며, 이는 미셀에 용해된 염료가 쌍극자 상호작용과 반데르발스 상호작용을 통해 MP 표면에 용이하게 흡착될 수 있음을 의미한다(Scheme 1).21,43 열처리 조건에서, 느슨해진 고분자 사슬 매트릭스에 흡착된 염료가 침투할 수 있게 되며,21,29 다시 온도를 실온으로 낮춤으로써 염료 분자는 고분자 매트릭스 내에 구속되어, 이후 소광 등 여러 주위 환경변화에도 염료의 형광 특성을 안정적으로 유지할 수 있게 해 줄 수 있다.29 본 연구자의 이전 연구에서는 저렴한 형광증백제인 S-FN을 채택하였었으나,44 본 연구에서는 가장 대중적이면서도 가시광선 영역에서 흡광/발광되는 형광 염료인 Nile red와 계면활성제의 조합에 의하여 MP의 수계 내 염색을 시도해 보았다.
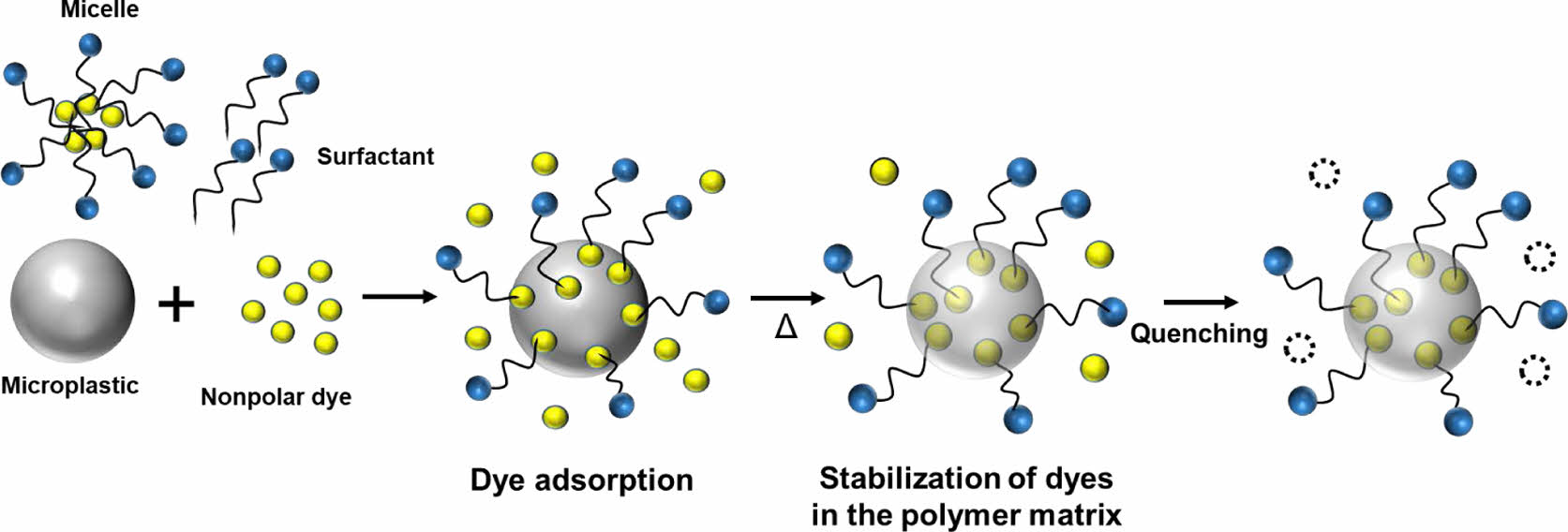
Scheme 1. Schematic representation of staining procedure of MPs in water with non-polar dye and surfactant.
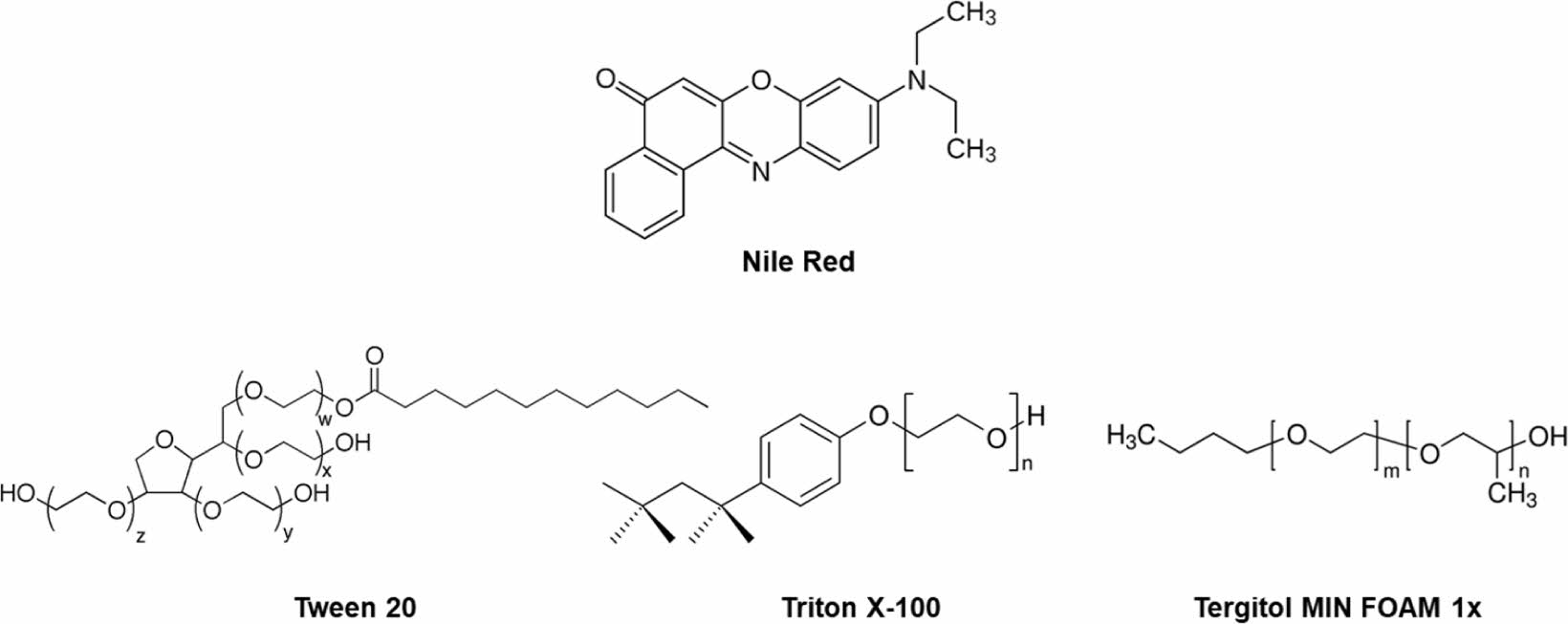
시료 및 시약. 염료로 사용된 Nile red(98.0%)는 Sigma-Aldrich(USA)로 구매하였으며 별도의 정제과정 없이 사용되었다. 계면활성제로는 상업적으로 구매 가능한 비이온성 계면활성제 Tween 20(Samchun, Korea), Triton X-100 (Hanlab, Korea) 및 Tergitol MIN FOAM 1x(Sigma-Aldrich, USA) 등을 사용하였다. 본 연구에 사용된 염료와 계면활성제의 화학적 구조는 Figure 1에 보였다. 아세톤(99.5%, Samchun, Korea), 에탄올(94.5%, Samchun, Korea) 등의 용매도 정제없이 사용되었다. MP 시료를 제조하기 위한 폴리프로필렌[PP, 중량평균분자량(Mw)=12000 g/mol], 폴리에틸렌(PE, Mw=4000 g/mol), PS(Mw=35000 g/mol)은 Sigma-Aldrich(St. Louis, MO, USA)에서 구입하여 사용하였다. 형광 소광제로 아닐린(99.5%, Sigma-Aldrich, USA) 혹은 NaOH(98.0%, Samchun, Korea)를 사용하였다.
MP 샘플. MP 샘플을 준비하는 전형적인 절차는 다음과 같다. 우선 PS, PP및 PE를 블렌더(UNIX, UNBO-A9100, Korea)를 사용하여 분쇄하였다. 분쇄된 MP를 testing sieves (Chunggye Sieve; Gunpo-Si, Gyonggido, Korea)를 이용하여 크기별로 분리하였다. 수집된 MP의 크기는 광학 현미경(IF.2253-PLF, Euromex, 네덜란드)을 사용하여 확인하였으며, 이미지는 ImageJ 소프트웨어 프로그램(미국국립보건원, 1.8.0_172 버전)을 사용하여 분석하었다. 본 연구에서는, 특별한 언급이 없는 경우 106-212 μm 크기의 MP를 실험에 사용하였다.
MP의 형광 염색. MPs 전형적인 형광 염색 절차는 다음과 같다. 염료 용액(예컨대, 염료/계면 활성제=1 g/L)은 1.571×10-5 몰의 Nile red(5×10-3 g)와 7.766×10-3 몰의 계면 활성제(즉, 4.97 g 또는 5×10-3 L의 Tergitol MIN FAOM 1x)를 혼합하고 50 oC에서 15분 동안 교반함으로써 준비하였다. 별도로, MP(~10 mg)를 10 mL의 탈염수/에탄올 수용액(7.63/2.37 v/v)에 넣어 MP 수용액을 준비하였다. 대표적인 PP, PE 및 PS의 밀도 값은 각각 약 0.92, 0.93 및 1.09 g/cm3이기 때문에,2,35 수용액의 밀도는 MP들의 염색 중 침강 및 부상 거동을 지연시키기 위해 탈염수/에탄올의 조성(7.63/2.37 v/v)을 제어함으로써 대표적인 각 MP들의 생산비율(생산 비율; PP~35%, PE~56%, PS~9%)로 가중평균된 밀도 값인 0.95 g/cm3과 가깝도록 맞추었다.5 적정량의 염료/계면활성제 염색액(예컨대, 0.25 mL)을 MP 수용액에 첨가한후, HS-R200 가열 블록(Humas Co. Ltd, Korea)을 사용하여 80 oC에서 60분 동안 가열하였다.
분석. 수중 염료 입자의 크기는 입자 크기 분석기(SZ-100, Horiba, 일본)를 이용하여 90°의 산란각, 532 nm의 레이저 파장에서 동적 광 산란법으로 관찰하였다. 염료 용액(염료/계면 활성제=1 g/L)을 10 mL의 물로 희석한 후 50 oC에서 15분 동안 교반하여 측정 조건과 염색 조건과 유사하도록 하었다. Nile red로 염색된 MP의 형광 사진을 찍기 위하여는, 염색 후의 MP 샘플을 F1002 등급 CHMLAB 필터 페이퍼로 여과하여 수집하고 탈 이온수로 반복적으로 씻은 후, 여기 파장(541-551 nm)/방출 파장(565-605 nm)에서 디지털 형광 현미경(Leica Microsystems, 독일)을 사용하여 촬영하였다. 염색된 MP의 상대적인 형광 강도는 Nile red의 최대 흡수 파장(520 nm)에서 형광 분광법(fluorescence spectroscopy, FS-2, Sinco, Korea)을 사용하여 조사하였다. 샘플 간의 정량적인 비교를 위해, 고정된 양의 염색된 MP(150 mg)가 FS-2를 사용한 형광 분광법에 사용되었다. 각각의 샘플에 대해 3번 이상의 실험을 반복하여 형광 강도 값을 결정하였다.
|
Figure 1 Chemical structures of dye and surfactants employed in this study |
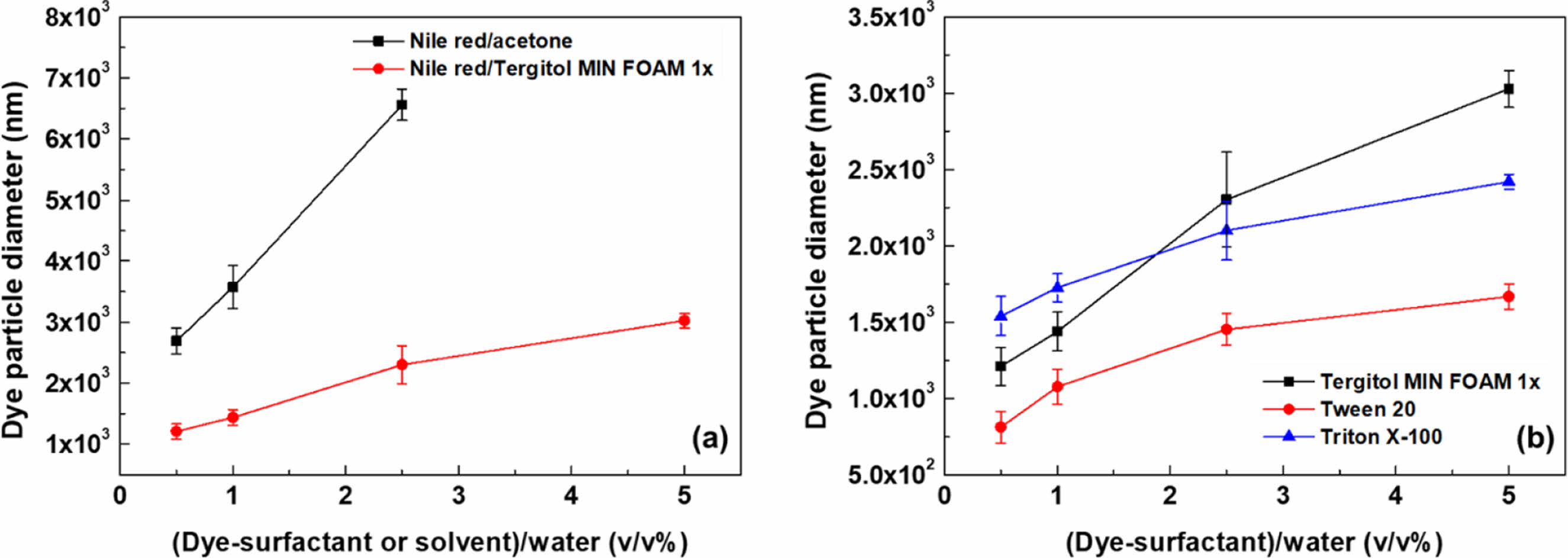
MP의 대부분은 지방족 화학 특성을 갖는 비극성 물질로, 결정성, 입체 규칙성 등으로 인해 물에 녹지 않아 수용액 상에서 염색하기 용이하지 않다. 형광 염료는 UV또는 가시 광선의 일부를 흡수하고 특정 가시 광선을 방출해 색을 내는 비극성 불포화 유기 물질로, 비극성인 특성으로 인해 MP에 상대적으로 친화성을 가지지만, MP와 마찬가지로 물에 용해되지 않아 수중에서 염료 분자가 MP의 고분자 매트릭스에 접근하기가 쉽지 않다. 예를 들어, Nile red는 아세톤에 용해되어 균일한 용액을 형성한다. 아세톤은 물과 혼화성이 있지만, 물에 투하된 Nile red/아세톤 용액은 더 이상 안정하지 못하며 3 μm 이상의 크기를 가지는 염료 입자로 응집/침전되었다(Figure 2의 Nile red/아세톤). 5 vol%에서는 물 속의 Nile red/아세톤 염료 입자가 너무 커서 입도 분석기 검출 범위를 벗어날 정도였다. 10 μm 이상의 크기를 가지는 염료 입자는 MP와 혼동될 수 있을 정도이기 때문에 MP의 염색을 위한 염색액으로는 바람직하지 않다. 또한 이렇게 염료입자의 크기가 클 경우, 낮아진 표면적으로 인하여 MP로의 흡착 능력도 떨어져 MP의 염색에 효과적이지 않을 수 있다. 이러한 결과는 MPs의 효과적인 염색을 위해서 본 연구에서 주장하는 바와 같이 염료의 수용액 내에서의 우수한 분산이 확보되는 것이 중요하다는 것을 시사한다.
이와는 대조적으로, 계면활성제의 사용은 수계 내 염료 입자 크기를 획기적으로 감소시켰다. 예를 들어, Nile red/Tergitol MIN FOAM 1x의 경우(Figure 2(a)), 수계에 2.5 vol%로 투입되면, 염료 입자의 크기가 ~2 μm정도였다. Tergitol MIN FOAM 1x 이외에 여러 다른 계면 활성제를 사용해 본 결과는 Figure 2(b)에 보였으며, 계면 활성제별로 Nile red 입자 크기에 대한 특별한 차이는 관찰되지 않았고, 계면활성제가 사용된 경우 염료 입자의 크기는 대체로 3 μm 이하였다.
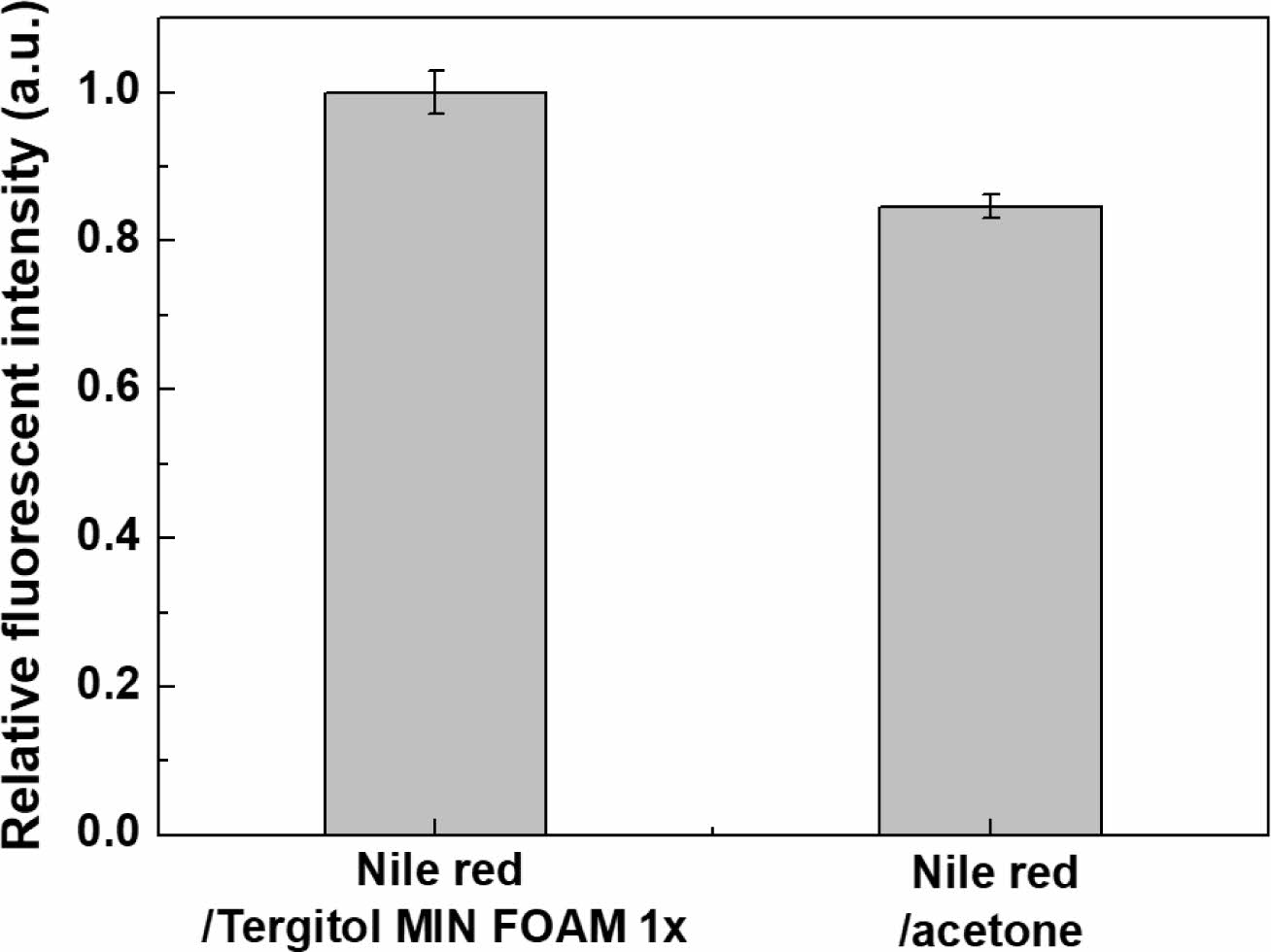
염료/용매 조합과 염료/계면활성제 조합의 MP 염색 효과를 비교하기 위하여, 동일한 조건에서 Nile red/아세톤과 Nile red/Tergitol MIN FOAM 1x로 염색한 PP MP의 상대적인 형광강도를 Figure 3에 보였다. Figure 3에서 보는 바와 같이, MP의 형광 염색시 계면활성제를 사용할 경우 염료/유기용매를 사용한 경우보다 15% 이상 향상된 MP의 형광강도를 보였다. Figure 2(a)에서 보는 바와 같이, Nile red/아세톤으로 염색할 경우 Nile red가 큰 염료 응집체를 형성하기 때문에 Nile red/Tergitol MIN FOAM 1x으로 염색된 MP에 비하여 상대적인 형광 강도 값이 낮은 것으로 판단된다(Figure 3). 계면활성제와 염료의 조합은 계면활성제가 염료의 수계 내 분산성을 높여 MP의 염색 효율을 향상시키는 것으로 판단되었다.
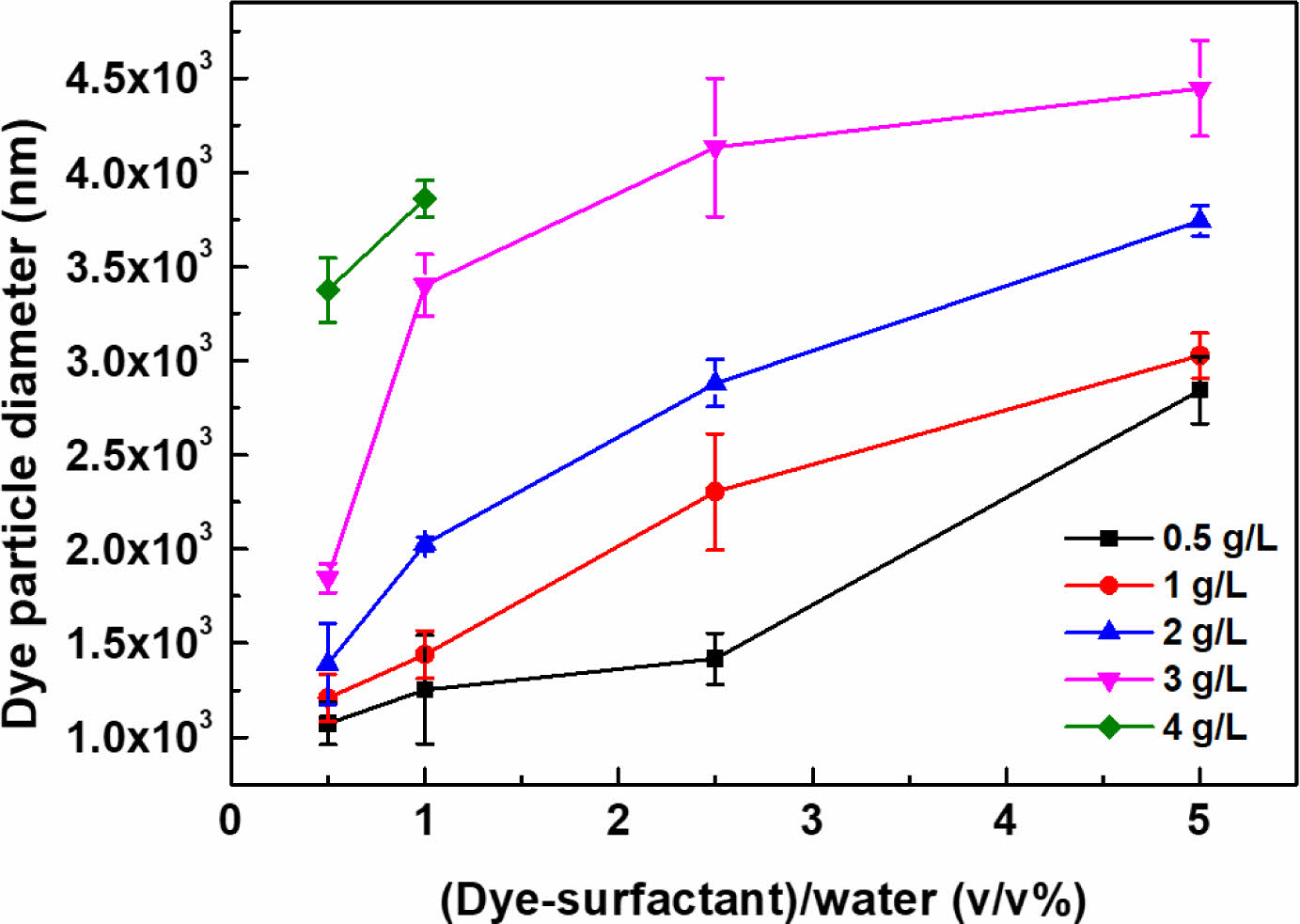
염료에 대한 계면활성제 양의 영향을 살펴보기 위하여, 염료/계면활성제 비율에 따른 수용액 내 Nile red의 입자 크기는 Figure 4에 보였다. 수용액 내 염료/계면활성제의 농도가 높아질수록(즉, Figure 4의 x축), 보다 큰 염료 입자가 관찰되었다. 또한, 염료/계면활성제 값이 높아질수록(즉, 염료에 비하여 계면활성제의 양이 상대적으로 적어질수록, 0.5-4 g/L in Figure 4) 보다 큰 입자를 형성했다. 염료/계면활성제 비율이 2-4 g/L인 경우, 3-4.5 μm의 크기를 갖는 큰 염료 입자가 관찰되었고 4 g/L의 경우 1 vol% 이상에서 입자 크기 분석기의 측정범위를 벗어날 정도로 큰 염료 입자를 형성하였다. 본 연구에서는 MP의 원활한 염색을 위한 표준 조건으로 1 g/L의 염료/계면 활성제 비율 및 2.5 vol%의 수계 내 염료/계면활성제 농도를 채택하였다.
Figure 5에는 제안된 해당 염색 조건에서 Nile red/Tergitol MIN FOAM 1x 조합을 사용하여 다양한 성분의 MP를 염색한 결과물들의 형광 사진을 보였다. MP의 성분과 관계없이 MP들이 성공적으로 염색됨과 우수한 형광 방출 특성이 있음을 잘 보여주고 있다.
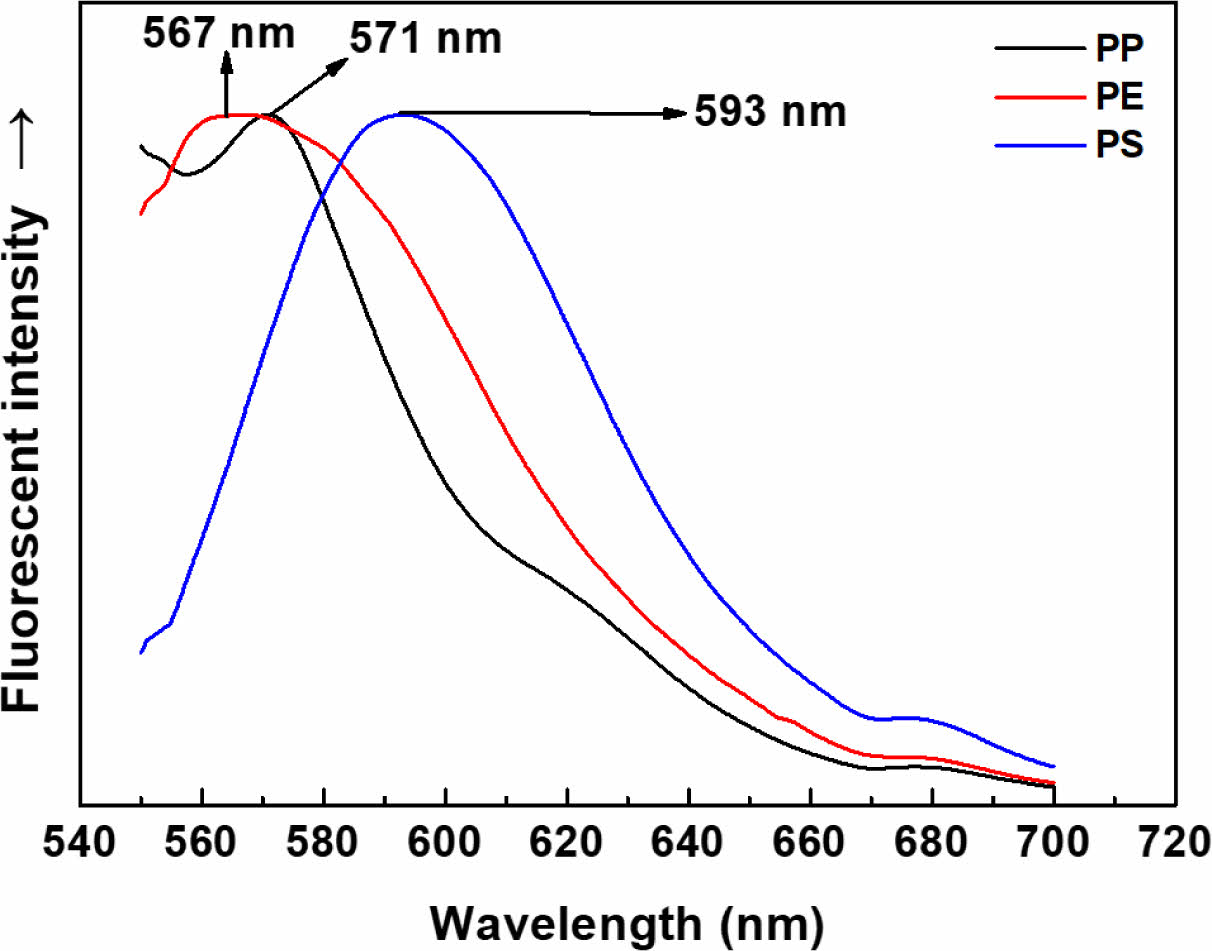
다양한 성분의 형광 염색된 MP들의 형광 방출 특성을 보다 자세히 살펴보기 위하여 Nile red/Tergitol MIN FOAM 1x로 염색된 PE, PP, PS MP들의 형광방출 스펙트럼을 Figure 6에 보였다. 각 MP들의 최대 방출 파장은 PE에서 567 nm였고, PP 및 PS의 나일 레드는 각각 571 nm 및 593 nm이었다. 즉, MP의 성분에 따라 서로 다른 최대 형광 방출 파장을 보였는데, 이는 다른 문헌들에서도 보고된 바와 같이, Nile red의 매질에 따른 변색(solvatochromic) 특성 때문인 것으로 판단된다.21,45-48 즉, Nile red는 고분자 matrix의 성질에 따라 서로 다른 상호작용을 하여 서로 다른 형광 방출 특성을 보였다.
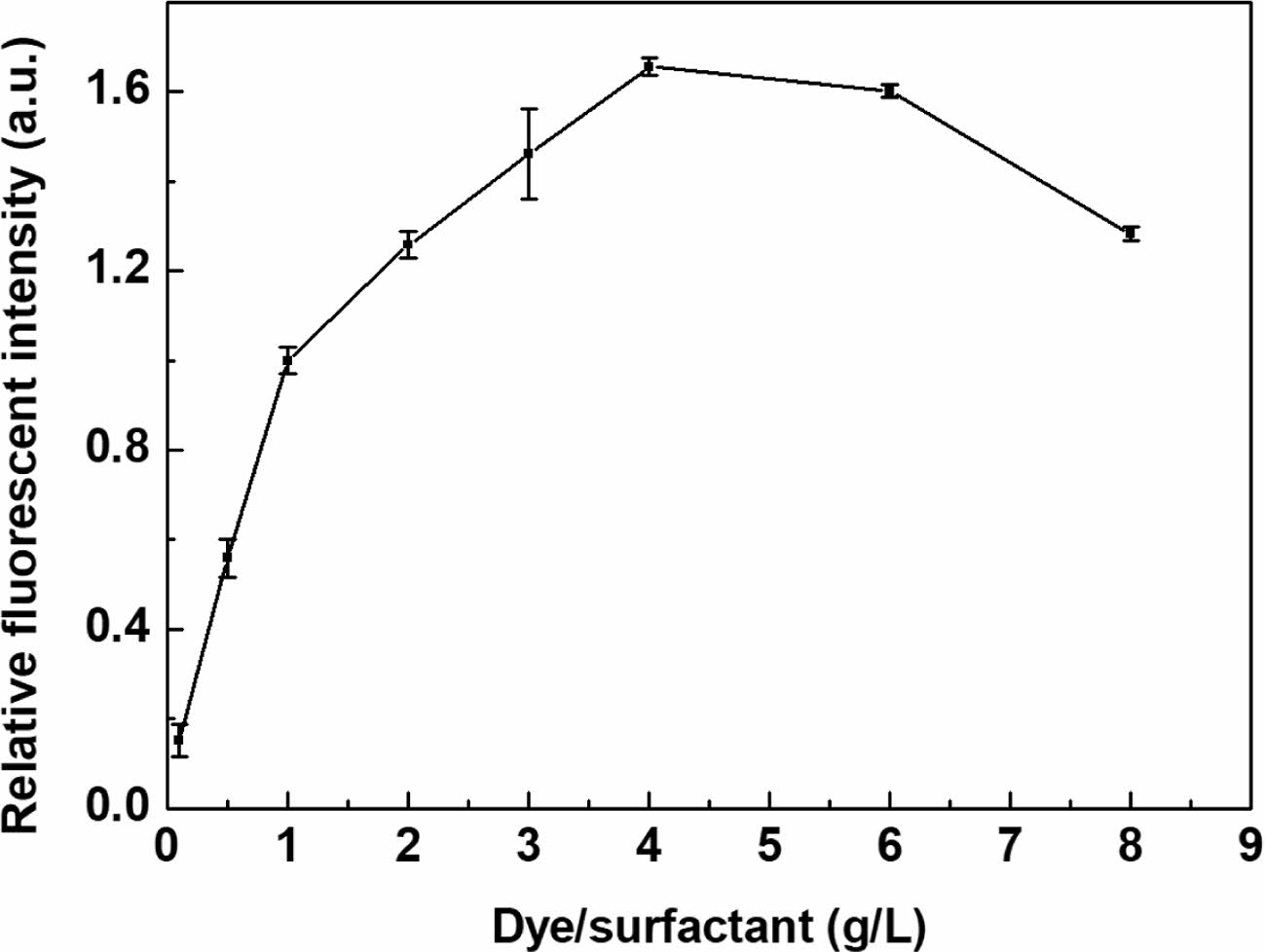
MP의 염색 및 형광 방출 강도에 영향을 끼치는 여러 요인들을 조사하기 위하여, 우선 Nile red/Tergitol MIN FOAM 1x 비율에 따른 PP MP의 상대적인 형광 강도 거동을 살펴보았다(Figure 7). 염료/MP의 비율이 2.5 wt%로 고정된 조건에서 염료/계면활성제 값이 낮아질수록 계면활성제의 양이 많아짐을 의미하며, 이에 따라 Nile red의 수용액상 분산을 위한 계면활성제의 양은 충분한 것으로 판단되었다. 다만, Nile red/Tergitol MIN FOAM 1x 비율이 1 g/L보다 낮은 경우, Tergitol MIN FOAM 1x의 양이 지나치게 많아져 80 °C 열처리 후에 일부 잉여 Tergitol MIN FOAM 1x과 수용액 간의 상분리가 관찰되었고, 이 영향으로 염료/계면활성제 MP의 염색 강도도 다소 낮아졌다. 반대로 염료/계면활성제 4 g/L 이상에서는 계면활성제의 양이 과소하여 염료의 수용액상 분산성이 낮아져 MP의 염색이 효율적으로 진행되지 못하여 MP의 형광강도가 저하되는 것으로 판단되었다.49
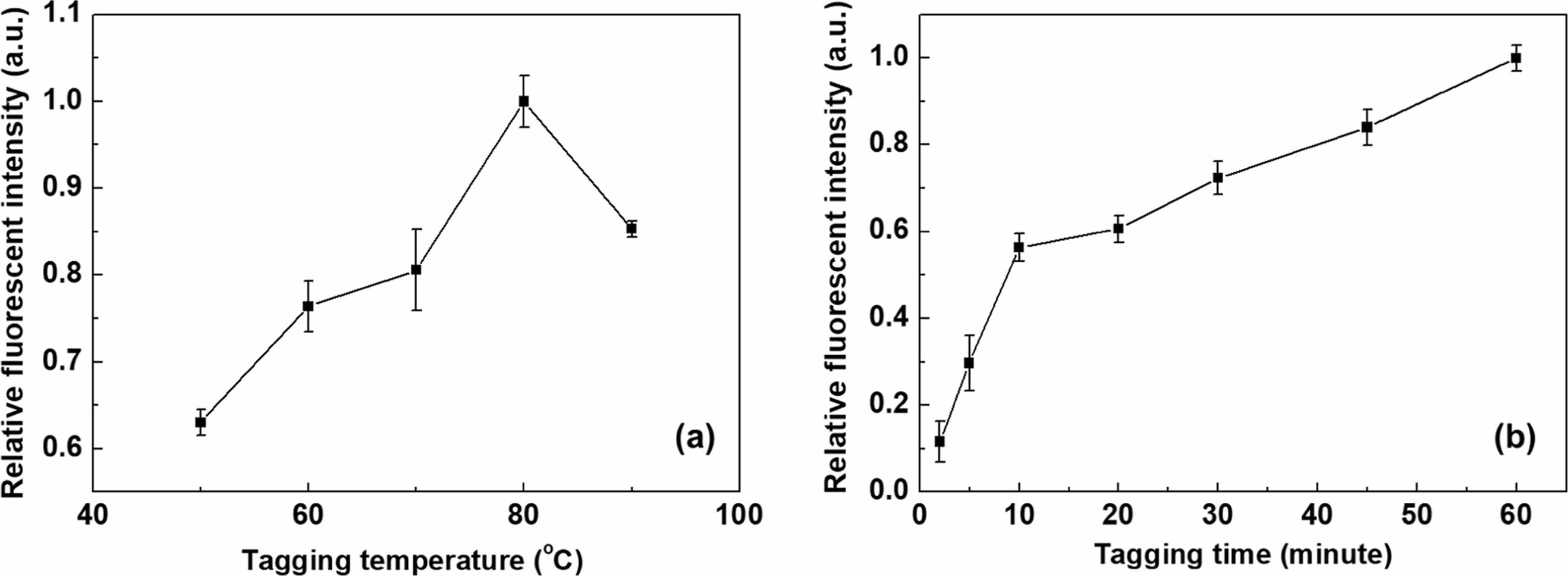
이어서 염색 과정에서 염색 온도, 염색 시간, 염료/MP 비율, MP/수용액 비율 등의 조건이 Nile red/Tergitol MIN FOAM 1x 조합으로 염색된 PP MP의 상대적인 형광방출 강도에 미치는 영향을 조사하여 보았다. 충분한 양의 계면활성제가 투입됨을 확보하기 위하여 염료/계면활성제 비율은 1 g/L로 고정하였다. 우선, Figure 8(a)에서 보는 바와 같이 보다 높은 염색 온도에서 상대적으로 높은 PP MP의 형광 방출 강도를 보여 주었으며, 이는 상대적으로 고온에서 MP의 고분자 사슬이 더 느슨해져 Nile red가 고분자 매트릭스로 더 잘 침투할 수 있게 되기 때문인 것으로 생각되었다.21,29 그러나, MP를 성분별로 각각의 유리 전이 온도 또는 용융 온도 이상으로 가열하면(예컨대, PS의 경우 유리 전이 온도가 100 °C), MP들의 융착으로 인해 서로 응집될 수 있기 때문에 MP의 합리적인 검출을 위한 염색 온도는 80 °C 이하가 바람직한 것으로 판단되었다.
마찬가지로, 상대적으로 더 긴 염색 시간에서 염료의 MP matrix로의 침투 가능성이 높아지기 때문에 일정한 염색 온도(본 실험의 경우 80 oC)에서 염색 시간이 길어질수록 PP MP의 형광 강도가 더 높아졌다(Figure 8(b)). 그러나, 10분의 염색시간 이후에는 다소 완만한 PP MP의 형광 강도 상승이 관찰되어, 일정 수준 이상의 PP MP 염색을 위해서는 다소 짧은 염색 시간(약 10분) 만으로도 충분했다. 해당 염색 온도(80 oC)는 PP의 용융 온도(약 147 oC) 보다 낮기 때문에, Nile red는 주로 PP MP의 표면층으로 침투되는 것으로 추정되었다.
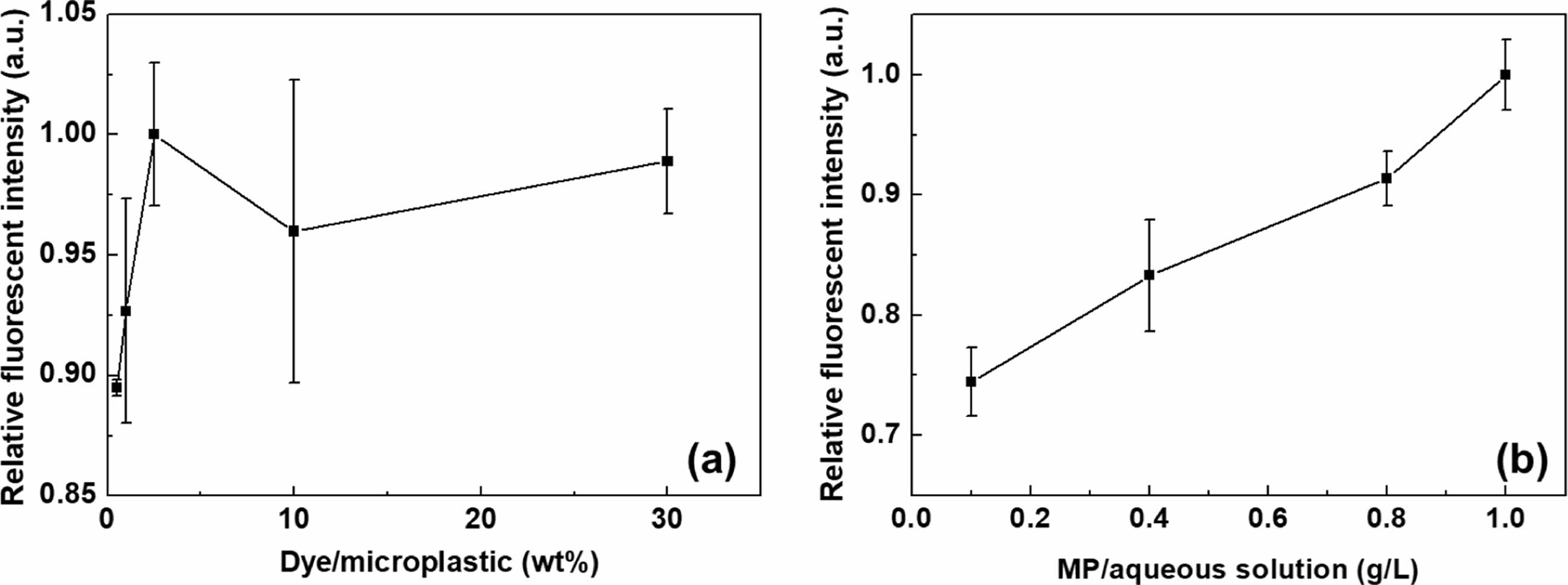
고정된 염료/계면활성제 비율에서 MP에 더 많은 염료를 첨가하면 더 높은 흡착 확률로 인해 염색된 MP의 상대 형광 강도가 증가하였다(Figure 9(a)). 단, 염료/MP 2.5 wt% 이상에서는 염료의 수용액상 제한된 용해성 또는 잉여 염료의 자기 소광 현상으로 인해 염색된 MP의 상대적 형광 강도가 더 이상 증가하지는 않았다.50 과량의 염료가 있는 경우, 방출된 형광은 인접 염료에 의해 재흡수되거나 열 진동 에너지로서 주변 매트릭스로 전달될 수 있으며, 이와 같은 자기 소광 현상으로 인해 염료를 추가적으로 투입하여도 전체 형광 강도는 더 이상 높아지지 않을 수 있다.51
MP의 수용액 내 농도에 따른 염색 거동을 살펴보기 위하여 MP/수용액 비율이 0.1-1.0 g/L인 범위에서 염색을 실시하고, 염색된 MP의 상대적 염색 강도를 살펴보았다(Figure 9(b)). 문헌상 현장 폐수 샘플에서 발견되는 MP입자의 농도는 1L 당 18000개 이상일 수 있는데,52 MP의 형상이 구형이고 직경이 159 μm(본 연구에서 106-212 μm의 중간 값)인 것으로 가정하면, 이러한 PP MP의 농도는 3.5×10-2 g/L에 해당한다 [PP의 밀도=0.92 g/cm3, MP부피=(1/6)×π×D3],53 Figure 9(b)에서의 MP/수용액 비율 0.1-1.0 g/L는 이를 10배 정도 농축한 상황을 가정한 것이다. Figure 9(b)에 표시된 바와 같이, dye/MP의 비율이 2.5 wt%로 고정된 상황에서 MP/수용액 농도가 증가할수록 FS-2에 의해 측정된 염색된 PP MP의 상대 형광 강도는 증가하는 것이 관찰되었다. 이는 수용액 내 MP와 염료의 농도가 증가하여 흡착 확률 및 이에 따른 염색 확률이 높아졌기 때문인 것으로 판단되었다.
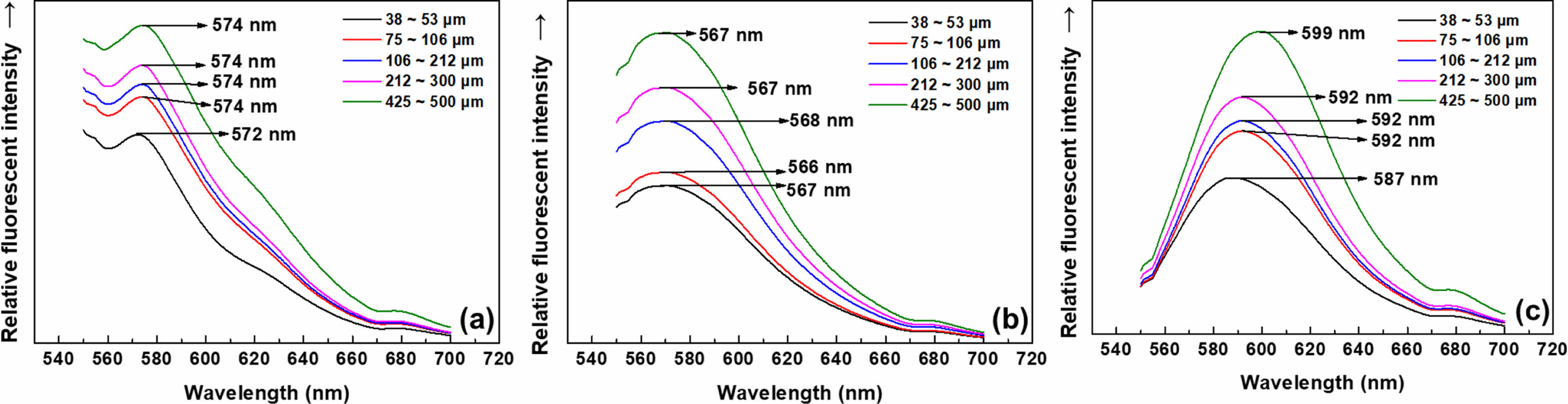
MP의 성분과 크기가 형광 거동에 미치는 영향은 Figure 10에 보였다. 모든 MP들이 우수한 염색 거동과 강한 형광 강도를 나타내었다. 성분의 종류와 관계없이 더 큰 크기의 MP들이 보다 높은 형광 강도를 나타내는 경향이 보였지만, 그 이유는 아직 명확하지 않다.
도입부에서 언급한 바와 같이 MP의 실시간 및 현장 모니터링에 대한 관심이 증대되고 있으며, 이를 위하여는 여과나 건조 등 시간이 오래 걸리고 복잡한 과정들은 바람직하지 않다. 이에 따라, 본 연구에서는 MP의 염색 후에 염색 수용액 내 비흡착 염료 분자의 in-situ 형광 소광을 시도하여 보았으며, 이를 통하여 염색된 MP만이 선택적으로 형광 발현되어 관찰되는 방법을 시도하여 보았다(Scheme 1의 최종 단계). 문헌 조사를 바탕으로, 본 연구에서는 NaOH과54 아닐린을55,56 Nile red의 형광 소광제 후보로 선정하고 Nile red/Tergitol MIN FOAM 1x가 포함되어 있는 MP 염색 용액에 투입하여 보았다. 0.5 M의 NaOH를 투입한 경우, 용액 내 비흡착 염료 분자의 형광 강도는 거의 완전히 사라졌지만 염색된 MP의 형광 강도는 어느 정도 유지됨을 관찰할 수 있었다(Figure 11). 하지만 50 oC에서 용액상 비흡착 염료 분자의 형광 특성이 완전히 사라지는데 약 3시간의 시간이 걸려 MP의 검출 공정을 신속화한다는 취지에는 다소 맞지 않았다.
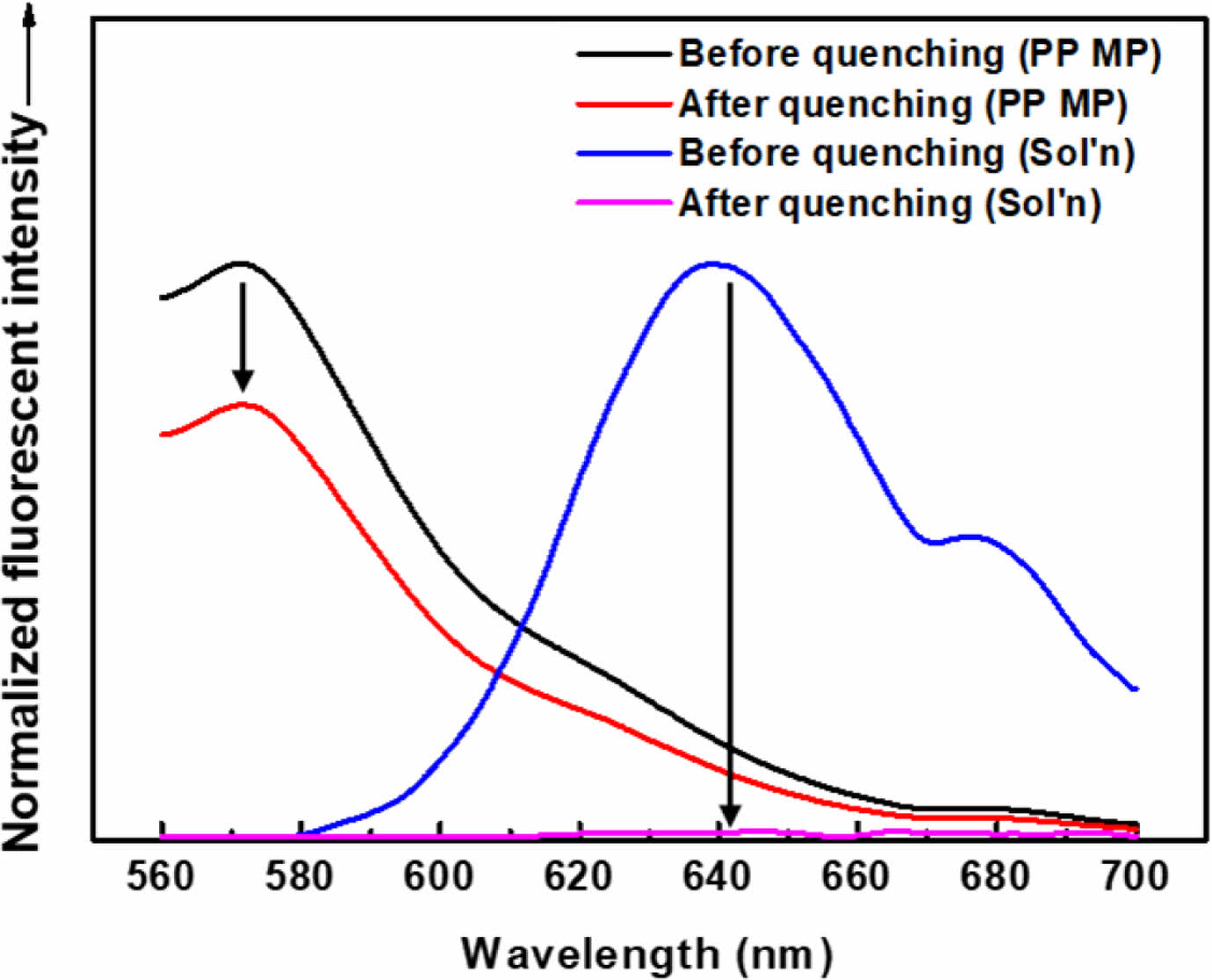
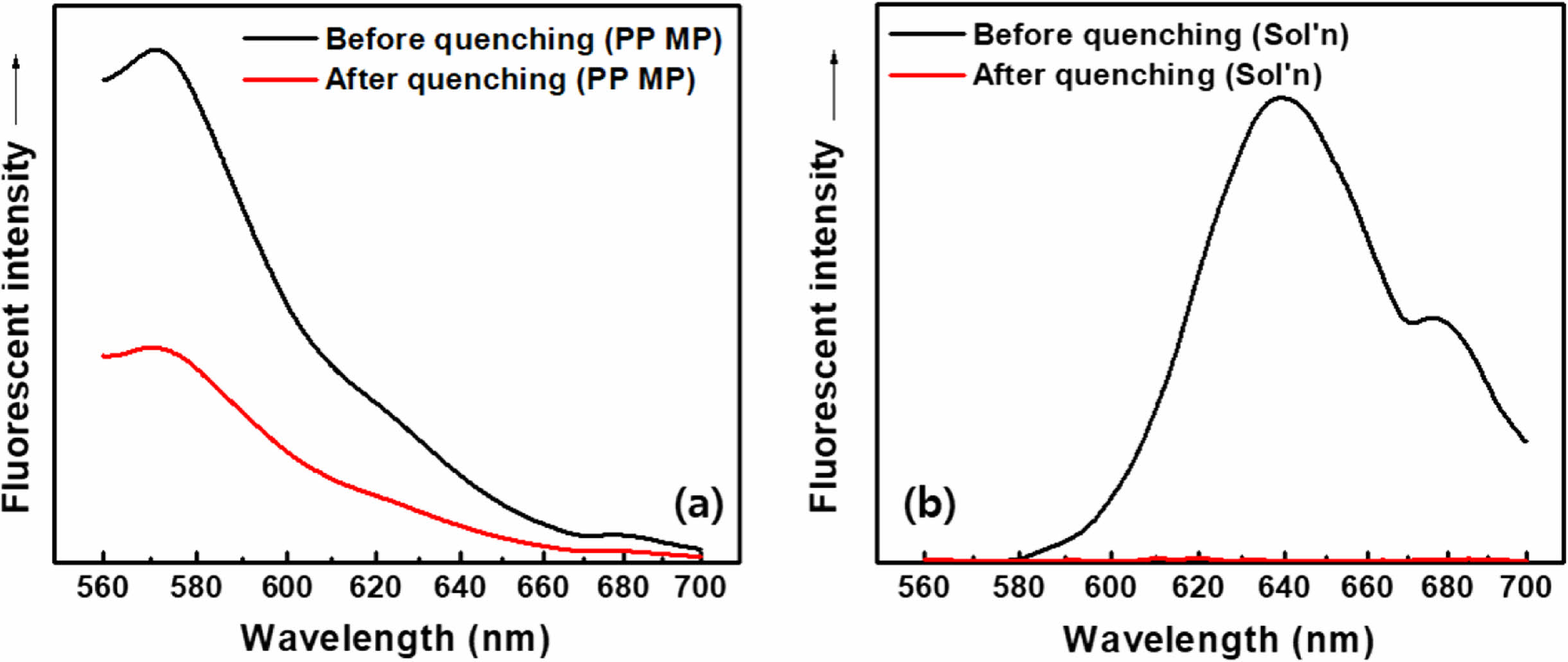
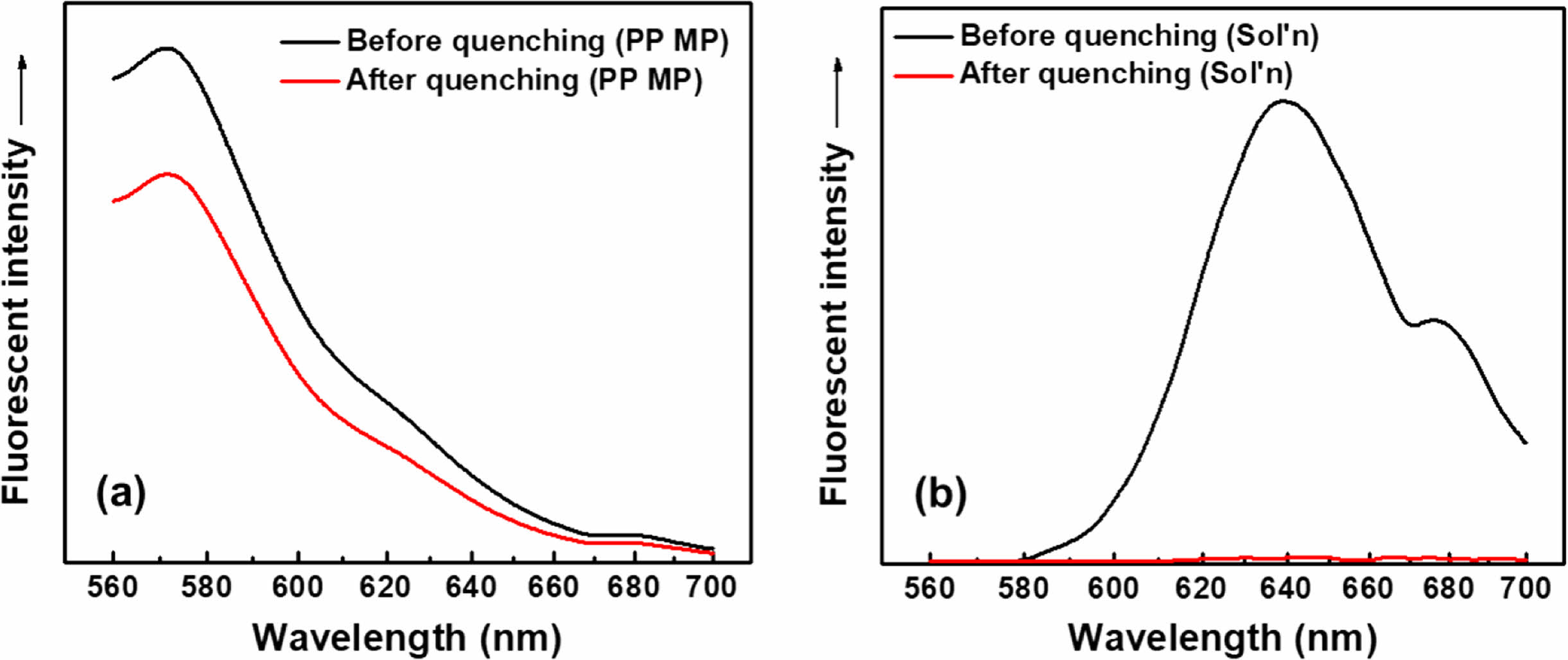
반면, 0.1 M의 아닐린을 염색 수용액에 투입하여 수용액상 비흡착 Nile red 분자의 형광 소광을 시도한 경우, Figure 12에서 보는 바와 같이 아닐린 투입 직후 수용액의 형광 강도는 거의 완전히 사라졌다(Figure 12(b)). 이 때 염색된 MP의 형광 강도는 폴리머 matrix의 염료 보호 효과로 인해 아닐린 첨가 이후에도 대체로 유지되는 것을 관찰할 수 있었다(Figure 12(a)). 이러한 결과는 아닐린을 형광소광제로 투입함에 의하여 수용액 내 비흡착 Nile red 분자만을 선택적이고 효과적으로 소광시키고, 염색된 MP의 형광은 유지되도록 하여(570 nm, Figure 12(a)), 여과 및 건조 등의 과정 없이도 특정 방출 파장에서 MP의 검출 및 정량이 가능할 것임을 의미한다.
|
Figure 2 Size of dye particles at various concentration in water (dye/surfactant or solvent=1 g/L): (a) with different dye and surfactant combinations; (b) with different surfactants. |
|
Figure 3 Relative fluorescence intensity of PP-MPs stained with Nile red/Tergitol MIN FOAM 1x and Nile red/acetone. Staining condition: dye/surfactant or solvent=1 g/L, dye/MP=2.5 wt%, MP/ water solution=1 g/L, staining time=60 minutes, staining temperature=80 oC. |
|
Figure 4 Size of dye particles with different dye/surfactant ratios at various concentration of Nile red/Tergitol MIN FOAM 1x in water. |

|
Figure 5 Fluorescence photographs of MPs with different compositions stained with Nile red. Staining condition: surfactant=Tergitol MIN FOAM 1x, dye/surfactant=1 g/L, dye/MP=2.5 wt%, MP/aqueous solution=1 g/L, staining time=60 minutes, staining temperature =80 oC. |
|
Figure 6 Normalized fluorescent spectra of Nile red in stained MPs. Staining condition: surfactant=Tergitol MIN FOAM 1x 20, dye/surfactant=1 g/L, dye/MP=2.5 wt%, MP/aqueous solution=1 g/ L, staining time=60 minutes, staining temperature=80 oC. |
|
Figure 7 Relative fluorescence intensity of PP MPs stained with different surfactants at different dye/surfactant ratios. Staining condition: dye=Nile red, surfactant=Tergitol MIN FOAM 1x, dye/ MP=2.5 wt%, MP/aqueous solution=1 g/L, staining time=60 minutes, staining temperature=80 oC. |
|
Figure 8 Relative fluorescence intensity of PP MPs stained with Nile red/Tergitol MIN FOAM 1x: (a) at different staining temperature; (b) at different time. Staining condition: dye/surfactant=1 g/L, dye/MP=2.5 wt%, MP/aqueous solution=1 g/L. Staining time is 60 minutes for (a) and staining temperature is 80 ℃ for (b). |
|
Figure 9 Relative fluorescence intensity of PP MPs: (a) stained with different dye/MP ratios; (b) stained with different MP/aqueous solution ratios. Staining condition: dye=Nile red, surfactant=Tergitol MIN FOAM 1x, dye/surfactant=1 g/L, staining time=60 minutes, staining temperature=80 ℃. MP/aqueous solution is 1 g/L for (a) and dye/MP is 2.5 wt% for (b). |
|
Figure 10 Fluorescent spectra of MPs with different sizes stained with Nile red/Tergitol MIN FOAM 1x: (a) PP; (b) PE; (c) PS. Staining condition: dye/surfactant=1 g/L, dye/MP=2.5 wt%, MP/aqueous solution=1 g/L, staining time=60 minutes, staining temperature=80 ℃. |
|
Figure 11 uorescent spectra before and after quenching with NaOH: (a) stained PP MPs; (b) aqueous staining solution without MPs. Staining condition: dye=Nile red, surfactant=Tergitol MIN FOAM 1x, dye/surfactant=3 g/L, dye/MP=2.5 wt%, MP/aqueous solution=1 g/L, staining time=60 minutes, staining temperature=80 ℃. Fluorescence quenching condition: 0.5 M NaOH, 50 ℃, 3 hours. |
|
Figure 12 Fluorescent spectra before and after quenching with aniline: (a) stained PP MPs; (b) aqueous staining solution without MPs. Staining condition: dye=Nile red, surfactant=Tergitol MIN FOAM 1x, dye/surfactant=3 g/L, dye/MP=2.5 wt%, MP/aqueous solution=1 g/L, staining time=60 minutes, staining temperature=80 ℃. Fluorescence quenching condition: 0.1 M aniline, room temperature, almost immediate. |
본 연구에서는 Nile red와 계면활성제의 조합을 이용하여 수용액 상에서 MP의 선택적 in-situ 형광 염색을 시도하여 보았다. Tergitol MIN FOAM 1x 등의 계면활성제를 사용하여 수계 내 비극성 Nile red형광 염료의 분산도를 향상시켜 염료 입자의 크기를 수 마이크론 이하로 낮출 수 있었으며, 이의 MP로의 흡착 및 열처리를 통한 고분자 메트릭스로의 침투를 통하여 효율적이고 성공적인 MP의 형광 염색을 달성할 수 있었다. PP, PE, PS 등 MP들의 성분과 관계없이 효과적인 형광 염색이 가능하였으나, 성분에 따라 Nile red의 방출 스펙트럼 및 최대 형광 파장이 서로 달라지는 변색 특성이 관찰되었다. Nile red에 비하여 Tergitol MIN FOAM 1x 계면활성제의 양이 너무 적을 경우 Nile red의 분산 효율에 문제가 있을 수 있었고, 너무 많을 경우 열처리시 일부 잉여의 Tergitol MIN FOAM 1x가 염색 수용액과 상분리되는 것이 관찰되었다. Nile red/Tergitol MIN FOAM 1x 조합을 사용하여 염색 온도, 염색 시간 및 염료/MP 비율과 같은 변수가 PP MP의 염색에 미치는 영향에 대해 살펴본 결과, 바람직한 염색 조건으로 각각 80 °C의 염색 온도, 약 10분의 염색 시간 및 약 2.5 wt%의 염료/MP 비율이 도출되었다. Nile red/Tergitol MIN FOAM 1x으로 PP MP를 염색하는 것은 0.1-1.0 g/L 등 다양한 MP/수용액 농도에서 가능하였다. 아닐린의 투입에 의하여 MP에 흡착되지 않은 수용액 내 Nile red 분자의 선택적 형광 소광이 가능함을 확인하였으며, 이 때 MP의 형광방출 특성은 대체로 유지되었다. 즉, Nile red/Tergitol MIN FOAM 1x조합에 의한 수계 내 MP들의 형광 염색과 아닐린의 투입에 의한 비흡착 Nile red의 형광 소광에 의하여 MP만의 선택적 형광 염색이 가능하였으며, 이를 통하여 여과/건조 과정 없이 MP의 수계 내 검출 및 정량이 가능해질 수 있을 것으로 기대된다.
- 1. Frias, J.; Nash, R. Microplastics: Finding a Consensus on the Definition. Mar. Pollut. Bull. 2019,138, 145-147.
-

- 2. Andrady, A. L. The Plastic in Microplastics: A review. Mar. Pollut. Bull. 2017,119, 12-22.
- 3. Wright, S. L.; Kelly, F. J. Plastic and Human Health: A Micro Issue? Environ. Sci. Technol. 2017,51, 6634-6647.
-

- 4. Li, J.; Liu, H.; Paul Chen, J. Microplastics in Freshwater Systems: A Review on Occurrence, Environmental Effects, and Methods for Microplastics Detection. Water Res. 2018, 137, 362-374.
-

- 5. Andrady, A. L. Microplastics in the Marine Environment. Mar. Pollut. Bull. 2011, 62, 1596-1605.
- 6. Joint Group of Experts on the Scientific Aspects of Marine Environmental Protection, Sources, Fate and Effects of Microplastics in the Marine Environment: A Global Assessment. In Reports and Studies GESAMP No. 90; Kershaw, P. J. Ed.; International Maritime Organization: London, 2015.
- 7. Hartmann, N. B.; Huffer, T.; Thompson, R. C.; Hassellov, M.; Verschoor, A.; Daugaard, A. E.; Rist, S.; Karlsson, T.; Brennholt, N.; Cole, M.; Herrling, M. P.; Hess, M. C.; Ivleva, N. P.; Lusher, A. L.; Wagner, M. Are We Speaking the Same Language? Recommendations for a Definition and Categorization Framework for Plastic Debris. Environ. Sci. Technol. 2019, 53, 1039-1047.
-

- 8. Erni-Cassola, G.; Gibson, M. I.; Thompson, R. C.; Christie-Oleza, J. A. Lost, But Found with Nile Red: A Novel Method for Detecting and Quantifying Small Microplastics (1 mm to 20 μm) in Environmental Samples. Environ. Sci. Technol. 2017, 51, 13641-13648.
-

- 9. Ziajahromi, S.; Kumar, A.; Neale, P. A.; Leusch, F. D. L. Environmentally Relevant Concentrations of Polyethylene Microplastics Negatively Impact the Survival, Growth and Emergence of Sediment-dwelling Invertebrates. Environ. Pollut. 2018, 236, 425-431.
-

- 10. Raju, S.; Carbery, M.; Kuttykattil, A.; Senathirajah, K.; Subashchandrabose, S. R.; Evans, G.; Thavamani, P. Transport and Fate of Microplastics in Wastewater Treatment Plants: Implications to Environmental Health. Rev. Environ. Sci. Biotechnol. 2018, 17, 637-653.
-

- 11. Cui, R.; Kim, S. W.; An, Y. J. Polystyrene Nanoplastics Inhibit Reproduction and Induce Abnormal Embryonic Development in the Freshwater Crustacean. Daphnia galeata. Sci. Rep. 2017, 7, 12095.
-

- 12. Huerta Lwanga, E.; Gertsen, H.; Gooren, H.; Peters, P.; Salanki, T.; van der Ploeg, M.; Besseling, E.; Koelmans, A. A.; Geissen, V. Microplastics in the Terrestrial Ecosystem: Implications for Lumbricus terrestris (Oligochaeta, Lumbricidae). Environ. Sci. Technol. 2016, 50, 2685-2691.
-

- 13. Primpke, S.; Christiansen, S. H.; Cowger, W.; De Frond, H.; Deshpande, A.; Fischer, M.; Holland, E. B.; Meyns, M.; O'Donnell, B. A.; Ossmann, B. E.; Pittroff, M.; Sarau, G.; Scholz-Bottcher, B. M.; Wiggin, K. J. Critical Assessment of Analytical Methods for the Harmonized and Cost-efficient Analysis of Microplastics. Appl. Spectrosc. 2020, 74, 1012-1047.
-

- 14. Zarfl, C. Promising Techniques and Open Challenges for Microplastic Identification and Quantification in Environmental Matrices. Anal. Bioanal. Chem. 2019, 411, 3743-3756.
-

- 15. Prata, J. C.; da Costa, J. P.; Duarte, A. C.; Rocha-Santos, T. Methods for Sampling and Detection of Microplastics in Water and Sediment: A Critical Review. Trends Analyt. Chem. 2019,110, 150-159.
-

- 16. Silva, A. B.; Bastos, A. S.; Justino, C. I. L.; da Costa, J. P.; Duarte, A. C.; Rocha-Santos, T. A. P. Microplastics in the Environment: Challenges in Analytical Chemistry - A Review. Anal. Chim. Acta 2018, 1017, 1-19.
-

- 17. Shim, W. J.; Hong, S. H.; Eo, S. E. Identification Methods in Microplastic Analysis: A Review. Anal. Methods 2017, 9, 1384-1391.
-

- 18. Ziajahromi, S.; Neale, P. A.; Rintoul, L.; Leusch, F. D. Wastewater Treatment Plants as a Pathway for Microplastics: Development of a New Approach to Sample Wastewater-based Microplastics. Water Res. 2017, 112, 93-99.
-

- 19. Löder, M. G. J.; Gerdts, G. Marine Anthropogenic Litter; Bergmann, M.; Gutow, L.; Klages, M., Eds., Springer: Heidelberg, 2015; pp. 201-227.
-

- 20. Lenz, R.; Enders, K.; Stedmon, C. A.; Mackenzie, D. M. A.; Nielsen, T. G. A Critical Assessment of Visual Identification of Marine Microplastic Using Raman Spectroscopy for Analysis Improvement. Mar. Pollut. Bull. 2015, 100, 82-91.
-

- 21. Shruti, V. C.; Perez-Guevara, F.; Roy, P. D.; Kutralam-Muniasamy, G. Analyzing Microplastics with Nile Red: Emerging Trends, Challenges, and Prospects. J. Hazard. Mater. 2022, 423, 127171.
-

- 22. Liu, S.; Shang, E.; Liu, J.; Wang, Y.; Bolan, N.; Kirkham, M. B.; Li, Y. What Have we Known so Far for Fluorescence Staining and Quantification of Microplastics: A Tutorial Review. Front. Environ. Sci. Eng. 2022, 16, 8.
-

- 23. Capolungo, C.; Genovese, D.; Montalti, M.; Rampazzo, E.; Zaccheroni, N.; Prodi, L. Photoluminescence-based Techniques for the Detection of Micro- and Nanoplastics. Chem. Eur. J. 2021, 27, 17529-17541.
-

- 24. Stanton, T.; Johnson, M.; Nathanail, P.; Gomes, R. L.; Needham, T.; Burson, A. Exploring the Efficacy of Nile Red in Microplastic Quantification: A Costaining Approach. Environ. Sci. Technol. Lett. 2019, 6, 606-611.
-

- 25. Hengstmann, E.; Fischer, E. K. Nile Red Staining in Microplastic Analysis-proposal for a Reliable and fast Identification Approach for Large Microplastics. Environ. Monit. Assess. 2019, 191, 612.
-

- 26. Maes, T.; Jessop, R.; Wellner, N.; Haupt, K.; Mayes, A. G. A Rapid-screening Approach to Detect and Quantify Microplastics Based on Fluorescent Tagging with Nile Red. Sci. Rep. 2017, 7, 44501.
-

- 27. Shim, W. J.; Song, Y. K.; Hong, S. H.; Jang, M. Identification and Quantification of Microplastics Using Nile Red Staining. Mar. Pollut. Bull. 2016, 113, 469-476.
-

- 28. Karakolis, E. G.; Nguyen, B.; You, J. B.; Rochman, C. M.; Sinton, D. Fluorescent Dyes for Visualizing Microplastic Particles and Fibers in Laboratory-based Studies. Environ. Sci. Technol. Lett. 2019, 6, 334-340.
-

- 29. Lv, L.; Qu, J.; Yu, Z.; Chen, D.; Zhou, C.; Hong, P.; Sun, S.; Li, C. A Simple Method for Detecting and Quantifying Microplastics Utilizing Fluorescent Dyes - Safranine T, Fluorescein Isophosphate, Nile Red Based on Thermal Expansion and Contraction Property. Environ. Pollut. 2019, 255, 113283.
-

- 30. Tamminga, M.; Hengstmann, E.; Fischer, E. K. Nile Red Staining as a Subsidiary Method for Microplastic Quantification: A Comparison of Three Solvents and Factors Influencing Application Reliability. SDRP J. Earth Sci. Environ. Studies 2017, 2, 165-172.
-

- 31. Wiggin, K. J.; Holland, E. B. Validation and Application of Cost and Time Effective Methods for the Detection of 3-500 μm Sized Microplastics in the Urban Marine and Estuarine Environments Surrounding Long Beach, California. Mar. Pollut. Bull. 2019, 143, 152-162.
-

- 32. Fischer, E. K.; Paglialonga, L.; Czech, E.; Tamminga, M. Microplastic Pollution in Lakes and Lake Shoreline Sediments - A Case Study on Lake Bolsena and Lake Chiusi (central Italy). Environ. Pollut. 2016, 213, 648-657.
-

- 33. Tosic, T. N.; Vruggink, M.; Vesman, A. Microplastics Quantification in Surface Waters of the Barents, Kara and White Seas. Mar. Pollut. Bull. 2020, 161, 111745.
-

- 34. Tong, H.; Jiang, Q.; Zhong, X.; Hu, X. Rhodamine B Dye Staining for Visualizing Microplastics in Laboratory-based Studies. Environ. Sci. Pollut. Res. 2021, 28, 4209-4215.
-

- 35. Hidalgo-Ruz, V.; Gutow, L.; Thompson, R. C.; Thiel, M. Microplastics in the Marine Environment: A Review of the Methods Used for Identification and Quantification. Environ. Sci. Technol. 2012, 46, 3060-3075.
-

- 36. Asamoah, B. O.; Salmi, P.; Raty, J.; Ryymin, K.; Talvitie, J.; Karjalainen, A. K.; Kukkonen, J. V. K.; Roussey, M.; Peiponen, K. E. Optical Monitoring of Microplastics Filtrated from Wastewater Sludge and Suspended in Ethanol. Polymers 2021, 13, 871.
-

- 37. Colson, B. C.; Michel, A. P. M. Flow-through Quantification of Microplastics Using Impedance Spectroscopy. ACS Sens. 2021, 6, 238-244.
-

- 38. Prata, J. C.; Reis, V.; Matos, J. T. V.; da Costa, J. P.; Duarte, A. C.; Rocha-Santos, T. A New Approach for Routine Quantification of Microplastics Using Nile Red and Automated Software (MP-VAT). Sci. Total Environ. 2019, 690, 1277-1283.
-

- 39. Tehrani-Bagha, A. R.; Holmberg, K. Solubilization of Hydrophobic Dyes in Surfactant Solutions. Materials 2013, 6, 580-608.
-

- 40. Weiss, J.; Coupland, J. N.; McClements, D. J. Solubilization of Hydrocarbon Emulsion Droplets Suspended in Nonionic Surfactant Micelle Solutions. J. Phys. Chem. 1996, 100, 1066-1071.
-

- 41. Smith McWilliams, A. D.; Ergülen, S.; Ogle, M. M.; de los Reyes, C. A.; Pasquali, M.; Martí, A. A. Fluorescent Surfactants from Common Dyes – Rhodamine B and Eosin Y. Pure Appl. Chem. 2019, 92, 265-274.
-

- 42. Weiss, J.; McClements, D. J. Mass Transport Phenomena in Oil-in-water Emulsions Containing Surfactant Micelles: Solubilization. Langmuir 2000, 16, 5879-5883.
-

- 43. Winnik, F. M.; Regismond, S. T. J. C.; Physicochemical, S. A.; Aspects, E. Fluorescence Methods in the Study of the Interactions of Surfactants with Polymers. Colloids Surf., A 1996, 118, 1-39.
-

- 44. Park, D. H.; Oh, S. B.; Hong, S. C. In Situ Fluorescent Illumination of Microplastics in Water Utilizing a Combination of Dye/Surfactant and Quenching Techniques. Polymers 2022, 14, 3084.
-

- 45. Koreiviene, J. Microalgae Lipid Staining with Fluorescent BODIPY Dye. Methods Mol. Biol. 2020, 1980, 47-53.
- 46. Yadigarli, A.; Song, Q.; Druzhinin, S. I.; Schonherr, H. Probing of Local Polarity in Poly(methyl methacrylate) with the Charge Transfer Transition in Nile red. Beilstein J. Org. Chem. 2019, 15, 2552-2562.
-

- 47. Gagne, F.; Auclair, J.; Quinn, B. Detection of Polystyrene Nanoplastics in Biological Samples Based on the Solvatochromic Properties of Nile Red: Application in Hydra attenuata Exposed to Nanoplastics. Environ. Sci. Pollut. Res. 2019, 26, 33524-33531.
-

- 48. Rumin, J.; Bonnefond, H.; Saint-Jean, B.; Rouxel, C.; Sciandra, A.; Bernard, O.; Cadoret, J. P.; Bougaran, G. The Use of Fluorescent Nile Red and BODIPY for Lipid Measurement in Microalgae. Biotechnol. Biofuels 2015, 8, 42.
-

- 49. Tae-soo Choi; Yoshio Shimizu; Hirofusa Shirai; Hamada, K. Disperse Dyeing of Nylon 6 Fiber Using Gemini Surfactants Containing Ammonium Cations as Auxiliaries. Dyes Pigm. 2001, 48, 217-226.
-

- 50. Zhegalova, N. G.; He, S.; Zhou, H.; Kim, D. M.; Berezin, M. Y. Minimization of Self-quenching Fluorescence on Dyes Conjugated to Biomolecules with Multiple Labeling Sites via Asymmetrically Charged NIR Fluorophores. Contrast Media Mol. Imaging 2014, 9, 355-362.
-

- 51. Lakowicz, J. R.; Malicka, J.; D’Auria, S.; Gryczynski, I. Release of the Self-quenching of Fluorescence Near Silver Metallic Surfaces. Anal. Biochem. 2003, 320, 13-20.
-

- 52. Simon, M.; van Alst, N.; Vollertsen, J. Quantification of Microplastic Mass and Removal Rates at Wastewater Treatment Plants Applying Focal Plane Array (FPA)-based Fourier Transform Infrared (FTIR) imaging. Water Res. 2018, 142, 1-9.
-

- 53. Anger, P. M.; von der Esch, E.; Baumann, T.; Elsner, M.; Niessner, R.; Ivleva, N. P. Raman Microspectroscopy as a Tool for Microplastic Particle Analysis. Trends Analyt. Chem. 2018,109, 214-226.
-

- 54. Yang, J.; Zhou, G.; Zhang, G.; Si, Z.; Hu, J. Determination of Some Cephalosporins in Pharmaceutical Formulations by a Fluorescence Quenching Method. Anal. Commun. 1996, 33, 167-169.
-

- 55. Thipperudrappa, J.; Biradar, D. S.; Lagare, M. T.; Hanagodimath, S. M.; Inamdar, S. R.; Kadadevaramath, J. S. Fluorescence Quenching of BPBD by Aniline in Benzene-acetonitrile Mixtures. J. Photochem. Photobiol., A 2006, 177, 89-93.
-

- 56. Geethanjali, H. S.; Nagaraja, D.; Melavanki, R. M.; Kusanur, R. A. Fluorescence Quenching of Boronic Acid Derivatives by Aniline in Alcohols – A Negative Deviation from Stern-Volmer Equation. J. Lumin. 2015, 167, 216-221.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(6): 827-836
Published online Nov 25, 2022
- 10.7317/pk.2022.46.6.827
- Received on Aug 9, 2022
- Revised on Sep 6, 2022
- Accepted on Sep 27, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sung Chul Hong
-
Department of Nanotechnology and Advanced Materials Engineering, Sejong University, Seoul 05006, Korea
- E-mail: sunghong@sejong.ac.kr
- ORCID:
0000-0003-0961-7245










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.