- Gelatin-Chitosan Membrane Containing Fish Bones for Guided Bone Regeneration
Ji Sun Park*,#, Jin Kim**,#, Geon Yi Kang***, and Chang-Moon Lee*, ***, ****, *****,†

*Interdisciplinary Program of Perfume and Cosmetics, Chonnam National University, Gwangju 61186, Korea
**Department of Oral and Maxillofacial Surgery, Chosun University Dental Hospital, Gwangju 61452, Korea
***Department of Biomedical Engineering, Chonnam National University, Jeonnam, Yeosu 59626, Korea
****School of Healthcare and Biomedical Engineering, Chonnam National University, Jeonnam, Yeosu 59626, Korea
*****Research Center of Healthcare and Biomedical Engineering, Chonnam National University, Jeonnam, Yeosu 59626, Korea- 골 유도 재생을 위한 어골 함유 젤라틴-키토산 차폐막
*전남대학교 대학원 향장품학협동과정, **조선대학교 치과대학 구강악안면외과, ***전남대학교 의공학과,
****전남대학교 헬스케어메디컬공학부, *****전남대학교 헬스케어의공학연구소Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Calcium phosphate obtained from fish bones is expected to be used as a material for bone regeneration. In this study, fish bones-included gelatin-chitosan membrane (FB@GEL-CS membrane) was prepared and investigated for guided bone regeneration (GBR). Cell proliferation of osteoblast MC3T3-E1 on FB@GEL-CS membrane according to the content of fish bones was evaluated. MC3T3-E1 cells grew much better on FB@CS-GEL membrane as the content of fish bones increase. In addition, MC3T3-E1 cells on FB@GEL-CS membrane significantly increased alkaline phosphatase (ALP) activity according to the content of fish bones. Analyses of alizarin-red S staining showed that MC3T3-E1 cells on FB@GEL-CS membrane caused increases in cell maturation as the content of fish bones increase. Taken together, results of this study demonstrate that FB@GEL-CS membrane can induce MC3T3-E1 cell proliferation and maturation.
어골은 골 대사와 연관된 유용한 성분을 포함하고 있어서 골 재생을 위한 재료로 활용이 기대된다. 본 연구에서는 어골을 함유한 젤라틴-키토산 차폐막을 제조하고 골 유도 재생에 있어서 골세포의 증식과 분화에 미치는 영향을 평가하였다. 어골의 함량이 증가함에 따라 젤라틴-키토산 차폐막에서 MC3T3-E1 세포의 증식은 증가하는 경향을 보였다. MC3T3-E1 세포의 alkaline phosphatase(ALP) 활성은 젤라틴-키토산 차폐막에서 어골의 함량이 증가함에 따라 유의하게 증가하였다. Alizarin-red S 염색 시험에서 어골의 함량이 증가함에 따라 젤라틴-키토산 차폐막은 MC3T3-E1 세포의 성숙을 유의하게 유도하는 것으로 나타났다. 따라서, 어골을 함유한 젤라틴-키토산 차폐막은 골세포의 증식과 성숙을 유도할 수 있고 골 유도 재생에 유용하게 사용될 수 있다.
Fish bones (FB) are useful for bone regeneration because they contain effective components relate to bone metabolism. Gelatin-chitosan membrane containing FB (FB@GEL-CS membrane) induced cell proliferation and maturation of MC3TC-E1 cells according to the content of FB. Consequently, FB@GEL-CS membrane has a potential for guided bone regeneration.

Keywords: fish bone, chitosan, gelatin, guided bone regeneration, osteoblast.
본 연구는 정부(과학기술정보통신부, 산업통상자원부, 보건복지부, 식품의약품안전처)의 재원으로 범부처전주기의료기기연구개발사업단의 지원을 받아 수행된 연구임 (과제고유번호 : 1415181807, RS-2021-KD000001).
본 논문의 저자들은 이해상충이 없음을 선언합니다.
최근 들어 기능이 상실된 치아의 보완을 위해 다양한 임플란트 시술이 시도되고 있다.1 성공적인 임플란트 시술을 위해 인공치아가 식립되는 주위의 골 조직의 양과 상태는 중요한 고려 사항이다.2 외상에 의한 치조골의 손상과 병적인 질환에 의한 치조골의 상실, 발치 후 시간이 경과되어 치조골이 흡수되는 경우 임플란트의 식립은 어렵게 된다.3 치조골이 부족한 경우 골 조직 보충을 위해 골 유도 재생술(guided bone regeneration, GBR)이 사용된다. GBR은 골세포 이외의 연조직 세포가 골 결손 부위에 이주해 오는 것을 막고 골세포가 자라도록 돕는 역할을 한다. GBR을 위해 사용되는 차폐막은 생체적합성, 적절한 분해성과 물리적 강도를 가지고 있어야 한다.4 골 재생능력을 증진시키고 다양한 골이식재들의 문제점을 해결하기 위해 GBR 차폐막은 다양한 약제나 재료를 이용하여 개발되고 있다.5
천연고분자는 생분해성과 생체적합성이 우수하고 안전한 생체 면역반응 등의 장점이 있어 GBR 차폐막 제조를 위해 주로 사용된다. 키토산(chitosan)은 셀룰로오스 다음으로 자연에서 풍부한 키틴(chitin)을 탈아세틸화(deacetylation)하여 얻어진다. 키토산은 항염성과 항균성을 보이고 특히, 골전도성을 가지고 있어서 치아와 잇몸을 연결시켜주는 조직의 재생 효과가 있어 치과용 소재로 활용되고 있다.6-8 젤라틴(gelatin)은 콜라겐(collagen)의 삼중나선(triple-helix) 구조를 단일나선(single-helix) 구조로 변형시켜 얻을 수 있다. 젤라틴은 세포 접착력과 낮은 면역 항원성을 가지고 있어서 세포 증식에 도움을 준다.9,10 최근, Georgopoulou 등은 키토산과 젤라틴을 이용한 스캐폴드가 골 재생에 유용하다고 보고하였다.11 따라서, 키토산과 젤라틴을 이용한 GBR 차폐막은 유용한 골 재생 유도 재료가 될 수 있다.
Hydroxyapatite(HA)는 체내의 골조직과 치아를 구성하는 주요한 무기물이다. HA는 우수한 생체적합성과 골전도성을 가지고 있어서 골 이식 재료로 널리 사용되고 있다.12 HA는 합성에 의해 생성될 수 있고 주로 소(bovine), 산호(coral), 어골(fish bone) 등을 비롯한 동종골로부터 얻을 수 있다. 천연유기물로부터 합성된 HA는 Na+, K+, Mg2+ 및 Zn2+ 등과 같이 골 대사와 연관된 여러 가지 생화학적 반응에 영향을 미치는 유익한 원소들을 포함하고 있다.13 따라서, 천연 소재로부터 얻을 수 있는 HA는 골 재생 목적을 위해 보다 유용하게 사용될 수 있다.
전 세계적으로 매년 9100만 톤의 어패류가 포살되고 일부만 식용으로 사용된 후 40-50%의 부산물(비늘, 뼈)이 발생한다.14 이러한 부산물은 환경적, 경제적 문제를 야기하기 때문에 재활용 대책이 필요하다. 어골을 고온에서 소성하면 유기물은 모두 제거되고 인산칼슘을 포함한 무기물을 얻을 수 있다. 어골로부터 얻은 인산칼슘은 골 재생을 위한 재료로 활용이 기대된다. 최근 Kim 등은 어골과 마린 콜라겐(marine collagen)을 함유한 3D-printed scaffold가 골 재생에 효과적이라고 보고하였다.15
본 연구에서는 젤라틴과 키토산을 이용하여 골 재생을 위한 GBR 차폐막을 제조하였다(Figure 1). 제조한 젤라틴-키토산 차폐막에 어골을 첨가하고 어골의 함유량이 조골세포의 증식에 미치는 영향을 평가함으로써 골 재생 효과를 예측하였다.
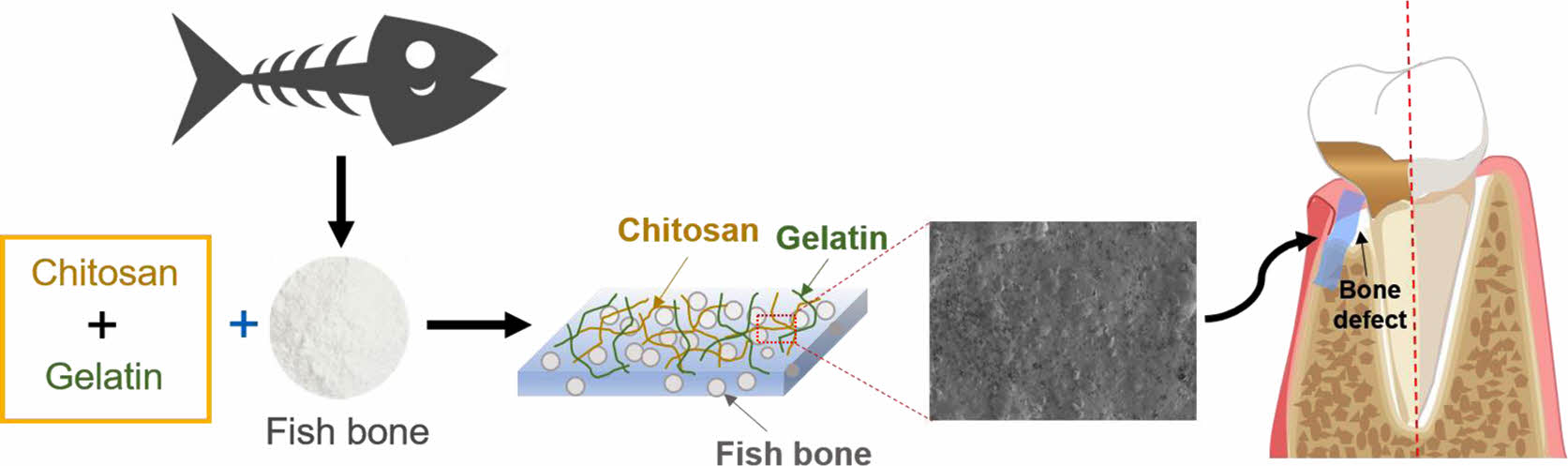
|
Figure 1 A schematic illustration of the gelatin-chitosan membrane containing fish bones for guided bone regeneration. |
재료. 젤라틴(gelatin from porcine skin, MW: 50-100 kDa), cetylpyridimium chloride와 Alizarin red solution은 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구입하였다. 키토산(chitosan, 200-600 mPa in 0.5% acetic acid solution at 20 oC, DA: 80%, MW: 500 kDa)은 TCI SEJUN CI Co., Ltd.(Tokyo, Japan)에서 구입하였다. 어류뼈는 Daedeok Pharm Co., Ltd.(Suwon, Korea)에서 구입하였고 제니핀(genipin)은 Chengdu Biopurify Phytochemicals Ltd.(Sichuan, China)의 제품을 사용하였다. Ethyl alcohol, dimethyl sulfoxide(DMSO), acetic acid는 Duksan Pure Chemicals CO., Ltd.(Ansan, Korea)에서 구입하였다. Phosphate buffered saline는 Lonza Co., Ltd.(Basel, Swiss)에서 구입하여 사용하였다. MC3T3E1 세포(ATCC CRL-2593)는 American Type Culture Collection에서 분양받았고 Minimum Essential Medium Eagle alpha(α-MEM)은 WELGEN Inc.(Gyeongsan, Korea)에 구입하여 사용하였다. Fetal bovine serum(FBS)와 PenicillinStreptomycin는 Thermo Fisher Scientific Inc.(Waltham, MA, USA)에서 구입하여 사용하였다.
GBR 차폐막 제조. 10%(w/v)의 젤라틴과 1%(w/v)의 키토산 용액을 4:1(volume ratio)로 혼합한 후 50 oC에서 30분간 교반하였다. 어골 0 mg, 95 mg, 475 mg, 950 mg이 각각 담긴 비이커에 젤라틴과 키토산 혼합물을 각각 9.5 g씩 담고 50 oC에서 교반하였다. Petri-dish에 8.5 g씩 캐스팅한 후, 40 oC의 열 건조기에서 48시간 동안 건조하였다. 완전히 건조된 차폐막을 0.1 N NaOH 용액으로 세척한 후, 0.25%(w/v) 제니핀에 담가 24시간 동안 가교시켰다. 가교된 차폐막을 증류수로 세척하고 동결건조를 하였다.
GBR 차폐막의 물리화학적 평가. 제조한 차폐막의 표면을 관찰하기 위해 전계방사형 주사전자현미경(field emission scanning electron microscope, S-4700, HITACHI Ltd., Tokyo, Japan)을 이용하였다. 제조된 차폐막을 10×10 mm의 크기로 절단하고 Pt 코팅처리한 후 1.5 kV에서 관찰을 수행하였다. 차폐막의 Fourier transform infrared spectroscopy(FTIR) 스펙트럼은 KBr 기반 pellet 형태로 Nicolet Impact 400 FTIR spectrometer(Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 4000-600 cm-1 범위에서 얻었다.
GBR 차폐막의 팽윤도 및 용해도 평가. 제조한 차폐막을 10×10 mm의 크기로 절단하고 건조된 중량을 측정하고 15 mL의 phosphate buffered saline(PBS, 0.1 M, pH 7.4) 용액에 담근 후 37 oC로 유지하고 정해진 시간에 꺼내어 표면의 물기를 제거하고 무게를 측정하였다. 차폐막의 용해도는 팽윤도의 측정조건과 동일하게 진행하였고, 7일 간격으로 차폐막을 꺼내어 동결건조한 후 처음 동결건조와 비교하여 용해되는 경향을 평가하였다.
조골세포 성장. 제조한 차폐막을 6 mm 직경의 원형모양으로 재단하고 96 well plate의 각 well에 넣었다. MC3T3-E1 조골세포를 5×104 cell을 각 well에 분주하고 10%(v/v)의 FBS와 1%(v/v)의 penicillinstreptomycin)이 첨가된 αMEM 배지를 이용하여 37 oC, 5% CO2 조건에서 세포를 배양하였다. 세포의 증식은 cell counting kit(CCK8, Abcam plc., Cambridge, UK)를 이용하여 평가하였다. CCK8이 처리된 배양액을 microplate reader(Multiskan SkyHigh Reader, Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 460 nm에서 흡광도를 측정하였다.
Alkaline Phosphatase(ALP) 활성 평가.제조한 차폐막(6 mm 직경)을96 well plate의 well에 각각 넣고 MC3T3-E1 조골세포를 5×104 cell/well로 분주한 다음 24시간 배양 후 10 mM β-glycerophosphate, 50 μg/mL ascorbic acid를 첨가한 분화유도 배지로 교환하고 3, 7, 14일간 배양하였다. 배양액을 제거하고 PBS로 세척한 다음 0.1%(v/v) Triton X-100을 사용하여 세포막을 용해시켰다. 세포의 상층액에 0.1 N glycone과 100 mM p-nitrophenylphosphate(p-NPP)를 첨가하고 37 oC의 배양기에서 60분간 반응시키고 0.1 N NaOH를 넣어 반응 정지시킨 후 405 nm에서 흡광도를 측정하고 ALP 표준검량 곡선을 이용하여 계산하였다.
Alizarin Red S 염색 평가. 제조한 차폐막(6 mm 직경)을96 well plate의 well에 각각 넣고 MC3T3-E1 조골세포를 5×104 cell/well로 분주한 다음 24시간 배양 후 석회화를 유도하기 위해 10 mM β-glycerophosphate, 50 μg/mL ascorbic acid를 첨가한 분화유도 배지로 교환하였다. 이후 3일 마다 배지를 교체하면서 7, 14, 21일 동안 배양하였다. 배양 종료 후 배지를 제거하고 PBS로 세척한 다음 4%(v/v) formaldehyde 용액으로 실온에서 15분 동안 고정하였다. 증류수로 세척한 후 40 mM Alizarin red solution으로 실온에서 10분간 염색하였다. 염색된 세포를 증류수로 세척하고 PBS를 첨가한 다음 15분 동안 방치한 후 PBS를 제거하고 10%(w/v) cetyl- pyridimium chloride를 첨가한 10 mM sodium phosphate(pH 7.0) 용액으로 Alizarin red S를 용해한 후 570 nm에서 흡광도를 측정하였다.
통계분석. 본 실험의 결과는 평균값과 표준편차로 표기하였다. 통계 유의성은 student’s t-test로 분석하였고 통계처리 후 통계적 유의성은 p 값을 0.05이하로 설정하였다.
수산부산물 중 어골은 천연비료, 칼슘제제 등으로 재활용 되고 있다. 최근, 해양척추동물 유래 어골을 기반으로한 바이오메디컬 소재의 개발이 관심을 받고 있다. 본 연구에서는 어골을 함유한 젤라틴-키토산 차폐막을 제조하고 조골 세포의 성장과 골형성에 미치는 효과를 평가하였다.
GBR 차폐막 표면 관찰. 제조한 차폐막은 어골의 첨가량이 증가함에 따라 표면색상은 어두운 남색에서 밝은 파란색으로 변하였다(Figure 2(a)). 어골의 첨가량이 증가함에 따라 차폐막의 두께도 증가하였다. 차폐막의 표면을 전계방사형 주사전자현미경으로 관찰하였다. Figure 2(b)에서 볼 수 있듯이 어골이 포함되지 않은 차폐막의 표면은 균열과 기공이 없이 매끄러웠다. 반면에 어골이 첨가된 차폐막의 표면은 굴곡이 관찰되었고 어골의 첨가량이 증가함에 따라 굴곡이 더 많이 관찰되었다. Figure 2(c)는 어골(10% w/w)을 함유한 차폐막을 energy dispersive X-ray spectroscopy(EDS)로 분석한 이미지를 보여주고 있다. 제조한 차폐막 표면에서 Ca, P, Na가 측정되었다. 차폐막 내에 어골이 함유되어 있음을 확인할 수 있는 결과이다.
FTIR 분석. 차폐막 내 어골의 첨가에 따른 화학적 특성 변화를 FTIR을 사용하여 분석하였다(Figure 3). 젤라틴-키토산 차폐막의 스펙트럼에서는 3269 cm-1(N-H 및 O-H) 1629 cm-1 (amide I), 1540 cm-1(amide II), 1444 cm-1(amid III)의 특징적인 피크가 나타났다. 어골을 함유한 젤라틴-키토산 차폐막에서는 어골의 존재를 나타내는 PO43- 특징적인 피크가 1007 cm-1에서 확인되었다. 어골이 첨가되지 않은 젤라틴-키토산 차폐막에 비해 어골을 함유한 차폐막에서는 젤라틴과 키토산의 amine 그룹과 어골의 phosphate 그룹 간 수소결합으로 2356 cm-1 피크가 감소했다.16 또한, amine 그룹과 phosphate 그룹 간 결합에 의해 1635, 1544, 1444 cm-1의 피크가 감소하였다.17 이러한 결과는 어골을 첨가한 젤라틴-키토산 차폐막에 어골이 잘 함유되어 있었고 수소결합 상태로 존재하는 것을 확인하였다.
팽윤도와 용해도. 제조한 차폐막을 PBS에 담그고 37 oC에서 시간에 따라 물 흡수에 의한 차폐막의 무게 변화를 측정하였다. Figure 4(a)에서 볼 수 있듯이, 모든 차폐막은 PBS에서 담근 후 1시간 이내에 급격하게 팽윤되었고, 시험 후 6시간에 최대 팽윤도를 보였다. 어골의 첨가량에 따라 팽윤도는 유의한 차이를 보였다. 어골의 첨가량이 증가함에 따라 팽윤도는 낮아지는 경향을 보였다. 차폐막을 PBS 버퍼에 담근 후 7일간 무게의 변화를 측정한 결과 1일 이내에 무게의 변화가 감소한 이후 큰 변화 없이 소량 감소하는 경향을 보였다 (Figure 4(b)). 어골에 있는 칼슘(calcium)과 인(phosphate) 이온은 키토산과 젤라틴 내 COOH 또는 NH2의 기능기와 상호작용을 하기 때문에 어골의 첨가량이 증가함에 따라 팽윤도와 용해도는 감소했다.18
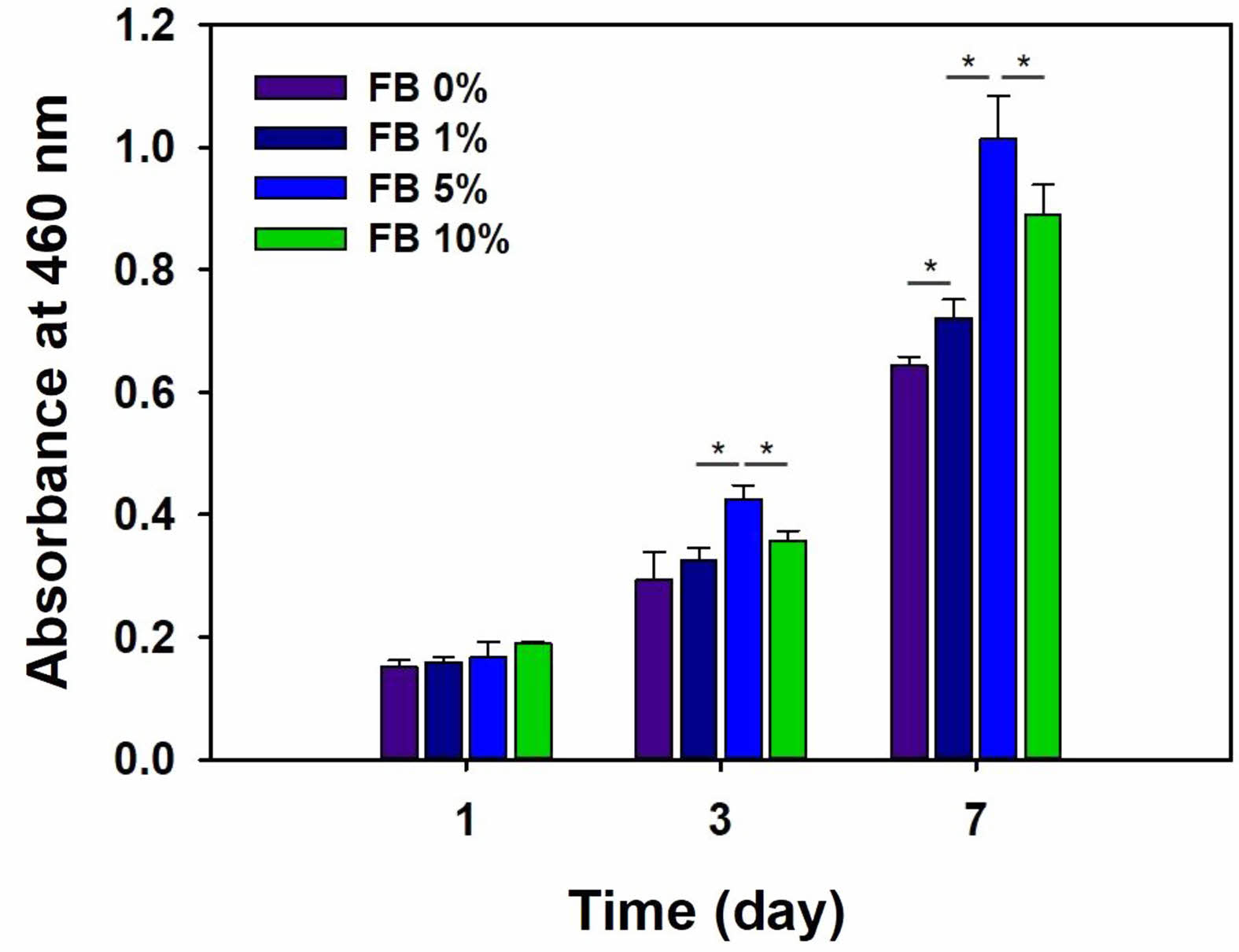
조골세포 성장. 어골을 함유한 젤라틴-키토산차폐막에서의 세포 생존과 증식을 살펴보기 위해 차폐막 위에 MC3T3-E1 세포를 분주하고 7일동안 배양한 후 세포의 생존률을 CCK-8 분석법을 이용하여 평가하였다. Figure 5에서 볼 수 있듯이 차폐막에서 MC3T3-E1 세포는 시간에 따라 성장하는 결과를 보였다. 어골을 함유한 젤라틴-키토산 차폐막에서 MC3T3-E1 세포의 성장은 어골의 첨가량이 증가함에 따라 세포의 성장은 증가했다. 테스트한 차폐막 중에서 5%(w/w) 어골을 함유한 차폐막이 유의하게 가장 많은 세포의 성장을 보였으며 세포의 confluency는 65%였다. 반면에 10%(w/w) 어골을 함유한 차폐막에서의 세포 성장은 오히려 5%(w/w) 어골을 함유한 차폐막 보다 감소했으며 confluency는 55%였다. 어골의 양이 증가하면 차폐막 내 젤라틴과 키토산의 화학적 기능기와 수소결합을 통해 기계적 강도는 증가하지만 차폐막 내부로의 세포의 부착과 증식을 감소시킬 수 있다.19 또한, 세포의 부착과 증식은 표면 거칠기, 표면 전하, 용해도, 결정도와 관련이 있다.19
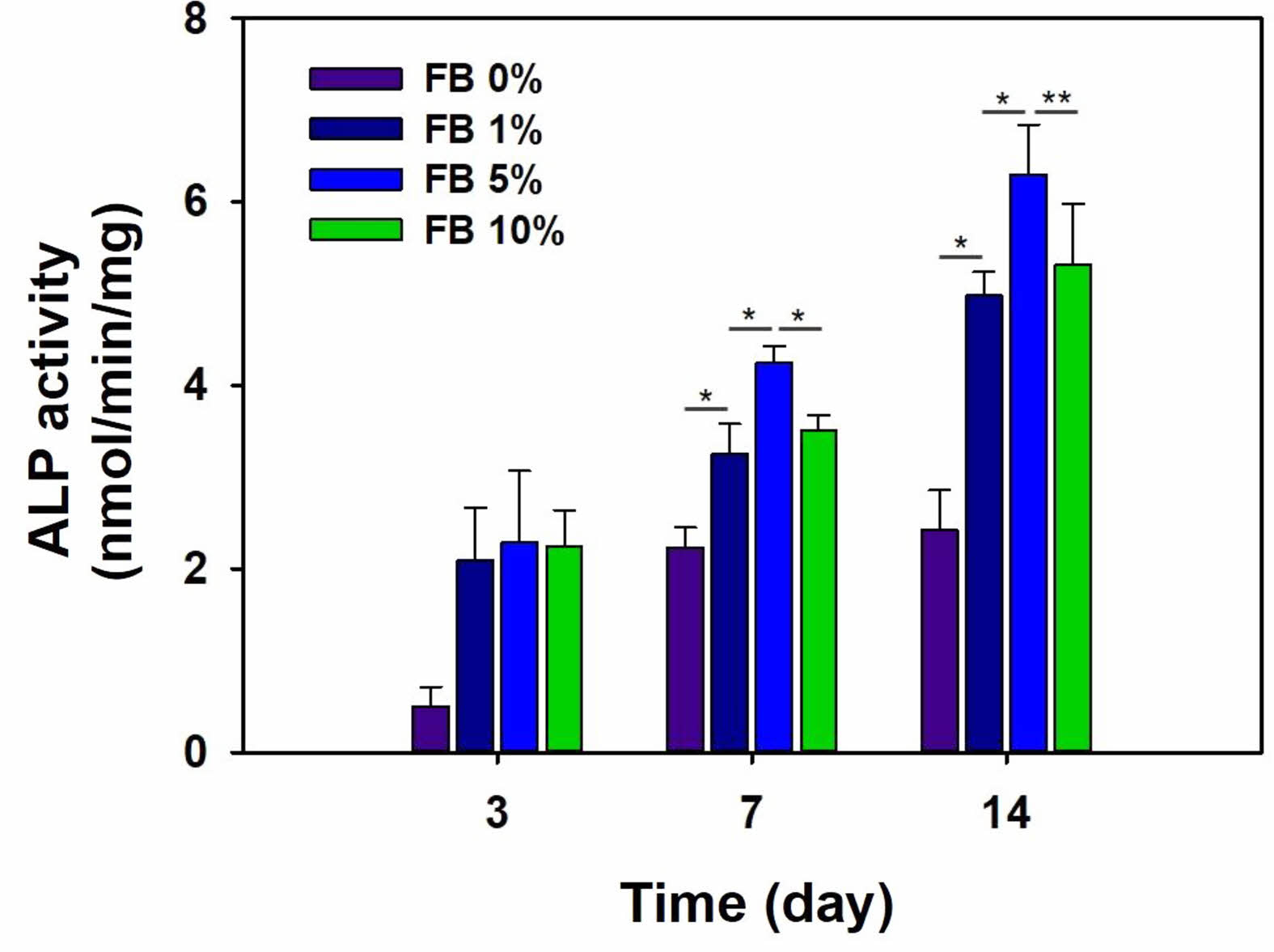
ALP 활성. 어골을 함유한차폐막이MC3T3E1 조골세포의 분화에 미치는 영향을 살펴보기 위해 염기성 인산가수분해효소 활성도 분석 실험을 수행하였다. Figure 6에서 볼 수 있듯이 어골을 함유한 차폐막에서 어골의 함량에 따라 ALP 활성이 증가하였다. 세포 배양 후 3일에는 그룹간 큰 차이를 보이지 않았고 7일과 14일 후에는 그룹 간에 유의한 차이를 보였다(*p<0.01, **p<0.05). 10%(w/w) 어골을 함유한 차폐막에서의 ALP 활성은 5%(w/w) 어골을 함유한 차폐막 보다 낮은 수치를 보였다. ALP는 칼슘과 인 대사에 관여하는 효소로 골세포 분화의 표지인자이다.20 차폐막 내 과량의 어골은 세포의 부착과 증식을 저해하고 세포의 분화에도 부정적인 영향을 준다. Sim et al.은 실크 피브로인 지지체에서 과량의 하이드록시아파타이트는 토끼 골수 유대 줄기세포의 골분화를 저해했다고 보고하였다.21
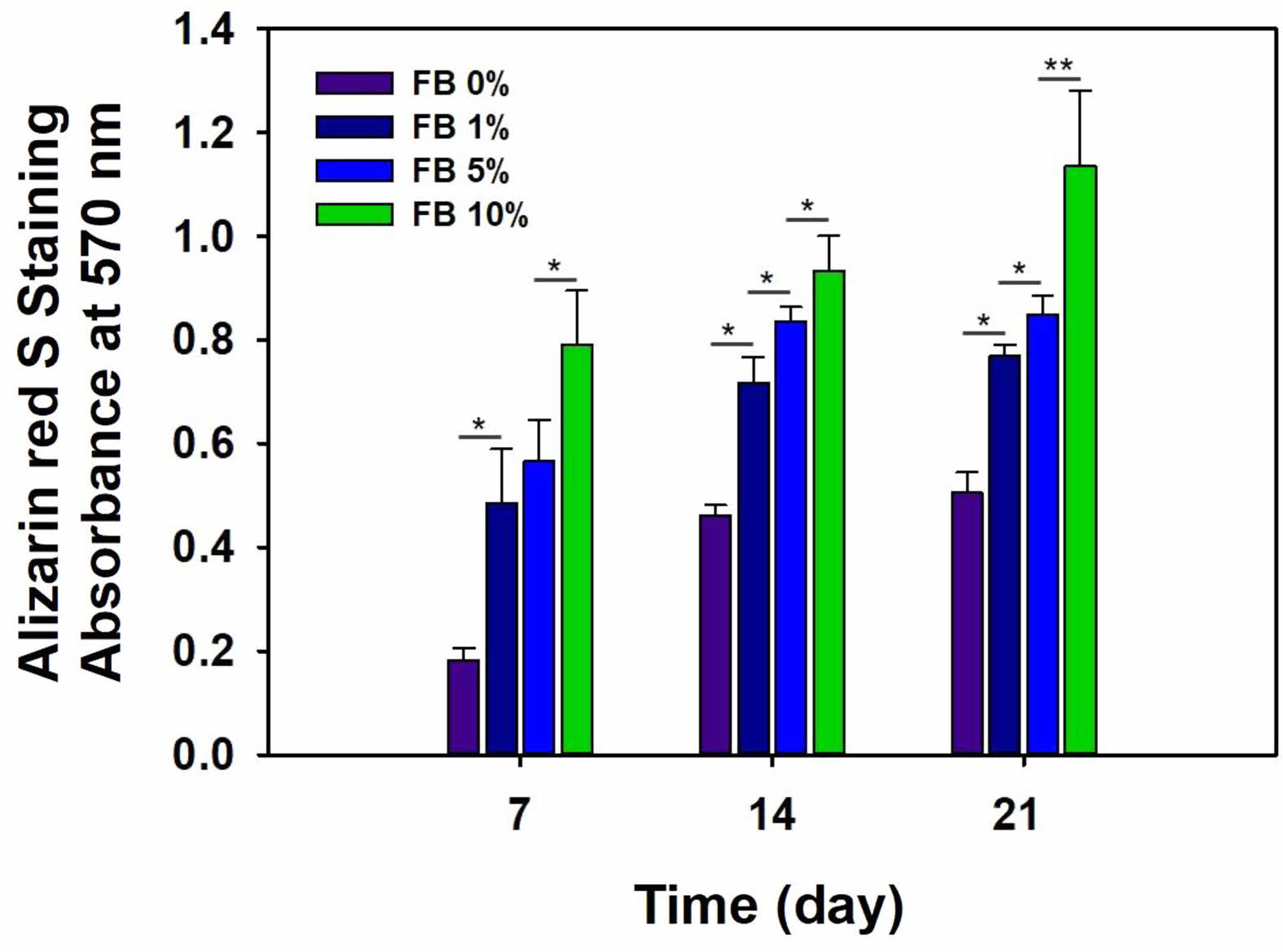
Alizarin Red S 염색. 골 형성은조골세포의 증식, 분화 및 석회화 과정을 거치며 형성된다. 어골을 함유한차폐막에 MC3T3E1 조골세포를 분주하고 배양한 후 골 분화를 확인하기 위해 Alizarin red S 염색 시험을 수행했다. Alizarin은 식물성 염료로 석회화 결정을 형성하는 세포 기질의 calcium에 특이적으로 염색되어 석회화 정도를 평가하는데 사용된다.22 Figure 7에서 볼 수 있듯이 시간이 지남에 따라 석회화 형성이 증가하였고 차폐막 내 어골의 첨가량이 증가함에 따라 석회화 정도가 유의하게 증가하였다(*p<0.01, **p<0.05). 이러한 결과는 차폐막 내에 함유된 어골이 Alizarin red S 염색에 영향을 줄 수 있다고 판단되지만 시간이 지남에 따라 석회화 결정이 증가했으므로 조골세포에 의한 석회화가 증가했다고 판단된다.
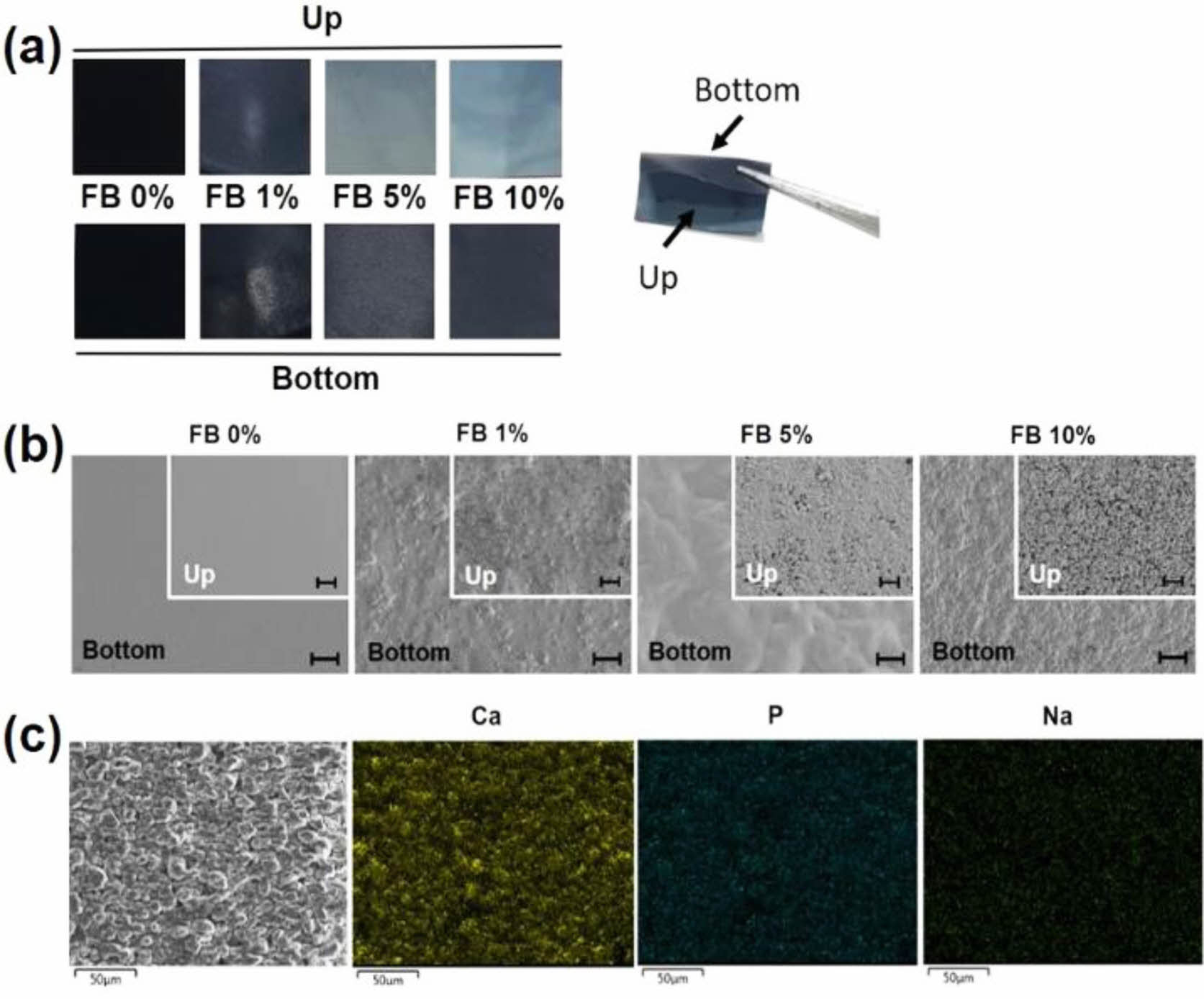
|
Figure 2 Characterization of gelatin-chitosan membrane containing different amount of fish bone (FB): (a) Photographs of gelatin-chitosan membrane containing FB; (b) field emission scanning electron microscopic images of gelatin-chitosan membrane containing FB (scale bar=40 µm); (c) energy dispersive X-ray spectroscopic images of gelatin-chitosan membrane containing FB (10% w/w). |
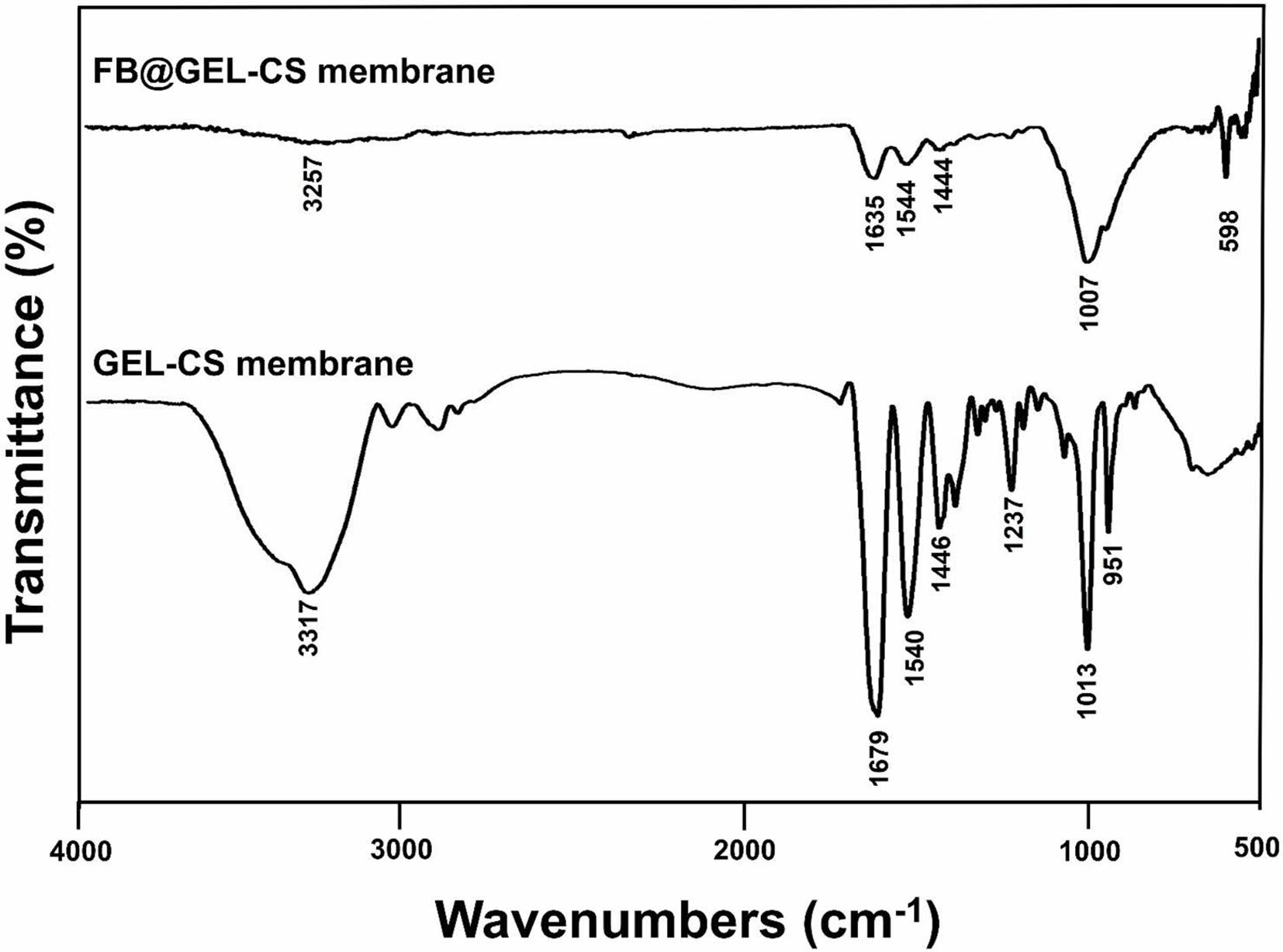
|
Figure 3 FTIR spectra of fish bone-loaded gelatin-chitosan (FB@GEL-CS) membrane and gelatin-chitosan (GEL-CS) membrane. |
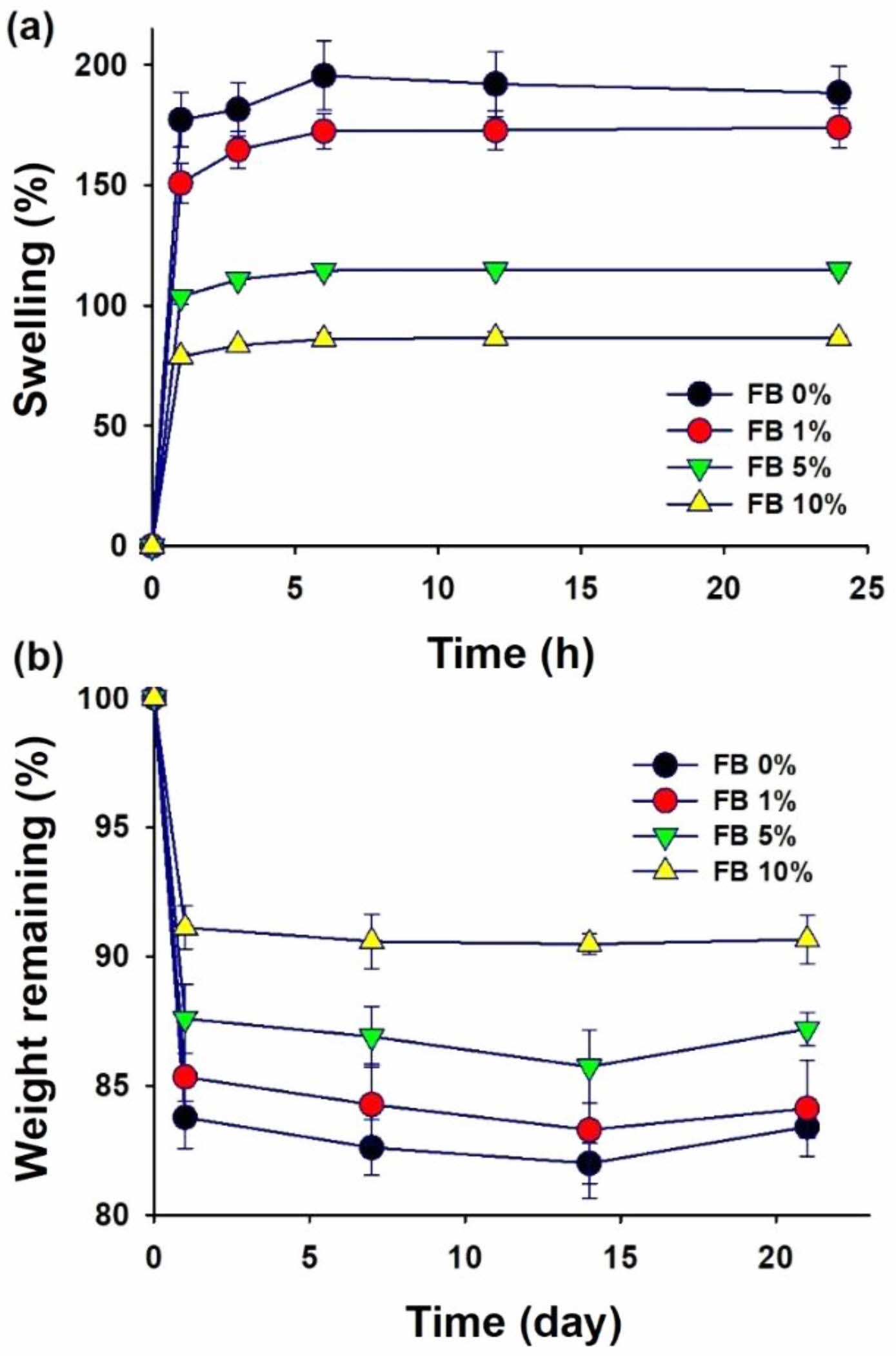
|
Figure 4 Swelling and weight remaining properties of gelatin-chitosan membrane crosslinked with genipin at various amount of fish bone (FB). |
|
Figure 5 Proliferation of MC3T3-E1 cells on gelatin-chitosan membrane containing fish bone (FB) for 7 days (*p<0.01). |
|
Figure 6 ALP activity assay of MC3T3-E1 cells on gelatin-chitosan membrane containing fish bone (FB) for 14 days (*p<0.01, **p<0.05). |
|
Figure 7 Alizarin red S staining of MC3T3-E1 cells on gelatin-chitosan membrane containing fish bone (FB) for 21 days (*p<0.01, **p<0.05). |
본 연구에서는 어골이 조골세포의 증식과 분화에 미치는 영향을 조사하기 위해 어골을 함유한 젤라틴-키토산 차폐막을 제조하였다. 어골을 함유한 차폐막을 전계방사형 주사전자현미경으로 관찰한 결과 어골의 함량이 증가함에 따라 표면이 더 거칠어지는 경향을 보였다. 젤라틴-키토산 차폐막에 어골을 첨가한 결과 조골세포의 증식과 분화에 긍정적인 영향을 주었다. 어골을 함유한 차폐막에서 증식한 조골세포의 ALP 활성과 석회화가 어골에 의해 증가하는 경향을 보였다. 따라서, 어골은 조골 세포의 증식과 골형성에 도움을 줄 수 있고 어골을 함유한 젤라틴-키토산 차폐막은 GBR 멤브레인으로 유용하다고 판단된다.
- 1. Smeets, R.; Stadlinger, B.; Schwarz, F.; Beck-Broichsitter, B.; Jung, O.; Precht, C.; Kloss, F.; Gröbe, A.; Heiland, M.; Ebker, T. Impact of Dental Implant Surface Modifications on Osseointegration. Biomed. Res. Int. 2016, 2016, 6285620.
-

- 2. Kim, J. C.; Lee, M.; Yeo, I. S. Three Interface of the Dental Implant System and Their Clinical Effects on Hard and Soft Tissues. Mater. Horiz. 2022, 9, 1387-1411.
-

- 3. Altundal, H.; Güvener, O. The Effect of Alendronate on Resorption of the Alveolar Bone Following Tooth Extraction. Int. J. Oral Maxillofac. Surg. 2004, 33, 286-293.
-

- 4. Alauddin, M. S.; Abdul Hayei, N. A.; Sabarudin, M. A.; Baharin, N. H. Barrier Membrane in Regenerative Therapy: A Narrative Review. Membranes 2022, 12, 444.
-

- 5. Kim, S. Y.; Lee, Y. J.; Cho, W. T.; Hwang, S. H.; Heo, S. C.; Kim, H. J.; Hub, J. B. Preliminary Animal Study on Bone Formation Ability of Commercialized Particle-Type Bone Graft with Increased Operability by Hydrogel. Materials (Basel) 2021, 14, 4464.
-

- 6. Moghadam, E. T.; Yazdanian, M.; Alam, M.; Tebyanian, H.; Tafazoli, A.; Tahmasebi, E.; Ranjbar, R.; Yazdanian, A.; Seifalian, A. Current Natural Bioactive Materials in Bone and Tooth Regeneration in Dentistry: a Comprehensive Overview. J. Mater. Res. Technol. 2021, 13, 2078-2114.
-

- 7. Yuan, Y.; Chesnutt, B. M.; Haggard, W. O.; Bumagardner, J. D. Deacetylation of Chitosan: Material Characterization and in vitro Evaluation via Albumin Adsorption and Pre-Osteoblastic Cell Cultures. Mater. (Basel) 2011, 4, 1399-1416.
-

- 8. Ueno, H.; Mori, T.; Fujinaga, T. Topical Formulations and Wound Healing Applications of Chitosan. Adv. Drug Deliver. Rev. 2001, 52, 105-115.
-

- 9. Kim, A. Y.; Kim, Y.; Lee, S. H.; Yoon, Y.; Kim, W. H.; Kweon, O. K. Effect of Gelatin on Osteogenic Cell Sheet Formation Using Canine Adipose-Derived Mesenchymal Stem Cells. Cell Transplant. 2017, 26, 115-123.
-

- 10. Santo, R. D.; Romanò, S.; Mazzini, A.; Jovanović, S.; Nocca, G.; Campi, G.; Papi, M.; Spirito, M. D.; Giacinto, F. D.; Ciasca, G. Recent Advances in the Label-Free Characterization of Exosomes for Cancer Liquid Biopsy: From Scattering and Spectroscopy to Nanoindentation and Nanodevices. Nanomaterials 2021, 11, 1476.
-

- 11. Georgopoulou, A.; Papdogiannis, F.; Batsali, A.; Marakis, J.; Alpantaki, K.; Eliopoulos, A. G.; Pontikoglou, C.; Chatzinikolaidou, M. Chitosan/Gelatin Scaffolds Support Bone Regeneration. J. Mater. Sci. Mater. Med. 2018, 29, 59.
-

- 12. Chang, H. H.; Yeh, C. L.; Wang, Y. L.; Fu, K. K.; Tsai, S. J.; Yang, J. H.; Lin, C. P. Neutralized Dicalcium Phosphate and Hydroxyapatite Biphasic Bioceramics Promote Bone Regeneration in Critical Peri-Implant Bone Defects. Mater. (Basel) 2020, 13, 823.
-

- 13. Akram, M.; Ahemd, R.; Shakir, I.; Ibrahim, W. A. W.; Hussain, R. Extracting Hydroxyapatite and its Precursors from Natural Resources. J. Mater. Sci. 2014, 49, 1461-1475.
-

- 14. Terzioğlu, P.; Öğüt, H.; Kalemtas, A. Natural Calcium Phosphates from Fish Bones and Their Potential Biomedical Applications. Mat. Sci. Eng. C 2018, 91, 899-911.
-

- 15. Kim, S. C.; Heo, S. Y.; Oh, G. W.; Yi, M.; Jung, W. K. A 3D-Printed Polycaprolactone/Marine Collagen Scaffold Reinforced with Carbonated Hydroxyapatite from Fish Bones for Bone Regeneration. Marine Drugs 2022, 20, 344.
-

- 16. Zhang, H.; Bhagwagar, D. E.; Graf, J. F.; Painter, P. C.; Coleman, M. M. The Effect of Hydrogen Bonding on the Phase Behaviour of Ternary Polymer Blends. Polymer 1994, 35, 5379-5397.
-

- 17. Jeong, J.; Kim, J. H.; Shim, J. H.; Hwang, N. S.; Heo, C. Y. Bioactive Calcium Phosphate Materials and Applications in Bone Regeneration. Biomater. Res. 2019, 23, 4.
-

- 18. Dan, Y.; Liu, O.; Zhang, Y. Y.; Li, S.; Feng, X.; Shao, Z.; Yang, C.; Yang, S. H.; Hong, J. Development of Novel Biocomposite Scaffold of Chitosan-Gelatin/Nanohydroxyapatite for Potential Bone Tissue Engineering Applications. Nanoscale Res. Lett. 2016, 11, 487.
-

- 19. Kodali, D.; Hembrick-Holloman, V.; Gunturu, D. R.; Samuel, T.; Jeelani, S.; Rangari, V. K. Influence of Fish Scale-Based Hydroxyapatite on Forcespun Polycaprolactone Fiber Scaffolds. ACS Omega 2022, 7, 8323-8355.
-

- 20. Samavedi, S.; Whittington, A. R.; Goldstein, A. S. Calcium Phosphate Ceramics in Bone Tissue Engineering: a Review of Properties and Their Influence on Cell Behavior. Acta Biomater. 2013, 9, 8037-8045.
-

- 21. Sim, B. R.; Kim, H. M.; Kim, S. M.; Kim, D. K.; Song, J. E.; Park, C. H.; Khang, G. Osteogenesis Differentiation of Rabbit Bone Marrow-mesenchymal Stem Cells in Silk Scaffold Loaded with Various Ratios of Hydroxyapatite. Polym. Korea 2016, 40, 915-924.
-

- 22. Hermann, J.; Gummi, M. R.; Xia, M.; van der Giet, M.; Tölle, M.; Schuchardt, M. Vascular Calcification in Rodent Models-Keeping Track with an Extend Method Assortment. Biology 2021, 10, 459.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(6): 849-854
Published online Nov 25, 2022
- 10.7317/pk.2022.46.6.849
- Received on Sep 7, 2022
- Revised on Sep 14, 2022
- Accepted on Sep 14, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Chang-Moon Lee
-
*Interdisciplinary Program of Perfume and Cosmetics, Chonnam National University, Gwangju 61186, Korea
***Department of Biomedical Engineering, Chonnam National University, Jeonnam, Yeosu 59626, Korea
****School of Healthcare and Biomedical Engineering, Chonnam National University, Jeonnam, Yeosu 59626, Korea
*****Research Center of Healthcare and Biomedical Engineering, Chonnam National University, Jeonnam, Yeosu 59626, Korea - E-mail: cmlee@jnu.ac.kr
- ORCID:
0000-0002-9119-6154









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.