- Preparation and Characterization of Blend Thermogel System for Biomedical Applications
Seo Yeong Park*,#, Thi Phuc Le*,#, Hye-Eun Shim*, **,#, Sun-Woong Kang**, ***,†
 , and Kang Moo Huh*,†
, and Kang Moo Huh*,† 
*Department of Polymer Science and Engineering, Chungnam National University,
99, Daehak-ro, Yuseong-gu, Daejeon 34134, Korea
**Research Group for Biomimetic Advanced Technology, Korea Institute of Toxicology, Daejeon 34114, Korea
***Department of Human and Environmental Toxicology, University of Science and Technology, Daejeon 34114, Korea- 바이오메디컬 응용을 위한 블렌드 써모젤 시스템의 제조 및 특성분석
*충남대학교 고분자공학과, **안전성평가연구소, ***과학기술연합대학원대학교 인체 및 환경 독성학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Thermogelling biomaterials have been extensively unitilized for diverse biomedical applications including injectable drug delivery. However, their practical uses for various applications have been limited due to their intrinsically week physical and mechanical properties and difficulty in tailor-making their properties for specific applications. To overcome these limitations with the use of typical thermogels, in this study, a series of blend thermogels have been prepared by physical mixing of poly(ethylene oxide)-poly(propylene oxide)-poly(ethylene oxide)(PEO-PPO-PEO) triblock copolymer as a representative synthetic thermogel, and hexanoyl glycol chitosan (HGC) as a natural polymer-based thermogel. Various blend thermogels with different compositions have been characterized and compared in terms of thermogelation, physicochemical properties, degradability, cytotoxicity and drug solubilization and release properties. Our blend thermogel system can demonstrate tunable thermogelling and physico-chemical properties, depending on the blend composition, extending their potential biomedical applications with customized properties.
생체 온도에 감응하여 젤화 거동을 보이는 써모젤 생체 재료는 주입형 약물전달 등 다양한 바이오메디컬 응용분야에 광범위하게 활용되어왔다. 그러나, 본질적으로 취약한 물리적 및 기계적 성질과 특정 응용을 위한 특성 조절의 어려움으로 다양한 적용에 제한이 있었다. 이러한 제한을 극복하기 위해 본 연구에서는 대표적 합성 써모젤인 poly(ethylene oxide)-poly(propylene oxide)-poly(ethylene oxide)(PEO-PPO-PEO) 삼중 블록 공중합체인 폴록사머와 천연고분자 기반 써모젤인 헥사노일 글리콜키토산(HGC)을 물리적으로 혼합하여 블렌드 써모젤을 제조하였다. 다양한 조성의 블렌드 써모젤을 제조하여 온도감응성, 물리화학적 특성, 분해성, 세포독성, 약물 가용화 및 방출 특성 측면에서 비교 분석하였다. 이러한 블렌드 써모젤 시스템은 블렌드 조성에 따라 온도감응 젤화 및 물리화학적 특성의 조절이 용이하여, 맞춤형 특성으로 바이오메디컬 응용성을 보다 확장할 수 있을 것으로 기대된다.
A series of blend thermogels have been prepared by physical mixing of poly(ethylene oxide)-poly(propylene oxide)-poly(ethylene oxide) triblock copolymer as a representative synthetic thermogel, and hexanoyl glycol chitosan as a natural polymer-based thermogel. Our blend thermogel system can demonstrate tunable thermogelling and physico-chemical properties, depending on the blend composition, extending their potential biomedical applications with customized properties.
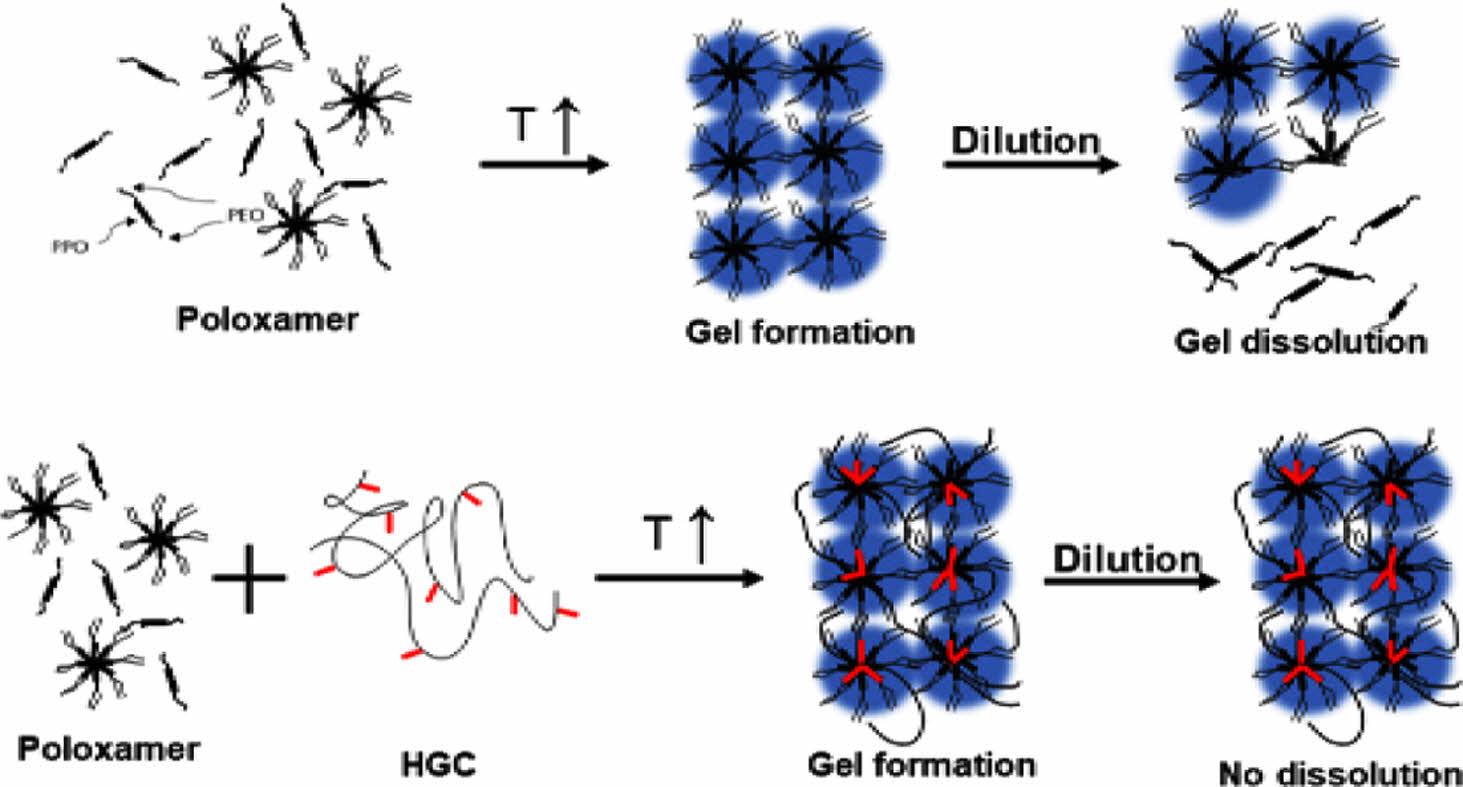
Keywords: thermogel, poloxamer, hexanoyl glycol chitosan, blend, sol-gel transition, customized properties.
본 연구는 한국연구재단의 기초연구실지원사업(NRF-2022R1A4A1028372)과 정부(과학기술정보통신부, 보건복지부)의 재원으로 (재)범부처재생의료기술개발사업단의 지원을 받아 수행된 연구결과입니다(22A0105L1-11).
저자들은 이해상충이 없음을 선언합니다.
써모젤은 생체 온도에 반응하여 가역적 졸-젤 상전이를 보이는 온도감응성 하이드로젤로서,1,2 일반적으로 상온에서는 수용액 상으로 존재하나, 생체 온도에서는 소수성 상호작용의 증가로 인한 가역적 젤화 현상을 보인다.3 온도에 의해 유도되는 물리적 가교의 특성을 갖기 때문에 화학적 가교제나 유기 용매의 사용 없이 젤화가 가능하며,4 주입형 제형으로서 최소 침습 방식으로 필요한 부위에 직접적으로 투여 및 적용될 수 있다.5-7 따라서, 이러한 다양한 장점으로 써모젤은 약물전달 시스템,8,9 상처치료,10 조직공학11,12 등의 다양한 메디컬 응용분야에서 활발히 적용되고 있다. 생체재료 분야에서 활용되고 있는 주요 써모젤 고분자로는 poly(ethylene oxide)(PEO)와 poly(propylene oxide)(PPO)의 삼중블록 공중합체인 폴록사머(PEO-PPO-PEO), 그리고 PEO와 생분해성 고분자인 polylactide (PLA), poly(lactide-co-glycolide)(PLGA), polycaprolactone(PCL) 등의 블록 공중합체 유도체들 등 주로 PEO 블록 공중합체 구조의 합성고분자이다.8,9
써모젤은 구성하는 고분자의 화학적 구조와 농도에 의존하는 특이한 졸-젤 상전이 온도를 갖는다. 이러한 온도감응성 젤화 거동을 보이기 위해서는 수용액 상에서 최소한의 고분자 농도(최소젤화농도)를 필요로 하며, 이는 형성되는 써모젤의 물성 및 안정성에 큰 영향을 미친다.7,13,14 화학적 가교보다 상대적으로 약한 물리적 가교의 특성 및 최소젤화농도의 한계로 인해 써모젤은 일반적으로 최소젤화농도 이하의 수성 환경에서는 수 시간 안에 써모젤이 용해되는 낮은 물리적 안정성을 보인다는 본질적인 단점이 있다.15 대표적인 써모젤인 폴록사머의 경우 우수한 생체적합성과 온도감응성으로 다양한 생체재료 응용분야에 활용되고 있는 반면, 높은 젤화농도(20 wt% 이상), 낮은 젤 안정성, 비분해성, 및 생체 내 부작용 등의 제한이 여전히 존재하여 다양한 응용 분야에 요구되는 특성을 모두 충족시키기에는 어려움이 있다.16-23
한편, 최근 연구에서 천연고분자 기반의 써모젤은 기존 합성고분자 기반의 써모젤과 비교하여 상이한 특성과 장점을 갖는 것으로 보고되고 있다. 수용성 키토산 유도체로 알려진 글리콜키토산의 아실화 반응으로 개질된 아실 글리콜키토산은 소수성 아실기의 존재에 기인하여 졸-젤 상전이 거동을 보일 수 있는 새로운 형태의 써모젤이다.24 이러한 아실 글리콜키토산 써모젤은 아실기의 종류와 치환율에 따라 온도감응성 및 물성의 조절이 용이하며, 특히 2-7 wt%의 낮은 최소젤화농도의 특성과 함께, 수 일에서 수 개월 이상의 넓은 스펙트럼의 물리적 안정성을 보일 수 있다. 또한 높은 분자량에 기인하여 상대적으로 낮은 농도에서도 높은 점도를 보이고, 우수한 접착 및 코팅 특성을 가질 수 있다. 따라서, 기존의 합성고분자 써모젤로는 적용이 어려웠던 다양한 3차원 세포배양, 주입형 조직공학, 점막 부착성 약물전달 등 여러 새로운 바이오메디컬 분야에 활용이 가능할 수 있다. 반면, 폴록사머 써모젤에 비해 상대적으로 높은 점도, 넓은 범위의 온도감응성 및 낮은 기계적 물성 등은 활용성을 제한시킨다.
본 연구에서는 기존 써모젤이 갖는 본질적인 특성의 한계를 극복하기 위한 방법으로 두가지 상이한 특성을 갖는 써모젤 조성물들의 물리적 혼합에 의해 제조된 블렌드 써모젤 시스템을 제시하였다. 블렌드 써모젤 시스템은 단독의 써모젤의 사용으로 구현이 어렵거나 부족한 특성을 보완시켜 줄 수 있을 뿐 아니라, 블렌딩 조성의 조절을 통해서 특정 응용에 적합할 수 있도록 물성, 생체적합성, 생분해성, 약물방출 특성 등 다양한 측면에서 최적화 및 시너지 효과를 보일 수 있을 것으로 기대 된다.16,17 본 실험에서는 블렌드 써모젤 제조를 위해 합성 고분자 기반의 폴록사머와 천연 고분자 기반의 아실 글리콜키토산을 선택하였다. 폴록사머는 친수성 고분자인 PEO와 소수성 고분자인 PPO로 구성된 양친매성 PEO-PPO-PEO로 이루어진 삼중 블록 공중합체 고분자인 P407을 사용하였다.18 천연고분자 기반의 아실 글리콜키토산 써모젤로는 헥사노일 글리콜키토산(hexanoyl glycol chitosan, HGC)을 사용하였다. HGC 써모젤은 고분자의 농도, 헥사노일기의 치환율 등의 변화를 통해 온도 감응성의 조절이 용이하고, 점막 부착성 및 다양한 생기능성을 보이는 것으로 알려져 있다.25,26 또한 기존 연구에서 소량의 HGC의 첨가가 취약한 폴록사머 써모젤의 안정성을 향상시키는 것에 기여할 수 있음이 밝혀졌다.27 기존 써모젤 연구 결과들을 바탕으로, 본 연구에서는 폴록사머와 HGC에 기반하여 다양한 조성의 블렌드 써모젤을 제조하여 조성에 따른 온도감응성, 물리화학적 특성, 분해성 및 약물 방출 특성 등의 변화를 비교하였다. 이러한 블렌드 써모젤 시스템은 조성의 변화를 통해 온도감응성 및 다양한 물리화학적 특성의 맞춤형 조절이 가능하여 기존 써모젤의 응용성을 보다 확장할 수 있는 유용한 방법으로 기대된다.
재료. 글리콜키토산(GC)(DP³400)은 Wako Pure Chemical Industries(Osaka, 일본)에서 구입하였고, 폴록사머(P407)와 hexanoic anhydride(97%)는 Sigma-Aldrich(St. Louis, MO, 미국)에서 구입하였다. 용매인 PBS는 GibcoTM(Thermo Fisher Scientific, 미국)에서 구입한 Dulbecco’s phosphate buffered saline를 사용하였다. 합성 과정을 위해 사용한 유기 용매인 메탄올과 아세톤은 (주)삼전화학(한국)에서 구입하였다.물은 3차 증류수를 사용하였고, 그 외 다른 시약들은 별도의 정제 과정 없이 사용하였다. 투석막(molecular weight cutoff:12-14 kDa)은 Spectrum Laboratories(미국) 제품을 사용하였다.
헥사노일 글리콜키토산(HGC) 합성 및 분석. Scheme 1과 같이 이미 보고된 실험 방법에 따라 HGC를 합성하였다.26 물과 메탄올 1:1 혼합 용매 750 mL과 GC 3 g을 교반시켜 24시간 동안 녹인 후, hexanoic anhydride 1.106 mL를 첨가하여 아실화 반응을 진행하였다. 24시간 후 반응된 용액을 아세톤에 침전시킨 후 4 ℃의 냉장고에 24시간 동안 보관하였다. 투석막(MWCO, 12-14 kDa)을 사용하여 침전 물질을 3차 증류수에 48시간 동안 투석한 후, 3-4일간 동결건조하여 파우더 형태의 HGC를 얻었다.
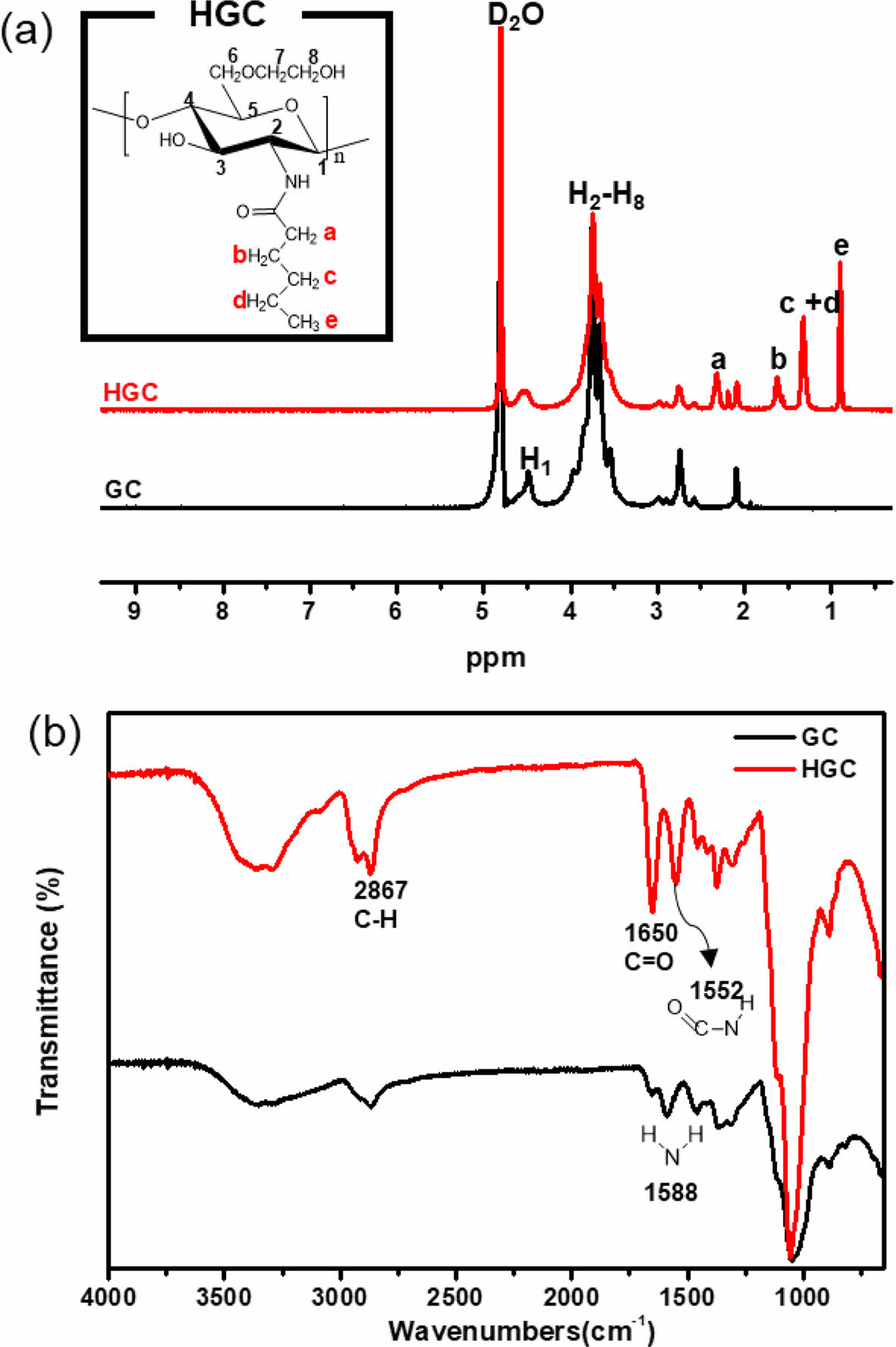
합성한 HGC의 화학적 조성을 1H NMR과 ATR-FTIR분석을 통해 확인하였다. AVANCE Ⅲ 600 spectrometer(Bruker, 독일)을 사용하여 1H NMR스펙트럼을 얻었으며 분석용 샘플은 0.5 wt%로 D2O 용매를 사용하여 분석하였다. ATR-FTIR(Nicolet iS 5, Thermo Scientific, 미국)은 분해능 2 cm-1으로 32번 스캔하여 결과를 얻었다.
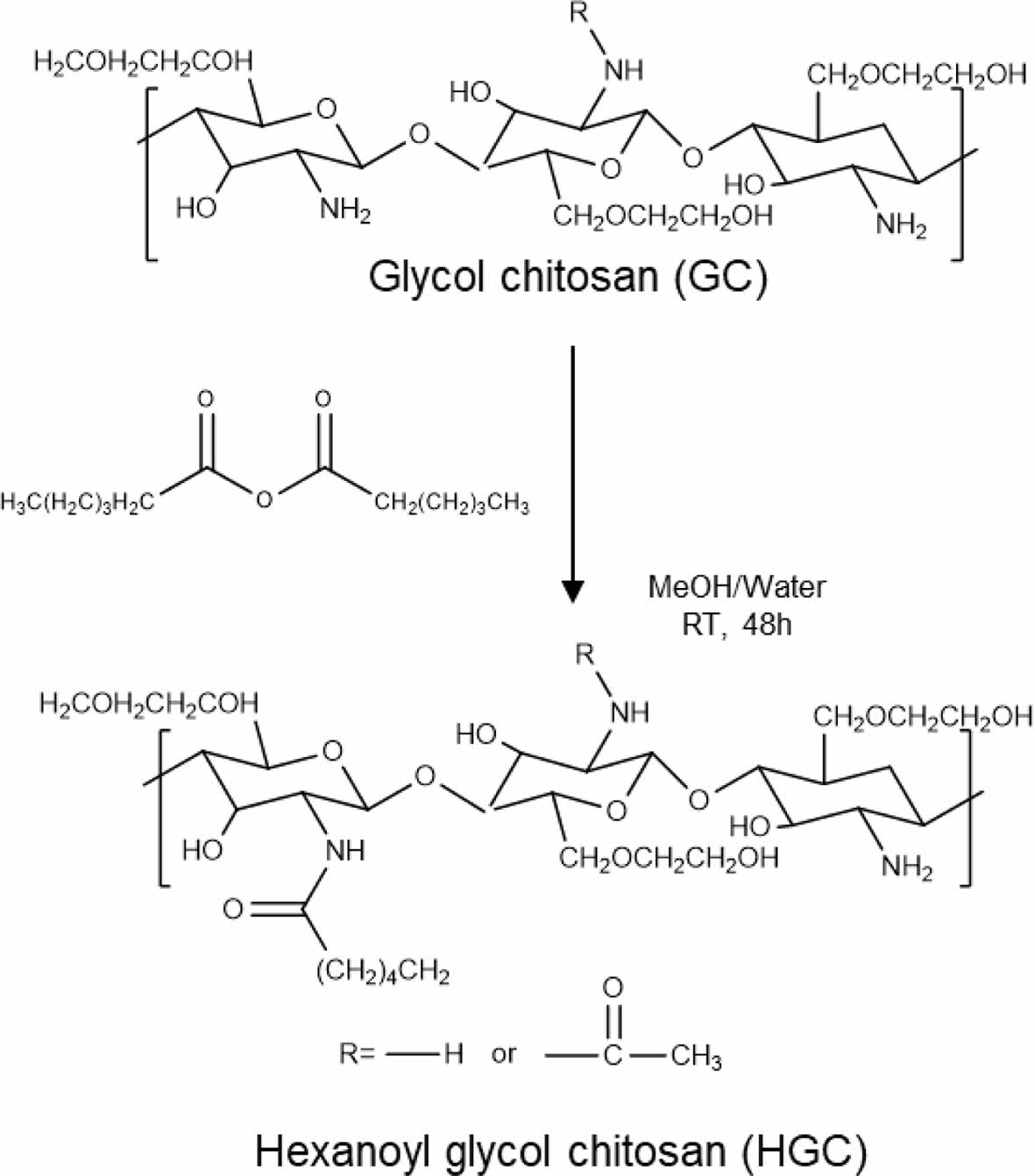
Scheme 1. Synthetic procedure of hexanoyl glycol chitosan.
HGC/P407 블렌드 써모젤의 제조. PBS 용매를 사용하여 상온에서 수용액 상태인 HGC(4 wt%)와 P407(20 wt%) 써모젤을 각각 제조하였다. 제조된 써모젤 수용액들을 5 mL 바이알에 다양한 조성비(HGC/P407 = 0.8/0.2, 0.6/0.4, 0.5/0.5, 0.4/0.6, 0.3/0.7, 0.2/0.8, 0.1/0.9, v/v)로 혼합하여 블렌드 써모젤을 제조하였다. 제조된 블렌드 써모젤의 성상을 단독 써모젤인 HGC, P407과 육안으로 비교하였다.
졸-젤 상전이 온도 측정. Tube-inverting 방법을 사용하여 합성된 HGC, P407 및 블렌드 써모젤의 졸-젤 상전이 온도를 육안으로 관찰하였다. 각각의 써모젤 1 mL를 5 mL 바이알에 넣고 0.5 ℃/min의 속도로 승온하면서 20 ℃에서 37 ℃까지 졸-젤 상전이 거동을 관찰하였다. 졸-젤 상전이는 바이알을 뒤집었을 때 1분간 흐름이 관찰되지 않을 때 젤 상태로, 흐름이 관찰되면 졸 상태로 기준하였다.
온도에 따른 유변학적 특성 및 점도 변화 측정. 고분자 수용액의 온도에 따른 유변학적 거동과 점도 변화를 관찰하기 위해 레오미터(HR-10 Rheometer, TA Instruments, New Castle, DE, 미국)를 사용하여 분석하였다. 시료는 1 mm 간격을 두고 있는 직경 60 mm의 두 평판 사이에 놓았으며 승온 속도 0.05 ℃/sec, 온도범위 10-50 ℃에서 진동수를 1 Hz로 놓고 1.5 Pa의 힘을 일정하게 고정하여 측정하였다.
써모젤 안정성 평가. 다양한 조성의 HGC/P407 블렌드 써모젤을 5 mL 바이알에 0.6 mL씩 준비하여 37 ℃가 유지되는 인큐베이터에 정치하여 젤화를 유도하였다. 30분 후에 같은 온도의 PBS를 2 mL씩 각각의 바이알에 넣어 다시 인큐베이터에 보관하였으며, 3, 6, 12, 24시간, 그 다음은 하루 간격으로 젤이 다 용해될 때까지 PBS를 교환하였다. PBS를 교환하기 직전에 써모젤의 잔류 무게를 측정하였다. 측정된 잔류 무게를 초기 무게와의 비를 백분율로 환산하여 시간에 따른 잔류량(%)을 다음과 같은 식으로 구하였다.
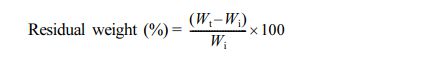
여기서 Wi는 써모젤의 초기 무게이고, Wt는 시간의 따른 써모젤 샘플의 무게이다.
생분해성 분석. 분해효소인 리소자임(lysozyme, 10 mg/mL)이 포함된 PBS를 이용하여 HGC/P407 블렌드 써모젤의 생분해성 평가를 진행하였다. 각각의 샘플들은 5 mL 바이알에 0.6 mL씩 준비하였다. 37 ℃의 인큐베이터에 각 샘플들을 보관하였으며 젤화가 일어난 이후 무게를 측정하였다. 무게 측정 후 각 써모젤 샘플들에 리소자임을 포함하는 PBS 용액 2 mL을 넣어주고 3, 6, 12, 24, 48시간 후에 써모젤의 무게를 측정한 후, 같은 양의 새로운 PBS를 넣어주었다. 시간에 따른 써모젤의 잔류량(%)를 구하여 서로 비교하였다.
약물 가용화능 평가. HGC/P407 블렌드 써모젤 조성물의 가용화능을 고분자 수용액상에서 소수성 모델 약물인 덱사메타손(dexamethasone, DEX, Strealoids, 미국)의 용해도 변화를 통해 관찰하였다. 용매는 PBS 용액(pH 7.4)을 사용하였으며, 각각의 써모젤 샘플에 10 mg/mL의 DEX를 넣어 상온에서 30분간 교반을 통해 분산시켰다. 이 후 샘플들을 37 ℃ 인큐베이터에 24시간동안 100 rpm하에서 약물을 용해시켰다. 24시간 후에 0.8 μm의 syringe filter를 이용하여 용해되지 않은 약물을 제거하였다. 여과된 수용액 샘플을 UV-visible spectrophotometer(SINCO, 한국)를 사용하여 242 nm 파장에서 흡광도를 측정함으로써 가용화된 약물의 농도를 분석하였다.
In vitro 약물 방출. 다양한 조성의 블렌드 써모젤의 약물방출 특성을 비교하기 위해 투석막을 사용하여 37 ℃의 PBS(pH 7.4)에서 방출실험을 진행하였다. 모델 약물인 소수성 DEX과 이의 친수성 형태인 dexamethasone phosphaste disodium salt(DSP, Farmabios, 이탈리아)를 각각 1 wt% 농도로 제조하여 대조군으로 사용하였다. 그리고 이와 동일한 DEX 약물 농도를 함유한 다양한 조성의 HGC/P407 블렌드 써모젤 샘플들을 준비하였다. 준비한 샘플을 각각 0.7 mL씩 투석막(MWCO, 12-14 kDa, width: 10 mm)에 넣은 후 50 mL PBS에 담그고 37 ℃, 100 rpm의 항온조(SI-600R, Jeio Tech, Seoul, 한국)에서 방출 실험을 진행하였다. 정해진 시간 간격으로 PBS를 수거하고, 다시 새로운 PBS로 채워주었다. 시간에 따라 수거된 PBS를 UV-vis 분석을 통해 DEX의 방출량을 측정하였다. 실험은 3번 반복 수행되었으며 데이터는 평균 ± SD로 표시되었다.
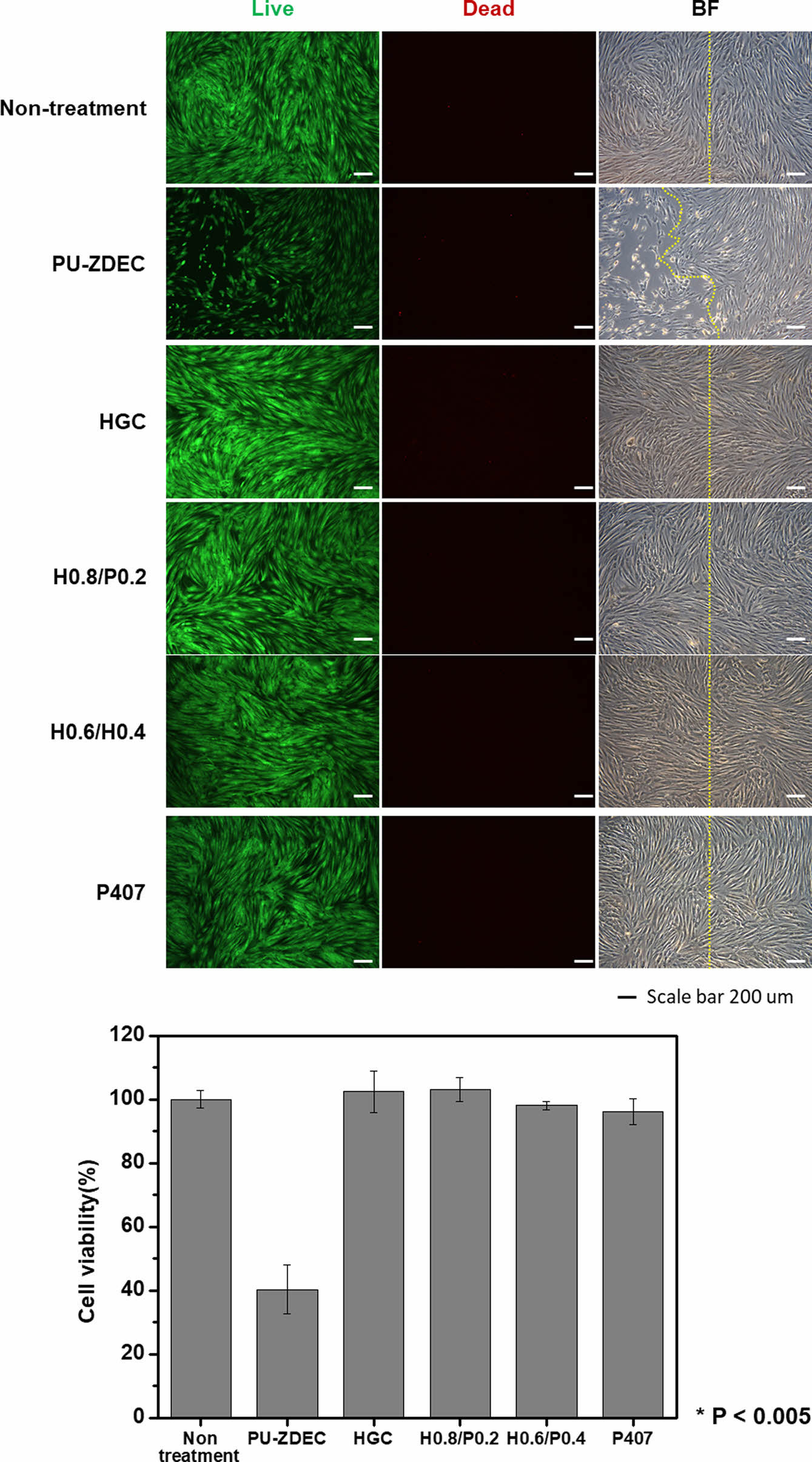
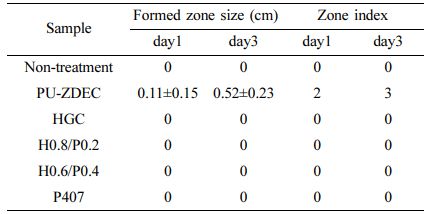
세포독성 평가. 써모젤 사용 시 인체에 노출되는 잠재적인 위해성을 예측하기 위해 국제표준화기구 규정(International Organization for Standardization(ISO), ISO 10993-5)에 근거하여 직접접촉 세포독성 평가를 실시하였다. 독성평가를 위해 인간 섬유아세포를 2×105 cells/well의 농도로 세포배양접시에(6-well, Corning, 미국) 접종 후 2일간 세포배양기(37 ℃, CO2 5%)에서 배양하였다. 배양 2일 후에 세포층에 검사시료를 직접 위치하도록 하기위해 써모젤(1×1 cm2)을 배양접시의 중앙에서 세포와 접촉하도록 한 후 3일 동안 배양하였다. 양성 대조군으로 세포 독성을 보이는 0.1%의 zinc diethyldithiocarbamate를 포함하는 polyetherurethane(PU-ZDEC, Hatano Research Institute, 일본)의 필름을 사용하였다. 배양 1일 후에 생존/사멸 분석(Live-Dead assay)(Invitrogen, L3224, 미국)을 시행하여 형광도립현미경(DMi8, Leica, 독일)을 통해 관찰하였고, 고분자와 접촉 1일과 3일에 세포관찰을 위해 헤마톡실린(HemaMAX, BBC Biochemical, 미국)으로 염색하였다. 독성반응 영역의 크기를 ImageJ 소프트웨어를 사용하여 계산하였고 독성의 정도를 분류하였다(Table 2).
HGC 고분자 합성 및 분석. GC의 N-아실화 반응을 통해 HGC 써모젤을 합성하였다. 합성된 HGC의 합성결과를 1H NMR과 ATR-FTIR 분석을 통해 확인하였다. Figure 1(a)는 헥사노일기의 도입을 확인하기 위하여 GC과 HGC의 1H NMR 분석결과를 비교하여 보여주고 있다. GC의 경우, glycopyranosyl 고리의 H2-H8에 해당하는 특성 피크가 δ=3.5- 3.9 ppm 범위에서 관찰되는 반면, HGC의 스펙트럼의 경우 도입된 헥사노일기의 메틸 그룹과 메틸렌 그룹에 해당하는 수소 특성 피크가 δ=0.9 ppm, δ=1.3 ppm, δ=1.6 ppm, δ=2.3 ppm에서 각각 확인될 수 있다. 헥사노일기에 대한 치환도(degree of hexanoylation)는 1H NMR 스펙트럼 상에서의 헥사노일기의 수소 적분 값과 GC의 glucopyranosyl 고리의 수소 적분 값을 비교하여 35.8%로 계산되었다. 기존의 합성된 HGC와 유사한 결과를 얻을 수 있었다. HGC 합성은 Figure 1(b)의 ATR-FTIR 분석결과를 통해서도 확인될 수 있었다. GC와 HGC의 경우 하이드록실기의 신축진동과 N-H의 신축진동에 기인한 특성 피크가 두 스펙트럼에서 모두 3300 cm-1 부근에서 넓게 관찰된 반면, HGC의 경우에는 2890 cm-1 부근에서 헥사노일 그룹에 존재하는 메틸기(-CH3)와 메틸렌 (-CH2-)의 C-H 신축진동에 의해 특성피크가 나타나는 것으로 관찰되었다. 또한, GC와 비교하여 헥사노일기의 도입을 위한 아실화 반응 후, 1차 아민의 굽힘 진동피크(1552 cm-1)이 감소한 반면, 아마이드기의 굽힘 진동피크(1588 cm-1)와 카보닐기의 신축 진동(1650 cm-1)이 뚜렷이 나타남을 관찰할 수 있었다.
블렌드 써모젤의 제조 및 졸-젤 상전이 온도. 대표적인 합성 써모젤인 P407과 천연 고분자 기반 써모젤인 HGC를 물리적으로 혼합하여 다양한 조성의 HGC/P407 블렌드 써모젤을 제조하였다(Scheme 2). 두 써모젤 수용액들의 다양한 혼합 조성에서 얻어진 HGC/P407 블렌드 써모젤의 특성과 졸-젤 상전이를 육안으로 관찰한 결과를 Table 1에 정리하였다. HGC써모젤과 HGC의 혼합비율이 높은 블렌드 써모젤(H0.8/P0.2, H0.6/P0.4)의 경우 투명하고 균일한 수용액이 얻어진 반면, P407의 조성비가 50% 이상 증가된 혼합물(H0.5/P0.5, H0.4/P0.6, H0.3/P0.7, H0.2/P0.8)에서는 투명한 수용액 내 젤 입자 형성이 육안으로 뚜렷이 관찰되었다. 이는 아민 그룹의 존재로 인해 양이온성을 갖는 HGC와 P407의 약한 음전하성을 갖는 PEO블록 사이에서의 정전기적 상호작용에 기인하여 젤 입자 형성이 유도된 것으로 사료된다.29 P407의 조성비가 높은 H0.1/P0.9에서는 이러한 젤 입자 형성이 더 이상 관찰되지 않았고, 다시 투명하고 균일한 수용액 혼합물이 관찰되었다. Figure 2는 5 ℃와 37 ℃에서의 HGC/P407 블렌드 써모젤을 보여주고 있다. 투명하고 균일하게 혼합된 블렌드 써모젤의 경우 저온에서는 모두 투명한 수용액상으로 존재하였으나, 37 ℃에서는 젤화되어 흐름성이 없는 고체상으로 변화된 것을 관찰할 수 있었다. 반면, 젤 입자 형성이 관찰된 혼합물의 경우 이러한 온도감응성 젤화 거동이 관찰되지 않았다. 이는 수용액 내 대부분의 써모젤 고분자가 고형 젤 입자 형성에 참여함으로써 남아 있는 고분자의 농도가 최소젤화농도에 미치지 못해 나타난 결과로 사료된다. 폴록사머의 경우 최소젤화농도는 17 wt%로 알려져 있다.27 따라서, 향후 실험에서는 균일하고 투명한 혼합물의 형태를 갖는 블렌드 써모젤 H0.8/P0.2, H0.6/P0.4, H0.1/P0.9에 대해서 단일 써모젤인 HGC와 P407과의 비교 분석을 진행하였다.
Tube inverting 방법에 의한 졸-젤 상전이 온도의 측정결과, 34 ℃에서 P407 20 wt% 써모젤은 23 ℃에서 졸-젤 상전이 거동이 관찰되었다. 블렌드 써모젤인 H0.8/P0.2, H0.6/P0.4 및 H0.1/P0.9은 HGC와 P407의 두 젤화 온도 사이 범위인 30 ℃, 27 ℃, 25 ℃에서 각각 상전이 거동이 관찰되었다. 예상한 바와 같이 더 낮은 온도에서 젤화 온도를 갖는 P407의 조성이 증가할수록 블렌드 써모젤의 젤화온도가 감소하는 경향을 보였다. 따라서, 본 결과를 통해 서로 다른 젤화 온도를 갖는 써모젤들의 혼합을 통해 제조된 블렌드 써모젤은 특정 응용에 적합한 졸-젤 전이 온도를 구현할 수 있도록 조절 가능하다는 것을 보여준다.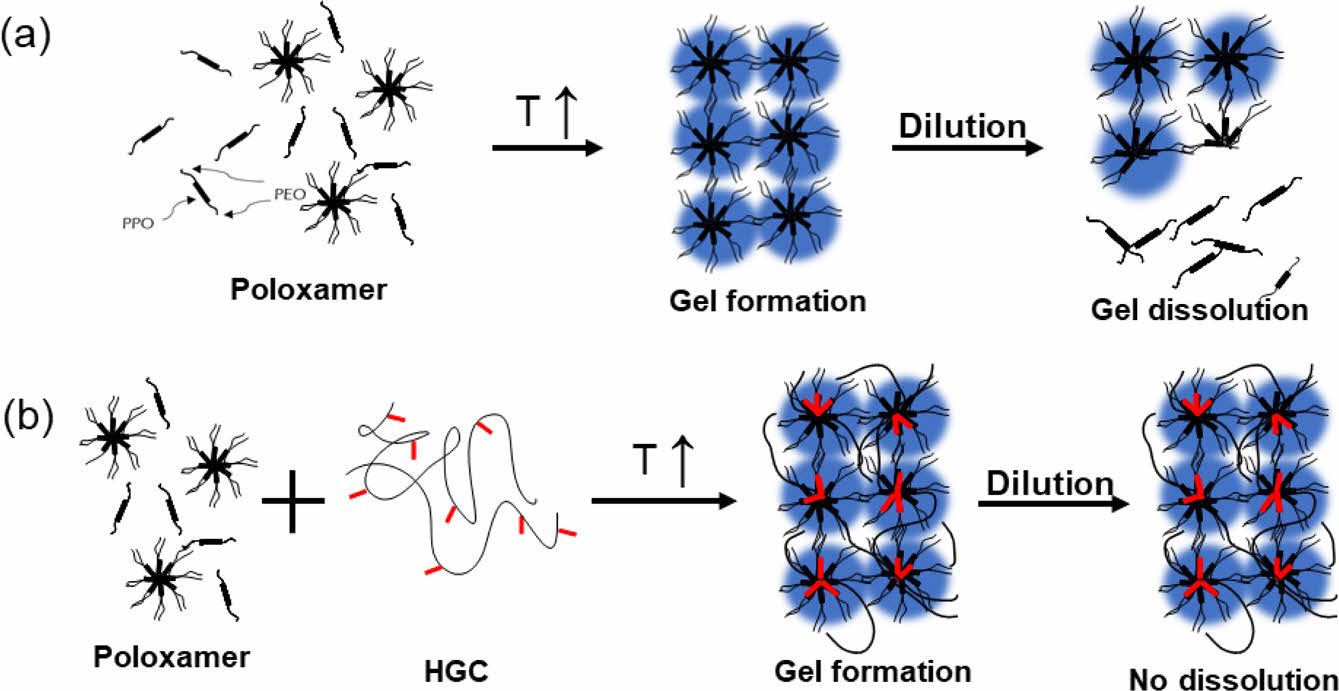
Scheme 2. Schematic illustration of (a) thermogelation of poloxamer; (b) HGC/Poloxamer blend.
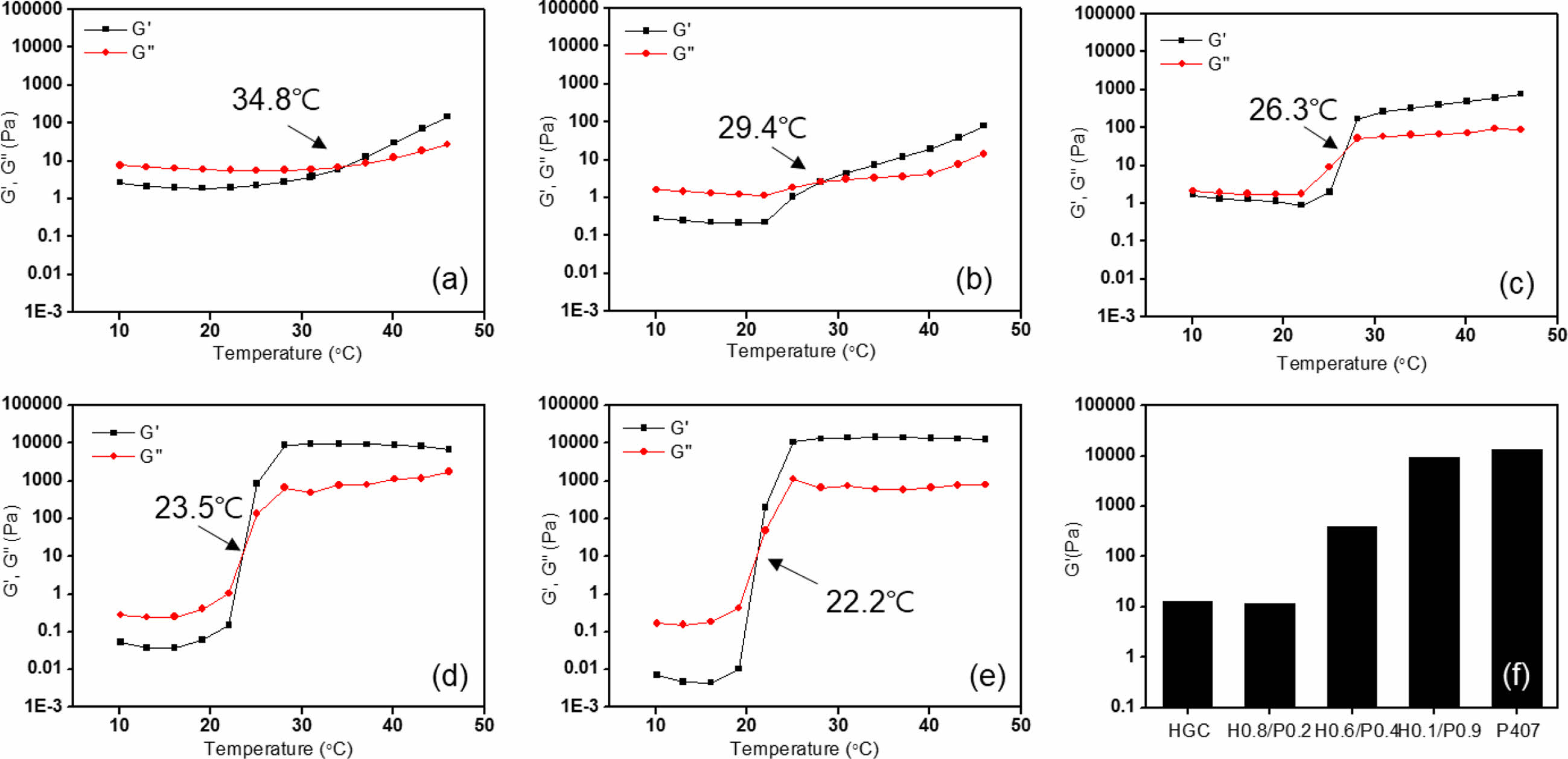
온도에 따른 유변학적 특성과 점도 변화 측정. 레오미터를 사용하여 다양한 조성의 HGC/P407 블렌드 써모젤의 유변학적 특성을 측정하였다(Figure 3). 모든 써모젤에서 온도 상승에 의한 젤화 현상에 기인하여 저장 탄성률(G’)이 특정 온도 부근에서 급격히 증가하여 손실 탄성률(G’’)를 교차하는 현상을 관찰할 수 있었다. 이러한 교차점으로 측정된 써모젤 및 블렌드 써모젤의 졸-젤 상전이 온도는 tube inverting 방법으로 측정한 온도 값과 유사하였다. Figure 3(f)는 각 단일 써모젤과 블렌드 써모젤 샘플들의 37 ℃에서의 저장 탄성률 값들을 비교한 그래프이다. P407의 경우 높은 고분자 농도(20 wt%)에 기인하여 가장 큰 탄성률을 보인 반면, 가장 낮은 농도(4 wt%)인 HGC 써모젤의 경우 상대적으로 가장 낮은 탄성률을 보였다. 한편, 블렌드 써모젤 샘플들의 경우 조성비에 의존하여 P407과 HGC사이의 탄성률을 보이는 것으로 관찰되었다. 따라서, 블렌드 써모젤의 물성은 혼합 조성의 변화를 통해 조절 가능함을 알 수 있었다.
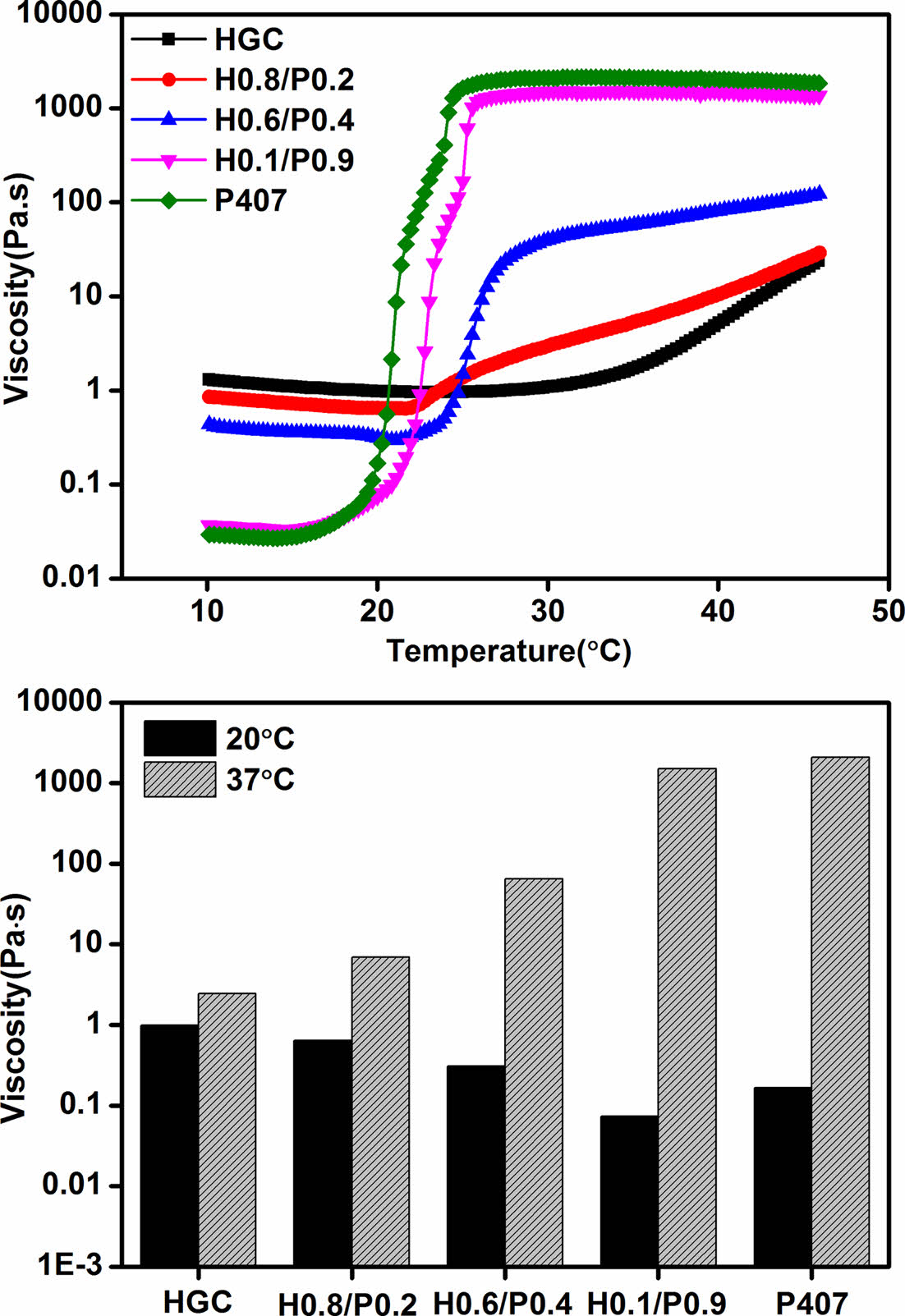
Figure 4는 온도에 따른 써모젤의 점도 변화를 관찰한 결과이다. HGC의 경우 낮은 온도에서 상대적으로 높은 점도를 가지고 있으며, 온도가 상승함에 따라 점차적으로 점도가 증가함을 보여주었다. 반면, P407의 경우 낮은 온도에서는 상대적으로 매우 낮은 점도를 가지며, 젤화 온도 부근에서 급격한 점도 상승과 함께 그 이상의 온도에서 매우 높은 점도를 보인다. HGC 써모젤이 낮은 고분자 농도(4 wt%)에도 불구하고 높은 P407 농도(20 wt%)의 써모젤 보다 점도가 높은 이유는 높은 분자량에 기인한 것으로 사료된다. 또한 P407의 마이셀 구조 형성 특성이 P407 수용액의 점도를 낮추는 데 기인했을 것으로 사료된다. 써모젤의 주요 응용분야인 주입형 제형의 경우 상온에서 수용액 상태의 제형이 주입에 용이할 수 있도록 낮은 점도를 갖는 것이 바람직하다. 블렌드 써모젤의 경우 20 ℃와 37 ℃에서의 점도를 비교하였을 때 P407의 조성비가 커질수록 20 ℃에서의 점도는 더 낮아졌으며, 37 ℃ 에서의 점도는 증가하는 것을 알 수 있었다. 이는 HGC 써모젤과 비교하였을 때, 낮은 온도에서는 주입에 용이한 낮은 점도의 수용액 상태로 존재함을 의미하고, 주입 후에는 생체 환경에서 보다 빠르게 젤화 거동이 일어날 수 있음을 의미한다. 결과적으로 두 단일 써모젤 조성의 혼합은 써모젤의 젤화 거동, 점도 및 주입형 제형으로서의 특성을 조절할 수 있는 유용한 방법으로 활용될 수 있을 것이다.
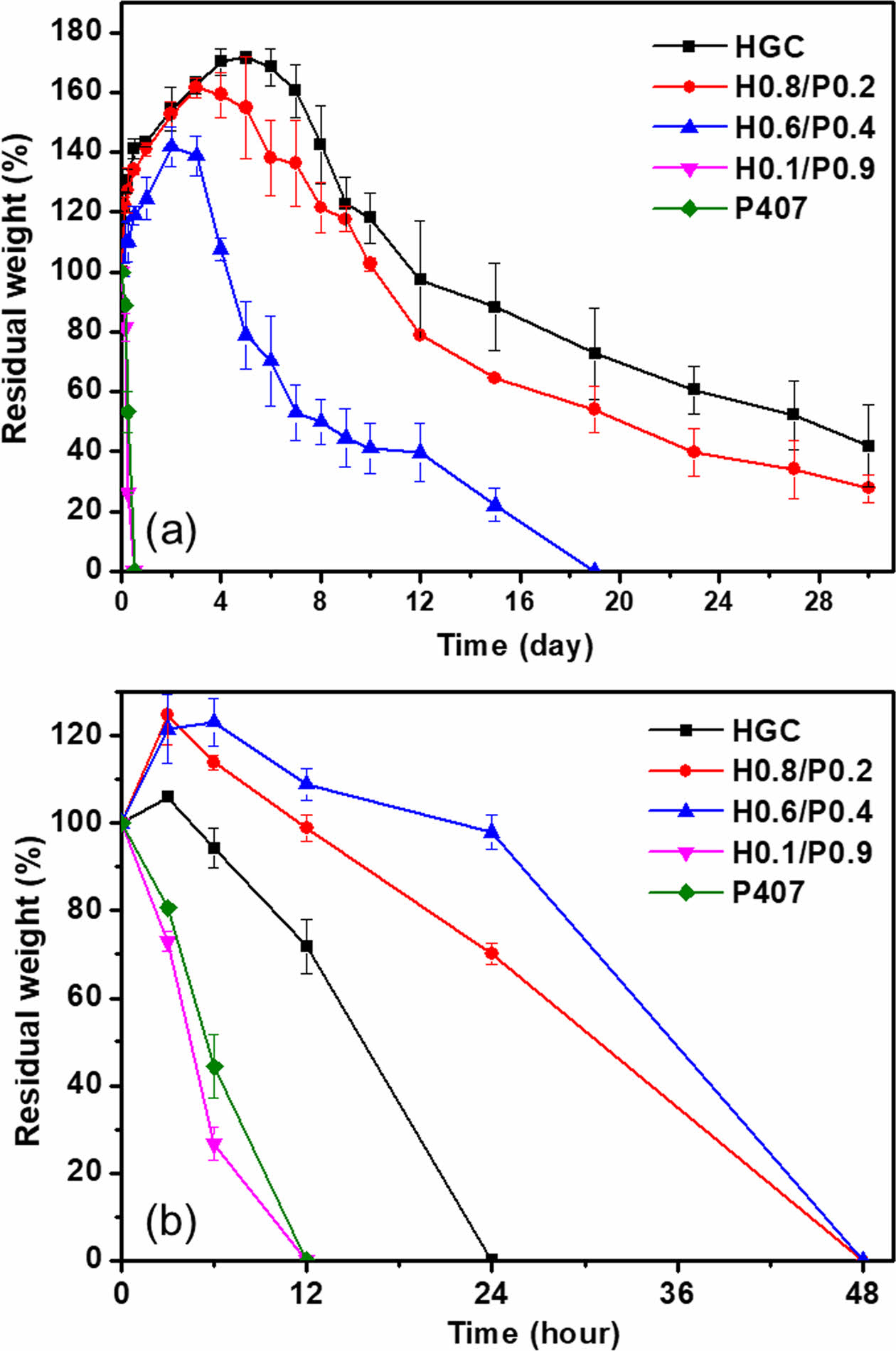
써모젤 안정성 평가. 37 ℃에서 HGC/P407 블렌드 써모젤의 시간에 따른 젤 안정성을 평가하였다. Figure 5(a)의 결과에서 보여주듯이 낮은 젤 안정성을 갖는 것으로 알려진 P407써모젤의 경우 12시간 이내에 모두 용해되는 것으로 관찰되었다. P407의 비율이 가장 높은 H0.1/P0.9 써모젤의 경우에도 비슷한 거동을 보였다. HGC 써모젤의 조성이 50% 이상인 블렌드 써모젤의 경우, Scheme 2와 같이 HGC와 P407이 소수성 작용에 의해 물리적으로 가교된 마이셀 구조를 형성함으로서 젤 안정성이 크게 증가하여 블렌드 써모젤이 한달 이상까지도 유지하는 것이 관찰되었다. 기존 써모젤 보다 높은 물리적 안정성을 갖는 것으로 알려진 천연고분자 기반의 HGC는 블렌딩을 통해 P407의 낮은 젤 안정성을 크게 향상시킬 수 있음을 확인할 수 있었다.
생분해성 특성 평가. 천연다당류 골격을 갖는 수용성 키토산 유도체인 GC는 분해효소인 리소자임에 의해 생분해가 일어나며, 다양한 화학적 개질에 의해 생분해 속도가 변화되는 것으로 알려져 있다. GC로부터 제조된 HGC 써모젤 역시 리소자임 존재 하에 효과적으로 분해가 일어나는 것으로 보고 되었다.26 다양한 혼합 조성의 HGC/P407 블렌드 써모젤의 분해효소 존재하에서의 분해성을 시간에 따라 관찰하여 단일 써모젤 조성물과 비교하였다. Figure 5(b)에서와 같이 HGC써모젤은 하루 정도에 걸쳐 분해가 완료되었다. 비분해성으로 알려진 P407써모젤은 HGC보다 더 빠른 12시간 안에 분해가 된 것으로 관찰되었다. 이러한 분해는 효소 분해에 의한 것보다는 고분자 자체의 낮은 젤 안정성에 기인한 물리적 분해에 때문이다. 한편, HGC와 P407의 블렌드 써모젤은 단일 써모젤 보다 높은 분해 안정성을 보였고, 특히 비슷한 조성으로 혼합된 H0.6/P0.4가 가장 느린 분해성을 보였다. 이는 혼재되어 있는 비분해성 P407의 존재로 인한 입체장애 효과로 HGC에 대한 생분해 속도가 지연되는 것으로 사료된다. 반면, 어느 한쪽의 조성이 높은 블렌드 써모젤 H0.1/P0.9나 H0.8/P0.2의 경우는 블렌딩에 의한 분해 지연 효과가 상대적으로 덜한 것으로 관찰되었다. 본 분해 실험의 결과를 통해 단일 써모젤이 본질적인 특성에 의해 결정되는 분해성을 갖는 반면, 블렌드 써모젤은 조성 변화에 따라 분해성을 조절할 수 있다는 점에서 생체재료로서의 사용에 보다 유용할 것으로 기대된다.
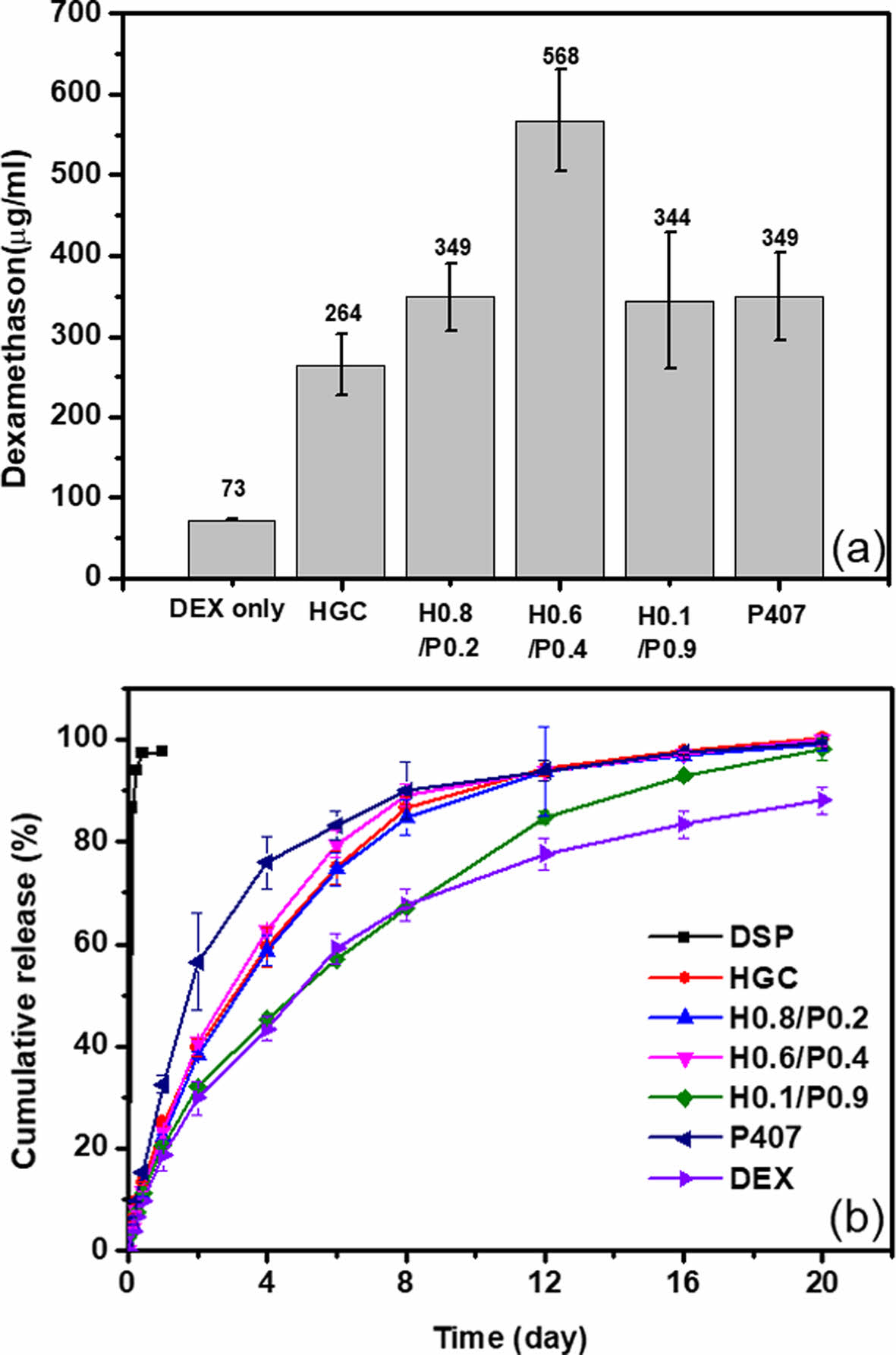
약물 가용화능 평가. P407은 친수성과 소수성 블록으로 이루어진 양친매성 고분자이며, 수용액 상에서 마이셀 구조 형성에 의해 소수성 약물을 효과적으로 가용화할 수 있는 특성이 있다고 알려져 있다.30 소수성 약물인 DEX에 대해 HGC와 P407, 그리고 이들의 블렌드 써모젤의 가용화 효과를 평가하였다. Figure 6(a)에서의 결과와 같이, DEX은 73 ㎍/mL의 수용해도를 갖는 것으로 측정되었고, 단일 써모젤인 HGC와 P407에서의 약물의 용해도는 264, 349 ㎍/mL로 각각 측정되었다. 두가지 써모젤 모두 소수성 약물의 가용화 효과를 보이는 것으로 나타났으며, P407이 HGC보다 우수한 가용화 효과를 나타내었다. 한편, 이들의 블렌드 써모젤은 해당 단일 조성물에 비해 동등 이상의 가용화 효과를 보였으며, 특히 H0.6/P0.4써모젤의 가용화 효과는 P407 보다 높은 시너지 효과를 보였다. 블렌드 써모젤 시스템의 경우 적절한 조성비의 조절에 따러 단일 성분보다 가용화능에 있어서 높은 시너지 효과를 기대할 수 있을 것이다.
In vitro 약물방출 평가. 소수성 DEX를 함유한 블렌드 써모젤의 약물 방출 거동을 친수성 약물인 DSP의 수용액 제형과 비교하였다. Figure 6(b)의 결과에서 보여주듯이 친수성 DSP의 경우 수시간 이내에 약물 방출이 모두 완료되었다. DSP의 경우 저분자량 친수성 약물로서 다공성 구조의 팽윤된 하이드로젤 구조에서 초기 빠른 방출이 이루어 지는 것으로 사료되며, 이러한 저분자 약물에 대한 초기 빠른 방출 특성은 일반적인 하이드로젤 제형에 있어 방출 제어 특성의 한계로 알려져 있다. 소수성 DEX의 경우 마이크로입자의 수용액 제형의 형태로서 약물 고유의 용해도에 의존한 방출이 서서히 3주간에 걸려 이루어 지는 것을 관찰할 수 있었다. 소수성 DEX를 함유한 써모젤 제형은 가용화 효과에 의해 약물 자체의 방출 속도 보다는 조금 빠르지만, 친수성 DSP와 비교하여 상당한 방출 지연 특성을 보였다. 써모젤 제형 중 P407 단일 제형의 방출속도가 가장 빠른 것으로 관찰되었는데, 이는 물리적 안정성이 낮은 특성으로 인해 빠르게 젤이 분해되어 마이셀 형태의 입자로 분산되면서 방출이 가속화된 것으로 사료된다. 블렌드 써모젤 중에서는 H0.6/P0.4써모젤이 다른 제형보다 상대적으로 좀 더 빠른 방출 거동을 보였는데, 이는 우수한 가용화 효과로 약물의 방출이 보다 가속화된 것으로 사료된다. H0.1/P0.9써모젤은 방출 실험 중 약물의 상분리가 이루어지면서 상대적으로 방출이 더디게 이루어지는 것으로 사료된다. 결과적으로 써모젤 제형을 활용하여 일반적인 하이드로젤 제형으로 적용이 어려운 소수성 저분자 약물인 DEX의 방출제어 특성을 구현 가능하였고, 조성 변화에 따라 방출특성의 조절이 가능함을 확인할 수 있었다.
세포 독성평가. 써모젤의 세포독성은 직접접촉 세포독성평가법을 통해 확인하였다. Figure 7은 직접접촉 세포 독성평가를 통해 얻은 양성대조군(PU-ZDEC)과 다양한 농도의 P407과 혼합된 HGC 하이드로젤의 세포독성 영역을 나타낸다. 양성대조군에서는 접촉 3일 후에 세포독성이 시료의 크기보다 0.65 ± 0.38 cm 벗어난 지점까지 영향을 미친 반면(Table 3), P407과 혼합된 모든 블렌드 써모젤들은 아무것도 처리하지 않은 대조군과 마찬가지로 세포독성 영역이 검출되지 않았다. Figure 8은 배양접시 표면에 붙어있는 세포가 살아있는 상태인지를 확인하기 위하여 생존/사멸 분석을 실시하였다. 단일 써모젤 뿐 아니라 모든 블렌드 써모젤 샘플들에 대해 배양접시 표면에 부착된 세포는 대부분 살아있는 상태를 유지하고 있었다. 이를 통해 P407과 HGC 기반의 블렌드 써모젤은 모두 의미 있는 독성을 나타내지 않는 것을 확인할 수 있었다.
|
Figure 1 Characterization of (a) 1 H NMR; (b) ATR-FTIR spectra of GC and HGC. |

|
Figure 2 Sol-gel transition images of HGC, P407, and HGC/P407 blend thermogels at 5 ℃ and 37 ℃, respectively |
|
Figure 3 Temperature-dependent rheological behavior of (a) thermogels HGC; (b) H0.8/P0.2; (c) H0.6/P0.4; (d) H0.1/P0.9; (e) P407; (f) elastic modulus of HGC, HGC/P407 blend and P407 thermogels at 37 ℃. |
|
Figure 4 Temperature-dependent viscosity change of HGC, HGC/ P407 blend and P407 thermogels. |
|
Figure 5 (a) In vitro gel stability test of HGC, HGC/P407 blend and P407 thermogels in PBS; (b) enzymatic degradation profile of HGC, HGC/P407 blend and P407 thermogels in PBS containing 10 mg/mL lysozyme at 37 ℃. |
|
Figure 6 (a) Solubilization capacity data of DEX in the presence of HGC, HGC/P407 blend and P407 thermogels at 20 ℃; (b) in vitro drug release profile of HGC, HGC/P407 blend and P407 thermogels at 37 ℃. |

|
Figure 7 Direct contact cytotoxicity assay: (a) Non-treatment; (b) PU-ZDEC; (c) HGC; (d) H0.8/P0.2; (e) H0.6/P0.4; (f) P407. |
|
Figure 8 Live/dead assay of HGC, HGC/P407 blend and P407 thermogels. |
|
Table 1 Preparation of HGC/P407 Blend Thermogels with Different Composition Ratio |
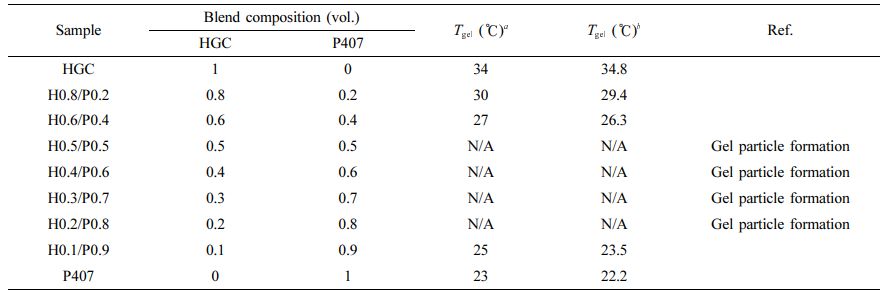
a Sol-gel transition temperature by tube inverting method. b Sol-gel transition temperature by rheological measurement. |
본 연구에서 합성고분자 써모젤인 P407과 천연고분자 기반 써모젤인 HGC의 물리적 혼합을 통해 다양한 조성비의 블렌드 써모젤을 제조하고, 물리화학적 성질 및 약물방출 특성을 평가하였다. 단일 성분의 써모젤과 비교하여 블렌드 써모젤은 낮은 세포독성을 유지할 수 있으면서, 온도감응성, 젤 안정성, 점도 및 유변학적 성질 등 다양한 물리화학적 특성 조절이 용이하였고, 단일 성분으로는 구현하기 어려운 생분해성 조절 및 약물 가용화 효과를 관찰할 수 있었다. 결과적으로 서로 상이한 특성의 써모젤들의 혼합으로부터 제조되는 블렌드 써모젤 시스템은 단일 써모젤 특성의 한계를 상호 보완할 수 있음을 보여주었고, 주입형 전달 제형 등 특정 응용에 필요한 맞춤형 특성의 구현으로 기존 써모젤의 성능을 향상시킴과 동시에 그 응용범위를 보다 확대시킬 수 있을 것으로 기대된다.
- 1. Kim, Y. J.; Matsunaga, Y. T. Thermo-responsive Polymers and Their Application as Smart Biomaterials. J. Mater. Chem. B 2017, 5, 4307-4321.
-

- 2. Dreiss, C. A. Hydrogel Design Strategies for Drug Delivery. Curr. Opin. Colloid Interface Sci. 2020, 48, 1-17.
-

- 3. Mortensen, K.; Pedersen, J. S. Structural Study on the Micelle Formation of poly(ethylene oxide)-poly(propylene oxide)-poly (ethylene oxide) Triblock Copolymer in Aqueous Solution. Macromolecules 1993, 26, 805-812.
-

- 4. Zhang, L.; Shen, W.; Luan, J.; Yang, D.; Wei, G.; Yu, L.; Lu, W.; Ding, J. Sustained Intravitreal Delivery of Dexamethasone Using an Injectable and Biodegradable Thermogel. Acta Biomater. 2015, 23, 271-281.
-

- 5. Jeznach, O.; Kołbuk, D.; Sajkiewicz, P. Injectable Hydrogels and Nanocomposite Hydrogels for Cartilage Regeneration. J. Biomed. Mater. Res. A 2018, 106, 2762-2776.
-

- 6. El Kechai, N.; Agnely, F.; Mamelle, E.; Nguyen, Y.; Ferrary, E.; Bochot, A. Recent Advances in Local Drug Delivery to the Inner Ear. Int. J. Pharm. 2015, 494, 83-101.
-

- 7. Yu, L.; Zhang, Z.; Zhang, H.; Ding, J. Mixing a Sol and a Precipitate of Block Copolymers with Different Block Ratios Leads to An Injectable Hydrogel. Biomacromolecules 2009, 10, 1547-1553.
-

- 8. Loh, X. J.; Li, J. Biodegradable Thermosensitive Copolymer Hydrogels for Drug Delivery. Expert Opin. Ther. Pat. 2007, 17, 965-977.
-

- 9. Ward, M. A.; Georgiou, T. K. Thermoresponsive Polymers for Biomedical Applications. Polymers 2011, 3, 1215-1242.
-

- 10. Yu, L.; Ding, J. Injectable Hydrogels as Unique Biomedical Materials. Chem. Soc. Rev. 2008, 37, 1473-1481.
-

- 11. Nagahama, K.; Ouchi, T.; Ohya, Y. Temperature-induced Hydrogels Through Self-assembly of Cholesterol-substituted Star PEG-b-PLLA Copolymers: An Injectable Scaffold for Tissue Engineering. Adv. Funct. Mater. 2008, 18, 1220-1231.
-

- 12. Da Silva, R. M.; Mano, J. F.; Reis, R. L. Smart Thermoresponsive Coatings and Surfaces for Tissue Engineering: Switching Cell-material Boundaries. Trends Biotechnol. 2007, 25, 577-583.
-

- 13. Schmaljohann, D. Thermo-and pH-responsive Polymers in Drug Delivery. Adv. Drug Deliv. Rev. 2006, 58, 1655-1670.
-

- 14. Giordano, C.; Albani, D.; Gloria, A.; Tunesi, M.; Rodilossi, S.; Russo, T.; Forloni, G.; Ambrosio, L.; Cigada, A. Nanocomposites for Neurodegenerative Diseases: Hydrogel-nanoparticle Combinations for a Challenging Drug Delivery. Int. J. Artif. Organs 2011, 34, 1115-1127.
-

- 15. Bhattarai, N.; Gunn, J.; Zhang, M. Chitosan-based Hydrogels for Controlled, Localized Drug Delivery. Adv. Drug Deliv. Rev. 2010, 62, 83-99.
-

- 16. Sarwan, T.; Kumar, P.; Choonara, Y. E.; Pillay, V. Hybrid Thermo-responsive Polymer Systems and Their Biomedical Applications. Front. Mater. 2020, 7, 73.
-

- 17. Liu, L. S.; Kost, J.; Yan, F.; Spiro, R. C. Hydrogels from Biopolymer Hybrid for Biomedical, Food, and Functional Food Applications. Polymers. 2012, 4, 997-1011.
-

- 18. Elluru, M.; Ma, H.; Hadjiargyrou, M.; Hsiao, B. S.; Chu, B. Synthesis and Characterization of Biocompatible Hydrogel Using Pluronics-based Block Copolymers. Polymer 2013, 54, 2088-2095.
-

- 19. Zhang, L.; Parsons, D. L.; Navarre, C.; Kompella, U. B. Development and in vitro Evaluation of Sustained Release Poloxamer 407 (P407) Gel Formulations of Ceftiofur. J. Control. Release 2002, 85, 73-81.
-

- 20. Escobar-Chávez, J.; López-Cervantes, M.; Naik, A.; Kalia, Y.; Quintanar-Guerrero, D.; Ganem-Quintanar, A. Applications of thermo-reversible Pluronic F-127 Gels in Pharmaceutical Formulations. J. Pharm. Pharm. Sci. 2006, 9, 339-58.
-

- 21. El-Kamel, A. In vitro and in vivo Evaluation of Pluronic F127-based Ocular Delivery System for Timolol Maleate. Int. J. Pharm. 2002, 241, 47-55.
-

- 22. Niu, G.; Du, F.; Song, L.; Zhang, H.; Yang, J.; Cao, H.; Zheng, Y.; Yang, Z.; Wang, G.; Yang, H. Synthesis and Characterization of Reactive Poloxamer 407s for Biomedical Applications. J. Control. Release 2009, 138, 49-56.
-

- 23. Ahn, J. S.; Suh, J. M.; Lee, M.; Jeong, B. Slow Eroding Biodegradable Multiblock Poloxamer Copolymers. Polym. Int. 2005, 54, 842-847.
-

- 24. Li, Z.; Cho, S.; Kwon, I. C.; Janát-Amsbury, M. M.; Huh, K. M. Preparation and Characterization of Glycol Chitin as a New Thermogelling Polymer for Biomedical Applications. Carbohyd. Polym. 2013, 92, 2267-2275.
-

- 25. Cho, I. S.; Oh, H. M.; Cho, M. O.; Jang, B. S.; Cho, J. K.; Park, K. H.; Kang, S. W.; Huh, K. M. Synthesis and Characterization of Thiolated Hexanoyl Glycol Chitosan as a Mucoadhesive Thermogelling Polymer. Biomater. Res. 2018, 22, 30.
-

- 26. Cho, M. O.; Li, Z.; Shim, H. E.; Cho, I. S.; Nurunnabi, M.; Park, H.; Lee, K. Y.; Moon, S. H.; Kim, K. S.; Kang, S. W.; Huh, K. M. Bioinspired Tuning of Glycol Chitosan for 3D Cell Culture. Npg Asia Mater. 2016, 8, e309.
-

- 27. Kim, D. E.; Oh, H. M.; Kang, S.-W.; Huh, K. M. Preparation and Characterization of Acyl Glycol Chitosan-Containing Poloxamer Gels. Polym. Korea. 2017, 41, 1033-1040.
-

- 28. Amin, M. C. I. M.; Ahmad, N.; Halib, N.; Ahmad, I. Synthesis and Characterization of Thermo-and pH-responsive Bacterial Cellulose/acrylic Acid Hydrogels for Drug Delivery. Carbohyd. Polym. 2012, 88, 465-473.
-

- 29. Stolnik, S.; Davies, M. C.; Illum, L.; Davis, S. S.; Boustta, M.; Vert, M. The Preparation of Sub-200 nm Biodegradable Colloidal Particles from Poly(β-malic acid-co-benzyl malate) Copolymers and Their Surface Modification with Poloxamer and Poloxamine Surfactants. J. Control. Release. 1994, 30, 57-67.
-

- 30. Merisko-Liversidge, E. M.; Liversidge, G. G. Drug Nanoparticles: Formulating Poorly Water-soluble Compounds. Toxicol. Pathol. 2008, 36, 43-48.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2023; 47(2): 181-190
Published online Mar 25, 2023
- 10.7317/pk.2023.47.2.181
- Received on Nov 13, 2022
- Revised on Jan 16, 2023
- Accepted on Jan 30, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sun-Woong Kang **, *** , and Kang Moo Huh *
-
*Department of Polymer Science and Engineering, Chungnam National University,
99, Daehak-ro, Yuseong-gu, Daejeon 34134, Korea
**Research Group for Biomimetic Advanced Technology, Korea Institute of Toxicology, Daejeon 34114, Korea
***Department of Human and Environmental Toxicology, University of Science and Technology, Daejeon 34114, Korea - E-mail: swkang@kitox.re.kr, khuh@cnu.ac.kr
- ORCID:
0000-0001-8862-2151, 0000-0002-2406-6659









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.