- Preparation of an Injectable Alginate Hydrogel by Enzymatic Crosslinking Reaction and Application to Wound Healing Agents
Seung Wook Lee# , Yunjeh Ko# , Ho Yun Chung*, and Oh Hyeong Kwon†

Department of Polymer Science and Engineering, Kumoh National Institute of Technology, Gumi, Gyeongbuk 39177, Korea
*Department of Plastic and Reconstructive Surgery, CMRI, Kyungpook National University School of Medicine, Daegu 41944, Korea- 효소촉매 가교반응에 의한 주사형 알긴산 하이드로젤의 제조 및 창상치료제로서의 응용
금오공과대학교 고분자공학과, *경북대학교 의과대학 성형외과, 세포기질연구소
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
In this study, an alginate hydrogel was prepared and characterized through an enzymatic crosslinking reaction of modified alginate with tyramine (Alg-Tyr) in order to develop an injectable wound healing agent that secures a moisture environment and dense adhesion to rough wound surface with controlled physical properties. The modification of Alg-Tyr was confirmed through attenuated total reflection-Fourier transform infrared spectroscope and proton nuclear magnetic resonance spectrometer. The storage modulus, gelation time, hydrolysis behavior and in vitro cytotoxicity of the hydrogel according to the crosslinking and concentration parameters of the alginate mixture were analyzed. The optimum hydrogel was selected as Alg-Tyr 4 w/w%, horseradish peroxidase 0.2 mg/mL and H2O2 4 μL/mL concentration of composition. As results of in vivo wound healing rate and histological evaluation, the alginate hydrogel group showed superior recovery speed and skin regeneration ability compared to the control group, and it is expected to be used as an injectable wound healing agent.
본 연구에서는 굴곡이 심한 창상면에서의 밀착성 및 습윤환경이 보장되고 물성이 제어된 주사형 창상치료제를 개발하고자 티라민이 도입된 알긴산(Alg-Tyr)을 합성한 후, 효소촉매 가교반응을 이용한 알긴산 하이드로젤을 제조하여 성능을 검증하였다. Alg-Tyr의 개질여부는 attenuated total reflection-Fourier transform infrared spectroscope 및 proton nuclear magnetic resonance spectrometer을 통해 확인하였다. 알긴산 혼합물의 가교반응에 관여하는 구성물의 농도 변수에 따른 하이드로젤의 저장탄성률, 젤화시간, 가수분해 거동, in vitro 세포독성을 분석하였으며, 주사형 창상치료제로서 최적조건의 하이드로젤은 Alg-Tyr 4 w/w%, horseradish peroxidase 0.2 mg/mL, H2O2 4 μL/mL 농도의 배합으로 선정하였다. In vivo 창상치유도 및 조직학적 평가결과에서 알긴산 하이드로젤군은 대조군에 비하여 우수한 회복속도 및 피부 재생능을 보여주었으며, 주사형 창상치료제로서의 활용이 기대된다.
The injectable hydrogel wound healing agent was developed with tyramine immobilized alginate using enzymatic crosslinking reaction. The wound healing ability of the alginate hydrogels with optimized formulation demonstrated superior recovery rate and skin regeneration.
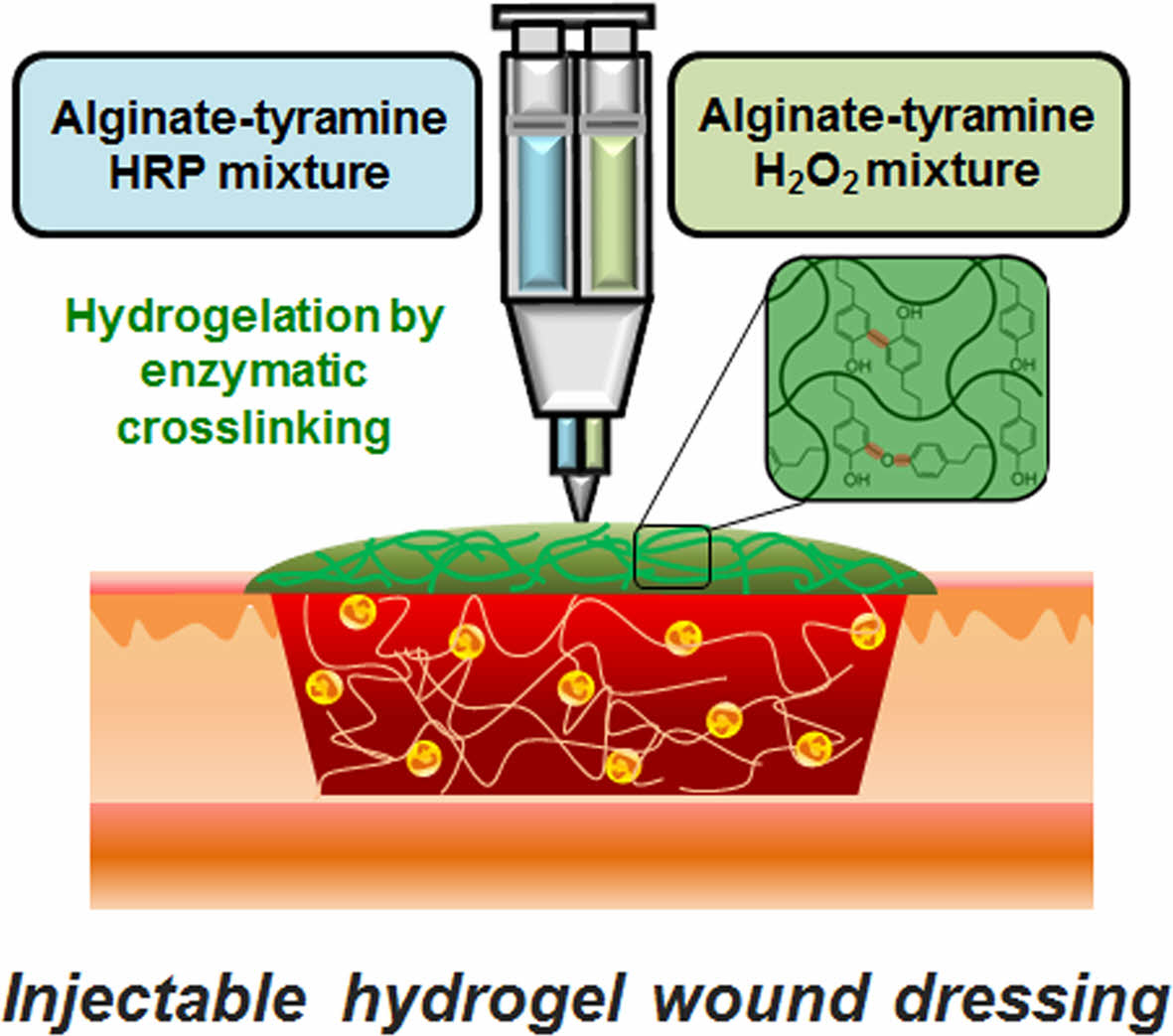
Keywords: alginate, hydrogel, injectable, enzymatic reaction, wound healing agent.
이 연구는 금오공과대학교 학술연구비에 의하여 지원된 논문임(과제번호 2019104130).
저자들은 이해상충이 없음을 선언합니다.
의료공학 기술의 눈부신 발달과 함께 인체의 장기나 조직의 결손에 의한 후유증을 완벽히 대체할 수 있는 조직재생기술의 실현에 대한 도전은 끊임없이 진행되고 있다. 결손된 생체조직을 복구하기 위해서는 의료기술과 더불어 다양한 고기능성 생체재료의 지속적인 연구개발이 동반되어야만 한다.1-3 특히, 심각한 생체조직의 결손을 비롯하여 경미한 상처의 발생빈도와 범주 중에서 피부조직과 관련된 사례가 가장 우세하며, 그에 따른 의료용 생체재료의 적용사례도 많이 보고되고 있다.4 피부는 가장 큰 표면적을 가지는 인체조직으로 크게 표피층(epidermis), 진피층(dermis), 피하지방층(hypodermis)의 3층 구조로 이루어져 있으며, 면역 기능, 외부의 유해환경으로부터 보호, 수분 증발 억제 및 항상성 기능을 하고 있다.4 다른 인체조직에 비해 피부조직은 외부와의 직접적인 접촉이 빈번하며 다양한 원인에 의해 창상, 찰과상, 화상, 욕창, 피부질환 등의 외상이 발생된다. 그 중에서 창상이 가장 흔하게 발생하고 치료법도 오랜 역사를 가지고 있다. 창상치료의 중요도가 상대적으로 낮았던 시대에는 동물성 유지나 벌꿀, 면화를 사용하였지만 의료 및 미용에 대한 수요와 관심도의 증가와 함께 창상의 치료 및 흉터관리 기술에도 많은 연구와 기술개발이 이루어져 다양한 제품들이 개발되었다.4-8 창상치유는 크게 지혈/염증발생단계, 증식단계, 성숙/수축단계의 일련과정으로 진행된다.4 이 과정들은 순차적으로 중첩되어 이루어지며, 창상의 양상에 따라 두드러지는 단계가 있다. 조직은 손상을 받게 되면 반흔(흉터)을 형성하거나 원래의 조직과 유사한 색상과 모양으로 재생됨으로써 복원된다. 이상적으로는 원래의 조직으로 완벽히 재생되어야 하지만, 피부의 경우 반흔을 형성하며 복원되는 것이 대표적이다. 이전까지는 창상치유를 위해 거즈나 면을 사용하여 상처를 건조환경 상태에서 딱지를 앉게 하였지만 1962년 동물학자 Winter에 의해 습윤환경에서 효과적인 치료효과를 보인다는 보고로 인해 최근에는 건조환경의 거즈 방법에서 벗어나 습윤환경의 드레싱제 방법이 널리 통용되고 있다.7 또한, Rovee에 의해 습윤한 환경을 유지하여 가피를 형성하지 않는 환경이 상피세포의 이동을 용이하게 하면서도 상피의 재생을 촉진시킨다는 연구가 발표되었으며, 개방이 된 창상의 경우 상피세포의 이동이 새롭게 형성된 콜라겐에 의해 방해되고 창상부 분비물이 신생혈관의 형성과 상피화를 자극하는 여러 성장인자(growth factor)를 없앤다는 연구결과가 이론을 더욱 뒷받침하였다.8 또한, 치유기간의 경우 건조한 환경이 습윤 환경보다 2배 정도 긴 것으로 밝혀지고 있다. 이처럼 인체에서 창상치유에는 여러 인자들이 관여하게 되며 습윤환경(humidity), 온도(temperature), 산소농도(oxygen), 감염(infection) 등을 예로 들 수 있다. 습윤환경의 경우 재생되는 상피세포의 자유로운 이동이 가능하기 때문에 효율적인 상처치료를 위해서 필수적으로 요구되며, 28 ℃ 이하에서는 세포의 증식과 분열이 크게 장애를 받기 때문에 온도 또한 창상 치유와 매우 밀접한 관련이 있다. 산소농도는 온도가 상승하면 조직에 공급되는 산소의 농도 또한 증가하기 때문에 세포증식이 촉진되고 창상치유 속도도 빨라지게 된다. 마지막으로, 세균감염은 창상치유에 직접적으로 영향을 주는 인자로 감염이 진행된 조직에서는 상피세포의 이동이 원활하지 못하고 장기간 지속되는 염증은 후속적 치유단계로의 진입을 지연시킨다.
현재, 창상치료용 제품으로 시판중인 습윤 드레싱제는 반투과성 필름(film), 하이드로콜로이드(hydrocolloid), 폼(foam), 하이드로젤(hydrogel) 형태 등이 있다. 그 중에서 하이드로젤 드레싱제는 1960년대에 개발되었으며, 친수성 부분을 가지는 불용성 가교 고분자로 약 90% 이상의 물을 함유한 젤형태의 드레싱제이다.5 하이드로젤 형태의 창상치료제로 활용된 천연소재로는 히알루론산, 알긴산, pectin, carrageenan, chondroitin sulfate, dextran, dextran sulfate, chitosan, polylysine, collagen, gelatin, carboxymethyl chitin, fibrin, agarose, pullulan 등이 다양하게 보고되어 있다.6 하이드로젤 자체의 물성은 약하지만 생분해가 가능하기에 약물전달이나 세포전달체로 사용하기 쉬우며, 초기에는 액상형태이기에 다양한 제재(주사형, 스프레이형)로 만들 수 있어 사용이 편리하고 위생적이며, 상처표면과의 밀착능이 우수하다.9-14 특히, 주사형 하이드로젤은 노즐을 통해서 사출되어야 하므로 효율적으로 사용하기 위해서는 유동성을 가져야 하며 창상표면에 균일하게 도포가 완료된 후에는 물리적, 화학적 반응에 의해 신속하게 젤화가 이루어져야 한다. 분자의 얽힘이나 수소결합, 이온결합, 소수성 상호작용을 포함한 이차결합에 의해 하이드로젤을 형성하는 경우 가역적 혹은 물리적 하이드로젤이라고 부른다. 물리적 하이드로젤은 사슬의 중간부 혹은 말단이 일시적으로 결합이 되는 상태라 균일하지 못한 형태이다. 이러한 물리적 하이드로젤은 물리적 조건이 변하면 쉽게 붕괴될 수 있다. 이외에 공유결합에 의해 가교된 하이드로젤의 경우 화학적 하이드로젤이라고 부르고 있다.15,16 물리적 하이드로젤의 경우 균일성이 부족하며 지속시간과 강도가 부족하여 많은 분야에서 화학적 가교방법을 주로 사용하게 된다. 이 때 사용할 수 있는 방법으로는 Michael-type 방법과 disulfide bond formation 방법, 그리고 aldehyde-mediated cross-linking 방법이 가장 널리 알려져 있다.17-20 화학적 하이드로젤의 장점은 가교점의 수를 조절함으로서 하이드로젤의 역학적 강도를 조절할 수 있고, 생분해성도 조절이 가능하다는 것을 의미하며 하이드로젤의 강도를 조절함에 따라 세포의 성장과 그에 의해 수반되는 조직의 기능성 구현에도 영향을 주게 된다. 하이드로젤 모델에서 가장 중요한 문제는 다양한 종류의 젤 전구체와 가교제의 농도에 큰 영향을 받으며, 가교제는 생물학적 독성 및 원치 않는 기계적 물성의 변화를 초래하기도 한다는 점이다.21-26 이러한 문제점을 극복하고자 천연물질에서 추출한 물질을 사용하는 등의 여러 연구가 진행되고 있으며 특히, 서양 고추냉이에서 추출한 효소인 horseradish peroxidase(HRP)는 많은 주목을 받고 있는 물질이다.27-30 HRP의 경우 과산화수소(H2O2)와 함께 반응하여 화학적 가교제 역할을 수행하면서 생분해성과 생체적합성이 우수한 가교제로 알려져 있다. HRP는 H2O2에 의해 산화되고 산화된 HRP는 페놀그룹을 산화시켜 중간체를 형성하게 되며 이렇게 생성된 물질이 가교점 역할을 하게 되어 네트워크 구조를 형성하게 된다. 이러한 이유로 HRP 및 H2O2의 농도를 조절하여 하이드로젤의 탄성률, 젤화시간, 가수분해시간을 제어할 수 있다.27
본 연구에서는 생체적합성 및 생분해성을 위해 천연고분자인 알긴산(alginate sodium salt)을 하이드로젤의 주재료로 하여 제작하고자 하였다. 알긴산은 갈조류의 구성성분으로 α-L-guluronic acid(G-blocks) 단량체와 β-D-mannuronic acid(M-blocks) 단량체가 반복된 선형 구조를 가지는 블록공중합체이다.6,12,13 알긴산은 carboxyl기를 갖는 음이온 중합체로써 Ca2+, Ba2+와 같은 2가 양이온과 상호 작용에 의해 젤화가 될 수 있으며, 이의 점착특성은 조직재생을 위한 기질로 이용이 가능하다.6,7,11 그러나 알긴산 하이드로젤은 생분해도 조절이 어렵고, 2가 양이온이 소실되면 쉽게 분해되는 문제로 인해 단독으로 하이드로젤을 만들기 보다 다른 물질과 공유결합된 형태로 쓰이고 있다. 이와 같은 이유로 알긴산을 아민기(-NH2)와 페놀그룹(ArOH)을 동시에 가지고 있는 티라민(tyramine)으로 개질하여 효소촉매 가교반응이 가능하도록 고안하였다. 가교제로는 H2O2, 촉매로는 HRP를 사용하였으며, HRP에 있는 철(Fe) 원자와 H2O2가 반응하여 산화라디칼 형성에 의해 개질된 티라민의 그룹간 가교반응을 촉진할 수 있다. 본 연구에서는 이러한 특성을 이용하여 티라민으로 개질된 알긴산 및 효소촉매 가교제인 HRP와 H2O2의 최적 농도배합비를 저장탄성율, 젤화시간, 가수분해 시간 등을 고려하여 선정하였고, 주사형으로 간편하게 주입함과 동시에 생화학적 가교반응이 진행되도록 알긴산 하이드로젤을 설계하였다. 최종적으로, 주사형 알긴산 하이드로젤을 창상치료제로 적용하여 in vitro 세포독성 및 in vivo 동물모델 실험을 통하여 평가한 검증내용을 정리하였다.
티라민이 도입된 알긴산의 합성. 하이드로젤의 주재료인 알긴산(alginate sodium salt, 15~20 cP; 1% 수용액)은 Sigma Aldrich(USA)에서 구매하였다. 알긴산의 카복실 그룹에 티라민(tyramine hydrochloride, ³98%, Sigma Aldrich, USA)을 도입하는 방법은 다음의 순서로 진행하였다. 먼저, 알긴산 분말(1.38 wt%)을 3차 정제수에 약 3시간동안 교반하여 균일하게 용해시킨 후, 커플링제인 1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride 0.66 wt%(EDC, ³98%, Tokyo Chemical Industry Co., Ltd, Japan) 및 N-hydroxysuccinimide 0.40 wt%(NHS, ³98%, Wako, Japan)와 가교점 역할을 하는 티라민(1.20 wt%)을 투입하였다. 이어서, 1 N HCl 수용액을 이용하여 혼합용액을 pH 4.0로 조정하고, 약 20시간 동안 교반하여 합성반응을 진행하였다. 그 후, 티라민이 도입된 알긴산과 미반응 물질이 혼합된 용액을 dialysis membrane tube (MWCO: 12,000~14,000, Viskase, USA)에 주입하고 0.1 M NaCl 용액에서 48시간, 25% ethanol 용액과 증류수에서 각각 24시간씩 총 4일간 투석하여 미반응물을 제거하였다. 투석이 완료된 용액은 동결건조를 통해 티라민이 도입된 알긴산 화합물(Alg-Tyr)을 스폰지 형태로 수득한 후, 밀봉보관 하였다.
티라민이 도입된 알긴산의 개질 확인. Alg-Tyr의 개질 유무를 확인하기 위해 attenuated total reflection-Fourier transform infrared spectroscope(ATR-FTIR, Nicolet 6700, Thermo Scientific, USA)를 이용하여 측정조건은 해상도 0.2 cm-1, scan 수 16회, scan 범위 600~4000 cm-1로 설정하였다. 또한, proton nuclear magnetic resonance spectrometer(1H NMR, BRUKER BIOSPIN/AVANCE III 400, 400 MHz FT-NMR, Bruker, Germany)를 이용하였으며, 각 시료는 deuterium oxide(D2O, Sigma, USA)에 용해하여 측정하였다. 티라민 그룹의 관능기 및 특성피크를 대조분석하여 개질여부를 확인하였다. 개질조건을 설정할 때 알긴산 1 g 당 존재하는 카복실기의 몰수를 계산하여 알긴산에 도입할 수 있는 이론적인 티라민의 몰수를 계산하고 개질전의 기준 수소피크의 몰당 적분값과 개질후의 티라민 수소피크의 몰당 적분값을 정량하여 티라민의 치환율을 산출하였다.
알긴산 하이드로젤의 제조. 동결건조된 Alg-Tyr 스폰지는 1~6 wt% 농도가 되도록 인산완충생리식염수(PBS, pH 7.2, Gibco, USA)로 약 30분간 용해시켜 용액상으로 준비하였다. 효소촉매 가교반응을 통한 하이드로젤화는 완전히 용해된 Alg-Tyr 용액에 HRP(specific activity 220~250 units/mg, Amresco, USA)와 H2O2(30 v/v%, Daejung, Korea)를 혼합하여 진행하였다. Alg-Tyr 용액에 HRP와 H2O2를 동시에 첨가할 경우, 가교반응이 즉각적으로 진행되기 때문에 넓은 창상표면상의 균일한 도포가 어렵다. 이를 보완하고자 이액형 주사기(5 + 5 mL, EVICEL®, USA)에 HRP를 첨가한 Alg-Tyr 용액(5 mL)과 H2O2를 첨가한 Alg-Tyr 용액(5 mL)을 각 실린더에 투입하여 효소촉매반응에 의한 즉각적인 가교를 방지하고 mixing nozzle(EVICEL®, USA)을 사용하여 사출과 동시에 혼합되면서 가교반응을 개시하는 젤화 방식을 이용하여 하이드로젤을 제조하였다.
알긴산 하이드로젤의 유변학적 특성 및 가수분해 거동 분석. 알긴산 하이드로젤의 제조 시, Alg-Tyr 용액, 효소촉매인 HRP 및 H2O2의 농도 및 티라민의 도입량에 따른 유변학적 특성을 분석하기 위해 물질의 점도, 탄성률, 응력, 전단속도와 같은 유변학적 물성을 측정해주는 modular compact rheometer (Physica MCR 301, Anton Paar, Austria)를 사용하였다. Alg-Tyr 용액, HRP 및 H2O2 농도에 따른 저장탄성률(storage modulus, G')의 값을 측정하여 유변학적 변화를 확인하였다 (온도: 36.5 ℃, gap: 1 mm, interval: 5초, 측정시간: 300초, dynamic frequency 모드). 이후 vial에 다양한 농도의 HRP, H2O2 및 Alg-Tyr 용액을 넣어준 뒤, 용액이 흘러내리지 않는 시간을 측정하여 최적화된 젤화시간을 채택하였다.
또한, 젤의 강도는 알긴산 하이드로젤의 가수분해시간에도 영향을 주기 때문에 여러 농도의 HRP, H2O2 및 Alg-Tyr 용액을 일정한 크기의 몰드(PVC 재질, 7 × 7 × 5 mm)에서 반응시켜 하이드로젤을 제작하여 가수분해 거동을 조사하였다. 실험방법을 간략히 서술하면, 하이드로젤을 PBS가 담긴 conical tube에 투입하고 shaking water bath(DS-23SN, DASOL SCIENTIFIC, Korea)에서 일정한 환경(37 ℃, 1000 rpm)을 유지시켜 주었고, 이후 매 24시간 주기로 관찰하여 알긴산 하이드로젤이 완전히 분해되어 액상이 되는 시점을 측정하여 각 하이드로젤의 가수분해 거동을 측정하였다.
In vitro 세포독성 평가. 창상조직에 직접적으로 접촉하는 의료용 창상치료제는 생물학적 안전성 평가가 요구된다. 알긴산 하이드로젤은 생체적합성 시험법 중에서 기본적으로 시행되고 있는 세포독성평가(cytotoxicity test)를 실시하였다. 세포독성 평가는 ISO 10993-5:2009, biological evaluation of medical device 중 extract test법으로 평가를 진행하였으며, 평가에는 마우스의 섬유아세포(mouse embryonic fibroblasts, NIH-3T3, Korean Cell Line Bank, Korea)를 계대배양하여 사용하였다. 용출배지는 20 mL Dulbecco’s modified Eagles medium(DMEM) 배지에 4 g의 알긴산 하이드로젤을 투입하고 인큐베이터(37 ℃, 5% CO2) 내에서 24시간 용출하여 수득하였다(ISO 10993-12:2012). 그 후, 증식된 세포를 회수하여 준비된 세포 현탁액을 2×105 cells/well의 농도로 6-well plate에 분주하고, 24시간동안 배양하였다. 이후, 기존의 DMEM 배지를 제거한 뒤, 수득한 용출배지를 투입하고 48시간 동안 배양 후, 광학현미경(ECLIPSE TS100, Nikon Corp., Japan)을 통해 세포의 성장 및 형태를 관찰하였으며 1 mL의 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) stock solution을 첨가하여 4시간 동안 MTT assay를 진행하였다. MTT stock solution과 남아있는 배지를 제거한 뒤 dimethyl sulfoxide(DMSO)로 처리하였으며, 수득한 용액을 96-well plate에 200 μL씩 분주하여 microplate reader (PHOmo, Autobio Labtec Instruments Co., Ltd., China)를 이용하여 흡광도(450 nm)를 측정하여 세포생존율을 산출하였다.
In vivo 창상회복률 분석. 본 연구에서 제조된 알긴산 하이드로젤의 창상치유효과를 평가하고자 실험대상으로 male Sprague Dawley(SD) rat(8주령, 250~300 g, 효창사이언스, Korea)을 이용하여 피부전층창상모델 실험을 진행하였다. 동물실험은 경북대학교병원 동물실험윤리위원회의 시행규정 및 승인(동물윤리 승인번호: 2017-0131)에 의해 진행하였다. SD rat의 수술을 시행하기 전 일주일 동안 항온항습 사육실(온도 22±5 ℃, 습도 50±5%)에서 적응시켰다. 대조군으로는 멸균된 거즈를 사용하였고, 실험군은 하이드로젤을 드레싱제로 사용하였다. 동물실험은 마취된 SD rat의 등부분에 직경 2 cm 원판형의 피부전층창상을 유발하여 각각의 창상에 샘플을 두고 시간 경과 후 대조군과 실험군의 창상치유거동을 확인하였다. 본 실험에서는 3, 5, 7, 10, 14일 시점의 창상부위를 관찰하고 사진을 촬영하였으며 영상분석프로그램(IMT I-Solution Lite, Image and Microscope Technology Inc., Korea)으로 창상면적을 측정하여 회복률을 산출하였다.
조직학적 평가. In vivo 실험 후, 채취한 조직의 피부전층창상 치유도, 표피형성과 진피의 성숙도 및 염증세포 분포를 평가하기 위해 hematoxylin-eosin(H&E) 및 Masson’s trichrome 염색을 실시하였다. 먼저, 채취한 조직을 10% 포르말린 용액에 넣어서 고정시킨 후 헹구어낸 다음, 자일린으로 용매를 치환하였다. 그리고 조직을 파라핀으로 포매한 후, 조직절편기를 이용하여 5 μm 정도의 두께로 절편하였다. 절편조직을 슬라이드글라스 위에 고정하고 세척한 뒤 염색 및 봉입하였다. 완성된 조직시편을 광학현미경(ECLIPSE TS100, Nikon Corp., Japan)으로 관찰하여 디지털 카메라를 이용하여 촬영하였다.
통계분석. 정량적인 측정수치의 유의성 평가는 통계분석 소프트웨어(KyPlot version 2.0, KyensLab, Inc., Japan)를 사용하여 분석하였다. 각 수치는 평균 ± 표준편차로 표기하였으며 significance level은 parametric Student’s t-test와 one-way ANOVA(analysis of variance)의 Tukey 사후검증법으로 판별하였다. 통계적 유의성은 p < 0.05의 값으로 설정하였다.
알긴산은 갈조류의 주요 구성성분으로 천연에 풍부하게 존재하며 독성이 없으므로 생체재료로 다양하게 사용되고 있다. 알긴산의 화학적 구조는 carboxyl기를 포함하기 때문에 2가 양이온과의 상호작용으로 물리적인 젤화가 가능하다. 그러나 알긴산 자체만으로 하이드로젤의 분해도를 일정하게 조절할 수 없으며 2가 양이온이 소실되면 쉽게 분해가 되기 때문에 알긴산에 EDC/NHS 커플링 반응을 통해 화학적 가교점 역할을 하는 티라민을 도입하였다. 본 연구에서의 티라민이 도입된 알긴산의 개질 농도조건을 설정할 때, 알긴산 1 g 당 존재하는 카복실기의 몰수를 계산하여 알긴산에 도입할 수 있는 이론적인 티라민의 몰수를 계산하고, 과량의 농도로 티라민과 커플링제를 투입하여 최대한의 티라민이 도입될 수 있도록 Alg-Tyr 시료를 제조하였다. 하이드로젤 가교를 위해서는 가교제가 요구되며, 창상모델에 적용하기 위해서는 생물학적 안전성이 검증된 가교제의 적용이 요구된다. 그래서, 본 연구에서는 알긴산에 티라민을 도입하여 가교점을 형성하고 서양 고추냉이에서 추출한 효소인 HRP와 H2O2를 사용하여 효소촉매 가교반응을 이용하여 알긴산 하이드로젤을 제조하였다.
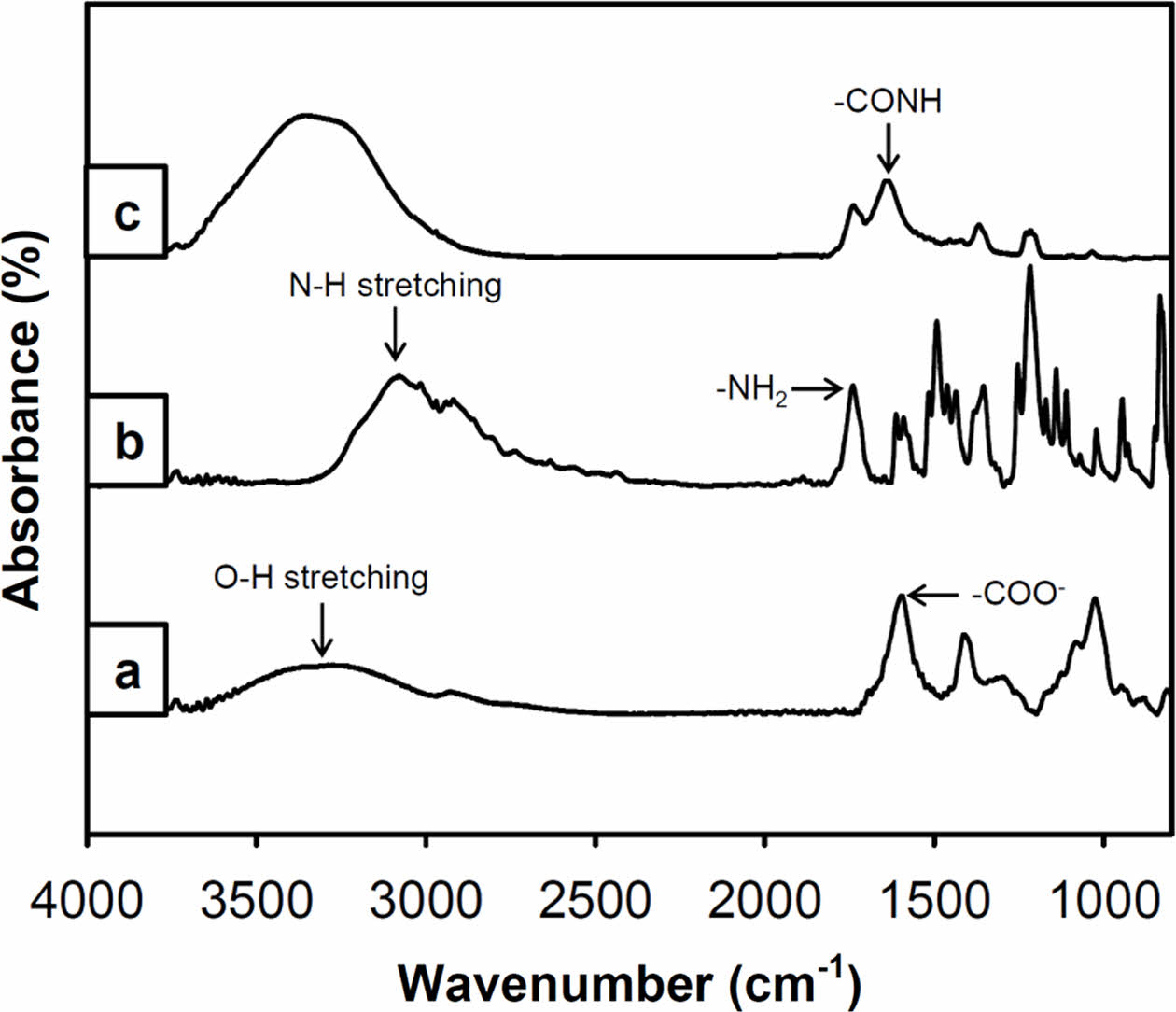
티라민이 도입된 알긴산의 화학적 분석. 다당류인 알긴산에 페놀 그룹을 가지고 있는 티라민 그룹의 도입여부 검증은 개질된 알긴산의 특성피크를 ATR-FTIR을 이용하여 확인할 수 있었다. EDC/NHS 반응을 통해 티라민 그룹이 도입된 알긴산(Alg-Tyr)은 순수한 알긴산과는 달리 티라민 그룹의 특성피크가 나타나는 것을 확인하였다(Figure 1). 알긴산은 3200-3400 cm-1 O-H stretching, 2924 cm-1 C-H stretching, 1600-1410 cm-1 -COO-그룹 및 C-O-C stretching, 1043 cm-1 C-O stretching, 960 cm-1 C-H stretching의 피크를 나타내었다. 그리고, 티라민은 3100 cm-1 및 1750 cm-1 N-H stretching, 1615 및 1590 cm-1 aromatic C=C stretching, 1210 cm-1 C-O, 1115 cm-1 C-N stretching에서의 고유한 특성 피크를 나타내었다.14,22 티라민으로 개질된 알긴산의 스펙트럼(Figure 1(c))과 알긴산과 티라민이 가지는 특성피크들의 비교를 통하여, O-H stretching 및 C-H stretching, N-H stretching aromatic, 그리고 C=C stretching 피크가 확인되어, 합성반응에 의한 개질여부를 확인할 수 있었다. 특히, 개질된 알긴산의 1640 cm-1에서 새로운 피크가 검출되었는데, 이는 알긴산에 존재하는 -COO-그룹(1600 cm-1)과 티라민의 -NH2 그룹이 결합 반응하여 -CONH 그룹을 형성함에 의한 것으로 보인다.
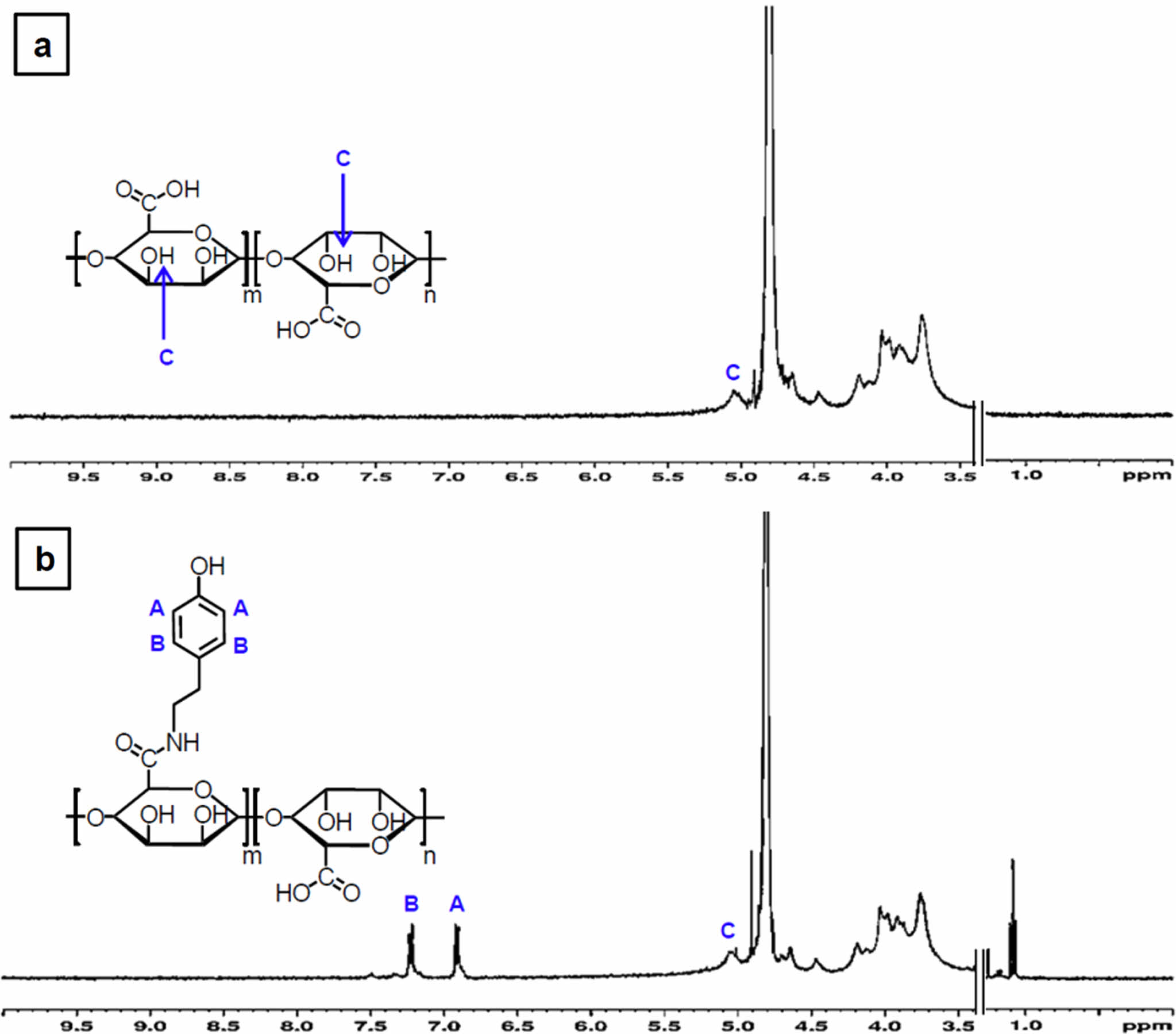
알긴산에 티라민의 도입여부 및 치환율은 1H NMR을 통해서 추가적으로 확인하였다. 순수한 알긴산과 EDC/NHS반응을 통하여 합성된 Alg-Tyr을 비교하여 6.9 ppm과 7.2 ppm 부근에서 나타나는 벤젠고리의 특성피크가 Alg-Tyr에서 나타나는 것을 분석함으로써 티라민 그룹이 도입된 것을 확인할 수 있었다(Figure 2). 본 연구에서의 티라민이 도입된 알긴산의 개질조건을 설정할 때, 알긴산 1 g 당 존재하는 카복실기의 몰수를 계산하여 알긴산에 도입할 수 있는 이론적인 티라민의 몰수를 계산하고, 과량의 티라민을 투입하여 최대한의 티라민이 도입될 수 있도록 Alg-Tyr 시료를 제조하였다. 또한, 각 스펙트럼의 5 ppm에서 나타나는 수소피크의 적분값과 벤젠고리 특성 수소피크(6.9 ppm, 7.2 ppm)의 적분값의 몰비 1/4을 정량적으로 산출하였으며, 알긴산 주쇄의 카복실그룹 중에서 티라민으로 치환된 비율이 약 4.9%임을 도출하였다.
알긴산 하이드로젤의 유변학적(저장탄성률, 젤화시간) 특성분석. 하이드로젤형 창상치료제의 특징은 습윤환경 유지와 더불어 입체적인 피부조직 표면과의 밀착성이다. 그러므로 창상부의 피부조직과 유사한 정도의 탄성을 가지는 하이드로젤로 제작하는 것이 밀착성과 이물감 측면에서 선호되며 표피 및 진피조직층에서 증식하는 섬유아세포의 이동자유도를 보장할 수 있다. 시료의 저장탄성률(G')을 측정할 수 있는 유변학적 특성분석은 하이드로젤의 점탄성을 평가할 수 있으며, Alg-Tyr 용액, HRP 및 H2O2의 농도배합비에 따른 하이드로젤의 저장탄성률 측정 및 최적화 조건을 확립할 수 있다. 더불어, 주사형 하이드로젤은 노즐에서 혼합되어 사출되는 과정에서 유동성을 가지고 창상표면에서 균일하게 도포가 완료된 후에는 신속하게 젤화가 진행되어야 한다. 그러므로, 알긴산 하이드로젤 전구체 구성물의 배합농도비에 따른 젤화시간의 최적화 조건도 저장탄성률의 조건과 동시에 고려되어야 한다.
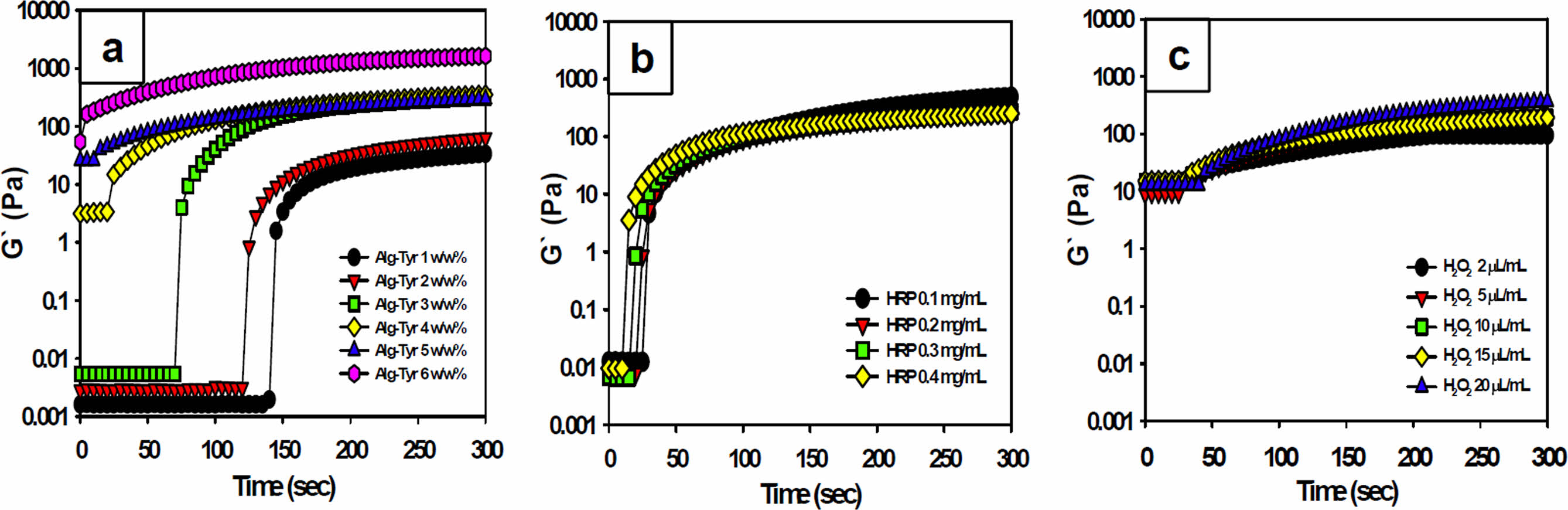
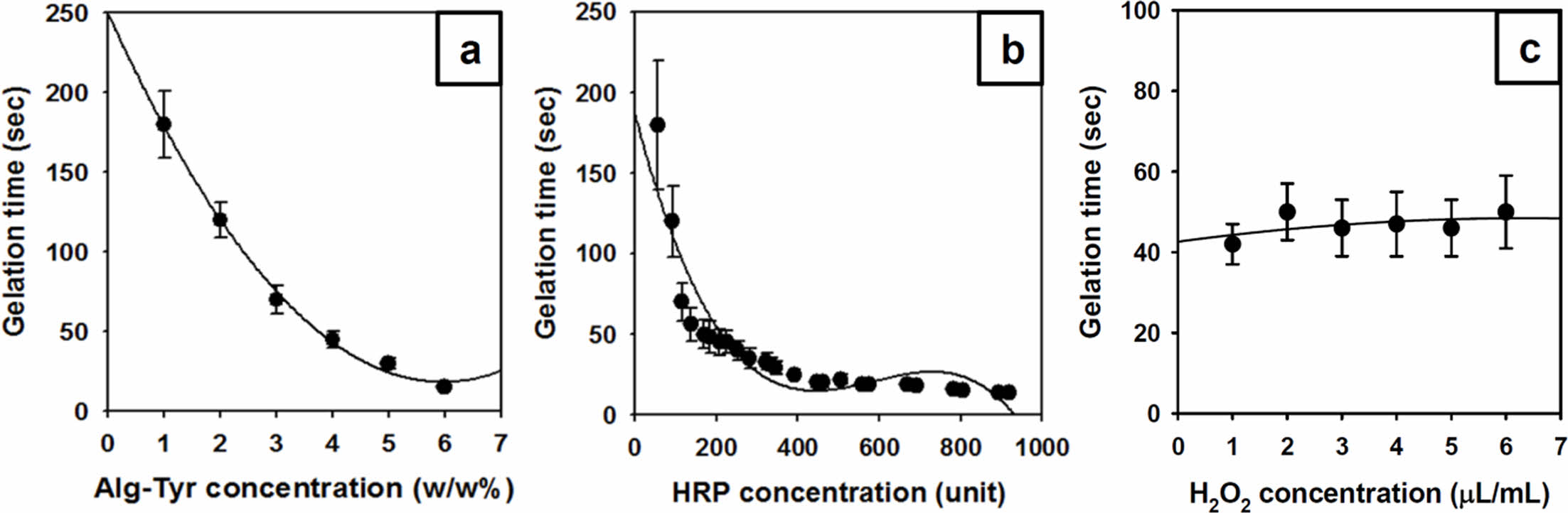
먼저, HRP의 농도를 0.2 mg/mL, H2O2의 농도를 5 μL/mL로 고정하고, Alg-Tyr 용액의 농도에 따른 알긴산 하이드로젤의 유변학적 변화를 측정하였다. 젤화가 진행되기 전 Alg-Tyr 용액의 농도가 증가함에 따라 저장탄성률의 급격한 증가가 확인되었고 Alg-Tyr 용액의 농도가 증가할수록 G'의 값이 평형구간에 이르는 시간이 단축되었으며 최종 G'의 수치도 비례하여 높게 나타났다(Figure 3(a)). 이는 하이드로젤을 구성하는 주성분인 Alg-Tyr 용액의 농도가 증가함에 따라 알긴산 하이드로젤을 구성하는 Alg-Tyr 주사슬의 분자량 뿐만아니라 주사슬에 도입된 티라민 페놀그룹 중간체의 가교점 단위 수량이 증가하여 더욱 높은 가교밀도를 형성하고 저농도일 때보다 저장탄성률이 높아진 것으로 사료된다. Kiselioviene의 연구에 의하면 피부조직의 창상피복제는 400-600 Pa 정도의 탄성률이 적합하다는 보고를 바탕으로 최소한 Alg-Tyr 용액 3 w/w% 이상의 농도에서 주사형 하이드로젤로 적용가능한 평형구간의 G' 값을 가지는 것을 확인할 수 있었다.31 창상치료용 하이드로젤의 제조에 있어서 저장탄성율과 함께 고려되어야 할 요소는 젤화시간이다. Figure 4(a)에서와 같이 Alg-Tyr 용액의 농도가 증가할수록 젤화시간은 급격히 단축되었다. 앞서 언급한 바와 동일하게, Alg-Tyr 용액에 포함된 가교점 단위수의 증가에 따른 젤화속도에 의한 영향인 것으로 사료된다. 주사형 창상치료제로 적용하기 용이한 젤화시간을 고려하였을 때, 30초 전후의 젤화시간을 가지는 Alg-Tyr 용액 4 w/w%를 기준농도로 설정하였다.
Alg-Tyr 용액의 농도를 4 w/w%, H2O2의 농도를 5 μL/mL로 고정하고 HRP의 농도에 따라 저장탄성률을 측정한 결과, HRP의 농도가 증가함에 따라 저장탄성률도 비례하여 증가하지만, 50초 이내의 짧은 시간에 모든 HRP 농도 그룹이 평형구간에 도달하였다(Figure 3(b)). 이는 Alg-Tyr의 주사슬에 도입된 티라민 페닐그룹을 산화시켜 중간체 형성에 영향을 미치는 HRP의 농도가 증가함으로써 산화라디칼의 수가 많아지고 이에 따라 알긴산 하이드로젤의 저장탄성률이 짧은 시간에 급격히 상승하였다고 판단하였다. 따라서 피부조직에 적용할 창상치료용 Alg-Tyr 용액의 농도는 4 w/w%, H2O2는 5 μL/mL, HRP의 농도는 젤화시간의 측정값을 기준으로 설정하고자 하였다. Figure 4에서와 같이, HRP의 농도 증가에 따라 하이드로젤의 젤화시간은 단축되었다. 이는 HRP의 농도가 증가할수록 G'의 평형구간에 이르는 시간이 단축된 결과와 일관성 있는 결과라고 할 수 있다. 본 연구는 창상치유를 위한 주사형 하이드로젤의 개발이 목표이므로 너무 빠른 젤화시간은 상처에 완전히 도포하기에 시간적 여유가 없으며, 오히려 너무 느리면 상처에서 쉽게 흘러내리므로 30초 정도의 젤화시간을 가지는 HRP 0.2 mg/mL의 농도가 적절한 것으로 사료되어 기준농도로 설정하였다.
기존의 연구결과에 의하면 젤화반응에 참여하는 H2O2의 농도 또한 하이드로젤의 유변학적 특성에 영향이 있으며, 본 연구에서도 H2O2의 농도가 증가할수록 G' 값이 다소 증가하는 것을 확인하였다(Figure 3(c)). 다만 앞선 실험결과와는 달리 젤화시간은 크게 차이가 없는 것을 확인하였다(Figure 4(c)). 이를 통해 필요한 G' 값을 얻기 위해서는 H2O2 5 μL/mL 이상이 되어야하는 것을 확인하였지만, H2O2가 세포에 독성을 나타내므로 가교반응에 필요한 최소치인 4 μL/mL를 적절한 농도로 설정하였다. Alg-Tyr 용액, HRP 및 H2O2의 농도는 유변학적 특성뿐만 아니라 하이드로젤의 물성에도 영향을 준다. 이와 같이, Alg-Tyr 용액과 HRP 농도의 경우 농도가 높아지면 젤화시간이 빨라지며 농도가 낮을 경우 젤화시간이 감소되면서 알긴산 하이드로젤의 젤화시간을 조절할 수 있지만 H2O2는 농도가 변해도 젤화시간에는 거의 영향을 주지 않음을 확인하였다. 이는 H2O2의 농도(4 μL/mL)는 이미 초과로 존재하여 H2O2를 산화시켜 라디칼로 만드는 효소촉매나 가교 반응기의 수와 직접적으로 연관되는 Alg-Tyr 용액의 농도가 가교속도에 있어서 더욱 주요하게 작용한다고 판단하였다. 따라서 가교가 진행되지 않는 3 μL/mL 이하의 H2O2의 농도는 제외하고 4 μL/mL 이상의 농도를 사용하였다. 즉, 30초 이내의 젤화시간을 가지며, 적합한 저장탄성률을 가지는 알긴산 하이드로젤은 4 w/w% Alg-Tyr 용액, 0.2 mg/mL HRP, 4 μL/mL H2O2 농도배합이 적합하다고 판단하였다.
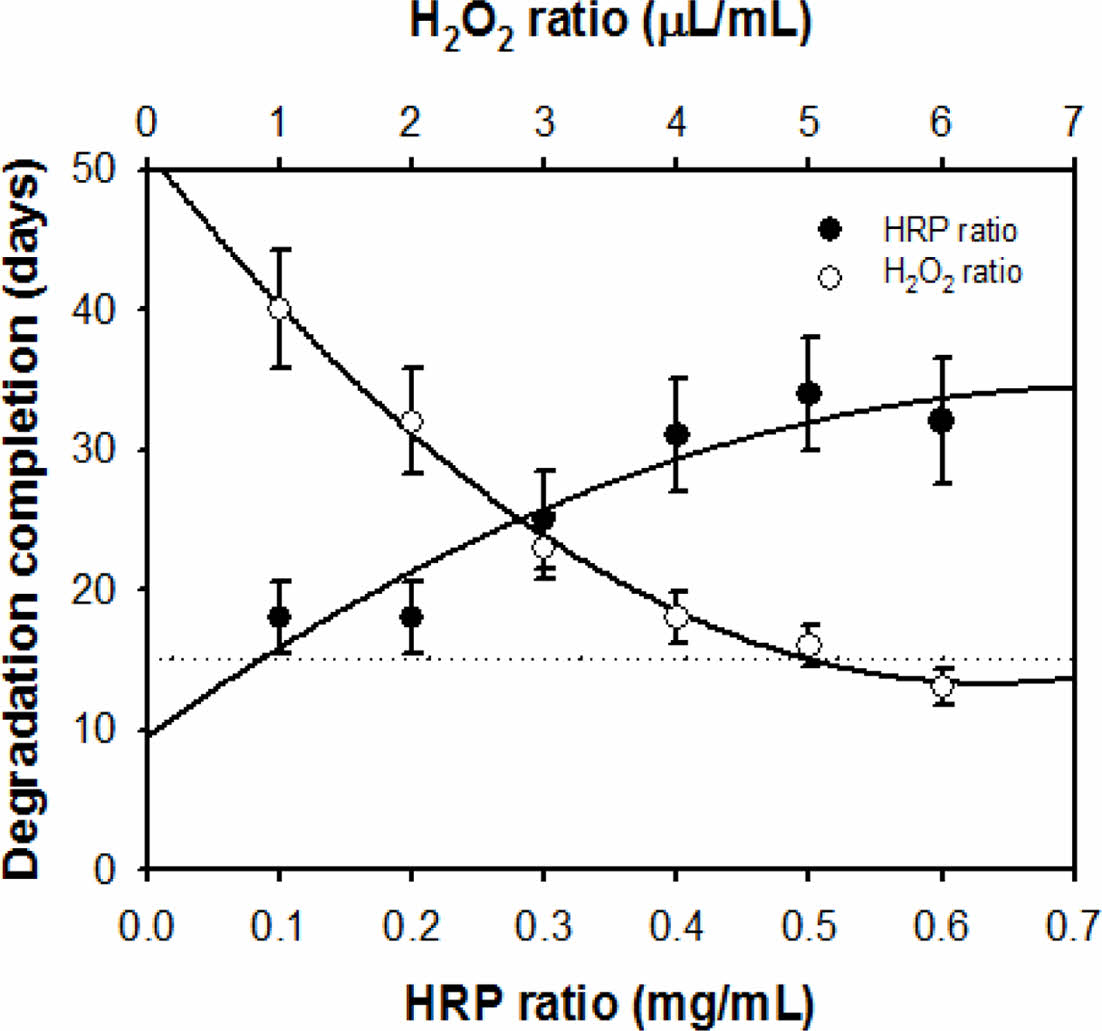
가수분해 거동 평가. 천연고분자인 알긴산은 일정시간이 경과하면서 임의적인 가수분해에 의한 형태붕괴가 진행된다.6 반면, 효소촉매 가교반응에 의하여 형성된 하이드로젤의 분해거동은 HRP와 H2O2의 배합농도를 통해 조절할 수 있다는 장점이 있다. 본 연구에서는 in vitro 환경에서의 생리식염수에 의한 가수분해 거동을 분석하여 창상치료제로서의 최적시점의 가수분해도를 조사하고자 하였다. 티라민이 도입된 알긴산 하이드로젤의 Alg-Tyr 용액농도 4 w/w% 및 H2O2 농도 4 μL/mL 변수는 고정하고 HRP의 농도에 따른 분해완료 시점을 측정하였다. HRP의 농도가 증가할수록 알긴산 하이드로젤의 분해가 지연되는 경향을 보였다. 앞서 유변학적 거동에서도 서술하였듯이 HRP에 의하여 산화된 페놀그룹 중간체는 가교점 역할을 하기 때문에, HRP의 농도에 비례하여 하이드로젤의 가교밀도를 증가시킴으로 가수분해 종료시점을 지연시키는 것으로 사료된다(Figure 5). 다음으로, H2O2의 농도에 따른 알긴산 하이드로젤의 분해시간을 측정한 결과(Alg-Tyr의 농도 4 w/w%, HRP의 농도 0.2 mg/mL로 고정), H2O2의 농도가 증가할수록 분해시간이 단축되는 것을 확인하였다. 이는 H2O2가 효소촉매 가교반응의 기질 역할을 수행하는 동시에 분해에도 영향을 주는 것으로 사료된다. 위 분석결과들을 토대로 HRP 및 H2O2의 농도를 조절하여 알긴산 하이드로젤의 분해속도를 조절할 수 있다. 창상치료제의 가수분해 완료시점을 15일로 설정하고자 한다면 Alg-Tyr 용액 4 w/w%, HRP 0.2 mg/mL, H2O2 4 μL/mL 농도의 배합조건으로 알긴산 하이드로젤을 제조할 수 있으며, 이후의 모든 실험군에 적용하여 사용하였다.
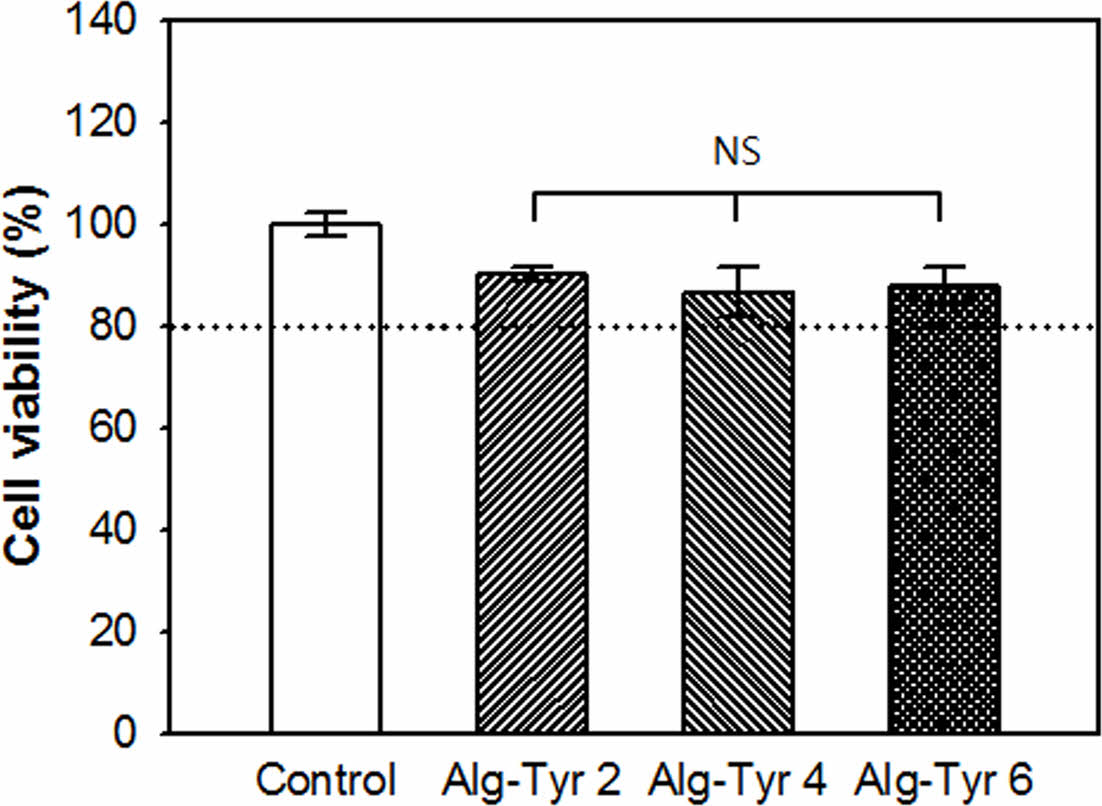
In vitro 세포독성 평가. 창상치료제는 노출된 결손조직과 직접적으로 접촉되는 의료용 소재로 in vitro 세포독성평가를 진행하여 생체적합성 확인이 필요하다. 세포독성평가는 국제시험규격 ISO 10993-5 중 extract test법을 사용하여 알긴산 하이드로젤 용출액을 마우스 섬유아세포(NIH-3T3)에 분주하여 세포의 형태변화와 생존율의 산출을 통해 독성여부를 평가하였다(Figure 6). 알긴산 하이드로젤 실험군 용출액을 적용한 세포의 형태적 변화와 탈착정도를 정성적으로 분석한 결과, 육안으로는 균일한 세포단층을 유지하는 것으로 보였으며 광학현미경을 통한 관찰에서도 심각한 성장저해는 관찰되지 않았다. 이는 알긴산 하이드로젤의 용출액이 배양세포에 대한 독성이 미미하다고 판단할 수 있다. 이후 MTT assay를 통한 정량분석 결과 또한 대조군과 비교하여 Alg-Tyr 하이드로젤 2, 4, 6 w/w% 용출액 실험군에서 모두 80% 이상의 세포생존율을 보여주었다. 이는 세포독성 평가기준에 따라 Grade 1(slightly cytotoxic) 등급으로 판정되며 의료용 창상치료제로의 적용이 가능한 수준인 것으로 확인 할 수 있었다.
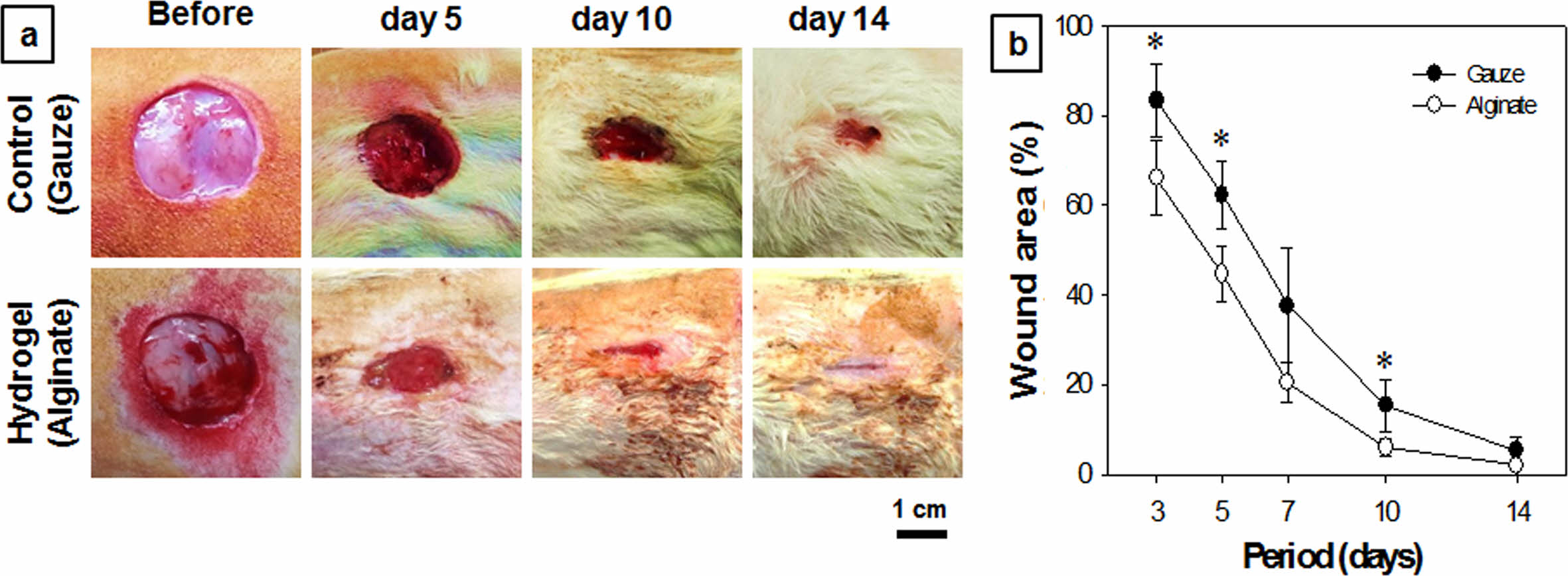
In vivo 창상치유도 평가. 본 연구의 피부전층창상 동물모델 실험은 SD rat의 피부에 임계결손면적(critical defect area)을 초과하는 원형(직경 2 cm)의 창상을 유발하고, 창상치료용 시료를 적용하여 시간경과에 따른 창상의 외형적 성상, 넓이를 측정하여 치유도를 평가하는 방법이다. In vivo 동물실험에 적용할 실험군의 알긴산 하이드로젤 창상치료제는 생분해기간을 고려하여 Alg-Tyr, 4 w/w%, HRP 0.2 mg/mL, H2O2 4 μL/mL 농도의 배합비로 2액형 혼합주사기를 이용하여 적용하였으며, 대조군으로는 면직물 거즈를 사용하였다. 피부 전층창상유발 수술 후, 각 시료를 적용한 창상의 외형을 확인한 결과, 5일 및 10일차에서 대조군(거즈)의 창상은 결손조직 부위에 습윤환경이 형성되지 않아 복막과 결손조직의 경계가 거칠고 뚜렷한 반면, 실험군(알긴산 하이드로젤)에서의 창상표면과 결손조직의 경계부에서는 습윤환경에 의한 부드러운 상태의 표피형성이 관찰되었다(Figure 7(a)). 또한, 3, 5, 7, 10, 14일차에서의 창상의 면적을 비교한 결과에서도 알긴산 하이드로젤이 대조군으로 사용한 거즈보다 모든 기간에서 높은 창상치유속도를 나타내었다(Figure 7(b)). 창상면적 그래프에서와 같이 3~10일차에서 창상면적의 급격한 축소를 보이다가 10일차 이후부터는 현저한 차이가 없었다. 이는 창상이 발생한 초기단계에서의 알긴산 하이드로젤이 상처에서 발생하는 삼출물을 보존하고, 상처부위에 밀착하여 외부의 오염물로부터 창상면을 보호하는 동시에 습윤환경을 유지시켜 창상면적의 신속한 수복에 기여한 것으로 사료된다. 특히, 대조군에서는 창상치유 과정에서 삼출물이 건조드레싱제인 거즈의 면직물 네트(net)면 사이에서 건조되어 고착되고, 신생조직이 증식하면서 거즈 교체 시 2차 손상을 초래하여 출혈이 발생하였으며, 이에 의한 치유속도의 지연도 영향이 있는 것으로 판단된다. 또한, 거즈는 알긴산 하이드로젤에 비해 2차 감염으로 보이는 화농성 염증이 관찰되는 개체들이 발생되었다. 반면, 알긴산 하이드로젤은 창상면에 고착되는 현상이 적었으며, 삼출물 흡수로 인한 하이드로젤의 부분적 팽윤(swelling)이 나타났다. 각 창상면적 산출값의 통계분석 비교에서도 거즈 대조군에 비하여 알긴산 하이드로젤 실험군의 창상치유도 값이 유의미함을 검증할 수 있었다.
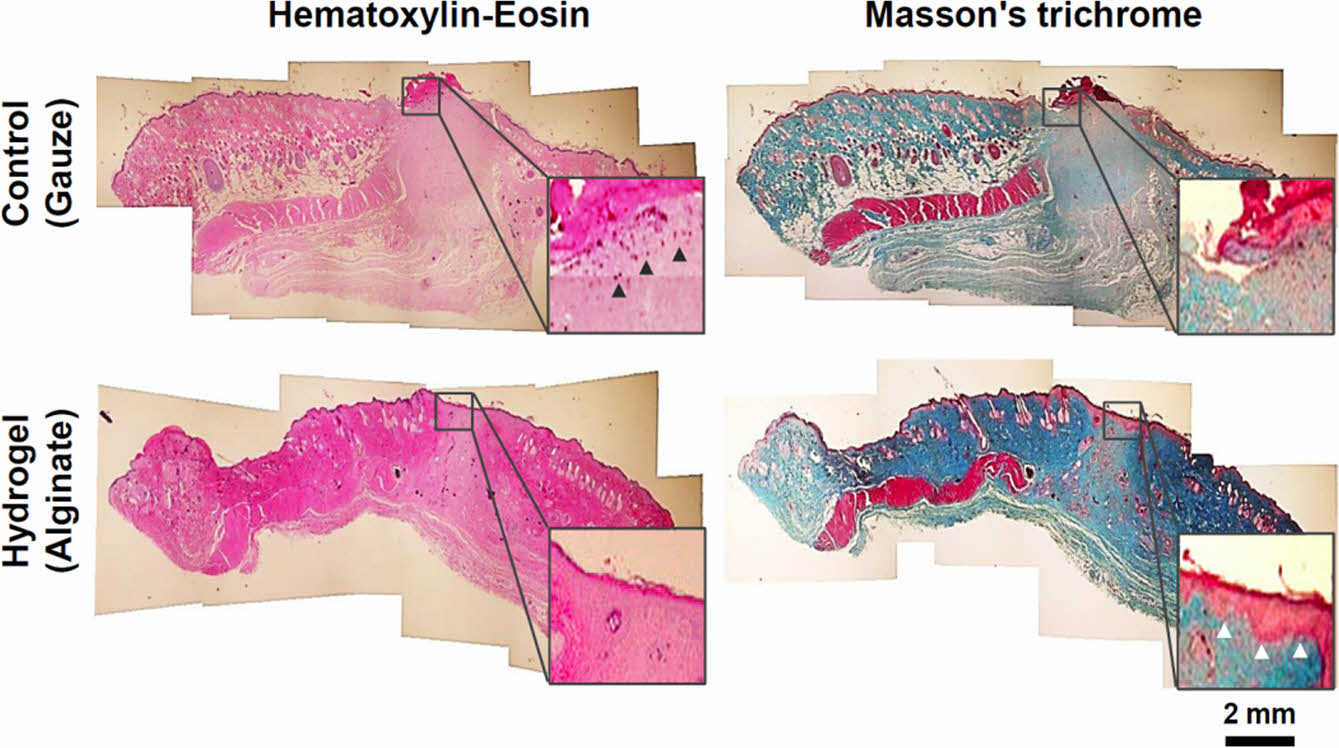
조직학적 평가. SD rat을 대상으로 한 피부전층창상 동물모델의 14일차에 조직을 채취하여 조직학적 분석을 진행하였다. Figure 8에서와 같이, H&E 및 Masson’s trichrome 조직염색을 통하여 결손된 조직경계부 종단면의 염증세포 분포와 표피조직의 재생형태 및 진피조직의 성숙도를 분석할 수 있었다. 창상을 유발한 조직의 14일차는 지혈/염증단계, 육아조직 증식단계 및 상피화의 단계 후반부와 중첩된 조직 성숙화 단계로 볼 수 있다. 대조군은 결손부 표피조직의 수복이 불완전하고 진피의 재생정도가 미성숙 상태였으며, 확대한 H&E 염색사진에서와 같이 육아조직이 과다하게 형성된 표피의 하단부에 염증세포 중에서 대식세포들이 많이 관찰되었다. 반면, 실험군은 진피의 증식상태가 대조군에 비하여 성숙한 상태였으며 선명하게 수복된 표피의 재생이 관찰되었고 염증세포가 거의 관찰되지 않았다. 또한, Masson’s trichrome 염색사진에서도 대조군의 과다한 육아조직과 불완전한 표피의 재생이 관찰되었으나, 실험군에서는 선명한 표피조직 수복 및 성숙된 진피조직의 콜라겐이 확인되었다. 이는 알긴산 하이드로젤이 결손조직의 상부표면에 밀착하여 창상치유과정의 초기에 발생할 수 있는 과도한 염증반응을 완화하고, 최적의 습윤환경을 조성함으로써 후속적인 섬유아세포의 증식 및 성숙화 단계로의 진입을 촉진한 결과에 의한 것으로 사료된다.
|
Figure 1 ATR-FTIR spectra of (a) the alginate; (b) the tyramine; (c) the modified alginate with tyramine (Alg-Tyr). The peaks of the Alg-Tyr compound of -CONH group at 1640 cm-1 and of O-H stretching at 3300-3200 cm-1 were originated from alginate and tyramine by EDC/NHS coupling reaction. |
|
Figure 2 1H NMR spectra of (a) the alginate; (b) the modified alginate with tyramine (Alg-Tyr) compound. The characteristic peaks of tyramine moiety in Alg-Tyr compound specimen were detected at (A) 6.9 ppm; (B) 7.2 ppm. The hydrogen peaks at (C) 5 ppm indicate reference peak of the alginate. |
|
Figure 3 The storage modulus (G') of the alginate hydrogels according to concentrations of (a) the Alg-Tyr solution at HRP 0.2 mg/mL, H2O2 5 μL/mL; (b) the HRP at Alg-Tyr 4 w/w%, H2O2 5 μL/mL; (c) the H2O2 at Alg-Tyr 4 w/w%, HRP 0.2 mg/mL, respectively |
|
Figure 4 Gelation time of the alginate hydrogels according to concentration of (a) the Alg-Tyr solution at HRP 0.2 mg/mL, H2O2 5 μL/mL; (b) the HRP (0.2 mg/mL = 460 unit) at Alg-Tyr 4 w/w%, H2O2 5 μL/mL; (c) the H2O2 at Alg-Tyr 4 w/w%, HRP 0.2 mg/mL, respectively (n = 3). |
|
Figure 5 Hydrolytic degradation completion time of the alginate hydrogels according to the HRP (at Alg-Tyr 4 w/w%, H2O2 4 μL/mL) and the H2O2 (at Alg-Tyr 4 w/w%, HRP 0.2 mg/mL) ratios, respectively (n = 3). |
|
Figure 6 Cell viability of alginate hydrogels with various concentration of alginate-tyramine (Alg-Tyr) solutions (at HRP 0.2 mg/mL, H2O2 4 μL/mL with 2, 4 and 6 w/w% of Alg-Tyr) (n = 5, NS means not significant). |
|
Figure 7 (a) Photographs; (b) wound area of in vivo rat skin defect model as a function of period of wounds treated with gauzes and alginate hydrogel dressings. Paired student t-test repeat with two groups (n = 5, *p < 0.05). |
|
Figure 8 Histological observation of the regenerated skin tissue layers with hematoxylin-eosin (pink; cytoplasm, dark blue; nuclei) and Masson’s trichrome (dark red; keratin and muscle fibers, pink; cytoplasm, light blue; collagen, dark blue; nuclei) staining by treating with the gauze controls and the alginate hydrogels as wound dressings after 14 days of SD rat skin defect model surgery. The black and white triangles in magnified square insets indicate inflammatory cells (macrophage) and regenerated epidermal tissues, respectively. |
본 연구에서 제조한 창상치료제는 효소촉매 가교반응을 이용한 알긴산 기반의 in situ 하이드로젤이다. 알긴산의 주쇄에 화학적 가교점 역할을 할 수 있는 티라민을 EDC/NHS 합성반응으로 도입하였으며, ATR-FTIR 및 1H NMR을 통하여 개질된 알긴산의 관능기를 확인하였다. 알긴산 하이드로젤의 저장탄성률은 배합된 Alg-Tyr 용액의 농도에 비례하여 증가하였으나, HRP 및 H2O2의 농도에 따른 증가폭은 미미하였다. 더불어, 알긴산 하이드로젤의 젤화시간은 배합된 Alg-Tyr 용액 및 HRP의 농도에 비례하여 감소하였으나, H2O2의 농도에 따른 변화 경향성은 없었다. 알긴산 하이드로젤의 가수분해 종료시점은 배합된 HRP의 농도에 따라 증가한 반면, H2O2의 농도에 따라 감소하는 것으로 나타났다. Alg-Tyr 용액, HRP 및 H2O2의 배합농도에 따른 효소촉매 가교반응에서 알긴산 하이드로젤의 저장탄성률, 젤화시간, 가수분해도의 종합적인 분석을 통하여 Alg-Tyr 용액 4 w/w%, HRP 0.2 mg/mL, H2O2 4 μL/mL의 농도를 의료용 창상치료제로서의 최적화 배합농도로 설정하여 성능평가에 적용하였다. In vitro 생체적합성이 검증된 알긴산 하이드로젤을 in vivo 피부전층창상 동물실험에 적용한 결과, 거즈를 사용한 대조군에 비하여 창상피부조직과의 우수한 밀착성 및 습윤환경 조성에 의한 향상된 회복속도를 나타내었으며, H&E 및 Masson’s trichrome 염색을 통한 조직학적 분석에서도 촉진된 진피 및 표피조직의 재생능을 보여주었다. 위와 같이 효소촉매 가교반응을 통하여 물리화학적 특성이 최적화된 주사형 알긴산 하이드로젤의 성능이 검증되었으며, 주사형 창상치료제로서의 응용가능성이 기대된다.
- 1. Langer, R.; Vacanti, J. P. Tissue Engineering. Science 1993, 260, 920-926.
-

- 2. Hollister, S. J. Porous Scaffold Design for Tissue Engineering. Nat. Mater. 2006, 4, 518-524.
- 3. Hubbell, J. A. Biomaterials in Tissue Engineering. Nat. Biotechnol. 1995, 13, 565-576.
- 4. Hanna, J. R.; Giacopelli, J. A. A Review of Wound Healing and Wound Dressing Products. J. Foot Ankle Surg. 1997, 36, 2-14.
-

- 5. Zeng, D.; Shen, S.; Fan, D. Molecular Design, Synthesis Strategies and Recent Advances of Hydrogels for Wound Dressing Applications. Chin. J. Chem. Eng. 2021, 30, 308-320.
-

- 6. Zhang, M.; Zhao, X. Alginate Hydrogel Dressings for Advanced Wound Management. Int. J. Biol. Macromol. 2020, 162, 1414-1428.
-

- 7. Winter, G. D. Formation of the Scab and the Rate of Epithelization of Superficial Wounds in the Skin of the Young Domestic Pig. Nature 1962, 193, 293-294.
-

- 8. Rovee, D. T. Evolution of Wound Dressings and their Effects on the Healing Process. Clin. Mater. 1991, 8, 183-188.
-

- 9. Cheng, H.; Shi, Z.; Yue, K.; Huang, X.; Xu, Y.; Gao, C.; Yao, Z.; Zhang, Y. S.; Wang, J. Sprayable Hydrogel Dressing Accelerates Wound Healing with Combined Reactive Oxygen Species-Scavenging and Antibacterial Abilities. Acta Biomater. 2021, 124, 219-232.
-

- 10. Amirsadeghi, A.; Jafari, A.; Hashemi, S.-S.; Kazemi, A.; Ghasemi, Y.; Derakhshanfar, A.; Shahbazi, M.-A.; Niknezhad, S.V. Sprayable Antibacterial Persian Gum-Silver Nanoparticle Dressing for Wound Healing Acceleration. Mater. Today Commun. 2021, 27, 102225.
-

- 11. Dauton, C.; Kothari, S.; Smith, L.; Steele, D. A History of Materials and Practices for Wound Management, Wound Prac. Res. 2012, 20, 174-186.
- 12. Varaprasad, K.; Raghavendra, G. M.; Jayaramudu, T. A Mini Review on Hydrogels Classification and Recent Developments in Miscellaneous Applications. Mater. Sci. Eng. C 2017, 79, 958-971.
-

- 13. Ullah, F.; Othman M. B. H.; Javed, F.; Ahmad, Z.; Akil, H. M. Classification, Processing and Application of Hydrogels: A Review. Mater. Sci. Eng. C 2015, 57, 414-433.
-

- 14. Bang, S.; Lee, E.; Ko, Y.-G.; Kim, W. I.; Kwon, O. H. Injectable Pullulan Hydrogel for the Prevention of Postoperative Tissue Adhesion. Int. J. Biol. Macromol. 2016, 87, 155-162.
-

- 15. Drumheller, P.; Hubbell, J. Hydrogels for Biomedical Applications. J. Biomed. Mater. Res. 1995, 29, 201-215.
- 16. Lutolf, M. P.; Lauer-Fields, J. L.; Schmoekel, H. G.; Metters, A. T.; Weber, F. E.; Fields, G. B.; Hubbell, J. A. Synthetic Matrix Metalloproteinase-Sensitive Hydrogels for the Conduction of Tissue Regeneration: Engineering Cell-Invasion Characteristics. Proc. Natl. Acad. Sci. U.S.A. 2003, 100, 5413-5418.
-

- 17. Shu, X. Z.; Liu,Y.; Palumbo, F. S.; Luo, Y.; Prestwich, G. D. In Situ Crosslinkable Hyaluronan Hydrogels for Tissue Engineering. Biomaterials 2004, 25, 1339-1348.
-

- 18. Lee, B. H.; West, B.; McLemore, R.; Pauken, C.; Vernon, B. L. In-Situ Injectable Physically and Chemically Gelling NIPAAm-Based Copolymer System for Embolization. Biomacromolecules 2006, 7, 2059-2064.
-

- 19. Shu, X. Z.; Liu, Y.; Luo, Y.; Roberts, M. C.; Prestwich, G. D. Disulfide Cross-Linked Hyaluronan Hydrogels. Biomacromolecules 2002, 3, 1304-1311.
-

- 20. Yeo, Y.; Highley, C. B.; Bellas, E.; Ito, T.; Marini, R.; Langer, R.; Kohane, D. S. In Situ Cross-Linkable Hyaluronic Acid Hydrogels Prevent Post-Operative Abdominal Adhesions in a Rabbit Model. Biomaterials 2006, 27, 5259-5267.
-

- 21. Brandl, F.; Sommer F.; Goepferich, A. Rational Design of Hydrogels for Tissue Engineering: Impact of Physical Factors on Cell Behavior. Biomaterials 2007, 28, 134-146.
-

- 22. Lee, F.; Chung, J. E.; Kurisawa, M. An Injectable Enzymatically Crosslinked Hyaluronic Acid-Tyramine Hydrogel System with Independent Tuning of Mechanical Strength and Gelation Rate. Soft Matter 2008, 4, 880-887.
-

- 23. Bang, S.; Ko, Y.-G.; Kim, W. I.; Cho, D.; Park, W. H.; Kwon, O. H. Preventing Postoperative Tissue Adhesion Using Injectable Carboxymethyl Cellulose-Pullulan Hydrogels. Int. J. Biol. Macromol. 2017, 105, 886-893.
-

- 24. Martinez-Diaz, G. J.; Nelson, D.; Crone, W. J.; Kao, W. J. Mechanical and Chemical Analysis of Gelatin-Based Hydrogel Degradation. Macromol. Chem. Phys. 2003, 204, 1898-1908.
-

- 25. Kim, Y.-H.; Cho, C.-S.; Kang, I.-K.; Kim, S. Y.; Kwon, O. H. Crosslinked Gelatin Nanofibers and Their Potential for Tissue Engineering. Key Eng. Mater. 2007, 342, 169-172.
-

- 26. Zhao, X.; Lang, Q.; Yildirimer, L.; Lin, Z. Y.; Cui, W.; Annabi, N.; Ng, K. W.; Dokmeci, M. R.; Ghaemmaghami, A. M.; Khademhosseini, A. Photocrosslinkable Gelatin Hydrogel for Epidermal Tissue Engineering. Adv. Healthc. Mater. 2016, 5, 108-118.
-

- 27. Sakai, S.; Hirose, K.; Taguchi, K.; Qgushi, Y.; Kawakami, K. An Injectable, In Situ Enzymatically Gellable, Gelatin Derivative for Drug Delivery and Tissue Engineering. Biomaterials 2009, 30, 3371-3377.
-

- 28. Akkara, J. A.; Senecal, K. J.; Kaplan, D. L. Synthesis and Characterization of Polymers Produced by Horseradish Peroxidase in Dioxane. J. Polym. Sci.: A Polym. Chem. 1991, 29, 1561-1574.
-

- 29. Ghasempur, S.; Torabi, S. F.; Siadat, S. O. R.; Heravi, M. J.; Ghami, N.; Khajeh, K. Optimization of Peroxidase-Catalyzed Oxidative Coupling Process for Phenol Removal from Wastewater Using Response Surface Methodology. Environ. Sci. Technol. 2007, 41, 7073-7079.
-

- 30. Linh, N. T. B.; Abueva, C. D. G.; Lee, B.-T. Enzymatic In Situ Formed Hydrogel from Gelatin–Tyramine and Chitosan-4-Hydroxylphenyl Acetamide for the Co-Delivery of Human Adipose-Derived Stem Cells and Platelet-Derived Growth Factor Towards Vascularization. Biomed. Mater. 2017, 12, 015026.
-

- 31. Kiselioviene, S.; Baniukaitiene, O.; Harkavenko, V.; Babenko, N. A.; Liesiene, J. Cellulose Hydrogel Sheets for Wound Dressings. Cellulose Chem. Technol. 2016, 50, 915-923.
- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2023; 47(4): 469-478
Published online Jul 25, 2023
- 10.7317/pk.2023.47.4.469
- Received on Feb 28, 2023
- Revised on Apr 13, 2023
- Accepted on Apr 17, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Oh Hyeong Kwon
-
Department of Polymer Science and Engineering, Kumoh National Institute of Technology, Gumi, Gyeongbuk 39177, Korea
- E-mail: ohkwon@kumoh.ac.kr
- ORCID:
0000-0002-7160-0105









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.