- Synthesis and Characterization of Cyclopentadithiophene and Pyridylthiadiazole-based Polymers with Single and Double Bonds
Division of Chemical Engineering, Dongseo University, Busan 47011, Korea
- Cyclopentadithiophene(CDT)과 Pyridylthiadiazole(PT)에 기반을 둔 단일결합과 이중결합을 갖는 전도성 고분자 합성 및 분석
동서대학교 화학공학부
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
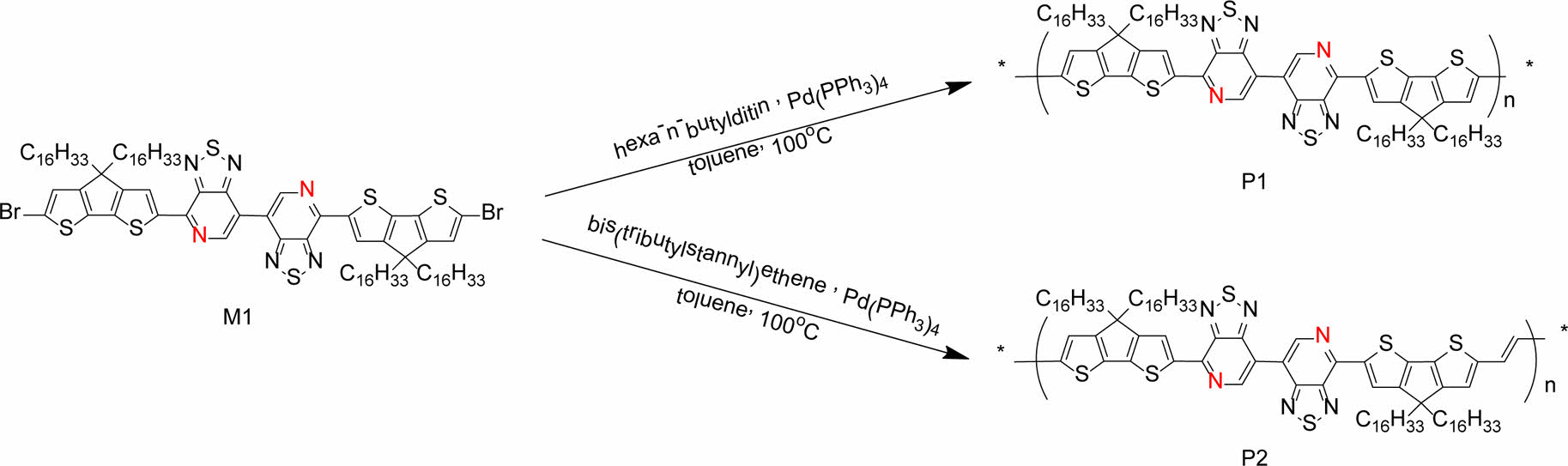
D-D-A-A type conjugated polymers with both cyclopentadithiopene and prydylthiadiazole, poly(4-(4,4,4',4'- tetrahexadecyl-4H,4'H-[2,2'-bi(cyclopenta[1,2-b:5,4-b']dithiophen)]-6-yl)-7,7'-bi[1,2,5]thiadiazolo[3,4-c]pyridine) (P1) and poly((E)-4-(6-(2-(4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)vinyl)-4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)-7,7'-bi[1,2,5]thiadiazolo[3,4-c]pyridine) (P2) were synthesized. To investigate optoelectro properties and theorical study, UV-visible spectroscopy, cyclic voltammetry, and density functional theory were carried out.
Poly(4-(4,4,4',4'-tetrahexadecyl-4H,4'H-[2,2'-bi(cyclopenta[1,2-b:5,4-b']dithiophen)]-6-yl)-7,7'-bi[1,2,5]thiadiazolo [3,4-c]pyridine) (P1)과 poly((E)-4-(6-(2-(4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)vinyl)-4,4-dihexadecyl4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)-7,7'-bi[1,2,5]thiadiazolo[3,4-c]pyridine) (P2)를 이중 결합에 대한 효과를 확인하기 위하여 P1과 P2를 합성하였고, P1과 P2의 광전기화학적, 계산화학적 성질을 각각 측정하였다.
Polymers with both cyclopentadithiopene and prydylthiadiazole, poly(4-(4,4,4',4'-tetrahexadecyl4H,4'H-[2,2'-bi(cyclopenta[1,2-b:5,4-b']dithiophen)]-6-yl)-7,7'-bi[1,2,5]thiadiazolo[3,4-c]pyridine) (P1) and poly((E)-4-(6-(2-(4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)vinyl)- 4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)-7,7'-bi[1,2,5]thiadiazolo[3,4- c]pyridine) (P2) were synthesized and investigated on opto-electro properties and theorical study, UV-visible spectroscopy, cyclic voltammetry, and density functional theory (DFT).
Keywords: conjugated polymer, double bond, organic semiconductor, cyclopentadithiophene, pyridylthiadiazole.
이 논문은 2022년도 동서대학교 “Dongseo Frontier Project” 지원에 의하여 이루어진 것임.
저자들은 이해상충이 없음을 선언합니다.
전도성 고분자(conductive polymers, CPs)란 금속(metal)과 반도체(semiconductor)와 유사한 광전기화학적 성질(opto-electronic properties)을 가지고 있으며 파이 전자(π-electron)가 분자 골격(molecular skeleton)에 따라 비편재화(delocalization) 되어 있는 고분자를 말한다.1-3 지난 50년간 전도성 고분자의 다양한 분자 구조, 메케니즘, 합성법에 관한 연구가 이루어졌고 그 결과 유기발광다이오드(organic light-emitting diodes, OLEDs), 유기트랜지스터(organic field-effect transistors, OFETs), 유기태양전지(organic photovoltaics, OPVs) 등의 응용분야에서 많은 발전이 이루어졌다.4 그중 전자 풍부(electron rich) 부분을 갖는 전자 주개(donor, D)와 전자 부족(electron deficient) 부분을 갖는 전자 받개(acceptor, A)로 구성된 D-A 교대공중합체(alternating copolymer)는 흡광도(absorbance) 및 밴드갭(band gap)을 체계적으로 조절할 수 있고, 고체 상태(solid state)에서 분자 내 및 분자 간 인력(intra- and inter-molecular interaction)을 강하게 할 수 있는 등의 장점이 있다.4,5
사이클로펜타다이싸이오펜(cyclopenta[2,1-b:3,4-b']dithiophene, CDT)과 벤조타이아다이아졸(benzothiadiazole, BT)은 대표적인 D-A 형태의 고분자에 활용되며, 분자구조의 평면성(rigid coplanar structure)과 좋은 π-π interaction 등의 장점으로 활발한 연구가 진행되었고,6 BT보다 π-π interaction을 더 강하게 하기 위하여 이중 전자 받개(dual electron acceptor)를 도입한 bis-(2,1,3-benzothiadiazole)(bisBT)와 BT를 변형한 pyridal[2,1,3]- thiadiazole(PT) 등이 D-A 고분자의 전자 받개 부분으로 대체되어 사용되었다.7-12 하지만 PT 분자의 경우는 Suzuki 또는 Stille 커플링(coupling) 등을 활용한 D-A 교대배열 고분자 중합과정에서 분자의 비대칭성으로 위치규칙성(regioregularity)에 연구의 필요성이 제기되었으며, 이 부분에 대한 연구가 진행되어 위치규칙성을 갖는 PT 기반의 고분자가 위치규칙성을 갖지 않은(regiorandom) 고분자보다 더 높은 성능(전하이동도)을 갖는다는 것이 밝혀졌다.8 뿐만 아니라 최근에 위치규칙성을 갖는 bisPT의 연구가 진행되었지만 더 많은 이중 전자 받개에 관한 체계적인 연구의 필요성이 제기된다.13
탄소-탄소 이중결합(double bond)은 전도성 고분자의 연결부위(linker)로 많이 사용되며, 결과적으로 콘쥬게이션 길이의 확장(extended π-conjugation), 분자의 강직성(rigidity), 광·전기화학적 성질, 분자간 및 분자내 인력 등에 많은 영향을 미친다.9-13 하지만, D-A를 갖는 전도성 고분자의 분자 디자인 측면에 있어서 대부분의 연구는 연결부위 보다는 고분자의 분자골격에 관하여 진행되었다.14-16 현재까지의 연구에 따르면 비닐기(vinyl)가 첨가되면 분자간 및 분자내 인력을 더 증가시켜서 분자간 결합각(dihedral angle)을 줄인다고 알려져 있다.17 이러한 특성은 특히 전도성 고분자의 활용분야인 OFETs의 성능에 많은 영향을 미치기 때문에 싸이오펜 중간에 vinyl기를 연결부위로 갖는 2-[(E)-2-(2-thienyl)ethenyl]thiophene이 많이 활용되어지고 있다.17-22 따라서 비닐기가 도입된 다양한 전도성 고분자의 콘쥬게이션 길이(conjugation length), 광·전기화학적 성질, 계산 화학적 성질 등에 관한 체계적인 연구가 필요하다.
본 연구에서는 높은 전하이동도를 나타내는 것으로 보고되어 있으며, D-A 고분자로 많이 활용하는 CDT(전자주개, D)와 PT(전자 받개, A)를 D-D-A-A 구조를 갖는 고분자를 합성하기 위하여 활용하였다. 위치 규칙성을 갖는 bis-pyridal[2,1,3]-thiadiazole(bisPT)에 대한 전도성 고분자를 개발하기 위하여 Br-PT-CDT-CDT-PT-Br 구조의 단량체(monomer)를 먼저 합성하였다. 그런 후, CDT와 CDT 사이에 단일결합과 이중결합을 갖는 전도성 고분자 poly(4-(4,4,4',4'-tetrahexadecyl-4H,4'H-[2,2'-bi(cyclopenta [1,2-b:5,4-b']dithiophen)]-6-yl)-7,7'-bi[1,2,5]thiadiazolo[3,4-c]pyridine)(P1)과poly((E)-4-(6-(2-(4,4-dihexadecyl-4H-cyclopenta [1,2-b:5,4-b']dithiophen-2-yl)vinyl)-4,4-dihexadecyl-4H-cyclopenta [1,2-b:5,4-b']dithiophen-2-yl)-7,7'-bi[1,2,5]thiadiazolo[3,4-c]pyridine)(P2)를 Stille 커플링 반응으로 각각 합성하였다. 자외선 및 가시선 분광분석법(UV-visible spectrophotometry), 순환 전압 전류법(cyclic voltametry, CV), density functional theory (DFT)계산을 통해서 P1과 P2의 광학적, 전기화학적, 계산 화학적 성질을 각각 측정하였다.
시약, 재료, 기기.반응 중간체 및 고분자 합성에 있어서 필요한 시약은 Sigma-Aldrich, TCI, 그리고 Alfa사에서 구매하였고, 별도의 추가 정제 없이 사용하였다. 그 중 반응 용매는 ACS등급을 사용하였다. 4,4'-bis(6-bromo-4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)-7,7'-bi[1,2,5]thiadiazolo [3,4-c]pyridine(M1)은 문헌을 참고하여 합성하였고,8 hexa-n-butylditin과 trans-1,2-bis(tributylstannyl)ethene은 Sigma-Aldich사에서 구매하여 추가 정제없이 사용하였다. 합성한 반응 중간체 및 고분자의 화학구조는 1H와 13C NMR 400 MHz 퓨리에 변환 핵 자기 공명 분광법(Fourier transform-nuclear magnetic resonance, FT-NMR, AVANCE III HD, Bruker, 미국)로 측정 결과를 얻었다. 자외/가시광선 분광광도계(OPTIZEN POP, mecasys, 한국)를 사용하여 P1과 P2의 광학적 특성을 확인하였으며, P1과 P2를 클로로포름(chloroform, CF)에 녹인 용액 상태(solution state)와 스핀 코터(spin coater EF-4op, 이플렉스, 한국)를 이용하여 석영판(Quartz plate)에 코팅한 필름 상태를 각각 측정하였다. 고분자의 수 평균 분자량(Mn)과 다분산지수(poly dispersity index, PDI)는 polystyrene을 기준으로 하고 tetrahydrofuran (THF)을 이동상으로 하여 젤 투과 크로마토그래피(gel permeation chromatography, GPC, Agilent 1200S/miniDAWN TREOS, Agilent/Wyatt, 미국)를 통해 측정하였다. 전기화학적 특성은 CV(Versa STAT3, AMETEK, 미국)으로 측정하였다. 기준전극(reference electrode), 작업전극(working electrode), 상대전극(counter electrode)은 Ag/Ag+, carbon disk, platinum(Pt) wire로 각각 사용하였으며, 100 mV/s의 속도로 측정하였다. Acetonitrile (ACN)에 tetra-n-butylammonium hexafluorophosphate(n-Bu4NPF6)를 용해시켜 0.1 M의 전해질로 사용하였고, 기준전극(Ag/Ag+)은 페로센/페로세늄(ferrocene/ferrocenium) 산화/환원 반응으로 교정하였고, 산화 전위는 진공수준일 때 -4.8 eV를 기준으로 설정하였다. 고분자의 HOMO와 LUMO 준위는 HOMO(eV) = -(E(oxi)onset - E1/2(ferrocene) + 4.8)와 LUMO(eV) = -(E(red)onset - E1/2 (ferrocene) + 4.8)의 식으로 각각 계산하였다. 고분자의 HOMO/LUMO 준위, 분자구조의 최적화, 광학적 성질 예측 등을 확인하기 위해 밀도범함수 이론(density functional theory, DFT) (Gaussian 16, Becke three-parameter Lee-Yang-Parr(B3LYP) function, 6-31G basis set)을 활용하여 계산하였다.
중간체 및 전도성 고분자합성. 4,4'-bis(4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)-7,7'-bi[1,2,5]thiadiazolo [3,4-c]pyridine (M2).
M1(7.38 g, 8.77 mmol), Pd(PPh3)4 (0.30 g, 0.263 mmol), 그리고 hexa-n-butylditin(2.42 g, 4.18 mmol)을 500 mL 둥근 바닥 플라스크에 넣었다. 그런 후 anhydrous toluene(150 mL)을 넣어서 반응물을 용해시킨 후 110 ℃에서 300시간 동안 교반하였다. TLC로 M1이 없어진 것을 확인하고 상온까지 온도를 낮춰서 toluene을 회전증발농축기를 사용하여 제거하였다. 그런 후 dichloromethane(DCM)을 100 mL씩 5번 사용하여 증류수와 추출을 진행하였다. 유기층을 추출한 후 소량을 물을 제거하기 위하여 MgSO4를 사용하였고, 감압여과장치를 이용하여 MgSO4를 제거하였다. 그런 후 여과액을 회전증발농축기를 사용하여 DCM을 제거하였다. 정제되지 않은 혼합물을 실리카젤 컬럼크로마토그래피(hexane과 클로로포름의 부피비: 100/0부터 70/30까지)로 분리 정제하여 중간체 M2 4.34 g(수득률: 66%)을 합성하였다. 1H NMR(400 MHz, CDCl3) δ(ppm): 9.46(s, 2H), 8.64(s, 2H), 7.34(d, J=4.9 Hz, 2H), 7.01(d, 4.9 Hz, 2H), 2.03-1.93(m, 8H), 1.28-1.16 (m, 104H), 1.07-1.00(m, 8H), 0.88-0.84(m, 12H). 13C(CDCl3, 100MHz) δ(ppm): 160.90, 160.13, 156.35, 148.45, 148.31, 146.22, 144.05, 141.89, 136.78, 127.93, 127.17, 121.97, 119.26, 54.09, 38.01, 32.06, 30.17, 29.82, 29.79, 29.75, 29.54, 29.50, 24.75, 22.83, 14.27. MALDI-TOF m/z 1521.990(C92H140N2S6 calcd. for m/z 1522.530).
4,4'-bis(6-bromo-4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)-7,7'-bi[1,2,5]thiadiazolo[3,4-c]pyridine M3.
M2(3.50 g, 2.30 mmol)를 anhydrous THF를 argon 분위기에서 완전히 용해시킨 후 bromosuccinimide(NBS)(0.90 g, 5.06 mmol)를 천천히 첨가하였다. 반응물은 빛을 완전히 차단하여 48시간 상온에서 교반하였다. 반응물에 증류수를 넣어서 반응을 종결시킨 후 DCM을 100 mL씩 3번 넣어서 증류수와 추출을 진행하였다. 유기층을 분리한 후 소량의 물을 제거하기 위하여 MgSO4를 사용하였고, 감압여과장치를 이용하여 MgSO4를 제거하였으며, 여과액을 회전증발농축기를 사용하여 DCM을 제거하였다. 정제되지 않은 혼합물을 실리카젤 컬럼크로마토그래피(hexane과 클로로포름의 부피비: 100/0 부터 60/40까지)로 분리 정제하여 중간체 M3 2.30 g의 검푸른색의 오일로 얻었다(수득률: 60%). 1H NMR(400 MHz, CDCl3) δ(ppm): 9.45(1s, 2H), 8.61(s, 2H), 7.02(s, 2H), 1.98-1.85(m, 8H), 1.25-1.16(m, 104H), 1.06-1.00(m, 8H) 0.88-0.85(m, 12H). 13C NMR(100 MHz, CDCl3) δ(ppm): 160.90, 160.13, 156.35, 148.45, 148.31, 146.22, 144.05, 141.89, 136.78, 127.93, 127.17, 121.97, 119.26, 54.09, 38.01, 32.06, 30.17, 29.82, 29.79, 29.75, 29.54, 29.50, 24.75, 22.83, 14.27. MALDI-TOF m/z 1681.936(C92H138Br2N6S6 calcd. for m/z 1680.320).
Poly(4-(4,4,4',4'-tetrahexadecyl-4H,4'H-[2,2'-bi(cyclopenta [1,2-b:5,4-b']dithiophen)]-6-yl)-7,7'-bi[1,2,5]thiadiazolo[3,4-c]pyridine)P1.
M3(0.30 g, 0.178 mmol)과 hexa-n-butylditin(0.10 g, 0.090 mmol)을 Schlenk flask에 넣고 10 mL의 anhydrous toluene에 완전히 용해시켰다. 이후 Pd(PPh3)4 (6.10 mg, 5.36 μmol)를 혼합물에 첨가하고 argon 환경에서 100 ℃로 가열하며 24시간 동안 교반을 진행했다. 반응물을 methanol(250 mL)에 침전시켰고, 마이크로 여과장치를 이용하여 고체 침전물을 methanol과 분리하였다. 합성 과정에서 생성되는 불순물과 저분자량을 제거하기 위하여 속슬렛 추출(Soxhlet extraction)을 methanol, acetone, hexane순으로 각각 24시간 동안 진행하였고, 이후 속슬렛 추출로 chloroform에 녹아 나온 용액을 농축한 후 methanol에 다시 침전시켰다. 그런 후 마이크로 여과지로 여과한 후 진공오븐에서 48시간 건조하여 생성물 P1을 합성하였다(수득률=75%). Mn=89.3 kg/mol, Mw=319.2 kg/mol, PDI=3.57. 1H NMR(400 MHz): δ(ppm): 9.54-9.46(br, 2H), 8.68-8.62(br, 2H), 7.17-7.12(br, 1H), 7.05-6.99(br, 1H), 2.05-1.96(br, 8H), 1.58-1.07(br, 112H), 0.89-0.76(br, 12H).
Poly((E)-4-(6-(2-(4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)vinyl)-4,4-dihexadecyl-4H-cyclopenta[1,2-b:5,4-b']dithiophen-2-yl)-7,7'-bi[1,2,5]thiadiazolo[3,4-c]pyridine) P2.
M3(0.30 g, 0.178 mmol)와 trans-1,2-bis(tributylstannyl) ethene(0.11 g, 0.178 mmol)을 Schlenk flask에 넣고 20 mL의 anhydrous toluene에 완전히 용해시켰다. 이후 Pd(PPh3)4 (6.10 mg, 5.36 μmol)를 혼합물에 첨가하고 argon 환경에서 12시간 동안 100 ℃로 가열하며 교반을 진행했다. 그런 후 혼합물을 methanol(250 mL)에 침전시킨 후, 마이크로 여과지를 이용하여 침전물을 분리하였다. 합성 과정에서 나오는 불순물과 저분자량을 제거하기 위해서 속슬렛 추출(Soxhlet extraction)을 진행했다. 속슬렛 추출은 methanol, acetone, hexane에서 각각 24시간 동안 진행하였고, 이후 chloroform으로 속슬렛 추출한 용액을 농축한 후 methanol에 다시 침전시켰다. 여과지로 여과한 후 진공오븐에서 건조하여 청록색의 생성물을 얻었다(수득률=60%). Mn=48.3 kg/mol, Mw=84.2 kg/mol, PDI=1.74. 1H NMR(CDCl3, 400 MHz, 348 K): δ(ppm): 9.60-9.50(br, 2H), 8.75-8.65(br, 2H), 7.20-7.10(br, 2H), 4.99-4.80 (br, 2H), 2.00-0.50(br, 132H).
중간체 및 고분자 합성. M1은 문헌에 보고된 대로 대략 70%의 수득률 합성하였다.8 Scheme 1에서 보는 것과 같이 M1과 hexa-n-butylditin을 1:1 Stille 크로스 커플링 반응으로 반응 중간체는 M2를 66%의 수득률로 합성하였다. 그런 후 NBS를 사용하는 bromination 반응으로 단량체 M3를 60% 수득률로 합성하였다. 자세한 합성과정은 실험부분에 정리하였다. 전도성 고분자 P1과 P2를 각각 합성하기 위하여 M3와hexa-n-butylditin을 1:0.5몰수 비율로 사용하고 bis(tributylstannyl) ethene과는 1:1몰수비로 toluene에 용해시켜 Pd(PPh3)4 촉매 하에 Stille 크로스 커플링(Stille cross-coupling) 반응을 진행하여 75%와 60%의 수득률로 P1과 P2를 각각 합성하였다 (Scheme 2). 전도성 고분자 P1과 P2는 CDT 부분에 2개의 hexadecanyl곁사슬을 갖으며, repeating unit에는 총 4개의 탄화수소(hydrocarbon) 곁사슬(side chain)을 갖기 때문에 일반적으로 많이 사용되는 클로로포름, 클로로벤젠(chlorobenzene), THF(tetrahydrofuran) 등의 유기 용매에 좋은 용해도를 보였다. 고분자의 중합도(degree of polymerization)는 GPC로 측정하여 표준 polystyrene을 통해 검정하였다. P1과 P2의 수평균 분자량(Mn)은 각각 89.3과 48.3 kg/mol이었고, 다분산도(poly dispersity index, PDI)는 각각 3.57과 1.74였다. 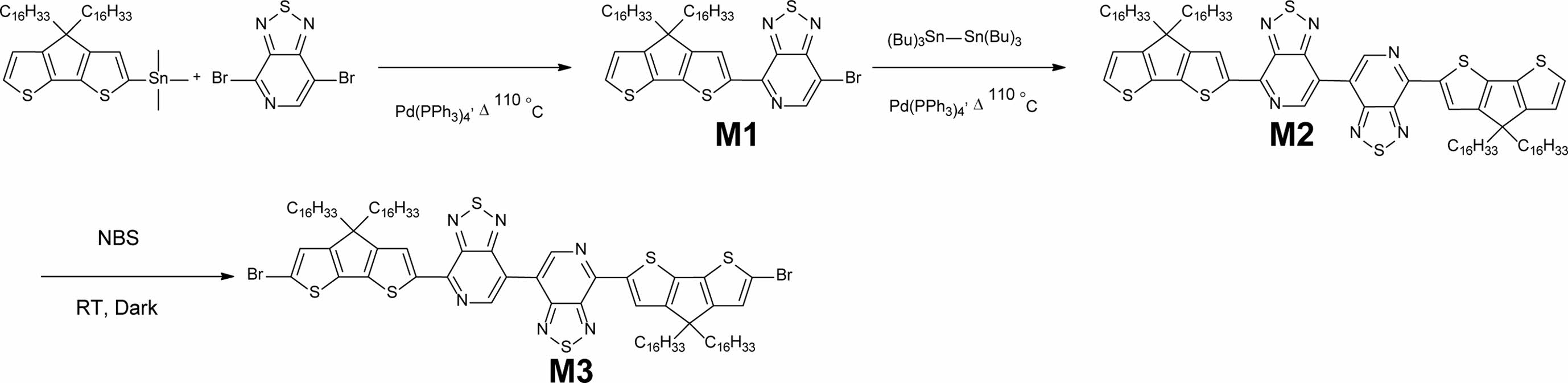
Scheme 1. Synthetic routes of M1, M2, and M3.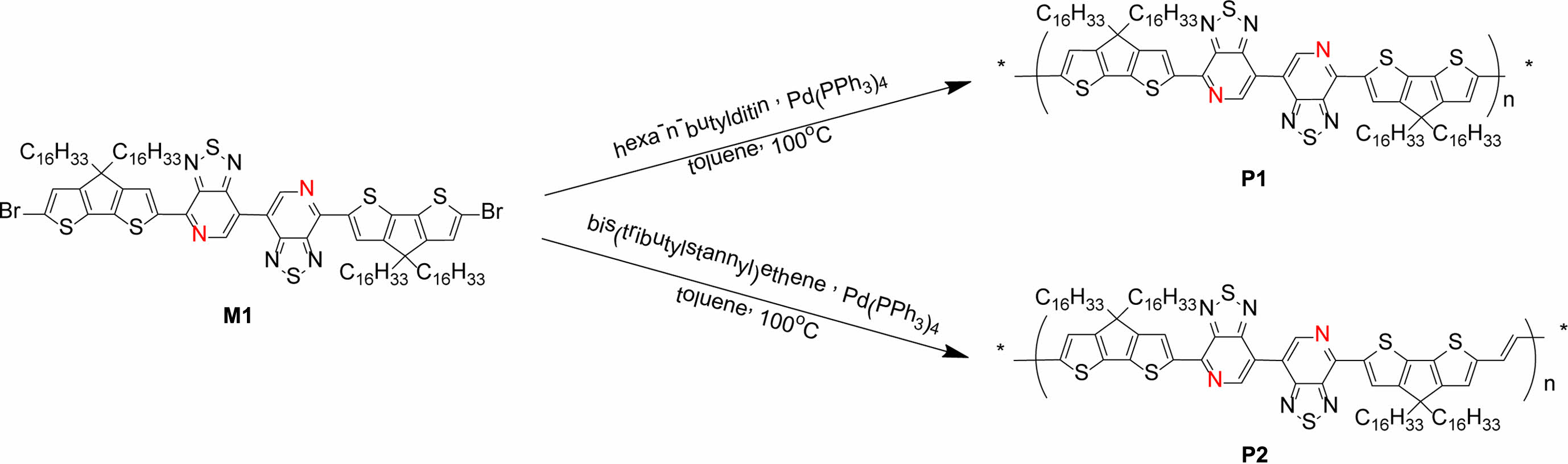
Scheme 2. Synthetic routes of P1 and P2.
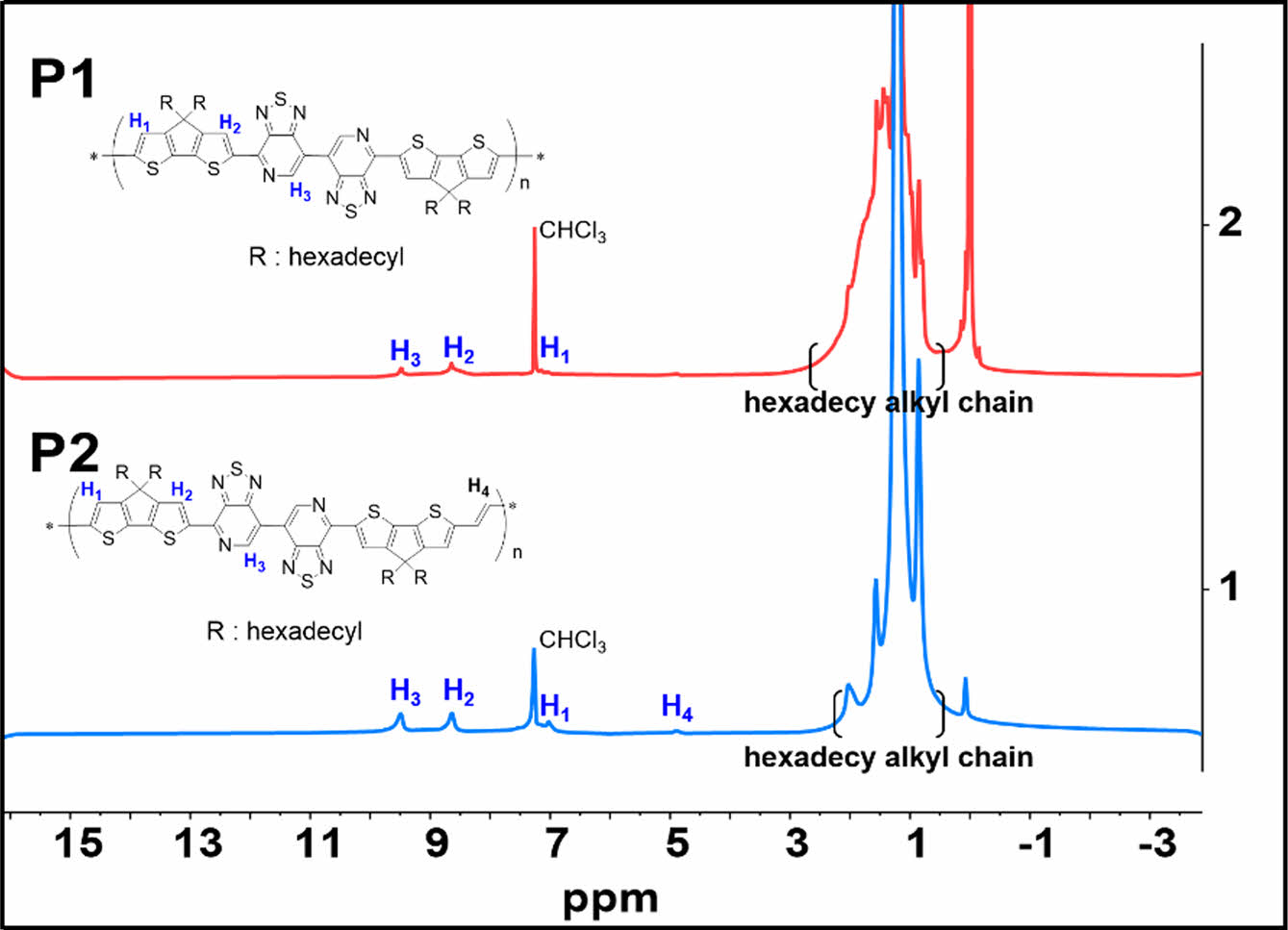
고분자 구조 1H NMR 분석.고분자 P1과 P2의 분자 구조를 분석하기 위하여 퓨리에 변환 핵 자기 공명 분광법(1H NMR)을 CDCl3 용액을 사용하였고, NMR 스펙트럼의 결과는 Figure 1 위(P1)와 아래(P2)에 나타내었다. P1 고분자의 NMR 스펙트럼의 9.50-9.40 ppm영역에서 넓게(broad) PT의 proton이 나타났다. P2 고분자의 경우도 유사하게 PT proton이 9.60-9.50 ppm영역에서 보였다. P1 CDT의 thiophene proton은 8.65-8.55와 7.20-7.10 ppm에서 각각 나타났다. P2 CDT의 thiophene proton은 8.75-8.65와 7.20-7.10 ppm에서 각각 나타났으면, vinyl기의 proton은 4.99-4.80에 나타났다.
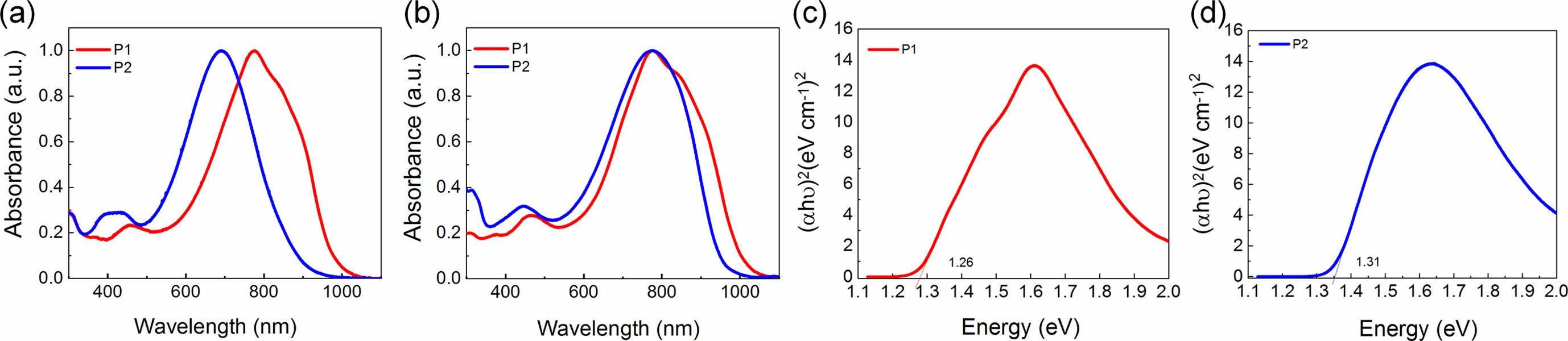
광학적특성. 단일결합과 이중결합을 각각 갖는 전도성 고분자 P1과 P2의 광학적 성질 측정하기 위해 자외/가시광선 분광광도계(UV-Vis spectrophotometer)를 이용하여 용액상태(solution state)와 박막상태(film state)의 흡광도를 측정하였다. 측정한 스펙트럼 결과는 Figure 2(a) 용액상태와 (b) 박막상태에 정리하여 나타내었다. 두 전도성 고분자 모두 350-1000 nm의 광범위한 영역에서 두 개의 두드러진 피크를 갖는 흡수 스펙트럼을 관찰하였다. 상대적으로 짧은 파장인 350-500 nm에서는 π-π* 전하이동(π-π* transition)을 나타내는 피크를 관찰하였고, 500-1000 nm 파장에서는 분자내 전하 전달(intermolecular charge transfer, ICT)을 나타내는 피크를 확인하였다. 용액상태를 측정한 스펙트럼/필름상태로 측정한 스펙트럼의 P1의 최대흡수파장(λmax)은 776.2/777.4 nm이었고, P2는 691.0/776.6 nm로 확인하였다. 용액상태와 필름상태 모두 P2의 최대흡수파장은 P1에 비해 더 짧은 파장으로 이동한 청색 편이(blue shift)하는 경향을 확인하였고, 두 고분자 모두 필름상태의 분자간의 응집이 증가하여 최대흡수파장이 용액상태보다 더 긴 파장으로 이동한 적색 편이(red shift)를 확인하였다. P1과 P2의 광학적 밴드 갭(optical band gap)은 각각 1.26, 1.31 eV로 Tauc plot을 하여 Figure 2(c)와 (d)에 나타내었고, 각 고분자의 광학적 특성을 정리한 결과는 Table 1에 정리하였다.
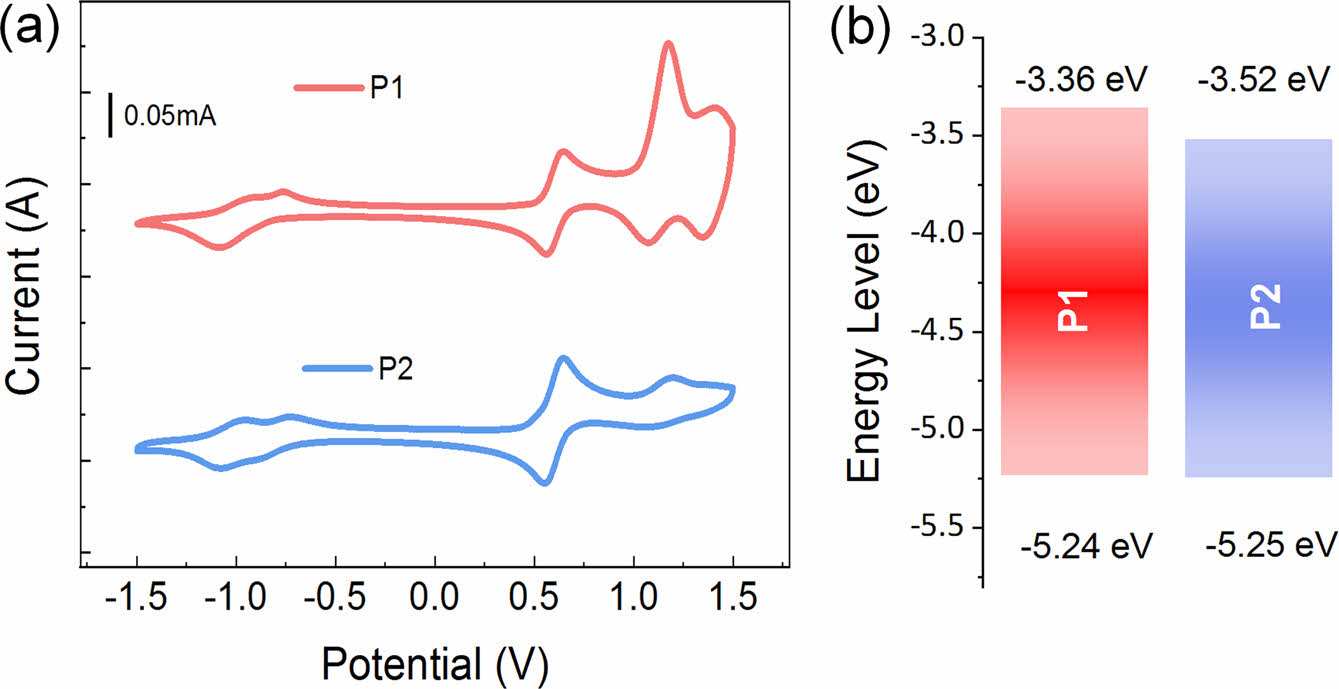
전기화학적 특성.CV를 측정하여 고분자 P1과 P2의 전기화학적 특성을 분석하였고, 그 결과는 Figure 3에 나타내었다. CV 산화/환원 전위를 얻었고, 식 (1), (2)에 대입하여 P1과 P2의 highest occupied molecular orbital(HOMO)와 lowest unoccupied molecular orbital(LUMO) 에너지 준위를 각각 계산하였다. P1과 P2의 각각의 HOMO/LUMO 에너지 준위 값은 -5.24/-3.38 eV, -5.25/-3.52 eV를 얻었다.
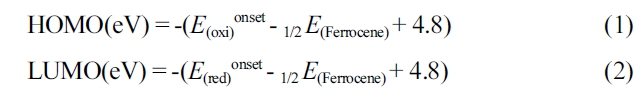
HOMO와 LUMO 에너지 레벨의 차이인 band gap은 P1과 P2 각각 1.65, 1.57 eV로 이중결합을 가진 P2의 밴드갭이 P1보다 낮아지는 것을 확인하였다. P1과 P2의 순환전압전류곡선과 에너지 레벨을 비교한 그래프는 Figure 3의 오른쪽에 나타냈으며, 각 고분자의 에너지 준위를 나타낸 수치는 Table 1에 정리하였다. P1과 P2의 광학적 밴드갭과 전기적 밴드갭(electrical band gap)이 차이가 나는 것은 순환전압전류법으로 산화 및 환원준위 측정시 전자(electron)를 투입하고 제거하는 과정을 거치게 되며, 이러한 과정은 Coulomb 인력을 추가로 필요하게 되기 때문으로 예상할 수 있다.23
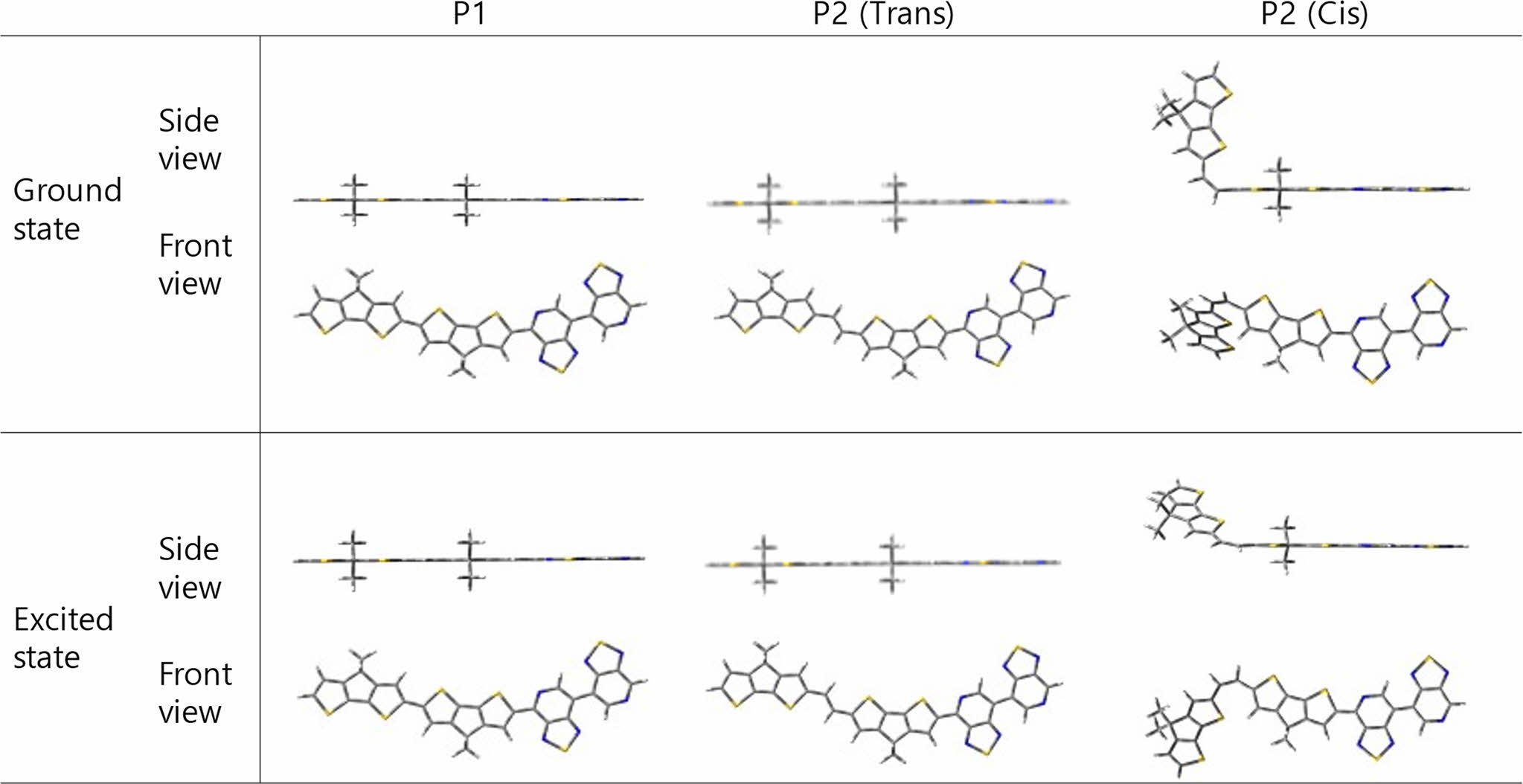
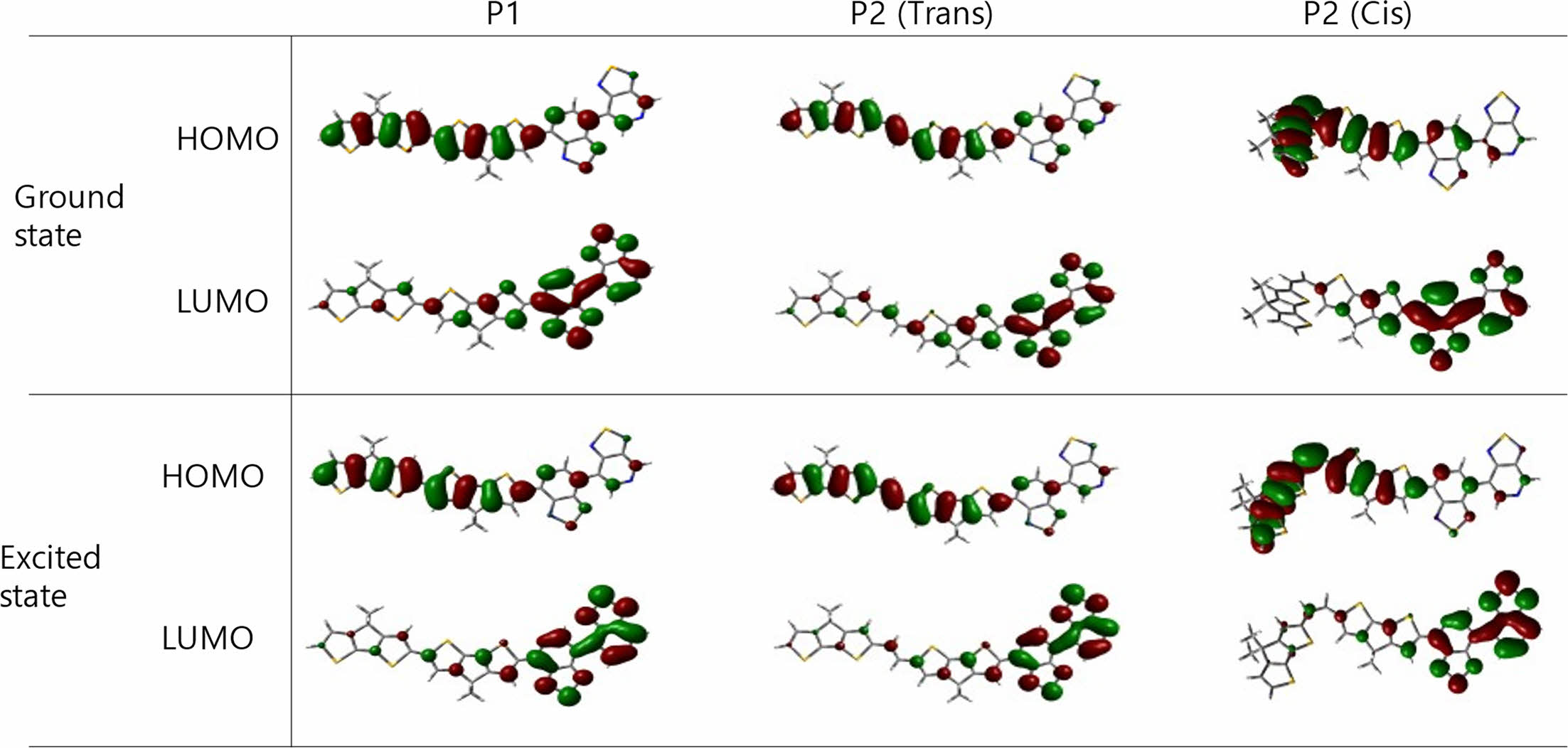
밀도 범함수 이론(Density Functional Theory, DFT). P1과 P2의 바닥상태(ground state) 및 들뜬상태(excited state)에서의 고분자가 가지는 이론적인 에너지 전위, 분자간 구조 최적화, 전하 밀도(charge density), 계산된 UV-Vis 스펙트럼을 확인하기 위해 Gaussian 16프로그램의 DFT, B3LYP, 6-31G basis set으로 설정하여 계산하였다. 각 고분자의 주골격이 가지는 최적화된 구조를 구하기위해 선형 곁사슬(hexadecyl alkyl side chain)은 메틸기(methyl group)으로 치환하여 계산시간을 줄였다. 전도성 고분자 P1과 P2의 바닥 상태 및 최적화된 구조는 Figure 4에 나타내었다. P1과 P2(trans 배열)는 전자주개인 CDT와 전자 받개인 PT로 이루어진 주 골격 내의 intramolecular interaction으로 인해 좋은 평형성(planarity)을 띄는 것을 확인하였다. 하지만 cis 배열을 갖는 P2의 최적화된 구조에서는 CDT가 가지고 있는 thiophene의 반발력으로 인해 비틀림이 있는 구조를 갖는 것을 확인하였다.
P1과 P2의 HOMO/LUMO 전하 밀도 결과를 Figure 5에 정리하였다. DFT를 통해 계산한 단일결합을 가진 P1의 HOMO 전하 밀도는 고분자 전체에 편재되어 있고, LUMO에서의 전하 밀도는 전자 받개인 PT에 비편재화되어 있는 것을 관찰하였다. 이중결합을 가진 P2의 경우 cis와 trans 두 배열 모두 P1과 동일한 전하 분포를 보이는 것을 확인했다.
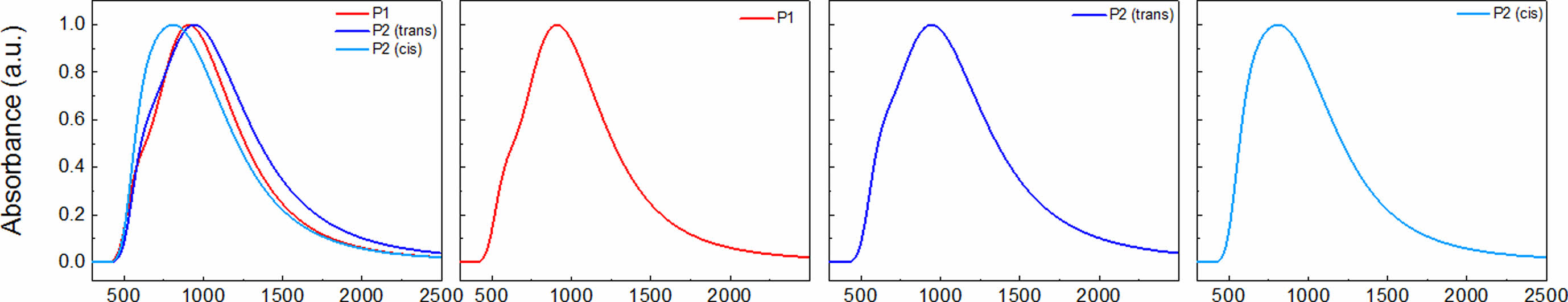
DFT 계산을 통해 계산한 UV-Vis 흡수 스펙트럼을 구하기 위하여 time-dependent(TD) DFT 계산을 진행하였고, 결과를 Figure 6에 정리하였다. P1, trans 배열의 P2, 그리고 cis 배열의 P2가 나타내는 최대 흡수 파장은 각각 910, 943, 그리고 808 nm이었다. P1의 최대흡수파장에 비해 trans 배열을 가지는 P2의 최대흡수파장이 장파장으로 이동한 적색편이 경향이 관찰되었고, cis 배열을 가지는 P2의 최대흡수파장은 더 짧은 파장으로 이동한 청색편이 경향을 나타냈다. 실험적으로 측정한 P1과 P2에 대한 자외/가시광선(Figure 1)으로 측정한 용액 상태의 UV-Vis 흡수 파장은 P1(776.2 nm)과 P2(691.0 nm)로 청색편이 되는 현상을 ‘광학적특성’ 부분에서 확인하였고, 이는 이중결합을 포함한 P2의 배열이 trans 뿐만 아니라 cis 구조와 혼합되어 있을 가능성을 나타낸다.
|
Figure 1 1 H spectrum of P1 (up) and P2 (down) in CDCl3. |
|
Figure 2 Normalized UV-Vis-NIR absorption spectra of P1 and P2 in chloroform. (a) solution; (b) film. Tauc plot; (c) P1; (d) P2. |
|
Figure 3 (a) Electrochemical properties of P1 and P2; (b) energy diagram of P1 and P2. |
|
Figure 4 Front and side view of the DFT-optimized structures for model dimer of P1 and P2. |
|
Figure 5 Calculated DFT-optimized geometries and charge-density isosurfaces for model dimer of P1 and P2; HOMO and LUMO level. |
|
Figure 6 Calculated UV-Vis absorption obtained by TD (time-dependent)-DFT calculations. |
|
Table 1 Optical and Electrochemical Properties of P1 and P2 |
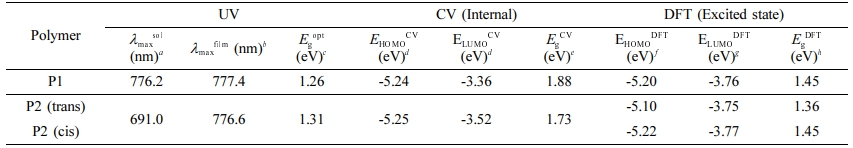
aChloroform solution; bSpin-coated from chloroform solution; cCalculated from the absorption band edge of the polymer film, Egopt = 1240/λedgefilm; dCV determined with (EHOMO = -(Eoxionset - E1/2(Ferrocene) + 4.8 eV) and (ELUMO = -(Eredonset - E1/2(Ferrocene) + 4.8 eV); eEgCV = ELUMO-EHOMO; calculated; f HOMO; gLUMO energy levels; hBand gap energy by TD-DFT calculation. |
BisPT의 구조 기반의 위치규칙성을 갖는 전도성 고분자의 단일결합과 이중결합에 대한 광학적, 전기화학적, 계산화학적 성질 등을 각각 관찰하기 위하여 전도성 고분자 P1과 P2를 Stille 커플링 반응으로 성공적으로 합성하였고, 1H NMR으로 고분자의 분자구조를 분석하였다. 자외/가시광선 분광광도계(UV-Vis spectrophotometer)를 이용하여 용액상태와 박막상태의 흡광도를 측정한 결과 용액상태와 필름상태 모두 P2의 최대흡수파장은 P1에 비해서 더 짧은 파장으로 이동한 청색 편이하는 경향을 확인하였다. TD-DFT 계산으로 P1과 P2 dimer의 최적합화된 분자구조를 얻었고, 계산화학으로 흡광도를 예측한 결과 trans 구조일 때가 cis 구조일 때보다 적색편이가 되는 것을 확인하였다. 이는 cis일 경우 thiophene 사이의 반발력으로 인해 비틀림이 있는 구조가 되는 것으로 예측된다. 이러한 결과를 바탕으로 전도성 고분자 P1과 P2를 유기전자재료로 활용할 계획이다.
- 1. Moliton, A.; Hiorns, R. C. Review of Electronic and Optical Properties of Semiconducting π-conjugated Polymers: Applications in Optoelectronics. Polym. Int. 2004, 53, 1397-1412.
-

- 2. Lu, H.; Li, X.; Lei, Q. Conjugated Conductive Polymer Materials and its Applications: A Mini-Review. Front. Chem. 2021, 9, 1-6.
-

- 3. Nezakati, T.; Seifalian, A.; Tan, A.; Seifalian, A. M. Conductive Polymers: Opportunities and Challenges in Biomedical Applications. Chem. Rev. 2018, 118, 6766-6843.
-

- 4. Facchetti, A. π-Conjugated Polymers for Organic Electronics and Photovoltaic Cell Applications. Chem. Mater. 2011, 23, 733-758.
-

- 5. Lei, T.; Wang, J.-Y.; Pei, J. Design, Synthesis, and Structure-Property Relationships of Isoindigo-Based Conjugated Polymers. Acc. Chem. Res. 2014, 47, 1117-1126.
-

- 6. Li, M.; An, C.; Pisula, W.; Müllen, K. Cyclopentadithiophene-Benzothiadiazole Donor-Acceptor Polymers as Prototypical Semiconductors for High-Performance Field-Effect Transistors. Acc. Chem. Res. 2018, 51, 1196-1205.
-

- 7. Lee, J.; Cho, S.; Seo, J. W.; Anant, P.; Jacob, J.; Yang, C. Swapping Field-effect Transistor Characteristics in Polymeric Diketopyrrolopyrrole Semiconductors: Debut of An Electron Dominant Transporting Polymer. J. Mater. Chem. 2012, 22, 1504-1510.
-

- 8. Ying, L.; Hsu, B. B. Y.; Zhan, H.; Welch, G. C.; Zalar, P.; Perez, L. A.; Kramer, E. J.; Nguyen, T.-Q.; Heeger, A. J.; Wong, W.-Y.; Bazan, G. C. Regioregular Pyridal[2,1,3]thiadiazole π-Conjugated Copolymers. J. Am. Chem. Soc. 2011, 133, 18538-18541.
-

- 9. Anant, P.; Lucas, N. T.; Jacob, J. A Simple Route Toward the Synthesis of Bisbenzothiadiazole Derivatives. Org. Lett. 2008, 10, 5533-5536.
-

- 10. Kim, J.; Yun, M. H.; Anant, P.; Cho, S.; Jacob, J.; Kim, J. Y.; Yang, C. Copolymers Comprising 2,7-Carbazole and Bis-benzothiadiazole Units for Bulk-Heterojunction Solar Cells. Chem.-Eur. J. 2011,17, 14681-14688.
-

- 11. Taylor-Shaw, E.; Angioni, E.; Findlay, N. J.; Breig, B.; Inigo, A. R.; Bruckbauer, J.; Wallis, D. J.; Skabara, P. J.; Martin, R. W. Cool to Warm White Light Emission from Hybrid Inorganic/organic Light-emitting Diodes. J. Mater. Chem. C 2016, 4, 11499-11507.
-

- 12. Bijleveld, J. C.; Shahid, M.; Gilot, J.; Wienk, M. M.; Janssen, R. A. J. Copolymers of Cyclopentadithiophene and Electron-Deficient Aromatic Units Designed for Photovoltaic Applications. Adv. Funct. Mater. 2009, 19, 3262-3270.
-

- 13. Zhu, C.; Zhao, Z.; Chen, H.; Zheng, L.; Li, X.; Chen, J.; Sun, Y.; Liu, F.; Guo, Y.; Liu, Y. Regioregular Bis-Pyridal[2,1,3]thiadiazole-Based Semiconducting Polymer for High-Performance Ambipolar Transistors. J. Am. Chem. Soc. 2017, 139, 17735-17738.
-

- 14. Liu, B.; Yu, W.-L.; Pei, J.; Liu, S.-Y.; Lai, Y.-H.; Huang, W. Design and Synthesis of Bipyridyl-Containing Conjugated Polymers: Effects of Polymer Rigidity on Metal Ion Sensing. Macromolecules 2001, 34, 7932-7940.
-

- 15. Zhang, S.; Fan, H.; Liu, Y.; Zhao, G.; Li, Q.; Li, Y.; Zhan, X.Soluble Dithienothiophene Polymers: Effect of Link Pattern. J. Polym. Sci. A Polym. Chem. 2009, 47, 2843-2852.
-

- 16. Ko, Y.-H.; Chandran, D.; Park, J.-G.; Lee, K.-S. Fluorene-based Conjugated Polymers Containing Acetylene Linkages for Photovoltaics. Mol. Cryst. Liq. Cryst. 2017, 655, 150-158.
-

- 17. An, N.; Ran, H.; Geng, Y.; Zeng, Q.; Hu, J.; Yang, J.; Sun, Y.; Wang, X.; Zhou, E. Exploring a Fused 2-(Thiophen-2-yl)thieno [3,2-b]thiophene(T-TT) Building Block to Construct n-Type Polymer for High-Performance All-Polymer Solar Cells. ACS Appl. Mater. Interfaces 2019, 11, 42412-42419.
-

- 18. Zhang, L.; Rose, B. D.; Liu, Y.; Nahid, M. M.; Gann, E.; Ly, J.; Zhao, W.; Rosa, S. J.; Russel, T. P.; Facchetti, A.; McNeill. C. R.; Brédas, J.-L.; Briseno, A. L. Efficient Naphthalenediimide-Based Hole Semiconducting Polymer with Vinylene Linkers between Donor and Acceptor Units. Chem. Mater. 2016, 28, 8580-8590.
-

- 19. Kang, S.-H.; Tabi, G. D.; Lee, J.; Kim, G; Noh, Y.-Y.; Yang, C. Chlorinated 2,1,3-Benzothiadiazole-Based Polymers for Organic Field-Effect Transistors. Macromolecules 2017, 50, 4649-4657.
-

- 20. Kim, G.; Kim, H.; Jang, M.; Jung, Y. K.; Oh, J. H.; Yang, C. Ultra-narrow-bandgap Thienoisoindigo Polymers: Structure-property Correlations in Field-effect Transistors. J. Mater. Chem. C 2016, 4, 9554-9560.
-

- 21. Wang, Y.; Hasegawa, T.; Matsumoto, H.; Michinobu, T. Significant Improvement of Unipolar n-Type Transistor Performances by Manipulating the Coplanar Backbone Conformation of Electron-Deficient Polymers via Hydrogen Bonding. J. Am. Chem. Soc. 2019, 141, 3566-3575.
-

- 22. Nakano, M.; Osaka, I.; Takimiya, K. Naphthodithiophene Diimide (NDTI)-Based Semiconducting Copolymers: From Ambipolar to Unipolar n-Type Polymers. Macromolecules 2015, 48, 576-584.
-

- 23. Barford, W. Electronic and Optical Properties of Conjugated Polymers, 2nd Ed.; International Series of Monographs on Physics; Oxford Science Publications: Oxford, 2013; pp 1-305.
- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2022 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2023; 47(4): 487-494
Published online Jul 25, 2023
- 10.7317/pk.2023.47.4.487
- Received on Mar 3, 2023
- Revised on Apr 14, 2023
- Accepted on Apr 19, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Junghoon Lee
-
Division of Chemical Engineering, Dongseo University, Busan 47011, Korea
- E-mail: junghoonlee@dongseo.ac.kr
- ORCID:
0000-0003-2638-851X










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.