- Drug Release Properties of Montelukast Imprinted Starch-based Biomaterials Adding Melanin as Photo-stabilizing Agent
Kyeong-Jung Kim# , Ji Yoon Kim*,# , Wang-Geun Shim**,†
 , and Soon-Do Yoon†
, and Soon-Do Yoon† 
Department of Chemical and Biomolecular Engineering, Chonnam National University, Yeosu, Jeollanam-do 59626, Korea
*Korea basic science institute gwangju center, Gwangju, 61186, Korea
**Department of Chemical Engineering, Sunchon National University, Suncheon, Jeollanam-do 57922, Korea- 광안정제로 멜라닌이 첨가된 Montelukast 각인 전분 기반 바이오 소재의 약물 방출 특성
전남대학교 화공생명공학과, *한국기초과학지원연구원 광주센터, **순천대학교 화학공학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
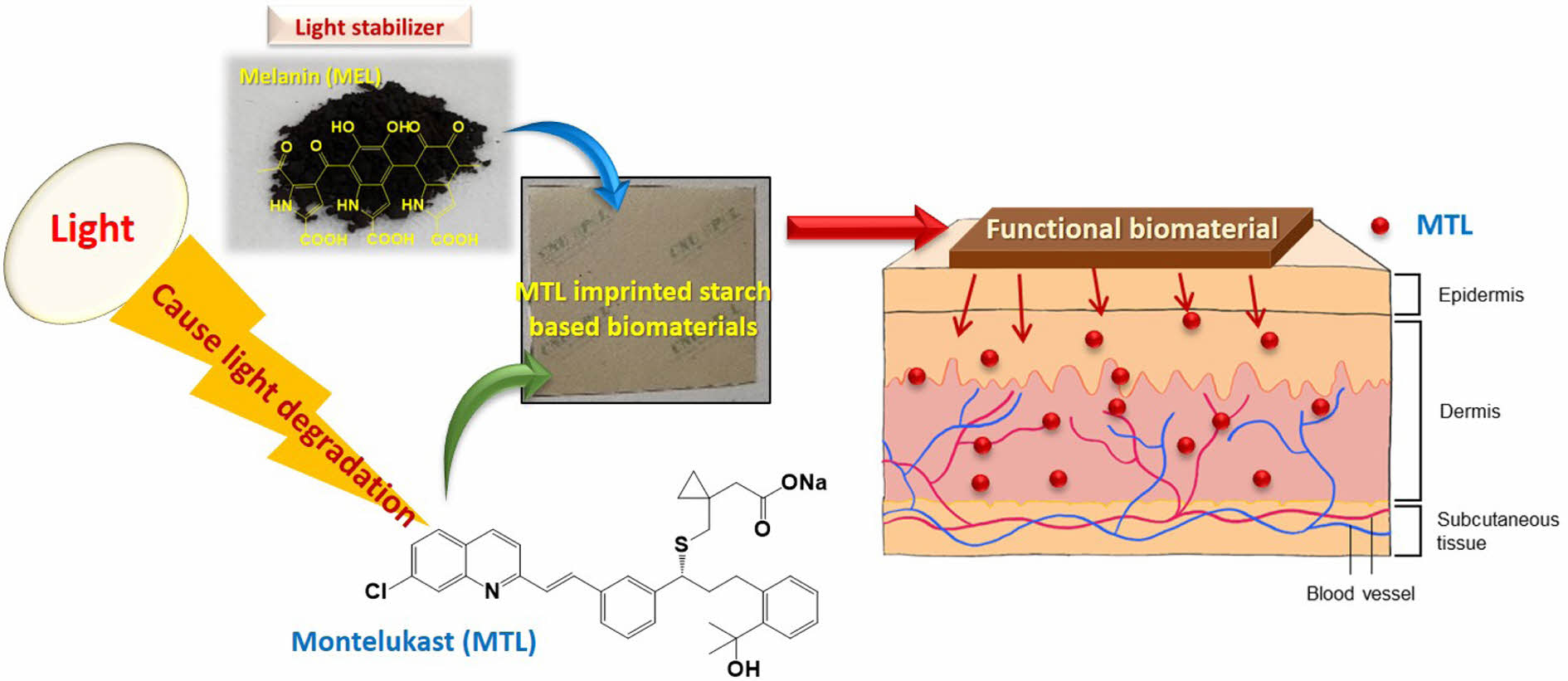
In this study, montelukast (MTL) imprinted starch-based biomaterials using mungbean starch (MS), polyvinyl alcohol (PVA), melanin (MEL) as a light stabilizer, and plasticizers were synthesized by the casting method and heat curing process. MTL release properties were evaluated at different temperatures and pH 5.5. Biomaterials were characterized using FE-SEM and FTIR. In addition, physical properties such as mechanical and water resistance properties for biomaterials were investigated. Results of MTL release properties in the buffer solution indicated that MTL was released about 36.74% within 120 min. In addition, MTL release from MEL-added biomaterials was increased about 1.30-1.43 times by the light stabilizer. In case of MTL release using the artificial skin, MTL was released continuously for 12 h, and the MTL release from MEL-added biomaterials was increased by about 1.54 times. MTL release in buffer solution followed the pseudo-Fickian diffusion mechanism, whereas the MTL release in artificial skin followed the non-Fickian diffusion mechanism.
본 연구에서는 montelukast(MTL), mungbean starch(MS), polyvinyl alcohol(PVA)과 광안정제로 melanin(MEL), 가소제들을 이용하여 MTL 각인 전분 기반 바이오 소재를 casting 방법과 열경화 공정을 이용하여 제조하고, pH 5.5에서 온도 변화에 따른 MTL 방출 특성을 평가하였다. 바이오 소재의 특성은 FE-SEM과 FTIR으로 분석하였다. 바이오 소재에 대한 기계적 특성, 내수성 같은 물리적 특성을 역시 조사하였다. 완충 용액에서 MTL은 120분 동안 약 36.74% 방출되었으며, MEL이 첨가된 바이오 소재는 MTL 방출이 1.30-1.43배 증가하였다. 인공피부에서 MTL은 12시간 동안 지속적으로 방출되었으며 MEL이 첨가된 경우 MTL의 방출량이 약 1.54배 증가하였다. 완충 용액에서 MTL의 방출 거동은 pseudo-Fickian 메커니즘을 따랐고, 반면에 인공피부에서 MTL의 방출 거동은 non-Fickian 메커니즘을 따랐다.
In this study, functional biomaterials for transdermal drug delivery system were successfully prepared using mungbean starch, polyvinyl alcohol, montelukast (MTL) as the drug, melanin (MEL) as a light stabilizer, and plasticizers. The results can be verified that MTL release of MEL added MTL imprinted biomaterials in artificial skin were 1.54 times higher than that of MEL non-added MTL imprinted biomaterials by the effects of light inhibition.
Keywords: starch-based biomaterials, montelukast, melanin, drug release mechanism, transdermal drug delivery system.
이 논문은 2019년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업(grant No. NRF-2019 R1I1A3A01061508)에 의해 수행하였음.
저자들은 이해상충이 없음을 선언합니다.
경피 약물전달시스템(transdermal drug delivery system, TDDS)는 피부를 통해 약물을 흡수하여 질병을 치료하는 약물전달 기술이다. 이 기술은 위장관 및 간의 대사로 인한 약물의 분해를 방지하여 생체 이용률을 증가시킬 수 있고, 약물 투여 시 전문적인 훈련이 필요치 않아 자가 투여가 용이하며, 약물 전달 시 통증이 없다는 장점이 있어서 경구 및 주사 투여를 대체하기에 유망하다.1,2 한편, TDDS를 적용하는 바이오 소재는 무독성 및 높은 생체적합성이 필수적인데 식물과 동물에서 파생된 천연고분자들은 우수한 생체적합성 및 생분해성을 지니고 있어 TDDS용 바이오 소재로 이용하기에 적합하다.3 이 중에서 전분은 선형 아밀로오스와 분지형 아밀로펙틴으로 구성되어있으며, 옥수수, 감자 및 녹두와 같은 다양한 식물에 존재한다. 이와 같은 전분 기반의 바이오 소재들은 생분해성과 생체적합성이 뛰어날 뿐만 아니라 저비용, 비세포독성 등의 장점도 지니고 있어 약물 전달 시스템, 조직 공학 스케폴드, 상처 드레싱, 식품 포장재 등과 같은 분야에서 널리 응용되고 있다.4,5
본 연구에서 사용된 montelukast(MTL)는 기도의 만성 염증 질환인 천식을 치료하는 약물로 시스테닐 류코트리엔(cysteinyl leukotrienes, CysLTs) 수용체에 선택적으로 결합하여 천식 증상을 억제하는 길항제이다. CysLTs는 외부의 알레르기 유발 물질이 체내에 유입될 때 아라키돈산으로부터 합성되는 염증성 물질로, 이것은 기관지 평활근의 CysLTs 수용체와 상호작용하여 기관지의 염증 반응을 유도한다.6,7 따라서, CysLTs의 작용을 효과적으로 방지하는 MTL은 천식 치료에 널리 사용되어왔다. 하지만, MTL은 경구 투여 시, 간 1차 대사를 통해 생체 이용률이 최대 64%까지 감소되는 단점을 가지고 있다.8,9 본 연구에서는 이러한 한계를 극복하고자 간 1차 대사를 우회하고 MTL의 생체이용률을 증가시키기 위해 MTL의 약물 전달에 TDDS를 이용하여 약물 전달 거동을 조사하려 한다. 그러나 MTL은 용해도가 매우 낮고 빛에 의해 빠르게 분해되는 특징이 있어 TDDS 적용에 한계가 있다. 따라서 이러한 문제를 해결하기 위해 MTL의 용해도를 높이고 광안정제를 첨가하여 MTL의 안정성을 증가시켜야 한다.
광안정제는 자외선을 흡수하여 물질이 빛에 노출될 때 물리화학적 분해 및 변성을 억제하는 효과를 지니고 그 종류는 플라보노이드, 방해형 아민 광안정제, 쿠마린 유도체, 안트라퀴논 유도체 등이 있다. 이들은 플라스틱 소재, 식품, 의약품 등의 분야에서 다양하게 사용되어 소재의 안정성을 향상시킨다고 보고되었다.10-12
본 연구에서는 멜라닌(melanin, MEL)를 광안정제로 사용하여 MTL의 광분해를 억제하고 효과적인 TDDS용 바이오 소재를 제조하려 한다. MEL은 다양한 유기체에서 티로신의 다단계 효소 반응으로 생성되는 생물학적 색소이며, 항산화, 항염증, 항균 등의 다양한 기능을 가지고 있다.13,14 Roy 등은 MEL을 안정제로 첨가한 나노 입자를 필름에 결합시켰을 때 MEL이 첨가되지 않은 것에 비하여 기계적 특성, 열 안정성, 자외선 차단 특성이 증가된다는 것을 보고하였다.15
본 연구의 최종 목적은 MTL의 TDDS 적용을 위해 MTL이 각인된 전분 기반 바이오 소재를 제조하고, 광안정제로 MEL을 첨가하였으며, 가소제로써 솔비톨(sorbitol, ST) 및 글리세롤(glycerol, GL) 첨가하였다. 제조한 바이오 소재의 방출 특성은 다양한 온도에서의 pH 5.5 완충 용액과 인공피부를 이용하여 조사하는 데 있으며, 수학적 모델링을 통하여 MTL의 방출 메커니즘을 확인하고자 한다.
시약 및 재료. Polyvinyl alcohol(PVA, 99% hydrolyzed; Mn 89000-98000), melanin(MEL), glycerol(GL), sorbitol(ST), montelukast(MTL)은 Sigma-Aldrich Co.(Louis, USA)에서 구입하였으며, potassium hydroxide(KOH)는 Duksan (Pharmaceutical Co., Ltd., South Korea)에서 구입하였다. 청포묵 전분(mungbean starch, MS)는 Chungwon Food(Incheon, South Korea)에서 구입하였다. 모든 실험에서 증류수(distilled water, DW)는 탈이온화 후 재증류하여 사용하였다.
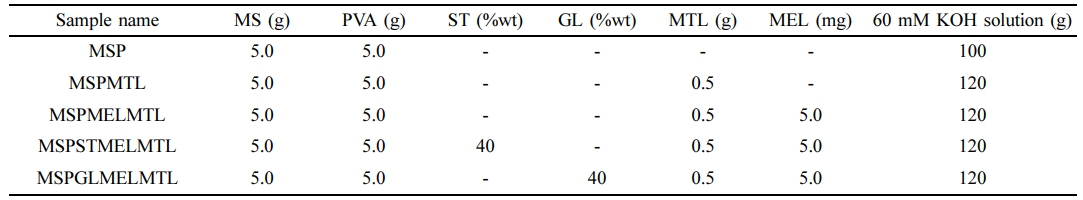
MS 기반 바이오 소재의 제조. MTL 각인 MS 기반 바이오 소재 성분의 함량 및 제조는 이전 연구에서 보고된 방법을 수정하여 이용하였다.16 MS와 가소제로써 GL 또는 ST를 0.1 M KOH에 용해시키고, 이 혼합 용액을 95 ℃의 0.1 M KOH에 PVA를 용해시켜 제조한 PVA 용액에 첨가하였다. 여기서 KOH는 MTL의 용해도가 염기성 용액에서 증가하기 때문에 이용하였다. 이후 혼합물을 95 ℃에서 10분 동안 혼합한 뒤, mechanical stirrer를 이용하여 실온에서 60분 동안 블렌딩하였다. 가소제인 GL과 ST는 MS와 PVA 무게를 기준으로 하여 40 wt%로 첨가하였다. 블렌딩 과정 중 MTL과 MEL을 0.1 M KOH에 용해시킨 혼합물을 dropwise하여 겔화 용액을 제조하였다. 본 연구에서 제조한 바이오 소재의 성분은 Table 1에서 확인할 수 있다. 경구 투여 제형의 MTL 최소 용량이 4 mg이므로 본 연구의 방출 특성 실험에서 사용되는 0.1 g의 바이오 소재에 약 4 mg이 함유되어 있을 수 있도록 MTL의 함량은 0.5 g으로 설정하였다. 겔화 용액의 기포는 aspirator로 제거하고 teflon mold(250×250×1 mm)에 부은 다음, 50 ℃로 설정된 오븐에서 12시간 동안 건조시켰다. MTL의 광분해를 최소화하기 위하여 제조한 바이오 소재의 가교는 100 ℃의 오븐에서 열경화 공정을 30분 동안 수행하였다.
MS 기반 바이오 소재의 내수성. 제조한 바이오 소재의 팽윤 거동(swelling behavior, SB)과 용해도(solubility, S)를 측정하여 내수성을 조사하였다. SB는 제조한 바이오 소재를 상온에서 DW에 24시간 방치 후 바이오 소재 표면의 수분을 제거하고 질량을 측정하여 분석하였다. SB를 계산하는 식은 다음과 같다.
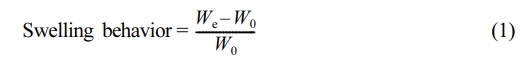
여기에서 We는 DW를 흡수한 바이오 소재의 질량이며 W0는 DW를 흡수하기 전의 바이오 소재의 질량이다.
S는 DW을 흡수한 바이오 소재를 50 ℃ 오븐에서 24시간 동안 재건조하여 질량을 측정하여 분석하였고 다음 식을 이용하여 계산하였다.

여기에서 Wd는 재건조된 바이오 소재의 질량을 의미한다.
MS 기반 바이오 소재의 기계적 특성. 제조한 바이오 소재의 물리적 특성은 Instron 6012 testing machine(Norwood, MA, USA)를 이용하여 인장강도(tensile strength, TS)와 신축률(elongation at break, EB)를 측정해 평가하였다. 각 바이오 소재는 ASTM D-421 규격으로 사용하였고, 바이오 소재의 두께는 주변의 5지점을 mechanical scanner(digital thickness gauge “Mitutoyo” Tokyo, Japan)로 측정한 평균값을 사용하였다. 평균 두께는 약 0.13 mm이었고, gauge length 및 grip distance는 모두 53.0 mm이었다. Crosshead는 20 mm/min이며 load cell은 250 kgf이었다. 모든 측정은 25 ℃, RH 55.0%에서 진행하였다.
MS 기반 바이오 소재의 특성 분석. 제조한 바이오 소재의 표면은 전계 방사 주사현미경(field emission scanning electron microscope, FE-SEM, ZEISS Sigma 500, Carl Zeiss Co., Ltd, Germany)을 이용하여 5.0 kV의 가속 전압에서 관찰하였다. 바이오 소재의 단면은 광학 현미경(ZEISS Primo Star 3, Carl Zeiss Co., Ltd, Germany)으로 관찰하였다. 또한, MTL의 광분해 특성은 빛의 노출 전/후의 MTL 흡광도를 UV-Vis spectrophotometer(OPTIZEN 2120UV, Neogen, Co., Ltd, South Korea)로 측정하여 조사하였다. 열경화로 인한 MTL과 MEL의 변형 및 제조한 바이오 소재의 결합 특성은 Fourier transform infrared spectrophotometry(FTIR, vertex-70, Bruker, Germany)를 이용해 분석하였다.
MTL 방출 특성. MTL 각인 MS 기반 바이오 소재의 TDDS 응용 가능성을 평가하기 위해 온도 변화에 따른 ‘in vitro’ 약물 방출 실험을 수행하였다. 이때, 사람의 피부는 약산성을 띠므로 pH 5.5의 아세테이트 완충 용액을 이용하였다.17 제조한 바이오 소재 약 0.1 g을 완충 용액 90 mL에 넣고 냉증 피부의 온도인 32.0 ℃, 일반적인 피부의 온도인 36.5 ℃, 염증성 피부의 온도인 40.0 ℃에서 shaking incubator(DS-210SF, Daewon Science, Inc., South Korea)를 50 rpm으로 설정하여 MTL을 방출시켰다. 그 후, 방출 시간에 따라 용액의 상등액 2 mL를 취해 UV-Vis spectrophotometer로 MTL의 농도를 측정하였다. MTL의 농도 측정 시 파장은 283 nm로 설정하였다. 또한, 인공피부(Neoderm-ED, Tego Science, Inc., South Korea)를 이용하여 36.5 ℃, RH 60%에서 제조한 바이오 소재의 MTL 방출 실험을 진행하였다.
MTL의 방출 메커니즘은 Fickian 확산 방정식과 empirical식을 적용하여 살펴보았다. 먼저, 고분자 film 형태에서 Fick’s 법칙은 다음과 같이 나타낼 수 있다.

여기서 C는 시간 t 에서 약물의 농도를 의미하고 De는 확산 계수를 의미한다. 두께 l이 (- <χ<
<χ< )인 고분자 film에서 x 방향으로 약물의 확산이 발생하면 경계조건은 다음과 같다.
)인 고분자 film에서 x 방향으로 약물의 확산이 발생하면 경계조건은 다음과 같다.
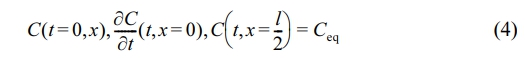
식 (4)에 보이는 Ceq는 약물 확산의 최종 평형 농도를 나타내며, 이러한 조건을 적용하면 식 (3)의 해는 trigonometric 시리즈 형태로 재배열되어 식 (5)로 나타낼 수 있다.
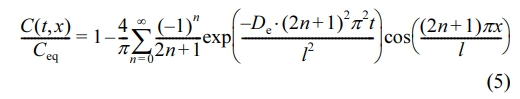
이 식의 적분 형태는 식 (6)으로 표현되며, 이를 Fickian 확산 모델이라고 한다.18-21
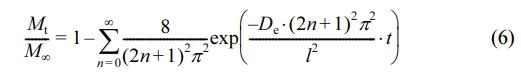
여기서 Mt는 시간 t에서 방출되는 약물의 농도이고 M∞는 무한대 시간에서 방출되는 약물의 농도이며 l는 고분자 film의 두께의 절반을 의미하고 De는 확산 계수를 나타낸다. 또한, 방출된 MTL에 대한 확산 분포 함수를 얻기 위해 다음 식을 이용하였다.22
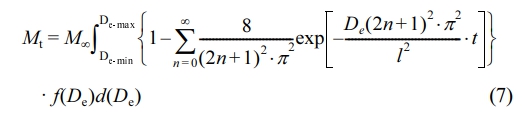
한편 empirical 모델은 다음과 같이 쓸 수 있다.23,24

여기서 k는 약물 전달 상수이고 n은 약물 방출 메커니즘을 결정하는 확산 지수이다. 지수 n 값이 0.5 보다 작으면 pseudo-Fickian 확산 메커니즘을 따르며 0.5와 같으면 Fickian 확산 메커니즘을, 그리고 0.5 < n < 1.0 이면 non-Fickian 확산 메커니즘을 따른다고 할 수 있다.25,26
통계 분석. 모든 실험 데이터는 5번의 실험 결과 평균값 ± 표준편차(standard deviation, SD)로 표시하였으며, 반복 실험을 통해 t-test를 이용하여 통계적 유의성 표시를 확인하였다.
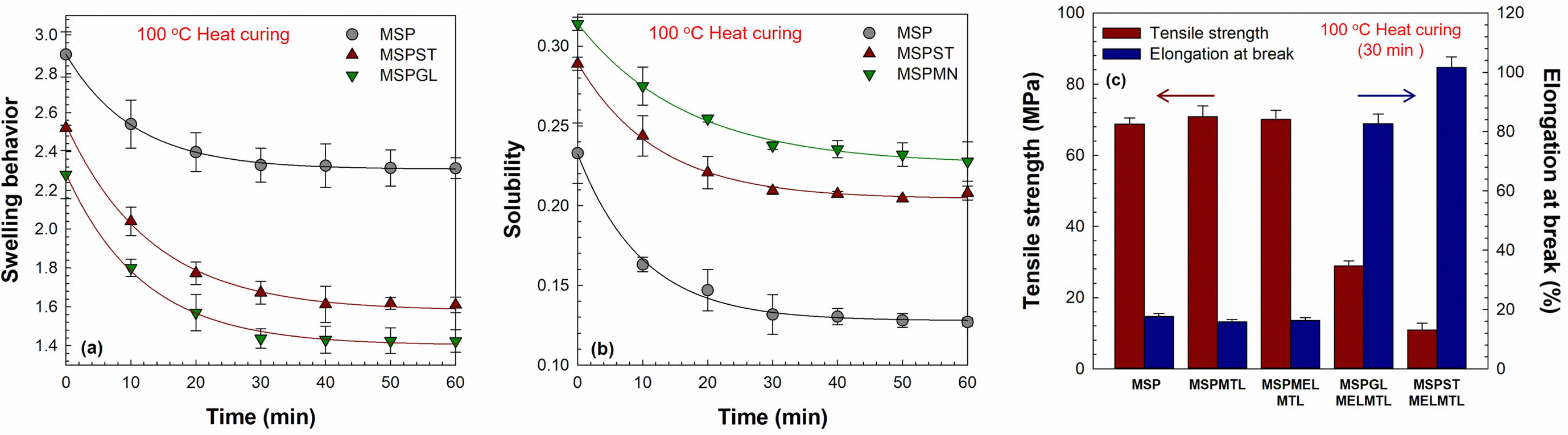
MS 기반 바이오 소재의 물리적 특성. 천연 고분자 기반 바이오 소재의 물리적 특성, 즉 인장강도(tensile strength, TS), 신축률(elongation behavior, EB), 팽윤 거동(swelling behavior, SB), 물에 대한 용해도(solubility, S)는 다양한 분야에 적용하기 위한 중요한 요소이다. Figure 1(a)와 (b)는 제조한 바이오 소재의 SB와 S를 평가한 결과이다. 제조한 바이오 소재의 SB와 S는 100 ℃에서 시간에 따라 열경화를 수행하여 조사하였으며, 열경화 시간이 증가할수록 SB와 S는 감소하는 경향이 보였다. 이러한 감소 경향은 열경화 공정으로 인하여 바이오 소재의 구성 성분들의 가교결합이 향상되었다는 것을 의미한다. 또한, 열경화를 30분 동안 진행하였을 때 SB와 S가 빠르게 감소하였고 30분을 초과하면 거의 감소되지 않았다. 따라서, 제조한 바이오 소재는 30분 동안 열경화하여 실험에 이용하였다. 제조한 바이오 소재 중 가소제로 GL이 첨가된 바이오 소재의 SB가 가장 낮고 S가 가장 높은 것으로 확인되었는데, 이러한 결과는 GL이 ST에 비하여 수소결합이 가능한 hydroxyl group이 더 적기 때문에 상대적으로 결합력이 부족하다는 것을 의미한다. Figure 1(c)는 열경화를 30분 동안 수행하여 제조한 바이오 소재의 TS와 EB를 나타낸 것이다. 가소제로써 GL과 ST를 바이오 소재에 첨가할 경우, 첨가되지 않은 바이오 소재에 비해 EB가 크게 증가한 반면에 TS는 감소하였다. 이것은 GL과 ST의 작용기인 hydroxyl group이 제조한 바이오 소재 내부의 분자간 상호작용에 영향을 주어 유연성이 증가되었고 이에 따라 연신 특성이 향상되었기 때문이다. 또한, ST는 GL보다 hydroxyl group이 많이 존재하므로 ST가 첨가된 바이오 소재가 가장 높은 EB를 나타내었다. MTL과 MEL을 첨가한 바이오 소재는 첨가하지 않은 바이오 소재와 비교하였을 때, 비교적 유사한 TS와 EB 값을 가지는 것으로 나타났다.
MS 기반 바이오 소재의 특성화. 제조한 MS 기반 바이오 소재의 표면과 단면은 FE-SEM과 광학 현미경 이미지로 살펴보았다(Figure 2(a-f)). 그림에 보인 것처럼, 열경화 30분 전/후의 바이오 소재의 표면과 단면에서 균열이나 응집은 관찰되지 않았다. 또한 가소제, MTL, MEL를 첨가한 바이오 소재의 경우에도 비교적 균일하게 제조되었음을 확인할 수 있었다. 그리고 바이오 소재에 MEL이 첨가되면 흑갈색을 띠는 것을 볼 수 있는데, 이는 MEL의 고유색인 흑갈색으로 인한 결과이다.
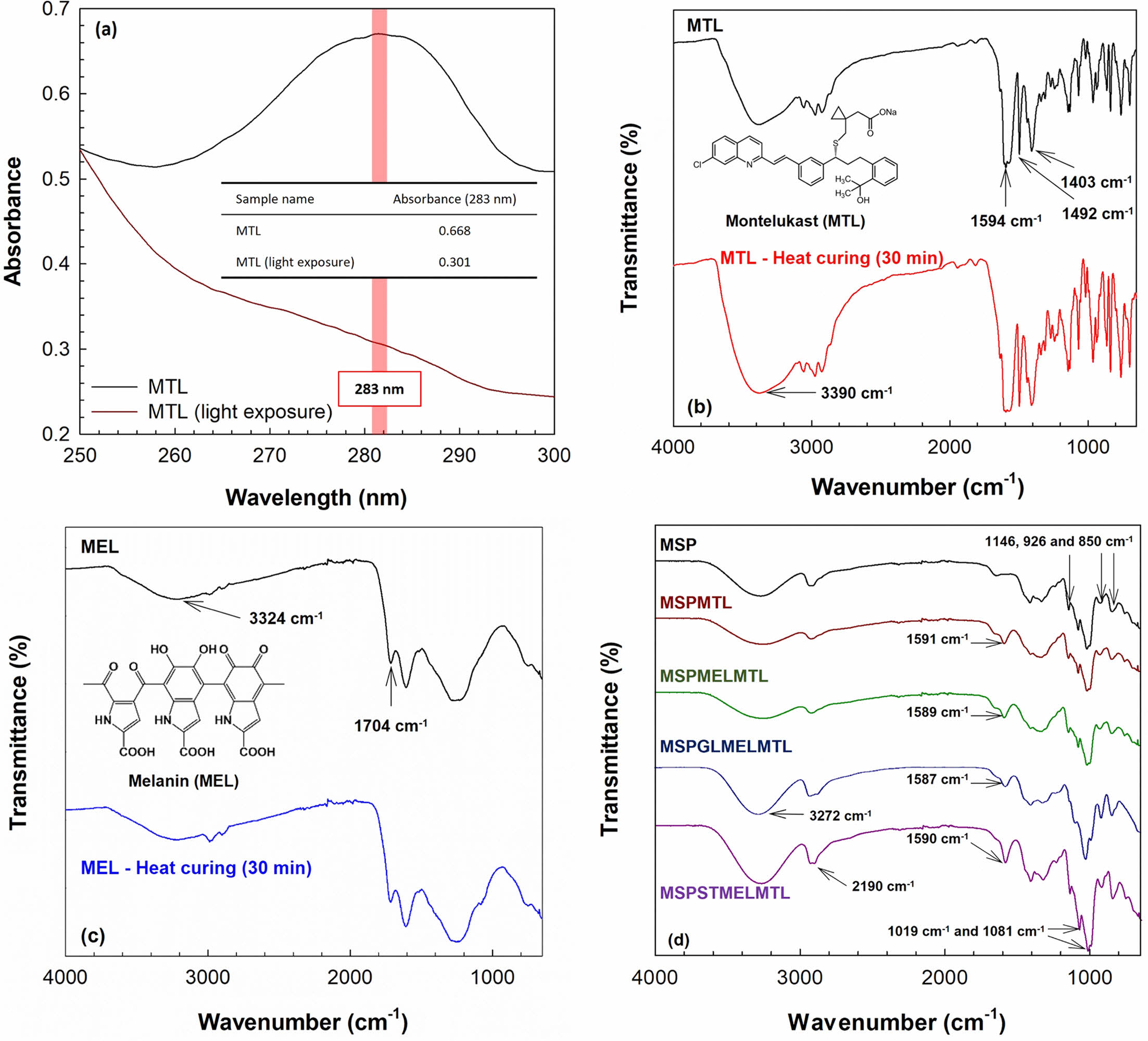
MTL의 광분해에 대한 UV 흡광도 측정 결과와 열경화에 대한 MTL과 MEL의 안정성 및 제조한 바이오 소재의 결합 특성을 평가한 FT-IR 분석 결과는 Figure 3에 나타내었다. Figure 3(a)는 빛의 노출 전/후의 MTL 흡광도 측정 결과이다. MTL은 빛에 노출되기전 특징적인 파장인 283 nm에서 흡광도 값이 0.668이었지만, 12시간 동안 빛에 노출된 후에는 0.301로 감소됨을 확인할 수 있었다. 이는 MTL의 광분해 현상으로 인해 구조가 변형되었기 때문이다. 따라서, MTL의 광분해를 억제하기 위해서는 광안정제가 필요하며, 열경화 공정이 바이오 소재의 물성을 개선하기 위해 적합하다고 판단할 수 있다. Figure 3(b)은 열경화 전/후 MTL의 FTIR 스펙트럼으로, 1403 cm-1 및 1492 cm-1의 피크는 각각 MTL의 CN 결합 진동과 방향족 C=C의 진동에 해당되며, 1594 cm-1의 피크는 carboxylate group의 진동과 관련이 있다. 또한, 3390 cm-1 파장에서 관찰된 넓은 band는 -OH와 해당된다.27,28 Figure 3(c)는 열경화 전/후 MEL의 FTIR 스펙트럼이다. 그림에 보인 것처럼 MEL의 carbonyl group 피크는 1704 cm-1에서 관찰되었다. 그리고 3324 cm-1 파장에서 넓은 band는 -NH와 -OH에 해당된다.29 이러한 결과로부터 열경화 전/후에도 MTL과 MEL의 피크가 유지된다는 것을 확인할 수 있었다. 다시 말해, 열경화로 인한 MTL과 MEL의 구조적 변형은 유발되지 않는 것을 의미한다. Figure 3(d)는 제조한 바이오 소재의 FTIR 스펙트럼 결과로, 전분의 고리형 -C-O-C- 결합 진동이 850, 926, 1146 cm-1 파장에서 확인되었다. 가소제가 첨가된 바이오 소재의 경우에는 GL과 ST의 구조적 특성으로 인하여 1019 및 1081(C-OH stretching), 2190(alkane CH stretching), 3272 cm-1(-OH stretching)에서 피크가 깊게 형성되었다.30-32 또한, MTL이 첨가된 바이오 소재들은 1587-1591 cm-1에서 MTL의 carboxylate group에 해당하는 피크가 확인되었다. 이를 통하여 MTL이 각인된 MS 기반 바이오 소재가 성공적으로 제조되었음을 확인할 수 있다.
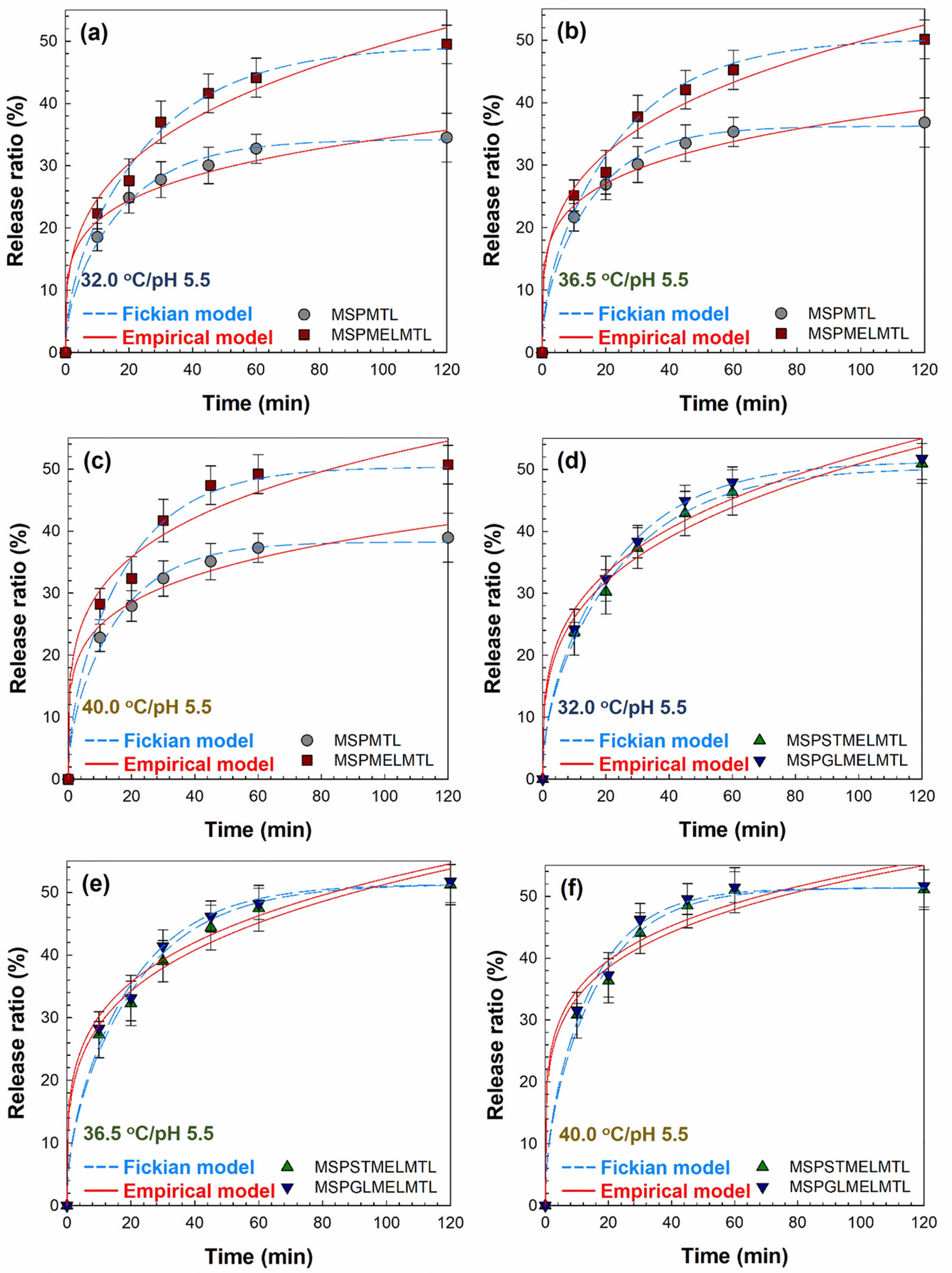
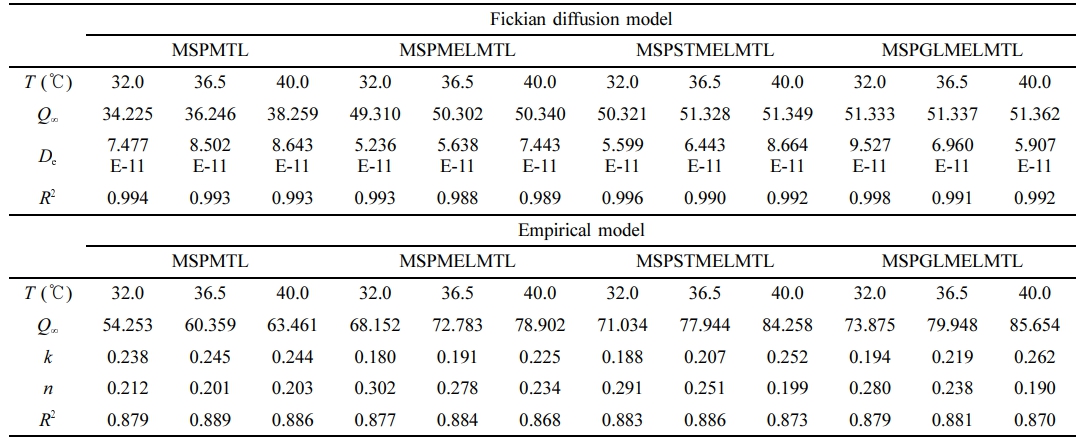
MTL 방출 특성. MTL 각인 MS 기반 바이오 소재의 방출 거동을 확인하기 위하여 여러 온도에서 완충 용액을 이용하여 MTL 방출 실험을 수행하였다. Figure 4는 제조한 바이오 소재의 시간에 따른 MTL 방출을 32.0, 36.5, 40.0 ℃에서 수행하고 이를 수학적 모델에 적용한 결과와 함께 나타낸 것이다. 모든 바이오 소재에서 MTL은 120분 이내에 거의 방출되었으며, 온도가 증가할수록 빠르게 방출되었다. 또한, MEL을 첨가한 바이오 소재는 MEL이 첨가되지 않은 바이오 소재에 비하여 MTL의 최대 방출률이 1.30-1.43배 증가하는 결과를 얻을 수 있었다. 이는 광안정제로써 MEL이 MTL의 광분해를 억제하기 때문인 것으로 판단된다. 그리고 첨가된 가소제의 종류에 따라 바이오 소재는 방출 속도 차이가 나타났으며 이것은 GL과 ST의 높은 용해도로 인하여 바이오 소재로부터 방출 매질인 완충 용액에 GL과 ST가 용해되어 바이오 소재 내부의 MTL과 함께 방출된 것이라 판단된다. 또한, GL의 hydroxyl group이 ST보다 적어 바이오 소재 내부의 분자간 상호작용이 상대적으로 약하기 때문에, GL이 첨가된 바이오 소재의 MTL 방출이 가장 빠른 속도를 나타내었다.33 Figure 4와 Table 2에 나타낸 수학적 모델링 결과를 보면 전반적으로 empirical 모델보다 Fickian 확산 모델이 더 적합하였고 제조한 바이오 소재의 확산 계수 De값은 온도가 높을수록 커졌다. 그리고 확산 지수 n 값은 모두 0.5 미만이므로 나타나 완충 용액에서 제조한 바이오 소재의 MTL 방출 메커니즘은 pseudo-Fickian 확산 메커니즘을 따르고 있음을 확인하였다.
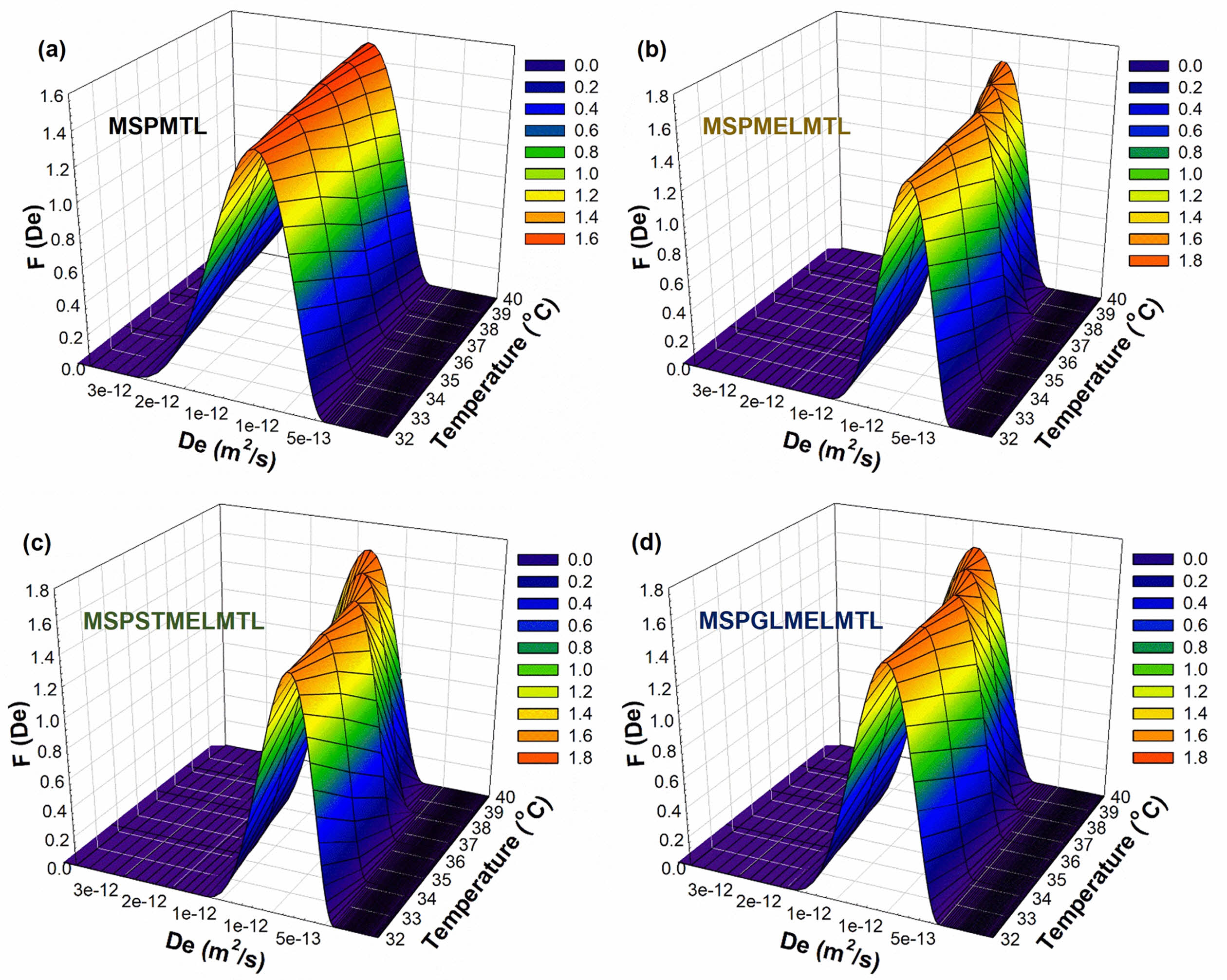
Figure 5에는 pH 5.5의 완충용액에서 구한 MTL의 확산 분포 함수 곡선을 나타내었다. 그림에 보인 것처럼, 각 바이오 소재의 MTL 확산 분포 함수는 온도가 증가함에 따라 폭이 넓어지는 경향을 보였으며, 40 ℃에서 피크가 가장 크게 나타났다. 각 바이오 소재의 확산 분포 함수 곡선의 최대 피크 값은 32.0 ℃의 경우 MSPMTL; 1.259E-12, MSPMELMTL; 8.157E-13, MSPSTMELMTL; 8.534E-13, MSPGLMELMTL; 9.122E-13에서 나타났으며, 36.5 ℃에서는 MSPMTL; 1.411E-12, MSPMELMTL; 9.049E-13, MSPSTMELMTL; 1.031E-12, MSPGLMELMTL; 1.125E-12, 40.0 ℃에서는 MSPMTL; 1.494E-12, MSPMELMTL; 1.177E-12, MSPSTMELMTL; 1.393E-12, MSPGLMELMTL; 1.475E-12였다. 이러한 결과는 온도가 증가할수록 바이오 소재로부터 MTL의 방출 속도가 증가한다는 것을 의미한다. 반면에 MEL이 첨가되지 않은 바이오 소재는 MTL의 분해로 인해 방출 후 빠르게 평형 농도에 도달한다는 것과 가소제가 첨가된 바이오 소재는 작용기로 인해 방출 속도가 비교적 빠르다는 것을 알 수 있었다.
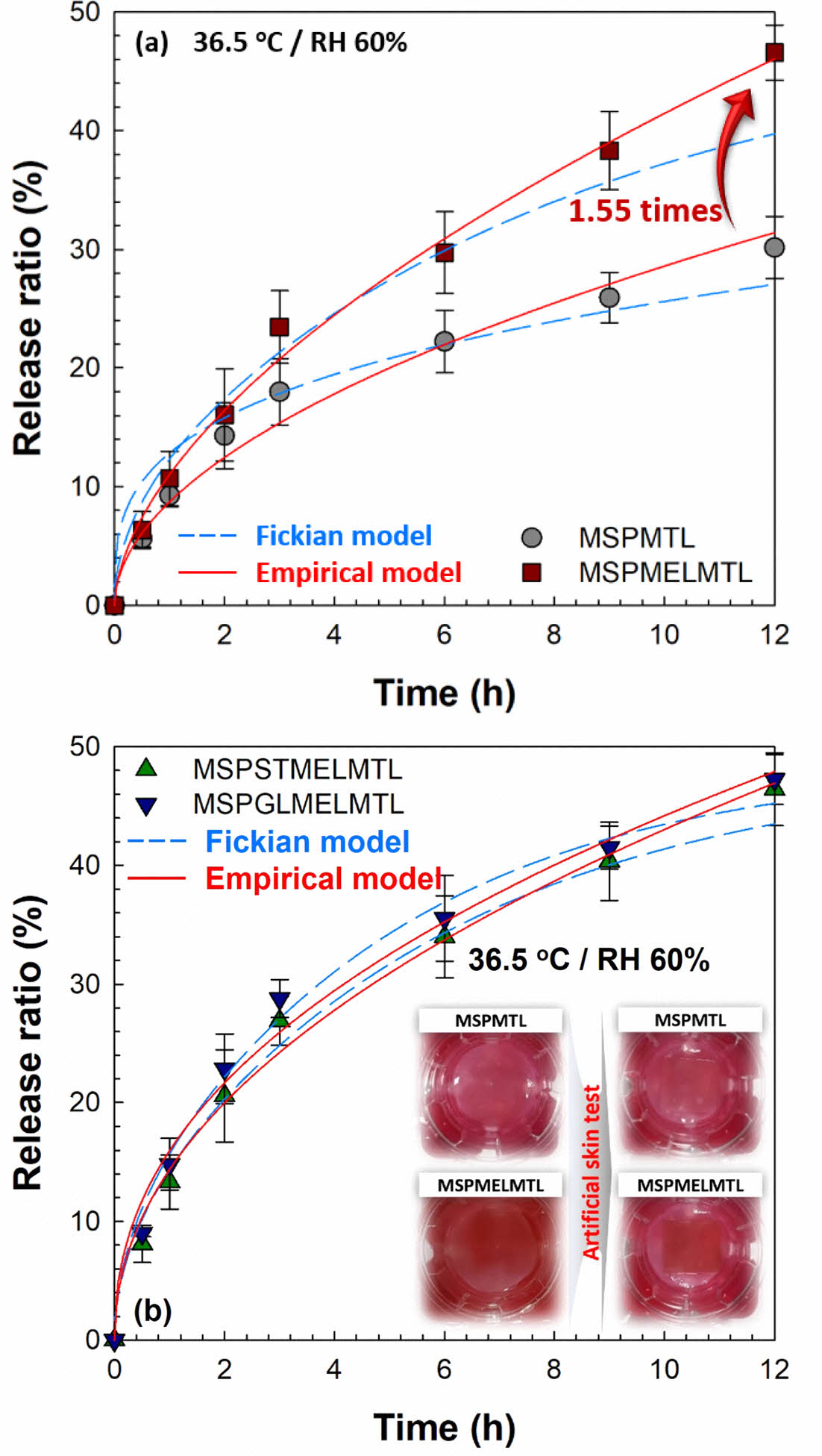
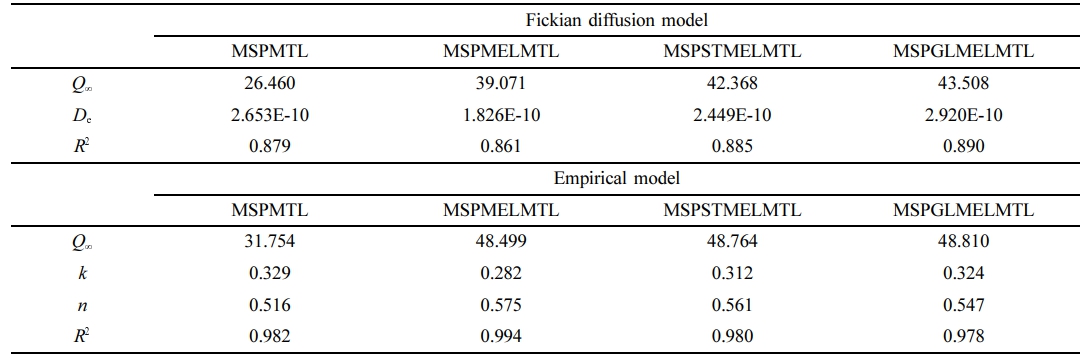
인공피부에서의 MTL 방출 특성. Figure 6은 사람의 피부 조건을 고려하여 36.5 ℃, RH 60%에서 인공피부를 이용해 MTL 각인 MS 기반 바이오 소재의 MTL의 방출 거동을 확인한 결과이다. 모든 바이오 소재에서 MTL은 12시간 동안 방출되었으며, MEL이 첨가되지 않은 바이오 소재는 약 30.15%의 MTL을 방출하였으나, MEL이 첨가된 바이오 소재의 경우 MTL 방출률이 약 1.54배 향상되었다. 이러한 결과는 MEL이 MTL의 광안정제로 작용된다는 것을 보여준다. MTL의 방출 정도는 MSPGLMELMTL > MSPSTMELMTL > MSPMELMTL > MSPMTL 순이었으며, 이것은 완충 용액에서의 MTL 방출과 같은 경향이었다. 인공피부에서의 MTL 방출 특성을 파악하기 위하여 수학적 모델링을 적용한 결과는 Figure 6과 Table 3에 정리하였다. 인공피부에서의 MTL 방출 특성은 empirical 모델이 Fickian 확산 모델보다 더 적합하게 예측한 것으로 확인되었다. 또한, 가소제 및 MEL 첨가 유·무와 관계없이 제조한 바이오 소재의 확산 지수 n 값은 0.5를 초과하였고, 이러한 결과로부터 인공피부를 이용한 MTL 방출 특성은 non-Fickian 확산 메커니즘을 따른다는 것을 확인할 수 있었다.
|
Figure 1 Physical properties of MS based biomaterials: (a) swelling behavior of prepared biomaterials with various heat curing time; (b) solubility of prepared biomaterials with various heat curing time; (c) tensile strength and elongation at break of MS based biomaterials with/ without the addition of MTL, MEL, plasticizers using heat curing for 30 min. |

|
Figure 2 FE-SEM and optical microscope images of the surface and cross-section of prepared biomaterials: (a) MS based biomaterials without heat curing; (b) heat cured MS based biomaterials; (c) heat cured MTL imprinted MS biomaterials; (d) heat cured MTL imprinted MS biomaterials with MEL; (e) heat cured MTL imprinted MS biomaterials with MEL and GL; (f) heat cured MTL imprinted MS biomaterials with MEL and ST |
|
Figure 3 (a) UV absorbance curves before/after light exposure for MTL solution; (b) FTIR spectra of MTL before/after heat curing; (c) FTIR spectra of MEL before/after heat curing; (d) FTIR spectra of prepared biomaterials with/without MTL, MEL, plasticizers. |
|
Figure 4 Experimental and mathematical model fits of MTL release from MTL imprinted MS based biomaterials with various temperature at pH 5.5 buffer. The symbols indicate experimental data and the dash line (Fickian model) and solid line (empirical model) depict prediction. |
|
Figure 5 Diffusion distribution function for MTL released from MTL imprinted biomaterials with various temperature at pH 5.5 buffer |
|
Figure 6 Experimental and mathematical model fits of MTL release from MTL imprinted MS based biomaterials using artificial skin test at 36.5 ℃ and RH60%. The symbols indicate experimental data and the dash line (Fickian diffusion model) and solid line (empirical model) depict prediction. |
|
Table 2 Fickian Diffusion and Empirical Model Parameters of MTL Release from MTL Imprinted MS Based Biomaterials with Various Temperature and pH 5.5 Buffer |
|
Table 3 Fickian Diffusion and Empirical Model Parameters of MTL Release from MTL Imprinted MS Based Biomaterials Using Artificial Skin |
본 연구에서 mungbean starch(MS), polyvinyl alcohol(PVA), 광안정제로 melanin(MEL), 가소제로 glycerol(GL) 또는 sorbitol(ST)를 이용하여 천식 치료제인 montelukast(MTL)를 각인한 MS 기반 바이오 소재를 제조하고, MTL의 약물 방출 거동을 조사하였다. MTL의 광분해를 최소화하기 위해 열경화 공정은 100 ℃에서 30분 동안 수행하였으며, 제조한 바이오 소재의 물리적 특성은 인장강도와 신축률을 조사하였다. 가소제가 첨가된 바이오 소재의 경우 GL과 ST의 hydroxyl group으로 인해 신축률이 크게 증가되었고, MEL과 MTL의 첨가에 따른 물리적 특성의 차이는 거의 확인되지 않았다. FE-SEM과 광학 현미경 분석 이미지를 통해 MS 기반 바이오 소재의 표면 및 단면은 균일하게 제조된 것으로 확인되었고, FTIR 결과로부터 바이오 소재의 MTL 및 가소제 첨가에 의한 특징적인 피크를 확인할 수 있었다. MTL의 방출 특성은 다양한 온도(40.0, 36.5, 32.0 ℃)와 사람의 피부 조건인 pH 5.5의 아세테이트 완충 용액으로 조사하였다. 그 결과, 제조한 바이오 소재에서 MTL은 120분 이내에 빠르게 방출되었고, 온도가 증가할수록 빠른 방출 속도를 보였다. MEL이 첨가된 바이오 소재는 MEL이 첨가되지 않은 바이오 소재의 MTL 방출률에 비해 1.30-1.43배 향상되었는데, 이것은 광안정제로써 MEL이 MTL의 분해를 억제한 것이라 판단되었다. 또한, 확산 분포 함수를 이용하여 바이오 소재에서 방출된 MTL의 분포 함수 곡선과 온도가 올라갈수록 방출 속도가 빨라진다는 것을 확인할 수 있었다. 인공피부 실험에서 제조한 바이오 소재로부터 MTL은 12시간 동안 방출되었다. 첨가된 가소제의 종류에 따라 다른 방출 속도를 보였는데 이는 가소제의 작용기인 hydroxyl group의 영향인 것으로 판단되었다. 또한, MEL이 첨가되지 않은 바이오 소재의 MTL 방출률은 약 30.15%인 것에 비하여 광안정제로 MEL이 첨가된 바이오 소재는 MTL을 약 46.75% 방출하였다. MTL의 방출 메커니즘을 평가하기 위해 수학적 모델링을 적용한 결과, 완충 용액에서 MTL의 방출 특성은 Fickian 확산 모델로 더 적합하게 예측되었으며 pseudo-Fickian 확산 메커니즘을 따르는 것으로 확인되었다. 반면에, 인공피부에서 MTL의 방출 거동은 empirical 모델이 더 적합한 것으로 나타나 방출 특성이 non-Fickian 확산 메커니즘임을 확인되었다.
- 1. Malaiya, M. K.; Jain, A.; Pooja, H.; Jain, A.; Jain, D. Controlled Delivery of Rivastigmine Using Transdermal Patch for Effective Management of Alzheimer’s Disease. J. Drug Deliv. Sci. Technol. 2018, 45, 408-414.
-

- 2. Prausnitz, M. R; Langer, R. Transdermal Drug Delivery. Nat. Biotechnol. 2008, 26, 1261-1268.
-

- 3. Sionkowska, A. Current research on the Blends of Natural and Synthetic Polymers as New Biomaterials. Prog. Polym. Sci. 2011, 36, 1254-1276.
-

- 4. Torres, F. G.; Commeaux, S.; Troncoso, O. P. Starch-based Biomaterials for Wound-dressing Applications. Starke. 2013,65, 543-551.
-

- 5. Alves, C. M.; Yang, Y.; Carnes, D. L.; Ong, J. L.; Sylvia, V. L.; Dean, D. D.; Agrawal, C. M.; Reis, R. L. Modulating Bone Cells Response Onto Starch-based Biomaterials by Surface Plasma Treatment and Protein Adsorption. Biomaterials 2007, 28, 307-315.
-

- 6. Wei, C. The Efficacy and Safety of H1-antihistamine Versus Montelukast for Allergic Rhinitis: A Systematic Review and Meta-analysis, Biomed. Pharmacother. 2016, 83, 989-997.
-

- 7. Reicin, A.; White, R.; Weinstein, S. F.; Finn, A. F.; Nguyen, H.; Peszek, I.; Geissler. L.; Seidenberg, B. C. Montelukast, a Leukotriene Receptor Antagonist, in Combination with Loratadine, a Histamine Receptor Antagonist, in the Treatment of Chronic Asthma. Arch. Intern. Med. 2000, 160, 2481-2488.
-

- 8. Aashli, Reddy, S. G.; Kumar, B. S.; Prashanthi, K.; Murthy, H. C. A. Fabricating Transdermal Film Formulations of Montelukast Sodium with Improved Chemical Stability and Extended Drug Release. Heliyon 2023, 9, e14469.
-

- 9. Abdel-Gawad, R.; Osman, R.; Awad, G. A. S.; Mortada, N. Lecithin-based Modified Soft Agglomerate Composite Microparticles for Inhalable Montelukast: Development, Tolerability and Pharmacodynamic Activity. Powder Technol. 2020,360, 1167-1176.
-

- 10. Samper, M. D.; Fages, E.; Fenollar, O.; Boronat, T.; Balart, R. The Potential of Flavonoids as Natural Antioxidants and UV Light Stabilizers for Polypropylene. J. Appl. Polym. Sci. 2013, 129, 1707-1716.
-

- 11. Klampfl, C. W.; Himmelsbach, M. Advances in the Determination of Hindered Amine Light Stabilizers – A Review. Anal. Chim. Acta 2016, 933, 10-22.
-

- 12. Sabaa, M. W.; Oraby, E. H.; Abdel naby, A. S.; Mohamed R. R. Anthraquinone Derivatives as Organic Stabilizers for Rigid Poly(vinyl chloride) Against Photo-degradation. Eur. Polym. J. 2005, 41, 2530-2543.
-

- 13. Roy, S.; Rhim, J. W. Agar-based Antioxidant Composite Films Incorporated with Melanin Nanoparticles. Food Hydrocoll. 2019, 94, 391-398.
-

- 14. Wang, L. F.; Rhim, J. W. Isolation and Characterization of Melanin From Black Garlic and Sepia ink. LWT-Food Sci. Technol. 2019, 99, 17-23.
-

- 15. Roy, S.; Rhim, J. W. Carrageenan-based Antimicrobial Bionanocomposite Films Incorporated with ZnO Nanoparticles Stabilized by Melanin. Food Hydrocoll. 2019, 90, 500-507.
-

- 16. Yun, Y. H.; Yoon, S. D. Effect of Amylose Contents of Starches on Physical Properties and Biodegradability of Starch/PVA-blended Films. Polym. Bull. 2010, 64, 553-568.
-

- 17. Iyi, N.; Sasake, T. Decarbonation of MgAl-LDHs (layered double hydroxides) Using Acetate–buffer/NaCl Mixed Solution. J. Colloid Interface Sci. 2008, 322, 237-245.
-

- 18. Xu, H.; Zhou, J.; Dong, Q.; Tan, Y. Characterization of Moisture Vapor Diffusion in Fine Aggregate Mixtures Using Fickian and Non-fickian Models. Mater. Des. 2017, 124, 108-120.
-

- 19. Rubilar, J. F.; Cruz, R. M. S.; Zuniga, R. N.; Khmelinskii, I.; Vieira, M. C. Mathematical Modeling of Gallic Acid Release from Chitosan Films with Grape Seed Extract and Carvacrol. Int. J. Biol. Macromol. 2017, 104, 197-203.
-

- 20. Siepmann, J.; Peppas, N. A. Higuchi Equation: Derivation, Applications, Use and Misuse. Int. J. Pharm. 2011, 418, 6-12.
-

- 21. Davis, E. M.; Minelli, M.; Baschetti, M. G.; Elabd, Y. A. Non-fickian Diffusion of Water in Polylactide. Ind. Eng. Chem. Res. 2013, 52, 8664-8673.
-

- 22. Kim, H. S.; Kim, K. J.; Lee, M. W.; Lee, S. Y.; Yun, Y. H.; Shim, W. G.; Yoon, S. D. Preparation and Release Properties of Arbutin Imprinted Inulin/polyvinyl Alcohol Biomaterials. Int. J. Biol. Macromol. 2020, 161, 763-770.
-

- 23. Siepmann, J.; Peppas, N. A. Modeling of Drug Release from Delivery Systems Based on Hydroxypropyl Methylcellulose (HPMC). Adv. Drug Deliv. Rev. 2012, 64, 163-174.
-

- 24. Li, N. N.; Fu, C. P.; Zhang, L. M. Using Casein and Oxidized Hyaluronic Acid to form Biocompatible Composite Hydrogels for Controlled Drug Release. Mater. Sci. Eng. C 2014, 36, 287-293.
-

- 25. Uliniuc, A.; Hamaide, T.; Popa, M.; Băcăiță, S. Modified Starch-based Hydrogels Cross-linked with Citric Acid and Their Use as Drug Delivery Systems for Levofloxacin. Soft Mater. 2013, 11, 483-493.
-

- 26. Rezaei, A.; Nasirpour, A.; Tavanai, H.; Fathi, M. A Study on the Release Kinetics and Mechanisms of Vanillin Incorporated in Almond Gum/polyvinyl Alcohol Composite Nanofibers in Different Aqueous Food Simulants and Simulated Saliva, Flavour Fraga. J. 2016, 31, 442-447.
-

- 27. Ranjan, O. P.; Nayak, U. Y.; Reddy, M. S.; Dengale, S. J.; Musmade, P. B.; Udupa, N. Osmotically Controlled Pulsatile Release Capsule of Montelukast Sodium for Chronotherapy: Statistical Optimization, in vitro and in vivo Evaluation. Drug Deliv. 2014, 21, 509-518.
-

- 28. Priyanka, K.; Hasan, S. A. A. Preparation and Evaluation of Montelukast Sodium Loaded Solid Lipid Nanoparticles. J. Young Pharm. 2012, 4, 129-137.
-

- 29. Stainsack, J.; Mangrich, A. S.; Maia, C. M. B. F.; Machado, V. G.; Santos, J. C. P. D.; Nakagaki, S. Spectroscopic Investigation of Hard and Soft Metal Binding Sites in Synthetic Melanin. Inorg. Chim. Acta 2003, 356, 243-248.
-

- 30. Ning, W.; Jiugao, Y.; Xiaofei, M.; Ying, W.; The Influence of Citric Acid on the Properties of Thermoplastic Starch/linear Low-density Polyethylene Blends. Carbohydr. Polym. 2007, 67, 446-453.
-

- 31. Pourfarzad, A.; Ahmadian, Z.; Najafi, M. B. H. Interactions Between Polyols and Wheat Biopolymers in a Bread Model System Fortified with Inulin: A Fourier Transform Infrared Study. Heliyon 2018, 4, e01017.
-

- 32. Mohsin, M.; Hossin, A.; Haik, Y. Thermal and Mechanical Properties of Poly(vinyl alcohol) Plasticized with Glycerol. J. Appl. Polym. Sci. 2011, 122, 3102-3109.
-

- 33. Kim, K. J.; Yun, Y. H.; Je, J. Y.; Kim, D. H.; Hwang, H. S.; Yoon, S. D. Photothermally Controlled Drug Release of Naproxen-incorporated Mungbean Starch/PVA Biomaterials Adding Melanin Nanoparticles. Process Biochem. 2023, 129, 268-280.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2024; 48(1): 10-19
Published online Jan 25, 2024
- 10.7317/pk.2024.48.1.10
- Received on Jul 12, 2023
- Revised on Aug 7, 2023
- Accepted on Oct 20, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Wang-Geun Shim** , and Soon-Do Yoon
-
Department of Chemical and Biomolecular Engineering, Chonnam National University, Yeosu, Jeollanam-do 59626, Korea
**Department of Chemical Engineering, Sunchon National University, Suncheon, Jeollanam-do 57922, Korea - E-mail: wgshim@sunchon.ac.kr, yunsd03@chonnam.ac.kr
- ORCID:
0000-0002-3521-4055, 0000-0002-3519-3071









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.