- The Fabrication of Acrylic Acid and Boron Nitride Coated Nanotopographical Substrate for New Bone Formation
Min Suk Lee*, Young Min Shin*, Jin Jeon*, and Hee Seok Yang*, **,†

*Department of Nanobiomedical Science, Dankook University, Cheonan 31116, Korea
**Bio-Medical Engineering Research Center, Dankook University, Cheonan 31116, Korea- 골 재생을 위한 Acrylic Acid와 Boron Nitirde가 코팅된 나노지형학 지지체 제조
*단국대학교 나노바이오의과학과, **단국대학교 바이오의료공학 핵심연구지원센터
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
In recent years, there has been increasing interest in the development of biomimetic scaffolds that mimic the native environment and structure of specific tissues for tissue engineering applications. In this study, we fabricated a scaffold mimicking the longitudinally aligned collagen bundles constituting bone tissue using poly(lactic-co-glycolic acid) nanopatterned substrate that was prepared via solvent-assisted drop casting and capillary force lithography. Furthermore, to enhance interactions between biological interfaces and our substrate, we modified surface of nanopatterned substrate that was grafted acrylic acid using gamma-irradiation. Also, we coated electrically conductive material, boron nitride through Van der Waals force with grafted acrylic acid (referred to P-BN-Np). We confirmed through SEM that surface of P-BN-NP was not damaged during surface modification process. P-BN-Np showed much higher mineral depositions compared to other group in in vitro osteogenic differentiation tests. For proving regenerative capacity of P-BN-Np about bone regeneration, we performed mouse calvarial defect model. After 8 weeks, P-BN-Np presented significantly higher new bone formation area, volume and density compared to other group through micro-CT, histological and immunohistological analyses. Therefore, P-BN-Np, developed in this study, holds promise as a biomimetic scaffold for tissue engineering, offering a versatile platform for regenerating various tissues.
최근 조직공학용 생체재료 개발 측면에서 특정 조직의 생체 내 환경 및 형태를 모사하는 생체모사형 지지체 개발에 관심이 높아지고 있다. 이에 본 연구진은 골 조직을 구성하고 있는 길이 방향의 콜라겐 다발을 생분해성 및 생체적합성 고분자인 poly(lactic-co-glycolic acid)로 solvent-assisted drop casting과 capillary force lithography를 이용하여 나노스케일의 그루브-릿지 형태의 패턴으로 모사한 지지체를 제조하였다. 또한 이식 시, 생물학적 계면과의 상호작용을 향상시키기 위해 지지체의 표면을 감마선 조사를 이용해 acrylic acid를 그라프팅 하였고 전기전도성 물질인 boron nitride를 그 위에 코팅하여 지지체의 표면개질을 완료하였다(P-BN-Np). 주사 전자 현미경을 통해 식각된 나노패턴이 표면개질 과정에서 영향을 받지 않는다는 것을 확인하였으며, P-BN-Np 위에서 조골세포 골 분화 유도 실험을 진행했을 때, 패턴이 식각되지 않은 그룹(P-BN-Flat) 보다 더 높은 칼슘 침착량을 보이는 것을 확인하였다. P-BN-Np의 골 재생효과를 검증하기 위해 마우스 두개골 결손 모델에 이식 8주 후 방사선학적 분석을 통해 결과를 확인했을 때, 골 결손 부위의 상단 부분이 재생되어 나노패턴과 표면개질 인자들의 시너지 효과를 확인할 수 있었다. 따라서 이상에서 개발된 P-BN-Np는 조직공학용 생체모사 지지체로서 다양한 조직을 재생시키기 위한 응용 플랫폼으로 활용될 수 있을 것으로 기대된다.
The fabricated biomimetic poly(lactic-co-glycolic acid) nanopatterned substrate was modified on the surface of the substrate via grafting acrylic acid (AA) using gamma-irradiation and coating boron nitride (BN) for improving bone regeneration.

Keywords: boron nitride, nanotopography, poly(lactic-co-glycolic acid), electrical conductivity, mouse calvarial defect model, bone regeneration.
본 연구는 2019년도 교육부의 재원으로 한국기초과학지원연구원 국가연구시설장비진흥센터의 지원을 받아 수행된 연구임(과제번호 2019R1A6C1010033). 이 성과는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(2023R1A2C1006750).
저자들은 이해상충이 없음을 선언합니다.
다음과 관련된 실험 결과에 대한 정보(TBO 염색 및 정량, BN의 전기전도성 측정). 이 자료는 다음 사이트에서 얻을 수 있습니다(http://journal.polymer-korea.or.kr).
PK_2024_048_01_86_Supporting_Information_template.pdf (468 kb)
Supplementary Information
인체에 선천적 및 후천적 질환 또는 피치못할 사고, 외력에 의한 조직 결손이 발생했을 경우, 우리 몸은 복잡한 치료 기작을 통해 재생시키는 과정을
거친다.1 그러나, 재생의 한계를 벗어나는 결손이 발생한 경우, 인체의 자가 치유에 의한 제한된 수복 능력으로 본래의 기능성까지 복구되는 것은 매우 한정적인 일이며 이를 해결하기 위해서는 결손부위에 적합한 인공 조직의 이식이 요구된다. 조직 공학은 이러한 문제를 해결하기 위해 인체의 손상된 조직이나 장기를 치유하거나 대체하여 정상적인 기능을 복원하는데 중요한 역할을 해 왔으며,2,3 여러가지 대체제를 개발해 왔다. 생체 조직은 세포와 세포외 다양한 물질과의 상호작용에 의해 기능과 형태가 유지되며, 특정 조직의 외부 형태나 세포외 기질이 부여하는 기계적 신호가 세포의 증식, 분열 그리고 분화에 영향을 미칠 수 있는 중요한 역할을 할 수 있다.4,5 최근, 이러한 특정 조직의 물리적 형태를 조직공학적인 접근으로 이식용 생체모사형 지지체 제작 연구가 활발히 진행되고 있으며 약물 사용 등의 외부 자극 없이 세포의 거동을 조절 할 수 있는 인공적인 물리적 환경을 제공할 수 있다는 결과가 이미 보고된 바 있다.6
조직공학 이식용 지지체를 제작하기 앞서, 중요하게 고려해야할 부분은 지지체 표면이 세포친화성 작용기를 가져야 한다는 것이다.5,7 생체모사형 지지체를 제작하여 생체 내에 이식했음에도 지지체 표면 특성에 의해서 초기의 세포 부착이 이루어지지 않는다면 전달하고자 하는 기계적 신호에 대한, 기대한 효과를 유도하기 어려울 것이다. 따라서 소재 표면과 세포막 사이의 상호작용을 향상시킬 수 있는 표면개질이 필요하다. 표면 개질 방법에는 다양한 방법이 있으나, 그 중 방사선 조사 기술은 감마선 또는 전자선을 지지체 표면에 조사하였을 때, 방사선의 이온화 에너지만을 이용해 세포 친화성이 높은 친수성 단량체에 흡수시킴으로써, 개시제나 촉매제와 같은 화학 첨가제 없이 자유 라디칼을 형성시켜 지지체 표면에 매우 균일하게 친수성 단량체를 도입할 수 있는 장점이 있다.5,8-11
보론 나이트라이드(boron nitride, BN)는 흑연과 유사한 결정구조를 가지는 화합물로서 기계적 물성, 열 전도성, 전기 전도성 및 구조적 안정성이 뛰어나며12,13 특히 조골세포에 대한 생체적합성이 안정한 것으로 알려져 있다.14 또한 보론 나이트라이드는 표면에 미네랄 침착을 유도할 수 있어15 골 재생 측면에서 긍정적인 역할을 할 것으로 사료된다.
본 연구진은 생분해성 및 생체적합성 고분자인 poly(lactic-co-glycolic acid)(PLGA)를 이용하여 골 조직을 구성하고 있는 길이 방향의 콜라겐 다발을 800 nm 스케일의 그루브-릿지 형태로 생체 모사하여 실제 조직과 유사한 기계적 신호를 부여할 수 있는 생체모사형 골 재생용 지지체를 제작하였다. 더불어 합성 고분자를 이용한 이식용 지지체의 단점인 소수성 표면을 친수성 단량체인 acrylic acid를 감마선 조사를 이용해 그라프트시켜 친수성을 높였으며 골 재생에 있어서 부족한 기능성을 보완하기 위해 보론 나이트라이드를 코팅하였다. 만들어진 지지체는 표면분석과 조골세포의 골분화 유도, 마우스 두개골 결손 모델에서 골 재생용 효과를 관찰하였고, 향후 조직공학용 플랫폼으로써의 응용 가능성을 검증하였다.
시약 및 재료. 나노패턴을 식각하기 위해 실리콘 웨이퍼 마스터(나노종합기술원, 한국), polyurethane acrylate(PUA; MINS 301 RM, 미뉴타텍, 한국)와 polydimethylsiloxane (PDMS; Sylgard184, Dow Corning, 미국)이 사용되었다. 나노패턴이 식각된 패치를 제조하기 위해서 생체적합성 및 생분해성을 가지는 PLGA(Mw 120000 Da, Evonik, 미국)와 용매로 chloroform (대정, 한국)이 사용되었다. BN(Sigma-Aldrich, 미국)을 코팅하기 위해서 acrylic acid(AAc; Sigma-Aldrich, 미국)을 구입하여 사용하였다.
나노패턴을 가지는 생분해성 및 생체적합성 지지체 제조. 나노패턴을 식각하기 위해서 본 연구팀에서 선행 연구되어진 solvent-assisted drop casting(SDC) 및 capillary force lithography (CFL)을 이용하여 PLGA 지지체를 제조하였다.16 나노패턴이 식각된 PUA 몰드(Groove : Ridge : height = 800 nm : 800 nm : 600 nm)는 polyethylene terephthalate(Skyrol®, SKC Inc., 한국) 필름을 이용해 UV(λ = 250-400 nm) 조사에 의해 실리콘 웨이퍼 마스터의 패턴을 복제하였다. 무게 비율로 준비된 모노머와 가교제(SYLGARDTM 184 Silicone Elastomer Kit, 미국)를 10:1 비율로 섞어 PDMS 시트를 제조하였다. 제조된 PDMS 시트 위에 유리로된 커버 글라스를 놓고 15% 농도 (w/v)의 PLGA 용액을 분주한 후, 다른 PDMS 시트를 분주된 PLGA 용액 위에 덮고 15분동안 압력(~10 kPa)을 가해주어 평평한 PLGA 지지체(P-Flat)를 제조하였다. 15분 후, 위에 덮여진 PDMS 시트를 제거하고 패턴이 복제된 PUA 몰드를 PLGA 지지체 위에 덮어 열(120 ℃)과 압력을 15분동안 동시에 가해 나노패턴이 식각된 PLGA 지지체(P-Np)를 제조하였다.
AAc 그라프트 및 BN 코팅. SDC와 CFL을 통해 제조된 나노패턴 PLGA 지지체의 표면에 아크릴산을 그라프트하기 위해서 감마선을 사용하였다. 간단히 0.01 M의 Mohr’s salt가 포함된 3%의 AAc 용액에 지지체를 담지하고 10 kGy(10 kGy hour-1)의 선량으로 조사하였으며, 조사된 지지체에서 반응을 하지 않은 AAc를 제거하기 위해 48시간 동안 증류수를 이용하여 세척하였다. 지지체에 그라프트된 AAc의 정량분석을 위해 toluidine blue O(TBO) 염색방법을 통하여 분석하였다. AAc가 그라프트된 지지체를 TBO 용액(20 mg NaCl, 0.01 M HCl, 4 mg TBO chloride)에 24시간 동안 상온에서 반응시킨 후, 미반응된 TBO를 3차 증류수를 이용하여 제거하였다. 이후에 EtOH와 0.1 M NaOH(4 : 1, v/v) 혼합 용액에서 염색된 TBO를 초음파 처리를 통해 완전히 용출시켰으며, 용출된 용액은 마이크로 플레이트 리더기(SparkTM 10M, TECAN, 스위스)를 이용하여 630 nm에서 흡광도를 측정하여 정량하였다. AAc가 그라프트된 지지체들은 3차 증류수에 BN 0.03 μg/mL 농도의 용액에 3시간 동안 침지시킨 후 증류수로 2번 세척하였다.
전기전도성 측정. 전기전도도 측정은 4 point probe법을 사용하였다. 면저항은 50 mVs-1의 주사율에서 선형전압전류법 (-0.5 - 0.5 V)으로 측정한 다음 문헌을 참고하여 면저항으로부터 전도도를 계산하였다.17
BN이 코팅된 나노패턴 PLGA 지지체의 표면분석. BN이 코팅된 나노패턴 PLGA 지지체의 표면은 단국대학교 바이오의료공학 핵심연구지원센터의 전계방출형 주사전자현미경 (FE-SEM; model S-4300, Hitachi, 일본)을 이용하여 관찰하였고, 지지체 표면의 Wettability은 물 접촉각 측정기(Phoenix-300, surface electro optics Ltd., 한국)를 이용하여 접촉각을 측정하였다. 물 접촉각은 1초 간격으로 4초 동안 측정하였으며, 물방울은 10 μL를 지지체 표면에 떨어트려 측정하였다.
BN이 코팅된 PLGA 지지체를 이용한 세포 골 분화실험. 세포 실험을 위한 모든 지지체는 산화 에틸렌 멸균 장치를 이용하여 멸균 후 사용하였다. 랫드 유래 조골세포(0.05 × 106 cells/mL)를 BN이 코팅된 PLGA 지지체에 접종하고 10% FBS가 첨가된 DMEM 배지에서 37 ℃, 5% CO2 조건에서 배양하였다. 24시간 배양 후 분화유도배지(50 μg/mL L-ascorbic acid, 10 mM β-glycerophosphate, 7 mM L-glutamine, 100 nM dexamethasone 포함된 DMEM)로 교환하여 격일로 배지를 갈아주었다. 2주 후, 배양한 조골세포는 4% paraformaldehyde (PFA; Sigma-Aldrich, 미국) 로 15분 동안 고정한 후, PBS로 2회 세척한 후에 Alizarin Red S(ARS; Sigma-Aldrich, 미국) 시약과 alkaline phosphatase(ALP; Amresco LLC, 미국) 시약을 각각 15분동안 처리하여 정성결과를 도출하였다. ALP 활성화 정량은 IGEPAL(Sigma-Aldrich, 미국) 용액과 p-nitrophentyl phosphate를 첨가하여 37 ℃에서 30분동안 반응시킨 후, 0.5 N의 NaOH를 첨가하여 반응을 종결시킨 다음 마이크로 플레이트 리더기로 410 nm의 파장에서 흡광도를 측정하였다. ARS 염색 정량은 ARS 염색된 샘플을 10% 농도의 아세트산과 수산화암모늄을 처리하여 얻어진 추출된 용액을 마이크로 플레이트 리더기로 405 nm의 파장에서 흡광도를 측정하였다. 칼슘 침착량은 2주 동안 분화시킨 세포를 0.6 N의 HCl을 24시간 동안 실온에서 처리하여 탈회시킨 용액을 calcium colormetric assay 키트(Sigma-Aldrich, 미국)를 이용해 정량하였다.
동물실험. 본 연구는 단국대학교 동물실험 윤리위원회의 승인을 얻은 후, 위원회의 감독을 받아 수행하였다(DKU-21-028). 6주령 암컷 ICR 마우스(다윤, 한국) 10마리를 사용하였으며, 이식재에 따라 2개 군으로 분류하여 실험하였다. 동물은 2% avertin(마우스 몸무게 g 당 20 μL)을 사용하여 마취하였다. 마우스 전두부의 털을 삭모하고 포비돈 솜으로 소독한 후, 비골에서 후두골 사이의 두개골 시상봉합을 따라 약 1.5 cm 가량 절개후에 두정골을 노출시켰다. 두정부에 4 mm 크기의 골 결손을 trephine bur(덴티움, 한국)을 소형 카바이드 라운드 버에 고정한 후에 저속 드릴 키트를 사용하여 형성하였다. 골 결손부에 각각의 이식재를 이식하였으며, 절개한 피부는 4-0 흡수성봉합사(Vicryl, Ethicon, 미국)를 사용하여 봉합하였다.
방사선학적 분석. 마우스 두개골에 이식재를 이식하고 8주 후, 이식재가 이식된 마우스는 모두 희생시킨 후, 마우스 두개골을 채취하여 4% PFA에 24시간 동안 고정시켰다. 고정시킨 표본은 micro-CT(Skyscan 1176, 벨기에) 내부에 있는 턴테이블에 표본을 고정한 후 0.2 mm 알루미늄 필터로 18 μm 크기의 픽셀로 촬영하였다. 촬영된 이미지는 micro-CT 자체 소프트웨어를 이용하여 3차원으로 재구성 및 정량하였다.
조직학적 분석 및 면역조직화학 염색. 고정시킨 표본은 tap water로 수세한 후 decalcifying solution(Sigma-Aldrich, 미국)을 이용해 탈회한 후, 에탄올 및 xylene를 이용하여 조직을 파라핀에 포매하였다. 파라핀 블록을 6 μm 두께로 절단하여 박절편을 만들어 Goldner’s trichrome(G. T.) 염색과 Osteopontin (OPN; abcam, 영국) 및 DAPI(DAPI-Vectashiled, Vector Laboratories, 미국) 면역조직화학 염색을 진행하였다. 염색된 조직표본은 광학(IX71, Olympus, 일본) 및 형광(Nikon ECLIPSE Ps2R, Nikon, 일본) 현미경은 단국대학교 바이오-의공학 핵심연구센터에서 진행하였다. 관찰 및 촬영 후, 이미지를 저장하여 조직학적 분석은 다음과 같은 수식으로 신생골 형성 영역 및 골밀도를 정량하였다.

통계학적 분석. 각 실험의 결과는 평균 ± 표준 편차 표현되었고, 통계 분석은 IBM SPSS Statistics 22(IBM, 미국)를 사용하여 수행되었다. 결과값은 일원 분산 분석(one-way analysis of variance)을 통해 평가되었으며, p 값이 0.05 미만인 경우를 통계적으로 유의미한 것으로 간주하였다.
BN이 코팅된 나노패턴 패치의 제조. 본 연구진은 이식가능한 나노패턴이 식각된 지지체를 만들기 위해 생분해성 및 생체적합성을 가지는 고분자인 PLGA를 SDC와 CFL을 이용하여 나노패턴을 식각하였다(Figure 1(a)). P-Flat 지지체는 PLGA 용액을 압력과 함께 PDMS 시트로 덮어주어 용매를 PDMS 시트에 흡수시킴으로써 쉽게 만들어질 수 있다. 또한 P-Flat 지지체에 열을 가해 필름형태의 PLGA를 유리전이온도에 도달시킴으로써 PUA 몰드의 나노패턴을 CFL에 의해 쉽게 복사시킬 수 있다. 이 과정은 복잡한 도구 및 절차를 요구하지 않아 쉽고 짧은 시간내 대량으로 여러가지의 형태의 패턴이 식각된 지지체를 생산할 수 있는 장점을 가진다. 나노패턴을 식각한 후, 본 연구진은 감마선 조사를 이용해 AAc를 지지체 표면에 그라프팅하여 지지체의 친수성기를 도입하였다(Figure 1(b)). AAc는 카복실산 말단에 바이닐기가 연결된 단순한 작용기로써 카복실 작용기의 밀도가 높을 경우 코팅된 표면의 친수성을 높일 수 있고, 더불어 친수성 작용기가 다수 분포된 표면은 세포 배양 시, 세포의 부착과 증식에 도움을 줄 수 있다는 장점이 있다.18 AAc가 그라프트된 지지체는 BN 용액에 담지하여 AAc와 BN 사이의 반데르발스 힘에 의한 결합에 의해 지지체 표면에 코팅이 유지되며, BN 코팅 후 지지체의 표면은 육안으로 관찰했을 때 하얗게 BN층이 형성되어져 있는 것을 확인할 수 있었다. BN은 붕소와 질화물의 결정구조로 이루어진 화합물로서 기계적 물성과 열전도성 및 전기전도성이 우수하며19,20 BN을 적용한 다양한 세포 실험에서 생체적합성이 뛰어나다는 것을 입증하였다.21,22 본 연구진은 BN 코팅과 AAc로 표면개질된 생분해성 및 생체적합성 나노패턴 지지체를 이용해 세포 골분화 및 생체 내 골재생 효과를 보고자 하였다.
표면개질된 P-Flat 및 P-Np 지지체의 표면분석. SDC와 CFL에 의해 식각된 PLGA 지지체에 AAc와 BN 코팅에 의해 표면개질된 지지체들의 표면을 주사 전자 현미경을 이용해 촬영하여 비교하였다(Figure 2(a)). 패턴이 식각되지 않은 P-flat 그룹의 경우 평평한 형태를 보여주는 반면, 패턴이 식각된 P-Np 그룹은 그루브와 릿지의 형태가 반복되는 명확한 패턴이 표면에 식각되어져 있음을 확인하였다. AAc가 그라프트된 패턴이 식각되지 않은 P-Flat(P-AAc-Flat) 및 패턴이 식각된 P-Np(P-AAc-Np) 그룹은 AAc 그라프트 과정에 의해 두 지지체 표면의 형태적 변화가 유도되었는지 확인하였으며, TBO 염색 및 정량을 통해 AAc가 실제로 그라프팅되었는지 확인하였다. 주사 전자 현미경으로 확인했을 때, 두 그룹 모두 전체적인 구조적 변화는 관찰되지 않았으며, 더불어 TBO 염색, 정량 결과 역시 AAc 농도에 따라 지지체 표면에서 용출되는 TBO의 양 증가하여 지지체 표면에 AAc가 그라프트된 것을 확인할 수 있었다(Figure S1). 또한 BN이 코팅된 패턴이 식각되지 않은 P-flat(P-BN-flat) 및 패턴이 식각된 P-Np(P-BN-Np) 그룹은 지지체 표면에 나노스케일의 BN 입자들이 표면의 형태 변화 및 훼손 없이 잘 코팅되어져 있음을 확인하였다.
조직공학용 지지체의 표면은 생체 내 이식 시, 세포의 부착과 증식에 중요한 영향을 미칠 수 있기 때문에 본 연구진은 각각의 지지체의 wettability를 지지체 표면의 물접촉각 측정을 통해 비교하였다(Figure 2(b,c)). 표면개질이 적용되지 않은 P-Flat(73.37 ± 0.95°)과 P-Np(63.65 ± 2.68°)은 본 연구진의 선행연구에서23 측정한 것과 유사한 값으로 측정되었으며, 이는 surface roughness에 의해 물접촉각이 감소된다는 Wenzel 이론에 기반한다.24 AAc 그라프팅된 P-AAc-Flat(63.55 ± 2.68°)과 P-AAc-Np(53.91 ± 3.06°)는 카복실 작용기의 밀도가 높아 그라프팅된 표면의 친수성이 증가되어 물접촉각의 측정값이 낮아진 것으로 사료된다. 또한 BN이 코팅된 P-BN-Flat(43.64 ± 1.92°)과 P-BN-Np(33.74 ± 2.26°)는 더 낮은 물접촉각이 측정되었으며, 이는 BN이 나노스케일의 표면을 가질경우 물분자 사이의 전기적 상호작용의 증가로 wettability가 증가한 것으로 사료된다.25 지지체의 wettability가 물접촉각으로 30도에서 40도사이에 분포하는 경우 세포 부착 측면에서 더 호의적일 수 있다고 보고된바 있기 때문에,23 P-BN-Np는 세포 부착이 P-BN-Flat에 비해 더 우수할 것으로 사료된다.
BN이 코팅된 지지체의 골 분화도 평가. BN이 코팅된 Flat과 Np 두 지지체에서 배양된 조골세포가 골 분화에 의한 골 형성의 역할에 영향을 미치는지 확인하게 위해 ALP와 ARS 정성, 정량 분석을 진행하였다(Figure 3). 2주 후의 정성, 정량분석에서 ALP 발현량은 두 그룹에서 P-BN-Flat은 0.22 ± 0.01 O.D./mg DNA으로 P-BN-Np의 0.14 ± 0.05 O.D./mg DNA 보다 유의하게 높은 값으로 측정되었다. 반면 ARS 정성, 정량분석에서는 P-BN-Np이 2.24 ± 0.24 mM/well으로 1.26 ± 0.25 mM/well인 P-BN-Flat보다 유의하게 높게 측정되었다. 칼슘 침착량 또한 P-BN-Np이 0.33 ± 0.09 mg/well으로 0.25 ± 0.07 mg/well인 P-BN-Flat보다 상대적으로 높게 측정되어 나노패턴이 식각된 그룹에서 더 높은 골 분화도를 보이고 있음을 확인하였다. 이 결과는 AAc 그라프팅으로 인한 친수성기 도입으로 접종한 세포의 안정적인 부착과 부착된 세포에 나노패턴이 부여하는 기계적 신호들을 골분화 인자와 함께 세포 핵에 전달시킴으로써 분화를 촉진시킬 수 있으며,16,26 전기전도성 물질인 BN(Figure S2)에 의해 단백질 및 미네랄 흡착을 촉진하여 세포 분화를 위한 세포 내 연쇄반응을 촉진시키는 등의 시너지 효과에 기인한 것으로 사료된다.27
동물실험군의 방사선학적 분석. 8주 후 희생 처리한 마우스 두개골을 Soft X-ray와 Micro-CT 이미지 분석을 이용해 골 결손부위에 이식한 지지체에 의한 골 형성 정도를 관찰하였다(Figure 4). Micro-CT를 이용해 3차원으로 표본을 재구성 했을 때(Figure 4(a)), P-BN-Flat은 골 결손 영역의 16.50 ± 1.89%로 신생골을 형성하고 있는 반면, P-BN-Np는 41.17 ± 5.51%로 유의하게 높은 값을 보이고 있음을 확인하였다 (Figure 4(c)). Figure 4(a)의 Soft X-ray 이미지를 관찰해보면, P-BN-Flat은 골 결손의 양 말단이 이어지지 않은 반면, P-BN-Np는 골 결손 양 말단의 골 두께와 유사한 골이 결손부위에 형성되어 이어진 형태를 보이며 골 결손 영역의 대부분이 신생골로 덮여있는 것을 확인하였다. 골 결손 영역에 대한 신생골의 부피(Figure 4(b))는 P-BN-Flat은 12.38 ± 3.68%, P-BN-Np는 25.35 ± 6.60%로 P-BN-Np가 유의하게 높은 결과를, 골 결손 영역에 대한 신생골의 밀도(Figure 4(d)) 역시 P-BN-Np가 0.66 ± 0.03 g/mm3로 P-BN-Flat의 0.38 ± 0.06 g/mm3 보다 유의하게 높은 값이 도출되었음을 확인하였다. 이러한 결과는 본 연구진의 골분화 실험결과와 마찬가지로 이식되어진 지지체가 골 결손부 위의 말단부로부터 유입되는 세포의 진입을 나노패턴에 의한 유도효과(Guidance effect)에23 의해 패턴이 식각되지 않은 flat 지지체보다 더 용이하게 하여, 골 결손 부위의 중심부로의 세포 이동량이 증가되고 패턴에 의한 기계적 신호전달, AAc 및 BN에 의한 세포 및 단백질의 부착율을 높여 신생골 형성에 크게 기여한 것으로 사료된다.
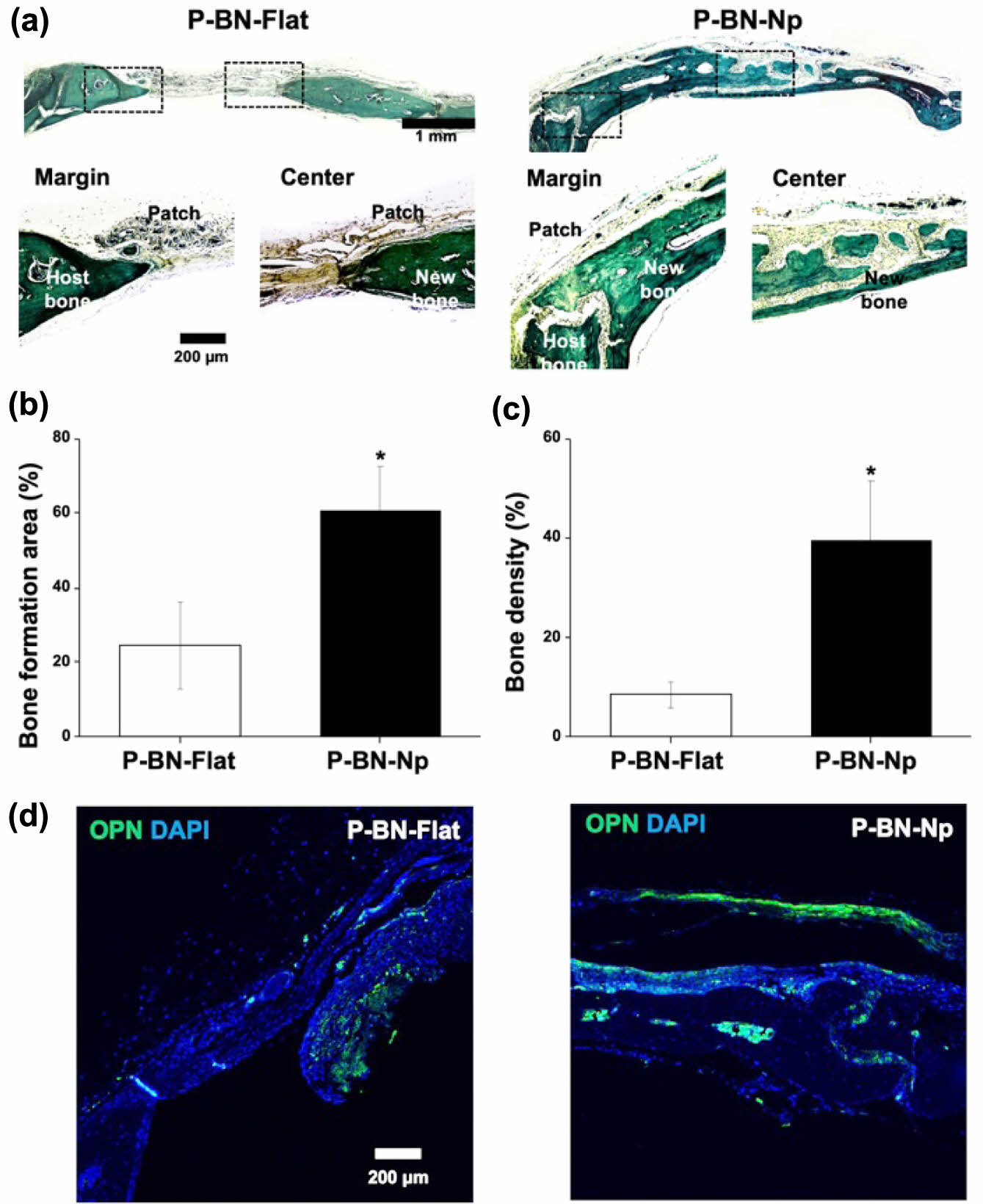
조직학적 및 면역조직화학적 분석. G. T. 염색된 조직 절편을 현미경을 이용해 이미지를 촬영하였다(Figure 5(a)). 골 결손부의 말단 및 중심 영역을 관찰한 결과, P-BN-Flat은 말단 부위에서 약간의 신생골 형성이, 중심부에서는 영역의 대부분이 섬유조직으로 형성되어 있는 것을 관찰할 수 있었다. P-BN-Np는 골 결손 부위의 대부분이 신생골이 형성되어져 있는것을 확인하였으며, 말단 부위에 형성된 신생골은 숙주의 기존 골 두께와 유사하며 중심 영역은 얇은 섬유성 결합조직을 따라 신생골이 형성되어져 있는 것을 관찰하였다. 현미경으로 촬영된 이미지를 기반으로 골 결손 영역에 대한 신생골 형성 영역 및 신생골의 밀도를 측정했을 때(Figure 5(b,c), P-BN-Flat의 신생골 형성 영역은 24.52 ± 11.81%, P-BN-Np는 60.39 ± 12.04%로 유의하게 높았으며, 신생골의 밀도 역시 39.46 ± 12.03%로 P-BN-Np가 8.49 ± 2.53%인 P-BN-Flat보다 두드러지게 높았다. 또한 조직학적 분석과 마찬가지로 면역조직화학적 분석에서 각 그룹간의 OPN의 발현량은 P-BN-Np에서 더 높게 나타나는 것을 형광현미경을 통해 확인할 수 있었다(Figure 5(d)). 이식된 지지체는 이식 기간 내 지지체로서의 기능성 제공 역할을 수행한 후 대부분 생분해되었으며 분해거동간 염증반응이 형성되지 않은 것으로 보아 숙주의 신생골 형성에 영향을 미치지 않은 것으로 사료된다.
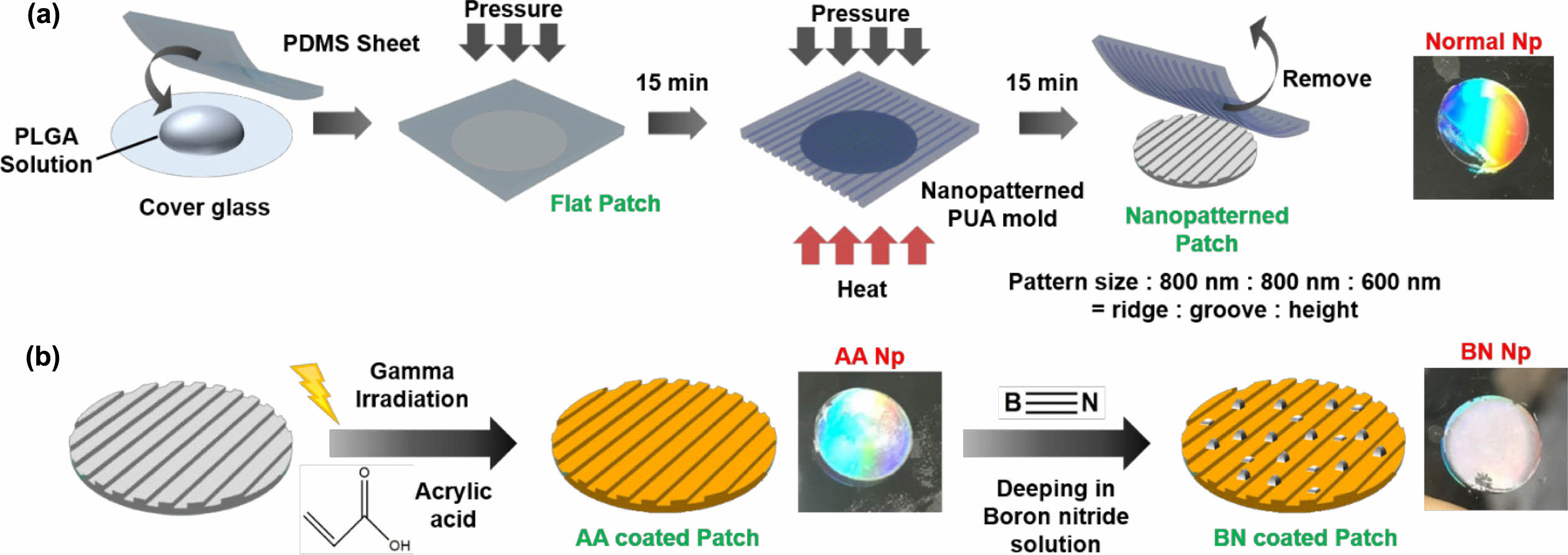
|
Figure 1 (a) Schematic illustration of capillary force lithography; (b) BN coating processes to fabricate P-BN-Np. |
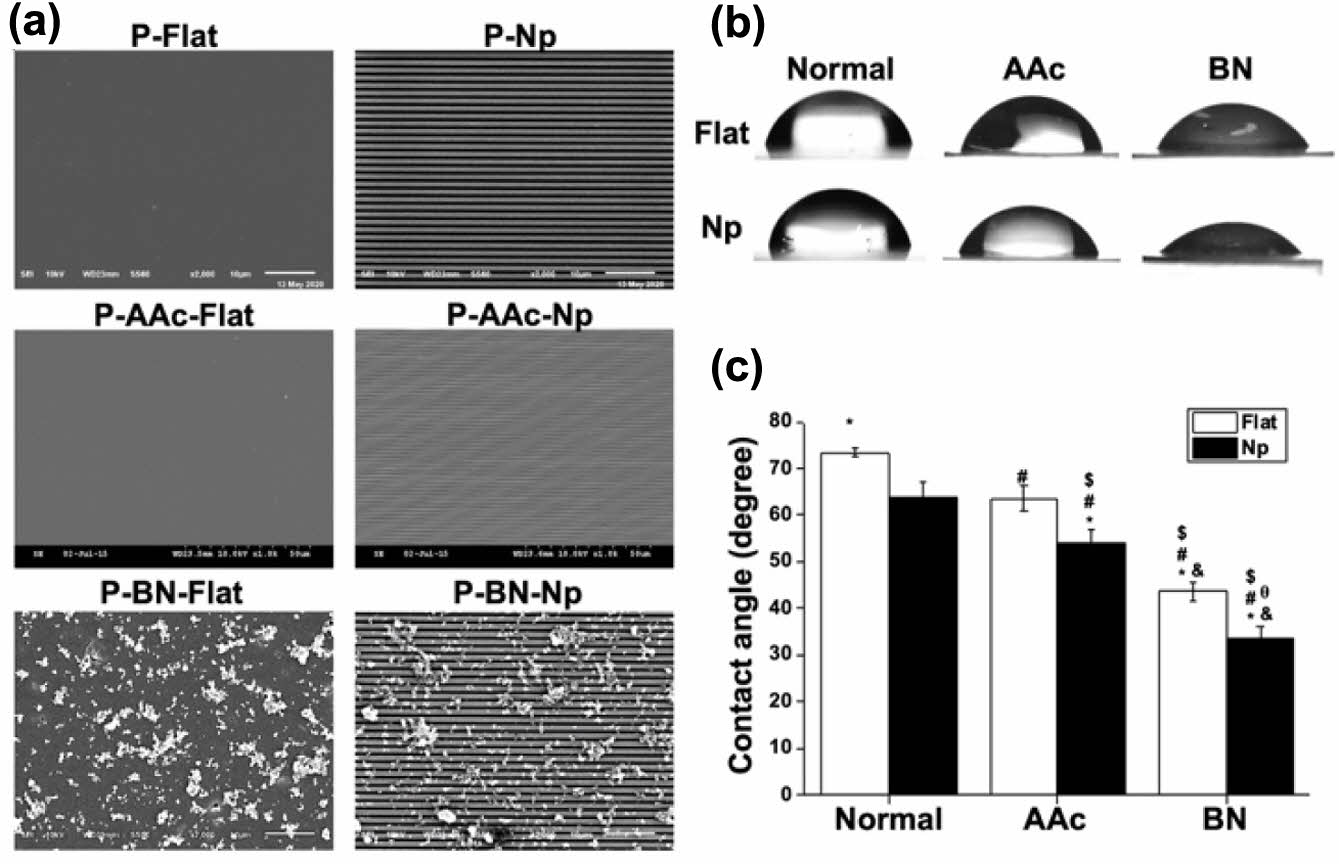
|
Figure 2 Surface characterization of various PLGA patches: (a) representative SEM images of various PLGA patches; (b) qualitative; (c) quantification results of water contact angle on various PLGA patches. |
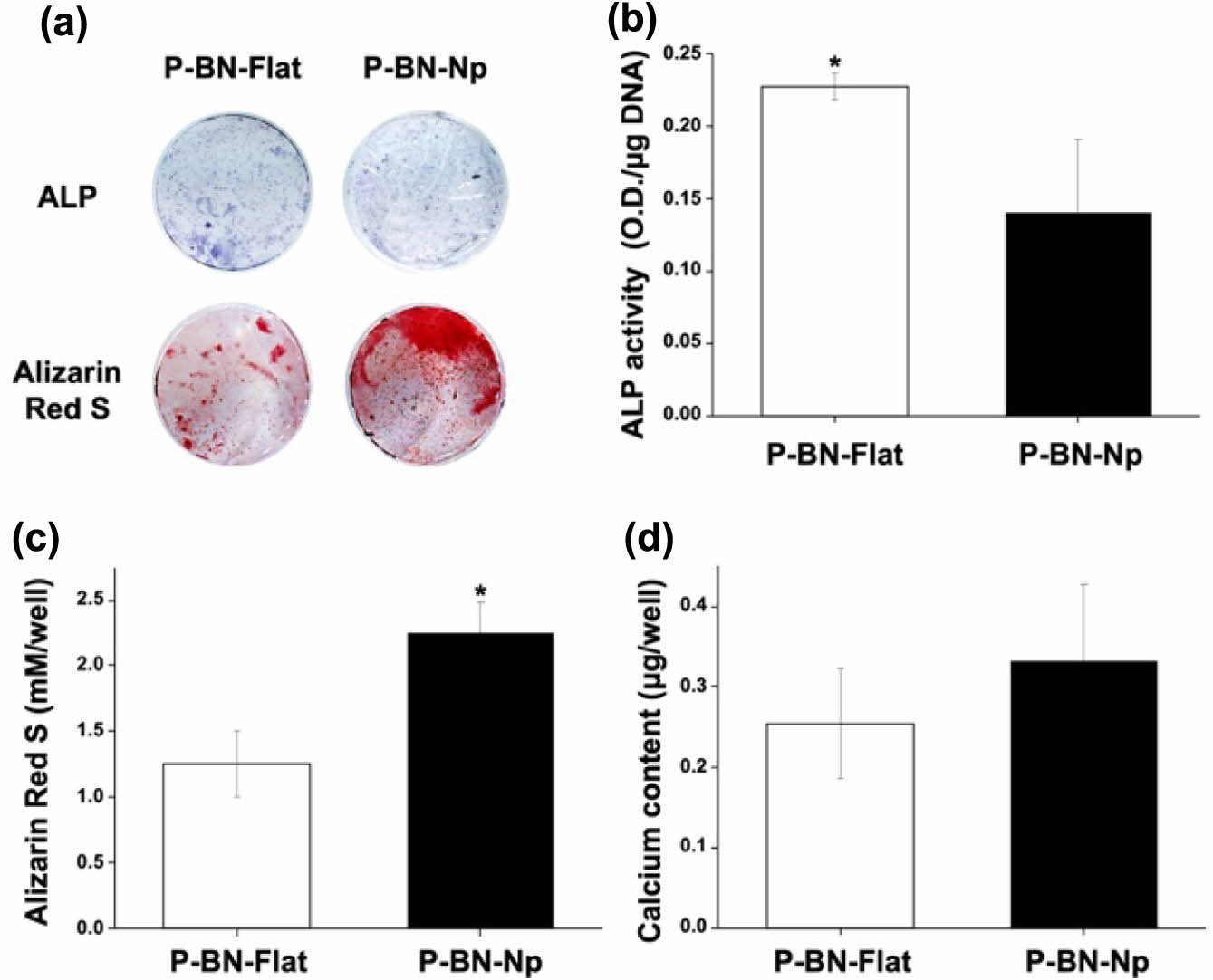
|
Figure 3 In vitro osteogenic differentiation tests on P-BN-Flat and P-BN-Np patches: (a) ALP and ARS staining of osteoblasts cultured on P-BN-Flat and P-BN-Np patches for 4 weeks. Quantification results of (b) ALP activity; (c) ARS; (d) calcium contents on PBN-Flat and P-BN-Np patches after 4 weeks (*p < 0.05). |
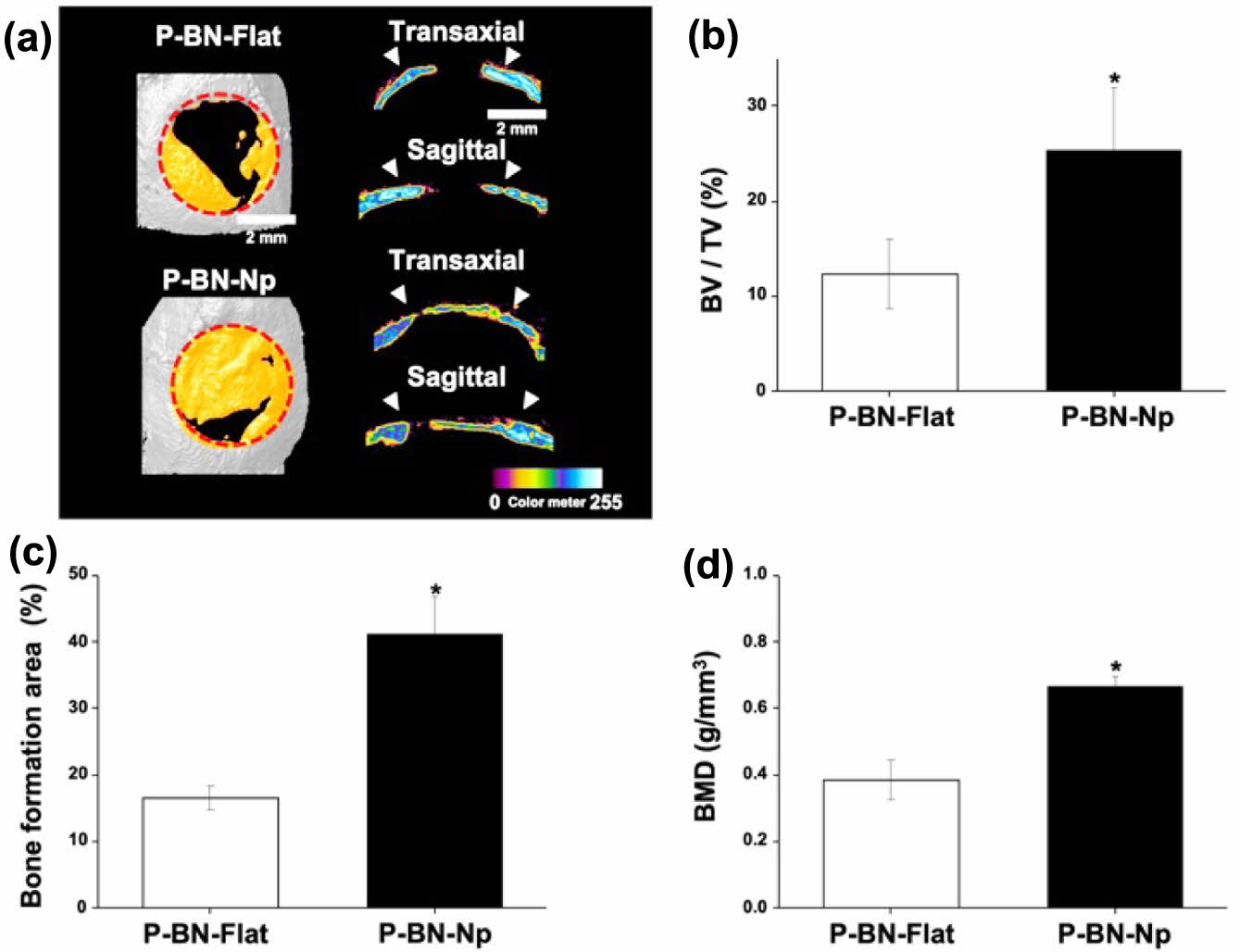
|
Figure 4 In vivo mouse calvarial defect bone regeneration using PBN-Flat and P-BN-Np patches: (a) Representative micro-CT images of P-BN-Flat and P-BN-Np after 8 weeks. Red dotted circles and arrow heads indicate defect margins. Yellow color indicate new bone formation. The scale bar = 2 mm. Quantification results: (b) of BV/TV; (c) bone formation area; (d) BMD (*p < 0.05). |
|
Figure 5 Representative images of Goldner’s trichrome staining of (a) P-BN-Flat and P-BN-Np after 8 weeks. Dotted boxes indicate magnified region of margin and center region. Quantification results of (b) bone formation area; (c) bone density on P-BN-Flat and PBN-Np (*p < 0.05); (d) immunofluorescent stain images of OPN and DAPI at defect area of P-BN-Flat and P-BN-Np groups. |
본 연구진은 생분해성 및 생체적합성 고분자인 PLGA를 SDC와 CFL을 이용하여 그루브-릿지 형태의 나노패턴을 식각하였고 감마선 조사에 의한 AAc 그라프팅과 전기전도성 물질인 BN을 코팅하여 골 재생용 지지체인 P-BN-Np를 제조하였다. P-BN-Np 위에서 조골세포를 배양해 골분화를 유도했을 때, 패턴이 식각되지 않은 P-BN-Flat 보다 뚜렷한 골분화율을 보여주었으며 마우스 두개골 결손 모델에 이식하여 신생골 형성에 미치는 결과 역시 우수하다는 것을 방사선학적 분석, 조직학적 및 면역조직화학적 분석에서 관찰할 수 있었다. 이러한 연구결과로부터 본 연구에서 개발 및 검증이 된 P-BN-Np는 연골, 신경, 근육 등 다양한 조직 재생을 위한 조직공학적 응용 및 활용이 가능할 것으로 사료된다.
- 1. Kim, C. H.; Jang, N. K.; Kim, D. K.; Song, Y. S. Osteogenic Differentiation of Rat Adipose Stem Cells in Demineralized Bone Particles Sponges. Polym. Korea 2017, 41, 13-20.
-

- 2. Kim, J. H.; Lee, B. K.; Yoo, J. J. Current Developments and Future Perspectives of Regenerative Medicie. In Regenerative Medicine; Yoo, J. J., Lee, I. W., Kim M. S.; KOONZA: Gyeonggi-do, 2018; pp. 3-22.
-

- 3. Choi, I.; Kim, C.; Song, J. E.; Baek, J.; Jeon, S. H.; Jeon, H.; Lee, S. Y.; Khang, G. A Comprehensive Study on Cartilage Regeneration Using Gellan-gum/Chondroitin Sulfate Hybrid Hydrogels. Polym. Korea 2017, 41, 962-966.
-

- 4. Chung, H. M.; Moon, S. H.; Park, S. J. Application of Functional Cardiomyocyte derived from Human Pluripotent Stem Cells. In Regenerative Medicine; Yoo, J. J., Lee, I. W., Kim M. S.; KOONZA: Gyeonggi-do, Korea, 2018; pp. 1013-1028.
- 5. Seo, D. E.; Jeong, S. I.; Park, J. S.; Gwon, H. J.; An, S. J.; Lee, B. H.; Im, D. S.; Shin, H.; Lim, Y. M. Preparation and Characterization of AEMA Grafted PCL Nanofibers Using Gamma-ray Irradiation. Polym. Korea 2017, 41, 143-150.
-

- 6. Kim, D. H.; Provenzano, P. P.; Smith, C. L.; Levchenko, A. Matrix Nanotopography as a Regulator of Cell Function. J. Cell. Biol. 2012, 30, 351-60.
-

- 7. Kim, S. K.; Jung, S. H.; Jung, S. H.; Seong, H.; Chi, S. C.; Cho, S. H.; Shin, B. C. Preparation of Protein-coated Cationic Liposomes Containing Doxorubicin and Their Binding Property of Blood Plasma Protein. J. Korean Chem. Soc. 2008, 52, 57-65.
-

- 8. Lim, J. Y.; Shin, Y. M.; Choi, J. B.; Jeong, J. O.; Gwon, H. J.; Jeong, S. I.; Park, J. S.; Lim, Y. M. Functionalization of Electrospun Nano/Micro-fibrous Scaffolds Using Gamma-ray Irradiation. J. Radiat. Res. 2013, 7, 1976-2402.
- 9. Jeong, S. I.; Jeong, J. O.; Choi, J. B.; Shin, Y. M.; Park, J. S.; Gwon, H. J.; Nho, Y. C.; An, S. J.; Park, M. Y.; Lim, Y. M. Development and Characterization of Heparin Immobilized Bacterial Cellulose (BC) for bone Tissue Engineering using Gamma-irradiation. J. Tissue. Eng. Regen. Med. 2014, 11, 56-63.
-

- 10. Jeong, S. I.; Choi, J. B.; Shin, Y. M.; Park, J. S.; Gwon, H. J.; Nho, Y. C.; Kang, S. S.; Lim, Y. M. Effect of Gamma Irradiation-Induced Degradation of Alginate Nanofibers for Tissue Engineering. J. Tissue Eng. Regen. Med. 2014, 11, 64-71.
-

- 11. Jeong, J. O.; Jeong, S. I.; Shin Y. M.; Park, J. S.; Gwon, H. J.; An, S. J.; Huh, J. B.; Shin, H.; Lim, Y. M. Development of Acrylic Acid Grafted Polycaprolactone (PCL)/Biphasic Calcium Phosphate (BCP) Nanofibers for Bone Tissue Engineering Using Gamma-Irradiation. Polym. Korea 2015, 39, 418-425.
-

- 12. Lu, M. Preparation of Poly(acrylic acid)-Boron Nitride Composite as a Highly Efficient Adsorbent for Adsorptive Removal of Heavy Metal Ions. ChemistrySelect 2021, 28, 3841-3847
-

- 13. Nose, K.; Oba, H.; Yoshida, T. Electric Conductivity of Boron Nitride Thin Films Enhanced by in situ Doping of Zinc. Appl. Phys. Lett. 2006, 89, 112124.
-

- 14. Sharker, S. M. Hexagonal Boron Nitrides (White Graphene): A Promising Method for Cancer Drug Delivery. Int. J. Nanomedicine 2019, 14, 9983-9993.
-

- 15. Lahiri, D.; Singh, V.; Keshri, A. K.; Seal, S.; Agarwal, A. Apatite Formability of Boron Nitride Nanotubes. Nanotechnology 2011, 22, 205601
-

- 16. Lee, M. S.; Lee, D. H.; Jeon, J.; Oh, S. H.; Yang, H. S. Topographically Defined, Biodegradable Nanopatterned Patches to Regulate Cell Fate and Acceleration of Bone Regeneration. ACS Appl. Mater. Interfaces 2018, 10, 38780-38790.
-

- 17. Park, J.; Jeon, J.; Kim, B.; Lee, M. S.; Park, S.; Lim, J.; Yi, J.; Lee, H.; Yang, H. S.; Lee, J. Y. Electrically Conductive Hydrogel Nerve Guidance Conduits for Peripheral Nerve Regeneration. Adv. Funct. Mater. 2020, 30, 2003759.
-

- 18. Ramkumar, M. C.; Cools, P.; Arunkumar, A.; Geyter, N. D,; Morent, R.; Kumar, V.; Udaykumar, S.; Gopinath, P.; Jaganathan, S. K.; Pandiyaraj, K. N. Polymer Coatings for Biocompatibility and Reduced Nonspecific Adsorption. In Functionalised Cardiovascular Stents; Wall, J. G.; Podbielska H.; Wawrzyńska, M.; Elsevier Ltd.: Amsterdam, 2018; pp. 155-198.
-

- 19. Xue, S.; Wu, Y.; Guo, M.; Liu, D.; Zhang, T.; Lei, W. Fabrication of Poly(acrylic acid)/Boron Nitride Composite Hydrogels with Excellent Mechanical Properties and Rapid Self-Healing Through Hierarchically physical Interactions. Nanoscale Res. Lett. 2018, 13, 393.
-

- 20. Shuai, C.; Han, Z.; Feng, P.; Gao, C.; Xiao, T.; Peng, S. Akermanite Scaffolds Reinforced with Boron Nitride Nanosheets in Bone Tissue Engineering. J Mater Sci Mater Med. 2015, 26, 188.
-

- 21. Belaid, H.; Nagarajan, S.; Barou, C.; Huon, V.; Bares, J.; Balme, S.; Miele, P.; Cornu, D.; Cavaillès, V.; Teyssier, C.; Bechelany, M. Boron Nitride Based Nanobiocomposites: Design by 3D Printing for Bone Tissue Engineering. ACS Appl. Bio. Mater. 2020, 3, 1865-1874.
-

- 22. Li, X.; Wang, X.; Jiang, X.; Yamaguchi, M.; Ito, A.; Bando, Y.; Golberg, D. Boron Nitride Nanotube-enhanced Osteogenic Differentiation of Mesenchymal Stem Cells. J. Biomed. Mater. Res. B: Appl. Biomater. 2016, 104, 323-329.
-

- 23. Lee, M. S.; La, W. G.; Park, E.; Yang, H. S. Synergetic Effect of 3,4-dihydroxy-l-phenylalanine-modified Poly(lactic-co-glycolic acid) Nanopatterned Patch with Fibroblast Growth Factor-2 for Skin Sound Regeneration. J. Biomed. Mater. Res. B: Appl. Biomater. 2017, 105, 594-604.
-

- 24. Jothi Praksh, C. G.; Prasanth, R. Approaches to Design a Surface with Tunable Wettability: a Review on Surface Properties. J. Mater. Sci. 2021, 56, 108-135.
-

- 25. Wagemann, E.; Wang, Y.; Das, S.; Mitra, S. K. Wettability of Nanostructured Hexagonal Boron Nitride Surfaces: Molecular Dynamics Insights on the Effect of Wetting Anisotropy. Phys. Chem. Chem. Phys. 2020, 28, 2488-2497.
-

- 26. Park, S.; Lee, M. S.; Jeon, J.; Lim, J.; Jo, C. H.; Bhang, S. H.; Yang, H. S. Micro-groove Patterned PCL Patches Witht DOPA for rat Achilles Tendon Regeneration. J. Ind. Eng. Chem. 2022, 105, 352-364.
-

- 27. Li, C.; Hsu, Y. T.; Hu, W. W. The Regulation of Osteogenesis Using Electroactive Polypyrrole Films. Polymers (Basel). 2016, 13, 258.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2024; 48(1): 86-92
Published online Jan 25, 2024
- 10.7317/pk.2024.48.1.86
- Received on Oct 6, 2023
- Revised on Dec 7, 2023
- Accepted on Dec 13, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Hee Seok Yang
-
*Department of Nanobiomedical Science, Dankook University, Cheonan 31116, Korea
**Bio-Medical Engineering Research Center, Dankook University, Cheonan 31116, Korea - E-mail: hsyang@dankook.ac.kr
- ORCID:
0000-0003-1500-9676









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.