- Formulation Design of pH Adjusted Rebamipide Solid Dispersions for Improved Solubility
Byungkwan Moon*,#, Youngjun Son**,#, Seung Jae Kim**, Sunjae Park**, Won Kyung Kim**, Jeong Eun Song**, and Gilson Khang*, **, ***,†

*Department of PolymerNano Science & Technology, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea
**Department of Bionanotechnology and Bio-Convergence Engineering, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea
***Polymer Materials Fusion Research Center, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea- 용해도 개선을 위한 pH가 조절된 레바미피드 고체분산체의 제형 설계
문병관*,# · 손영준**,# · 김승재** · 박선재** · 김원경** · 송정은** · 강길선*, **, ***,†

*전북대학교 고분자나노공학과, **전북대학교 바이오나노융합공학과, ***전북대학교 고분자융합소재연구소
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Rebamipide is a drug mainly used for gastric protection. However, due to low solubility and bioavailability, it is classified as Biopharmaceutical Classification System IV. In this study, to improve the solubility and bioavailability of rebamipide, a solid dispersion was prepared by encapsulating the drug in HPMC, a hydrophilic polymer, using a spray drying method. In addition, the pH-dependent solubility of rebamipide was improved by adjusting the pH of the solid dispersion and adding various surfactants. Chemical changes in the drug were confirmed through Fourier transform infrared spectroscopy, morphological changes were confirmed through scanning electron microscopy and crystallinity and saturation of the drug were confirmed through differential scanning calorimetry and X-ray diffractometer. Lastly, the release behavior of the drug was confirmed through solubility evaluation of the solid dispersion and dissolution test of the formulation, confirming the possibility of developing a formulation with improved solubility.
레바미피드는 위장 보호 작용을 촉진하여 위궤양을 완화하는데 주로 사용되는 약물이다. 하지만 낮은 용해도 및 생체 이용률로 인해 생물약제학적 분류체계 IV로 분류된다. 본 연구에서는 레바미피드의 용해도 및 생체 이용율을 개선하기 위해서 분무건조법을 이용하여 약물을 친수성 고분자인 하이드록시프로필 메틸셀룰로오스(hydroxypropyl methylcellulose, HPMC)에 포접시켜 고체 분산체를 제조하였다. 또한, pH의존적인 레바미피드의 용해도를 개선하기 위해 고체 분산액의 pH를 조절하고 다양한 계면활성제를 첨가하였다. 제조된 약물의 화학적 구조 변화는 퓨리에변환 적외선 분광법을 통해 확인하였고, 주사전자현미경을 통해 상전환에 의한 형태학적 변화를 확인하고 시차 주사 열량법, X-선 회절 분석을 통해 약물의 결정성 및 포접여부를 확인하였다. 최종적으로 고체분산체의 가용화도 평가와 제형의 용출시험을 통해 약물의 방출 거동을 확인하여 용해도가 개선된 제형의 개발 가능성을 확인하였다.
We prepared solid dispersion (SD) from various polymer combinations for solubilization of rebamipide (RBM). SD is known as a representative solubilization strategy to improve the solubility of poorly soluble drugs. It can be seen that the prepared SD exhibits improved in vitro release behavior compared to the control drug.
Keywords: rebamipide, solid dispersion, solubilization, pH adjuster, surfactant.
본 연구는 산업통상자원부의 재원으로 산업기술평가관리원(KEIT) 연구비 지원을 받아 수행된 바이오산업핵심기술개발사업(20014222)이다.
저자(들)는 이해상충이 없음을 선언합니다.
위 궤양은 위점막의 손상으로 인해 흔하게 발생하는 질환으로 위장관 출혈 및 협착과 천공 등의 합병증을 유발할 수 있으며, 재발 가능성이 높은 만성 질환이다.1 위궤양 치료에는 양성자 펌프 억제제(proton pump inhibitors, PPI), 히스타민 2 수용체 길항제(histamine 2 receptor antagonists, H2RA) 및 레바미피드가 사용되고 있다.1,2 PPI와 H2RA의 경우 위산을 억제하여 지속적인 병변 악화를 예방하는 점막 장벽의 회복을 유도하는 약물이다. 그러나, 이들은 인체 내 감염원에 대한 방어작용을 하는 위산을 감소시킴으로써 감염에 대한 위험성이 증가할 수 있는 문제점이 발생할 수 있다.3-5 이와 달리 레바미피드(rebamipide, RBM)는 위산분비에 관여하지 않고 위 점막 자체의 보호활성을 촉진하여 위 점막 재생을 유도하는 작용기전을 가지는 약물이다.6 레바미피드는 위 점막 프로스타글란딘(prostaglandin)의 생성을 촉진하여 염증성 사이토카인이 억제되어 항염증 효과를 유발하고 위 점막의 점액 분비를 증가시켜 위점막의 보호를 강화한다.7-9 이렇듯 다른 약물과 비교하여 부작용이 적기 때문에 위궤양 등의 위장질환 치료제로 채택되어 사용되고 있다.
하지만, 레바미피드는 낮은 용해도 및 투과성으로 인해 생물약제학적 분류체계(biopharmaceutics classification system, BCS) IV 등급으로 분류되는 약물이다.10,11 이러한 난용성 약물의 경우 가용화를 통해 용해도를 향상시켜 생체 이용률을 개선시킬 필요성이 있다.
난용성 약물의 가용화를 위한 다양한 가용화 방법 중에 대표적으로 분무건조법을 이용하여 친수성 고분자에 포접된 고체분산체의 제작은 난용성 약물의 용해도를 향상하기 위한 효과적인 방법으로 알려져 있다.12 분무건조법은 약물과 친수성 고분자를 공용매에 혼합하여 고온의 열풍으로 분산시킴으로써 고분자 매트릭스로 사이로 약물이 포접 된다. 이를 통해 결정형의 약물은 무정형의 형태로 전환되어 격자 에너지 장벽 감소, 습윤성 및 분산성 향상 및 입자 크기가 감소에 따른 표면적 증가를 통해 효과적으로 용해도 개선할 수 있다.13-17 또한, 고체 분산체 제형은 공용매의 pH 미세환경을 조정함으로써 pH 의존적 용해도를 가지는 레바미피드와 같은 난용성 약물의 용해도를 향상시키거나, 쉽게 이온화 시킴으로써 약물의 재결정화 감소 및 약물의 확산성을 증가시킬 수 있다.10,14,18 이외에도 계면활성제를 첨가하여 약물의 물리적 혼화성을 증가시키고, 침전을 방지함으로써 약물을 친수성 고분자 매트릭스내에 효과적으로 분산시켜 약물의 용해도를 개선할 수 있다.12,19,20
본 연구에서는 분무건조법을 이용하여 친수성 고분자 하이드록시프로필 메틸셀룰로오스(hydroxypropyl methylcellulose, HPMC)에 레바미피드를 포접시켜, 고체분산체를 제조하였다. 또한, pH 조절에 의한 용해도 변화를 확인하기 위해 공용매에 수산화나트륨을 사용하여 염기성 환경을 조성하였고 다양한 계면활성제 라우릴 황산 나트륨(sodium lauryl sulfate, SLS), Span 80, Kolliphor EL 및 Kolliphor P 407을 첨가하여 레바미피드의 용해도 개선효과를 확인하였다. 제조된 고체분산체는 고성능 액체 크로마토그래피(high performance liquid chromatography, HPLC)를 사용하여 가용화도 및 용출 거동을 평가하였으며, 용출시험은 미국 약전(United States Pharmacopeia, USP) 용출 시험법 II(dissolution apparatus II) 패들법으로 진행하여 시판제에 비해 향상된 용해도를 얻을 수 있는지를 확인하고자 하였다.
시약 및 재료. 본 연구에 사용된 레바미피드는 INIST ST (한국), 친수성 고분자인 hydroxypropyl methylcellulose는 Colorcon(미국), pH 조절제인 수산화 나트륨(sodium hydroxide)은 Showa(일본), 계면활성제인 Kolliphor P 407와 Kolliphor EL는 BASF(독일), sodium lauryl sulfate는 Duksan(한국), Span 80은 Showa(일본)에서 각각 구입하여 사용하였으며 실험에 사용된 모든 용매 및 시약은 HPLC 등급을 사용하였다.
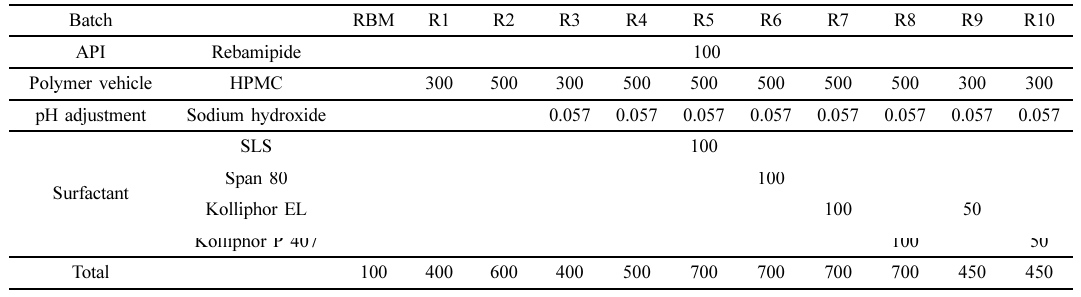
고체분산체 제조. Table 1의 조성에 따라 원료의약품인 레바미피드에 수용성 고분자 HPMC를 상이한 함량으로 첨가하여 분무건조법을 통해 고체분산체를 제조하였다. 공용매의 pH에 따른 레바미피드의 용해도 개선도를 확인하기 위해 수산화 나트륨을 통해 pH를 9로 조정하였고 추가적인 용해도 개선을 위해 계면활성제(Kolliphor P 407, Kolliphor EL, SLS, Span 80)를 균일하게 첨가하였다. 모든 고체 분산체는 증류수:에탄올 = 1:1 비율의 공용매에 충분히 용해시킨 후 분무건조기(spray dryer SD-1000, Eyela, 일본)를 사용하여 90 ℃의 일정한 온도에서 2.5 mL/min의 유량으로 분무하여 제조되었으며 사용 전까지 데시케이터에 보관하였다.
고체분산체의 구조학적 분석. 약물과 고분자가 포함된 고체분산체들의 분자구조를 분석하기 위해 퓨리에 변환 적외선 분광기(Fourier transform infrared spectroscopy, FTIR, Perkin Elmer, Waltham, Massachusetts, 미국)을 사용하였다. 측정방식은 ATR법을 사용하여 측정 범위 4000-400 cm−1에서 분석하였다.
고체분산체의 형태학적 분석. 약물과 고분자가 포함된 고체분산체의 형태학적 특성은 주사전자현미경(scanning electron microscope, SEM, S-3000N, Hitachi Co., Tokyo, 일본)을 통해 관찰하였다. 관찰을 위해 시료를 탄소 테이프에 고정하고 팔라듐-백금코팅기(SC7640, Quorumech, 영국)를 통해 아르곤 가스 하에서 180초간 코팅 후 20 kV의 전압 조건에서 관찰하였다.
고체분산체의 열역학적 및 결정학적 분석. 레바미피드의 결정성과 고체분산체의 상전환을 확인하기 위해 시차 주사 열량계(differential scanning calorimetry, DSC, Perkin Elmer, 미국)와 X선 회절 분석기(X-ray diffractometer, XRD, MAX 2500, Rigaku, 일본)를 이용하여 분석하였다. DSC는 standard alum pan(Perkinelmer, 미국)에 시료 5 mg을 넣고 커버를 덮어 압축하여 준비하였다. 모든 측정은 건조 질소 가스 하에서 25-350 ℃의 온도범위에서 10 ℃/min의 가열 속도로 수행하였다. XRD는 전원 전류 30 mA, 전압 40 kV의 조건에서 모든 시료는 1°/min의 속도로 측정범위 3-50°에서 분석하였다.
HPLC 분석. 시료를 분석하기 위해 HPLC 분석기(NS-4000 HPLC System, Futec, 한국), 오토샘플러(NS-6000 Autosampler, Futec, 한국), 컬럼 오븐(AT-4000, Futec, 한국)을 사용하였고 분석 컬럼은 ProntoSIL C18 SH 컬럼(250 × 4.6 mm, 5 mm, Bischoff Chromatography, 독일)으로 분석하였다. HPLC 조건은 유속 1.2 mL/min, 시료 주입량 20 mL, 컬럼 온도 35 ℃에서 측정하였고, UV 검출 파장은 327 nm, 시료 측정 시간은 10분으로 설정하였다. 이동상은 증류수와 메탄올을 3:7 비율로 혼합한 용액으로 구성되었으며, 아세트산을 사용하여 pH를 2.6으로 조정하고 초음파 처리를 통해 잔여 가스를 제거한 후 사용하였다.
고체분산체의 가용화도 평가. 레바미피드 100 mg과 동량의 약물을 함유하는 고체분산체를 400 mL 증류수에 용해시킨 후 0.45 mm PTFE 필터를 사용하여 여과하였다. 여과액은 이동상에 희석하여 HPLC 분석을 통해 가용화도를 확인하였다. 모든 샘플은 각각 6회씩 측정하여 평균값과 표준편차를 계산하였다.
캡슐제의 생체 외 방출거동. 제조된 고체 분산체와 시판제인 무코스타 정(한국오츠카제약, 한국)을 분쇄하여 분말을 젤라틴 캡슐에 충진하여 정제를 준비하였다. 용출시험은 미국 약전 용출 시험법 II(패들법)에 따라 진행하였고, 용출액은 증류수와 미국약전(USP Method A Acid stage, Buffer stage)에 따라 인공위액(pH 1.2)을 제조하여 캡슐제의 방출거동을 확인하였다. 용출기는 DST-610(Labfine Sci. Instr., 한국)을 사용하여 회전 속도 50 rpm, 용출액의 온도 37 ± 2 ℃, 용출액 900 mL의 조건에서 5, 10, 15, 30, 45 그리고 60분에 1 mL 각 시료를 채취하고, 동량의 완충액을 첨가하였다. 시료는 0.45 μm PTFE 필터를 사용하여 여과한 후 HPLC 분석을 진행하였다.
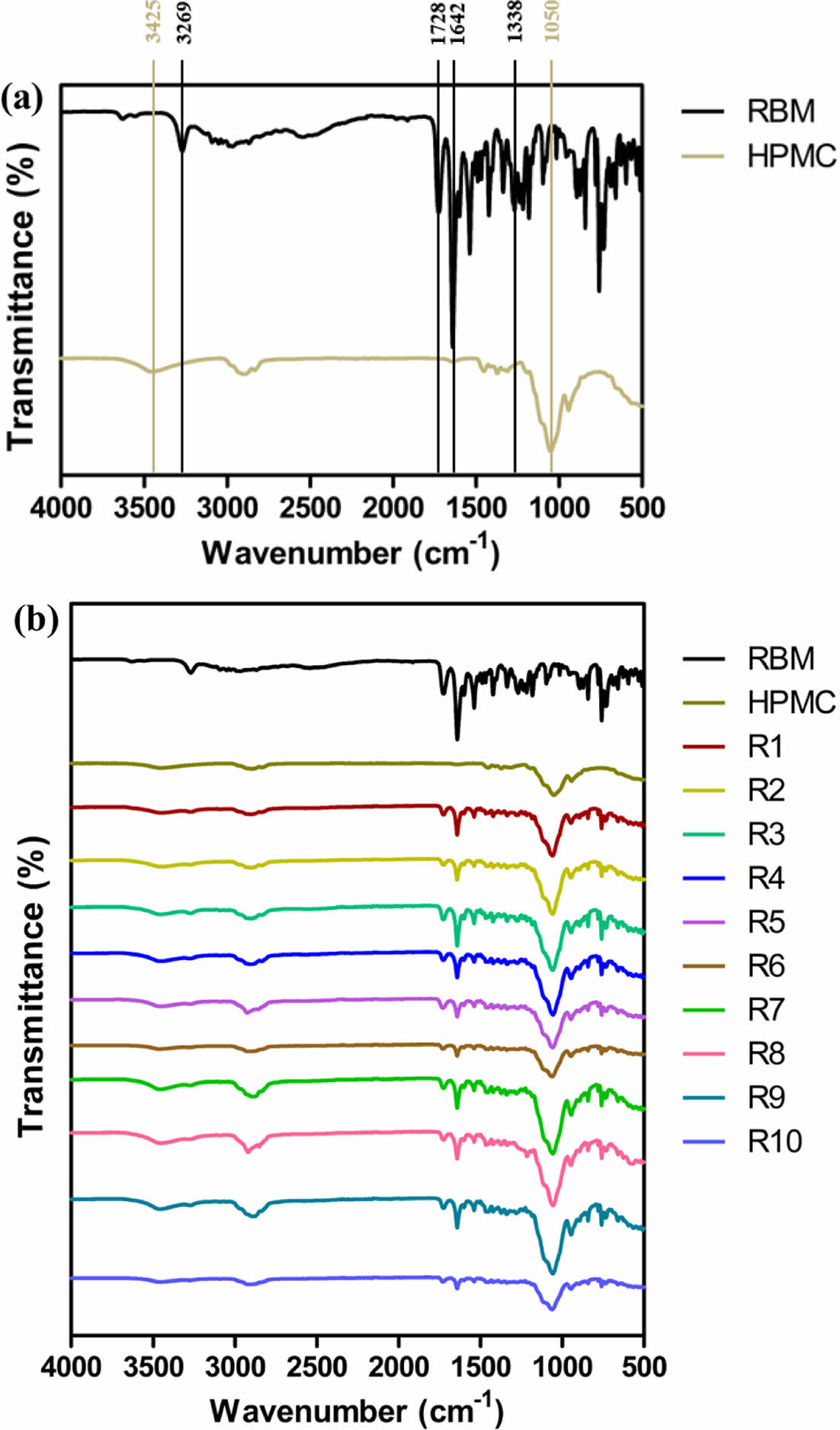
고체분산체의 구조학적 분석. Figure 1은 레바미피드, HPMC 및 고체 분산체(R1-10)의 물리화학적 상호작용 및 변화를 확인하기 위한 FTIR 스펙트럼을 나타내었다. Figure 1(a)에서 레바미피드는 3267 cm-1(N-H stretching), 1642 cm-1 (C=O band), 1728 cm-1(carboxyl and amide groups) 및 1388 cm-1 (C-H stretching)에서 특징적인 피크를 나타내었다. HPMC는 1050 cm-1(C-O-C stretching) 및 3425 cm-1(-OH stretching)에서 특징적인 피크가 관찰되었다. 이 특징적인 피크들은 Figure 1(b)의 고체분산체(R1-10)에서도 관찰됨에 따라, 고체분산체 제조과정 중 약물의 변성이 일어나지 않았다고 판단하였다. 또한, HPMC의 C-O-C stretching이 증가하여 HPMC와 유사한 구조적 특성을 가져 기존 약물의 결정형보다 무정형에 가깝게 제조된 것으로 사료된다.
고체분산체의 형태학적 분석. 레바미피드와 고체분산체(R1-10)의 SEM 이미지는 Figure 2에 나타내었다. 레바미피드는 결정형의 입자형태를 나타내고 있고, 고체분산체의 경우 무정형의 HPMC에 분산되어 약간 고르지 못한 구형의 입자형태로 상전환이 이루어졌다. 또한, R1과 R2에 비해 R3-10의 고체분산체들은 수산화 나트륨 및 계면활성제의 첨가되어 결정형의 입자가 감소함을 확인할 수 있다.
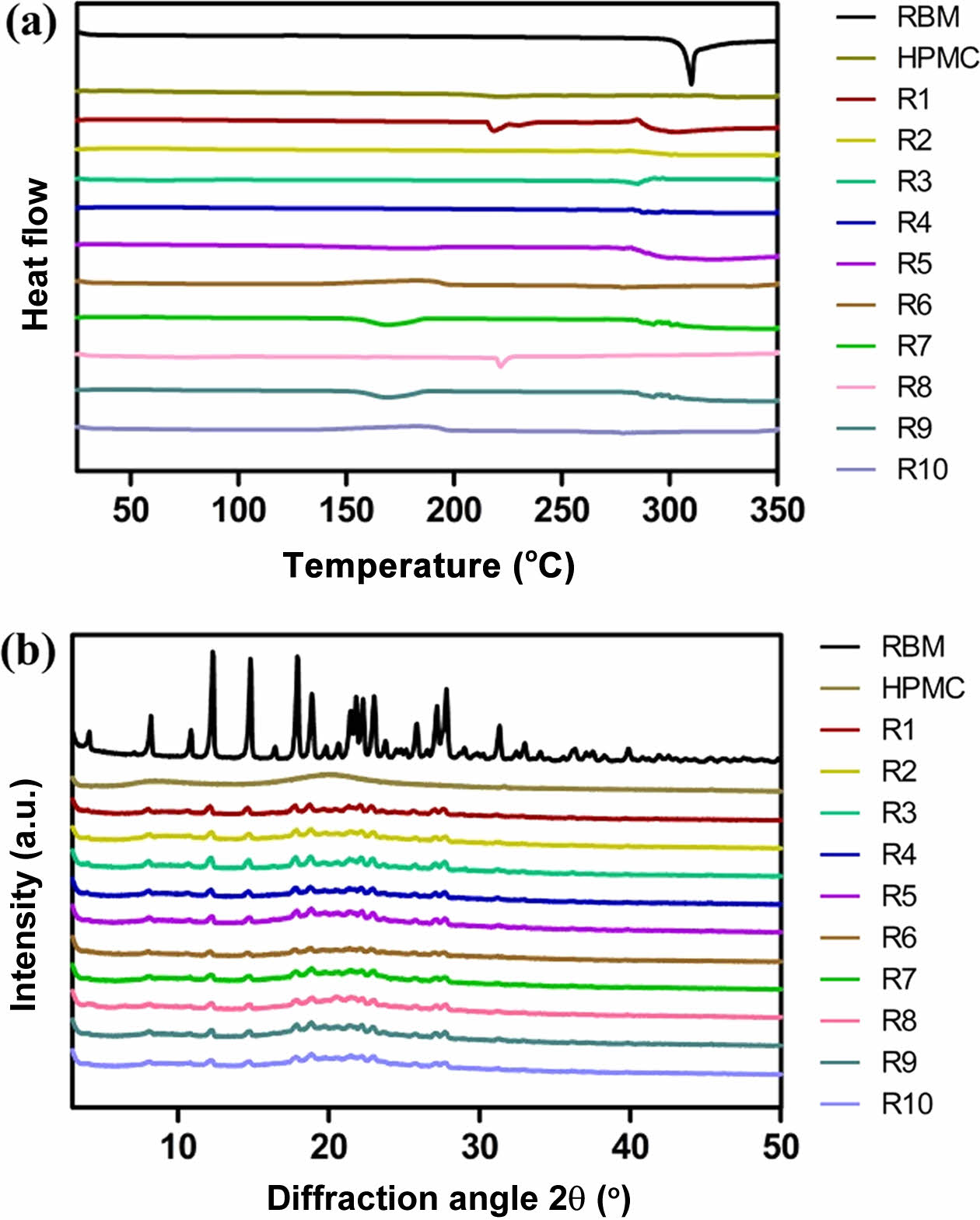
고체분산체의 열역학적 및 결정학적 분석. 레바미피드, HPMC, 각 고체분산체(R1-10)의 DSC와 XRD로 분석한 결과는 Figure 3에 나타내었다. Figure 3(a)는 DSC 분석 결과로 레바미피드는 310 ℃에서 특징적인 흡열 피크를 보였으며 이는 레바미피드가 특유의 결정 형태를 가지고 있음을 확인하였다. 반면, 고체분산체(R1-10)에서는 결정성을 나타내는 특징적인 흡열 피크가 나타나지 않았으며 이는 약물의 결정형이 무정형으로 상전환되었음을 나타낸다. 또한 Figure 3(b)에 나타낸 XRD 분석 결과로부터 레바미피드는 40° 이하의 다양한 각도에서 많은 특징적인 피크가 나타나 결정성이 높다는 것을 확인하였고, 고체분산체의 경우 레바미피드의 특징적인 피크들이 사라졌음을 확인할 수 있다. 이러한 차이는 분무건조를 통해 약물이 무정형의 고분자 매트릭스에 효과적으로 분산되어 결정형에서 무정형으로 전환된 것으로 사료된다.
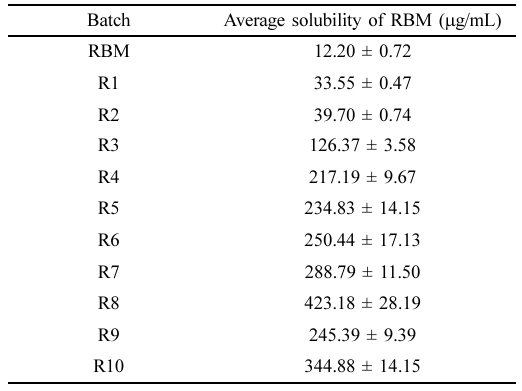
고체분산체의 가용화도 평가. 레바미피드와 고체분산체(R1-10)의 가용화도는 HPLC를 통해 포화 용해도를 분석하였으며 분석 결과는 Table 2에 나타내었다. 레바미피드의 포화 용해도는 12.20 mg/mL인 것으로 나타났으며, 친수성 고분자 매트릭스에 분산된 R1과 R2는 각각 33.55 ± 0.47 μg/mL, 39.70 ± 0.74 μg/mL로 순수약물 대비 약 2배 증가한 수치를 보였으며, 이는 결정형의 약물이 친수성 고분자 매트릭스에 분산되어 무정형으로의 상전환을 통한 용해도 향상을 의미한다. 염기성 조건에서 제조된 R3과 R4의 경우, 각각 126.37 ± 3.58 μg/mL 및 217.19 ± 9.67 μg/mL로 약 10배, 20배 증가한 수치를 나타냈으며, 약산성을 띄는 레바미피드가 염기성 조건에서 이온화되어 약물의 용해도가 증가함을 확인하였다.21 이 중 포화 용해도가 가장 높은 R4를 기준으로 다양한 계면활성제를 첨가하여 R5-8을 제조하였다. 이들의 용해도는 각각 250.44 ± 17.13 μg/mL, 234.83 ± 14.15 μg/mL, 288.79 ± 11.50 μg/mL 및 423.18 ± 28.19 μg/mL를 나타냈으며 계면활성제의 첨가는 약물의 침전을 방지하여 약물의 혼화성을 증가시켜 용해도가 상승하였다.19,22 특히 비이온성 계면활성제인 Kolliphor EL과 Kolliphor P 407를 첨가한 R7, R8은 순수 약물 대비 약 20배, 30배의 가장 높은 용해도 증가를 확인하였다. 하지만 부피 밀도가 낮아 캡슐제의 제조가 어렵다는 문제점이 존재하여 가장 높은 용해도를 나타내는 R7, R8의 전체 질량을 줄이면서 기존의 용해도를 유지하기 위해 HPMC와 계면활성제의 조성을 조절하여 R9-10 제조하였다. 이들은 용해도는 각각 245.39 ± 9.39 μg/mL 및 344.88 ± 14.15 μg/mL로 순수 약물 대비 약 20배, 30배 증가한 수치를 나타냈다.
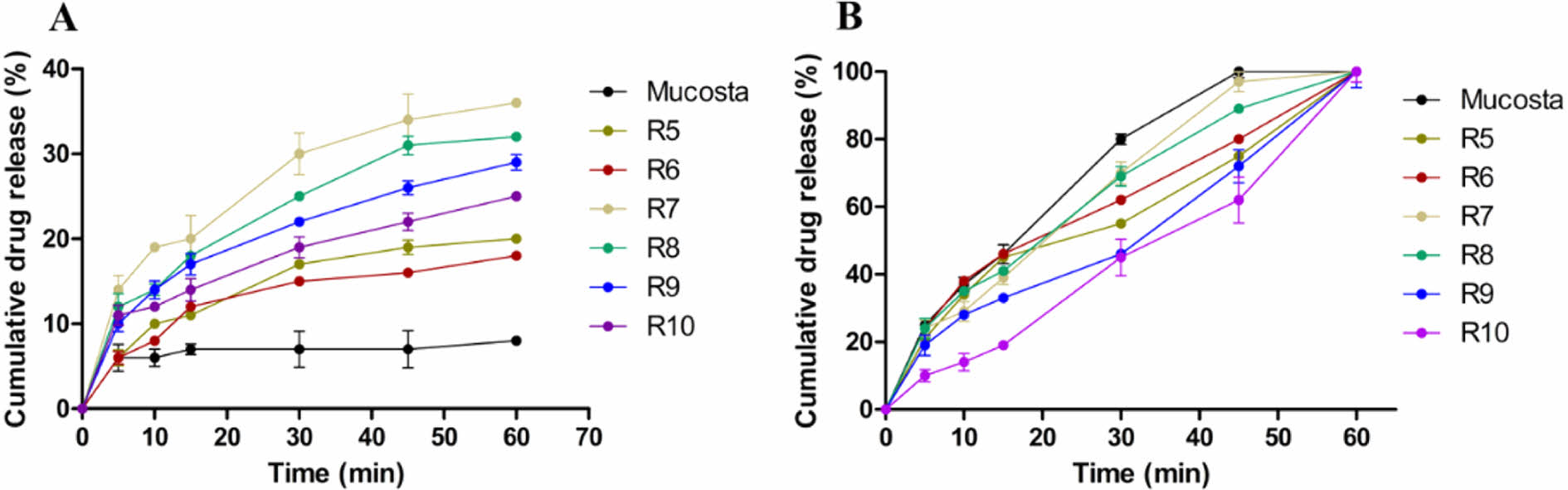
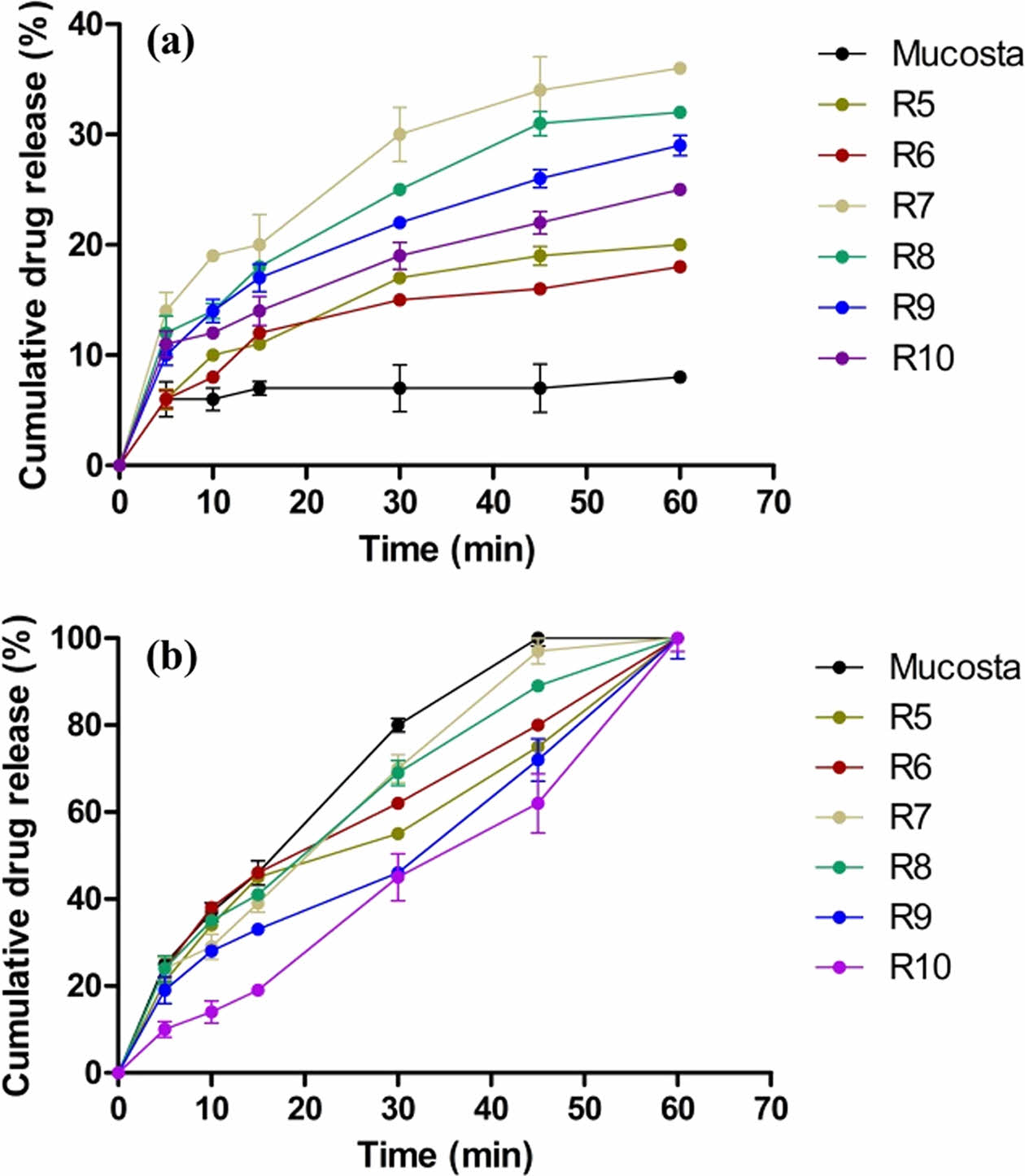
캡슐제의 생체 외 방출거동. 가용화도 평가 결과를 바탕으로 가용화도가 높은 R5-10을 선정하여 방출거동을 평가하였다. Figure 4는 인공위액(pH 1.2)과 증류수에서 각 캡슐제의 1시간동안의 용출 거동을 나타내었다. 인공위액에서는 무코스타의 경우 10% 미만으로 상대적으로 낮은 최종 용출률을 나타냈다. 반면 R5와 R6은 15% 이상의 최종 용출률을 나타내었고, 상대적으로 질량비가 낮은 R9, R10 경우에도 20% 이상의 최종 용출률을 나타냄으로 제조된 고체분산체가 무코스타에 비해 향상된 용출률을 나타냄을 확인하였다. 이는 약물이 친수성 고분자 매트릭스에 분산되어 수분 투과성이 증가하고 무정형으로의 상전환을 통해 용해도가 개선됨을 확인하였다. 또한, 극성 카복실기를 가지는 RBM은 공용매의 pH미세환경을 조정함으로써 염 형성이 발생하여 약물의 용해도 및 분산성을 향상되었고 용출률이 개선되었음을 확인하였다. 계면활성제가 첨가된 R5, R6, R7 및 R8의 경우 각각 20, 18, 36, 32%의 최종 용출률을 나타냈으며, 이 중 비이온성 계면활성제인 Kolliphor P407 및 Kolliphor EL이 첨가된 R7과 R8이 무코스타에 비해 3배 이상 증가된 가장 높은 용출률을 확인하였다. 이는 비이온성 계면활성제의 경우 다른 이온성 계면활성제에 비해 낮은 임계 미셀농도를 가지고 있어 약물의 용해능이 증가하여 가장 높은 융출률이 나타난 것으로 사료됩니다. 증류수의 경우 모든 군에서 60분 이내에 완전히 용해되어 무코스타와 유사한 용출 거동을 확인하였다.
|
Figure 1 The FTIR spectra of (a) rebamipide, hydroxypropyl methylcellulose; (b) solide dispersions. |

|
Figure 2 SEM micrographs of Rebamipide, Hydroxypropyl methylcellulose and solid dispersions. |
|
Figure 3 (a) DSC thermogram; (b) XRD patterns of raw materials and solid dispersions. |
|
Figure 4 Dissolution profiles of R5-10 capsule, and MucostaTM capsule in (a) artificial gastric juice (pH 1.2); (b) purified water. |
|
Table 2 Solubility Results of RBM and Solid Dispersions in Water at Room Temperature (n = 6, mean ± SD) |
본 연구에서는 난용성 약물인 레바미피드의 용해도를 향상시켜 생체 이용률을 개선시키기 위해 분무건조법을 이용하여 친수성 고분자인 HPMC에 포접시켜 고체분산체를 제조하였다. 제조된 고체분산체는 FTIR 분석을 통해 화학적 구조 변형이 일어나지 않았음을 확인하였고, DSC, XRD 분석 및 SEM을 통해 레바미피드가 고분자 매트릭스에 분산되어 결정 형태에서 무정형으로 상전환되었음을 확인하였다. 또한, 가용화도를 평가하여 pH조절제 존재 하에 비이온성 계면활성제가 추가된 고체분산체 R8이 가장 높은 용해도를 나타냄을 확인하였다. 최종적으로 생체 외 방출거동 평가를 통해 인공 위액에서의 최종 용출률은 고체분산체 모두 무코스타에 비해 높았으며, R8의 경우 3배 이상 증가한 최종 용출률을 확인하였고 캡슐제의 제조를 위해 질량비를 낮춘 R9, R10에서도 2배 이상 증가한 최종 용출률을 확인하였다. 따라서 난용성 약물인 레바미피드의 용해도를 향상시켜 기존 제제에 비해 약물의 생체 이용률이 향상된 치료제로 개발할 수 있음을 확인하였다.
- 1. Kobayashi, M.; Takeuchi, M.; Hashimoto, S.; Mizuno, K. I.; Sato, Y.; Narisawa, R.; Aoyagi, Y. Contributing Factors to Gastric Ulcer Healing after Endoscopic Submucosal Dissection Including the Promoting Effect of Rebamipide. Dig. Dis. Sci. 2012, 57, 119-126.
-

- 2. Jeon, J.; Kim, J. Risk of Post-Myocardial Infarction Pneumonia with Proton Pump Inhibitors, H2 Receptor Antagonists and Mucoprotective Agents: A Retrospective Nationwide Cohort Study. J. Pers. Med. 2022, 12, 78.
-

- 3. Deshpande, A.; Pasupuleti, V.; Thota, P.; Pant, C.; Mapara, S.; Hassan, S.; Rolston, D. D. K.; Sferra, T. J.; Hernandez, A. V. Acid-suppressive Therapy is Associated with Spontaneous Bacterial Peritonitis in Cirrhotic Patients: A Meta-analysis. J. Gastroenterol. Hepatol. 2013, 28, 235-242.
-

- 4. Rosenberg, K. Acid Suppressants Increase Risk of Colonization with Multidrug-Resistant Microorganisms. AJN Am. J. Nurs. 2020, 120, 57.
-

- 5. Naito, Y.; Yoshikawa, T. Rebamipide : A Gastrointestinal Protective Drug with Pleiotropic Activities. Expert Rev. Gastroenterol. Hepatol. 2010, 4, 261-270.
-

- 6. Arakawa, T.; Kobayashi, K.; Yoshikawa, T.; Tarnawski, A. Rebamipide : Overview of Its Mechanisms of Action and Efficacy in Mucosal Protection and Ulcer Healing. Dig. Dis. Sci. 1998, 43, 5-13.
- 7. Zhang, S.; Qing, Q.; Bai, Y.; Mao, H.; Zhu, W.; Chen, Q.; Zhang, Y.; Chen, Y. Rebamipide Helps Defend Against Nonsteroidal Anti-inflammatory Drugs Induced Gastroenteropathy : A Systematic Review and Meta-analysis. Dig. Dis. Sci. 2013, 58, 1991-2000.
-

- 8. Jaafar, M. H.; Safi, S. Z.; Tan, M. P.; Rampal, S.; Mahadeva, S. Efficacy of Rebamipide in Organic and Functional Dyspepsia : a Systematic Review and Metaanalysis. Dig. Dis. Sci. 2018, 63, 1250-1260.
-

- 9. Markovic, M.; Zur, M.; Dahan, A.; Cvijić, S. Biopharmaceutical Characterization of Rebamipide : The Role of Mucus Binding in Regional-dependent Intestinal Permeability. Eur. J. Pharm. Sci. 2020, 152, 105440.
-

- 10. Okawa, S.; Sumimoto, Y.; Masuda, K.; Ogawara, K. I.; Maruyama, M.; Higaki, K. Improvement of Lipid Solubility and Oral Bioavailability of a Poorly Water-and Poorly Lipid -soluble Drug, Rebamipide, by utilizing Its Counter Ion and SNEDDS Preparation. Eur. J. Pharm. Sci. 2021, 159, 105721.
-

- 11. Kalepu, S.; Nekkanti, V. Insoluble Drug Delivery Strategies : Review of Recent Advances and Business Prospects. Acta Pharm. Sin. B. 2015, 5, 442-453.
-

- 12. Zuccari, G.; Russo, E.; Villa, C.; Zorzoli, A.; Marimpietri, D.; Marchitto, L.; Alfei, S. Preparation and Characterization of Amorphous Solid Dispersions for the Solubilization of Fenretinide. Pharmaceuticals. 2023, 16, 388.
-

- 13. Vo, C. L. N.; Park, C.; Lee, B. J. Current Trends and Future Perspectives of Solid Dispersions Containing Poorly Watersoluble Drugs. Eur. J. Pharm. Biopharm. 2013, 85, 799-813.
-

- 14. Frizon, F.; de Oliveira Eloy, J.; Donaduzzi, C. M.; Mitsui, M. L.; Marchetti, J. M. Dissolution Rate Enhancement of Loratadine in Polyvinylpyrrolidone K-30 Solid Dispersions by Solvent Methods. Powder Technol. 2013, 235, 532-539.
-

- 15. Tekade, A. R.; Yadav, J. N. Yadav. A Review on Solid Dispersion and Carriers Used Therein for Solubility Enhancement of Poorly Water Soluble Drugs. Adv. Pharm. Bull. 2020, 10, 359-369.
-

- 16. Adibkia, K.; Barzegar-Jalali, M.; Maheri-Esfanjani, H.; Ghanbarzadeh, S.; Shokri, J.; Sabzevari, A.; Javadzadeh, Y. Physicochemical Characterization of Naproxen Solid Dispersions Prepared Via Spray Drying Technology. Powder Technol. 2013, 246, 448-455.
-

- 17. Pradhan, R.; Tran, T. H.; Choi, J. Y.; Choi, I. S.; Choi, H. G.; Yong, C. S.; Kim, J. O. Development of A Rebamipide Solid Dispersion System with Improved Dissolution and Oral Bioavailability. Arch. Pharm. Res. 2015, 38, 522-533.
-

- 18. Ha, E. S.; Lee, S. K.; Jeong, J. S.; Sim, W. Y.; Yang, J. I.; Kim, J. S.; Kim, M. S. Solvent Effect and Solubility Modeling of Rebamipide in Twelve Solvents at Different Temperatures. J. Mol. Liq. 2019, 288, 111041.
-

- 19. Chaudhari, S. P.; Dugar, R. P. Application of Surfactants in Solid Dispersion Technology for Improving Solubility of Poorly Water Soluble Drugs. J. Drug Deliv. Sci. Technol. 2017, 41, 68-77.
-

- 20. Tung, N. T.; Park, C. W.; Oh, T. O.; Kim, J. Y.; Ha, J. M.; Rhee, Y. S.; Park, E. S. Formulation of Solid Dispersion of Rebamipide Evaluated in a Rat Model for Improved Bioavailability and Efficacy. J. Pharm. Pharmacol. 2011, 63, 1539-1547.
-

- 21. Tran, P. H. L.; Tran, T. T. D.; Lee, K. H.; Kim, D. J.; Lee, B. J. Dissolution-modulating Mechanism of pH Modifiers in Solid Dispersion Containing Weakly Acidic or Basic Drugs with Poor Water Solubility. Expert Opin. Drug Deliv. 2010, 7, 647-661.
-

- 22. Qi, S.; Roser, S.; Edler, K. J.; Pigliacelli, C.; Rogerson, M.; Weuts, I.; Dycke, F. V.; Stokbroekx, S. Insights into the Role of Polymersurfactant Complexes in Drug Solubilisation / stabilisation During Drug Release from Solid Dispersions. Pharm. Res. 2013, 30, 290-302.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2024; 48(3): 299-304
Published online May 25, 2024
- 10.7317/pk.2024.48.3.299
- Received on Nov 30, 2023
- Revised on Feb 23, 2024
- Accepted on Mar 11, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Gilson Khang
-
*Department of PolymerNano Science & Technology, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea
**Department of Bionanotechnology and Bio-Convergence Engineering, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea
***Polymer Materials Fusion Research Center, Jeonbuk National University, 567 Baekje-daero, Deokjin-gu, Jeonju-si, Jeollabuk-do 54896, Korea - E-mail: gskhang@jbnu.ac.kr
- ORCID:
0000-0002-6452-5653









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.