- Effect of the Ratio of Oxidizing Agent to Monomer for Polyaniline Synthesis on the Activity of Catalyst for Oxygen Reduction Reaction in Anion Exchange Membrane Fuel Cells
School of Food Biotechnology and Chemical Engineering, Hankyong National University, 327 Jungang-ro, Anseong 17579, Korea
*Research Center of Chemical Technology, Hankyong National University, 327 Jungang-ro, Anseong 17579, Korea- Polyaniline 합성 시 단량체와 산화제 비율이 음이온 교환막 연료전지에 대한 산소 환원 촉매의 활성에 미치는 영향
한경국립대학교 식품생명화학공학부, *한경국립대학교 화학기술연구센터
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Anion exchange membrane fuel cells are attractive while proton exchange membrane fuel cells need costly precious metal for the catalysts and have durability issue. Anion exchange membrane fuel cells have low activation energy and use non-precious metals as catalysts for the oxygen reduction reaction, which can operate the system with low cost. In this study, we study the polyaniline-derived catalysts with different molar ratios of monomer to oxidizing agent for the activity toward the oxygen reduction reaction. As a function of molar ratio of monomer and oxidizing agent, the physical property and the catalytic activity are observed by various electrochemical characterizations and physico-chemical techniques. The research can help the commercialization of anion exchange membrane fuel cells since the conductive polymer is widely used for the synthesis of non-precious metal catalysts, provided the optimal condition for the polyaniline synthesis in the electrochemical application.
양이온 교환막 연료 전지는 값비싼 귀금속을 촉매로 사용하여 생산 비용이 높고 내구성의 문제로 인해 음이온 교환막 연료전지가 관심을 받고 있다. 음이온 교환막 연료 전지는 산소 환원 반응의 활성화 에너지가 낮고 산소 환원 촉매로 비백금 촉매의 사용이 가능하여 저렴한 비용으로 운전할 수 있다. 본 연구에서는 전도성 고분자인 폴리아닐린의 단량체와 산화제의 비율에 따라 합성된 촉매의 산소 환원 반응에 대한 활성 변화를 연구하였다. 이를 위해 단량체와 산화제의 몰비를 조절하여 촉매 활성 변화를 관찰하였으며, 다양한 물리화학적 분석법과 전기화학적 분석법을 통해 성능 평가 및 분석하였다. 본 연구 결과는 비귀금속 촉매를 합성할 때 주로 사용되는 전도성 고분자의 합성 시 최적의 조건을 제시하여 활성을 높여 음이온 교환막 연료전지의 상용화에 도움이 될 수 있다.
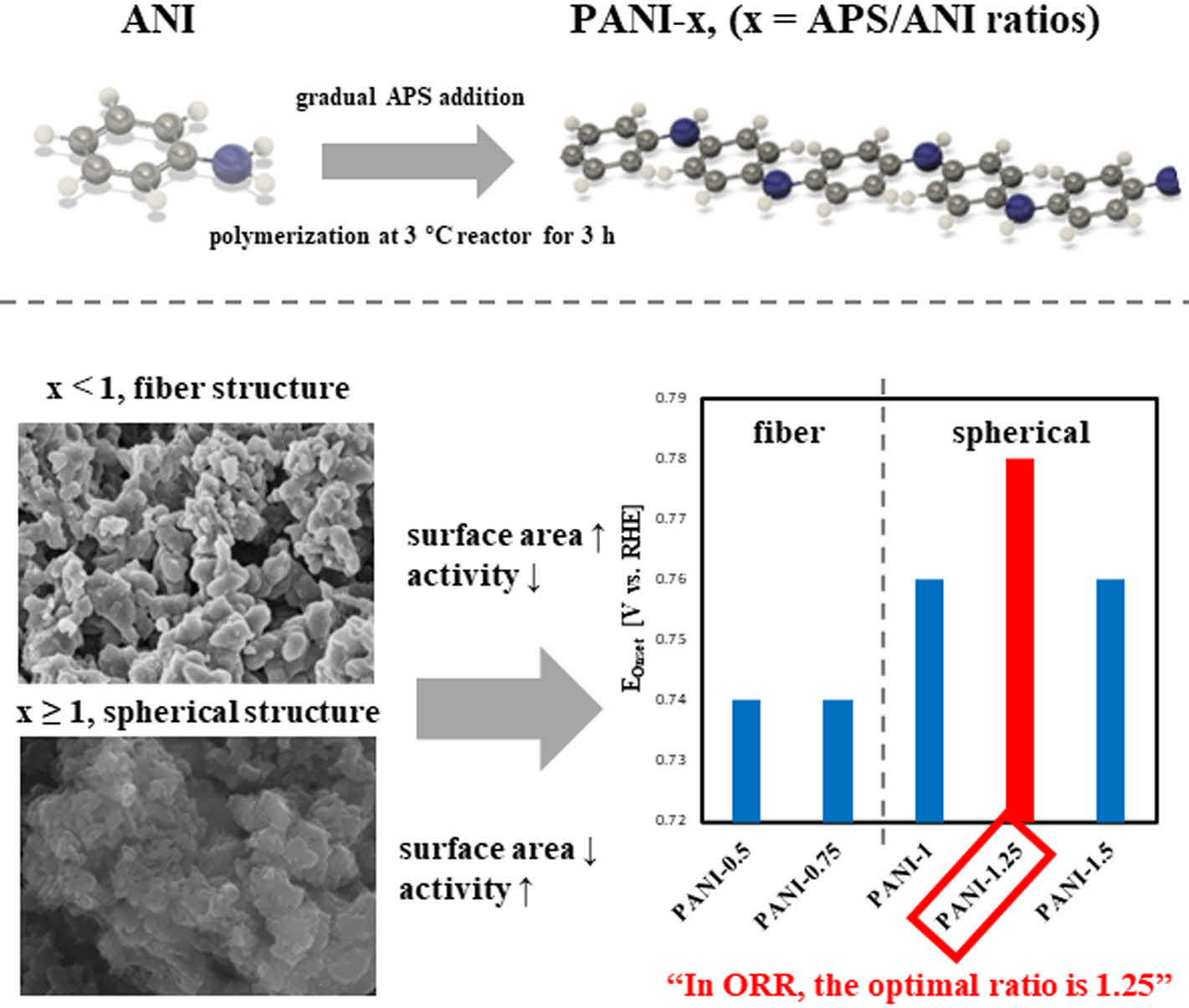
The ratio (X) of APS to aniline is varied from 0.5 to 1.5 as synthesizing the polyaniline as a catalyst for the oxygen reduction reaction. According to the electrochemical performance and physical characterizations, the optimal onset potential and performance of catalysts exhibit at X = 1.25.
Keywords: anion exchange membrane fuel cells, polyaniline, oxidizing agent, activity, non-precious metal catalyst.
이 성과는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구과제(No. 2020R1C1C1004206).
저자들은 이해상충이 없음을 선언합니다.
양이온 교환막 연료전지(proton exchange membrane fuel cells, PEMFCs)는 부산물로 물만 배출하며, 수소와 산소의 화학 에너지를 전기에너지로 변환시키는 친환경 에너지 변환 시스템이다. PEMFCs는 기존 내연기관에 비해 높은 에너지 전환 효율 및 유해 물질 배출이 없으며 소음이 없다는 장점을 가지고 있다. 연료전지 중에 시동이 빠르고 낮은 온도에서 작동 가능하다.1-4 하지만 cathode에서의 산소 환원 반응(oxygen reduction reaction, ORR)은 anode에서의 수소 산화 반응(hydrogen oxidation reaction, HOR)에 비해 느린 반응 속도로 인해 연료전지의 전반적 성능을 조절하는 중요한 반응으로 간주된다. 또한 내구성을 확보하기 위해 다량의 희귀하고 백금과 같이 값비싼 귀금속 촉매를 사용해야 하기 때문에 PEMFCs의 상용화의 걸림돌로 작용하고 있다. 유사한 특징을 갖는 음이온 교환막 연료전지(anion exchange membrane fuel cells, AEMFCs)에서 비귀금속 촉매의 ORR 성능은 산성 환경보다 높은 것으로 보고된다. 이로 인해 적은 비용으로 연료전지를 생산할 수 있다. 하지만 여전히 비귀금속 촉매는 귀금속 촉매보다 낮은 성능을 보이기 때문에 이를 극복하기 위해 많은 노력을 기울이고 있다.
비귀금속 촉매 중 질소 도핑된 탄소 촉매는 높은 효율, 내구성, 성능 및 저렴한 비용으로 인해 산소 환원 반응 촉매로 큰 잠재력을 가지고 있다.5 여러 연구 결과에 따르면 폴리아닐린(polyaniline, PANI)의 탄화 공정을 이용한 촉매는 전기화학적 촉매 합성 및 에너지 저장 분야에 유망하다고 보고되어왔다.5,6 일반적으로 질소를 함유한 전도성 고분자인 PANI은 질소 도핑된 탄소 촉매의 활성 부위를 생성하는데 좋은 전구체이다.4,7 PANI의 일부 나노 구조는 특정 조건 하에서의 열처리 후에도 보존될 수 있으며, 폴리머 자체로부터 유래된 탄소상은 상당한 수의 활성 부위를 수용할 수 있어 합성 시 추가적인 탄소 지지체를 사용하지 않아도 활성 부위의 밀도가 낮아지는 결과를 피할 수 있다.7 또한 PANI의 π-conjugated 구조는 전자 전이를 촉진하며 나노 물질의 전자 구조를 조절함으로써 촉매 능력을 조절할 수 있다.8 하지만 비귀금속 촉매의 성능이 백금계 촉매에 비하면 여전히 낮은 성능을 보이기 때문에, 전도성 폴리머인 PANI에 Fe, Co와 같은 비귀금속을 적용하여 백금계 촉매와 유사한 성능을 보이는 M-N-C타입의 비귀금속 촉매에 대한 연구가 큰 주목을 받고 있다.
PANI은 다양한 중합방법을 통해 제조될 수 있는데, 그 중 계면 중합은 추가적인 실험 장치 없이, 산 활성화제, 단량체, 산화제만을 이용하여 나노 구조의 PANI을 합성할 수 있다. Jiaxing Huang의 연구에 따르면 중합과정에서 일반적으로 산화제를 첨가하는 방법은 고분자 성장에 영향을 미친다. 산화제를 일시적으로 첨가하게 되면, 단량체와 산화제의 빠른 상호작용으로 고품질의 균일한 입자를 얻을 수 있지만 산화제가 빠르게 소모되므로 고분자의 2차 성장을 억제하게 된다. 반면에 산화제를 점진적으로 첨가할 경우 이와 반대로 느린 반응에 의해 불균일하며 응집된 입자가 형성된다.9,10 응집된 구조의 PANI은 비귀금속 촉매의 중요한 활성 부위인 M-N site를 보호하여 촉매 내구성을 향상시킬 수 있어 위와 같은 점진적 산화제 첨가 방법을 채택하였다. PANI의 성능은 단량체와 산화제의 몰비, 단량체와 활성화제의 몰비, 중합 온도 및 시간 등과 같은 다양한 합성 변수에 따라 달라질 수 있다.
여러 PANI 연구결과에 따르면 낮은 중합 온도(-40 - 5 ℃)는 합성된 PANI의 더 나은 수율과 전기화학적 특성을 제공한다.11 그리고 낮은 중합 온도는 초기 형성된 PANI 나노 입자의 이동을 억제하며, 점진적 산화제 첨가 방법과 동일하게 경계면에서 2차 성장을 일으켜 불균일한 나노입자와 응집체를 형성된다. 단량체와 산화제의 몰비 또한 나노입자 형태에 영향을 미친다. 단량체와 산화제의 몰비가 1:1보다 낮을 경우 나노섬유 형태가 형성되며, 1:1을 넘어가는 경우 나노입자가 응집된 형태로 나타난다.12 PANI의 중합에 대한 연구가 다양하게 지속되어왔으나, 아직까지 산소 환원 반응 활성에 관해 PANI 중합에서 단량체와 산화제의 몰비에 관한 연구가 보고 되어있지 않다.
본 연구에서는 응집된 형태의 PANI 합성을 위해 3 ℃의 낮은 중합 온도와 3시간의 짧은 중합시간으로 조건을 설정하였으며, 1:0.125부터 1:1.5의 다양한 단량체와 산화제의 몰비를 설정하여 PANI을 합성하고, 이에 따른 PANI의 물리화학적, 전기화학적 특성 및 산소 환원 반응 활성 변화를 비교, 분석하여 산소 환원 반응에서 단량체와 산화제의 최적 비율을 확인하고자 한다.
PANI 촉매의 합성. 300 mL jacketed beaker에서 3 ℃로 일정하게 유지하면 합성하였다. Jacketed beaker에서 0.5 M 염산(35.0%, OCI, Korea) 수용액을 교반시키며 1.09 mL의 aniline(99+%, Alfa Aesar, Portugal)을 넣어 10분 동안 충분히 혼합시켜 준다. 차가운 DI water(18.2 MΩ, DI water)에 알맞은 양의 ammonium persulfate(98+%, ACS reagent, APS, ACROS ORGANICS, India)를 용해시켜 jacketed baeker에 넣는다. 위의 혼합 용액을 3시간 동안 교반한다. 멤브레인 필터를 이용하여 용매를 제거하고 DI water로 불순물을 제거한 후 80 ℃ 진공오븐에서 건조한다. 다음으로 질소 분위기에서 1시간 동안 800 ℃로 열처리한 후 촉매로 사용하였다. 이와 같이 합성된 촉매는 PANI-X(X=aniline에 대한 APS의 몰비)와 같이 명명하였다.
물리화학적 분석. 전계방사형 주사전자현미경(field emission scanning electron microscopy, FE-SEM, Carl zeiss, SUPRA40VP, Germany)을 사용해 촉매 표면의 구성 원자의 분산도를 분석하였고, 촉매의 비표면적, 평균 기공 크기는 BELSORP MINI X (MICROTRAC MRB, Japan)를 통해 분석하였다. X-선 회절 분석기(X-ray diffractometer, XRD, Rigaku, Smartlab, Japan)를 이용하여 PANI 촉매의 흑연화도 비교하였다.
전기화학적 분석. 전기화학적 특성을 분석하기 위해 촉매 잉크는 다음과 같이 제조하였다. 합성한 촉매 5 mg에 isopropyl alcohol(IPA, SAMCUN, 99.8%, Korea) 475 μL와 25 μL의 Nafion(Alfa Aesar, 5% w/w in water and 1-propanol)을 넣어 30분 동안 초음파(Qsonica sonicatiors, Q55 Sonicator, U.S.A)를 사용하여 균일하게 분산시켰다. 촉매 잉크 15 μL를 glassy carbon(GC, d = 5.6 mm) 위에 도포하였다. 마지막으로 촉매 필름 위에 5 μL의 binder(1:19 = Nafion:IPA)를 추가로 도포하였다.
표준 3전극 시스템으로 bi-potentiostat(Digi-Ivy, DY2300, U.S.A)과 rotating ring-disk electrode(RRDE, Pine research, WaveVortex 10, U.S.A)를 이용하여 측정하였다. 상대전극으로 Pt Plate(10 × 10 × 0.1 mm)를 사용하였고, Hg/HgO를 기준전극으로 사용하였다. 선형주사전위법(linear sweep voltammetry, LSV) 측정 과정에서 전해질은 0.1 M KOH(SAMCUN, Korea)를 이용하여 상온에서 측정하였고 본 논문에 표시된 모든 전압 값은 다음 식에 따라 reversible hydrogen electrode(RHE)으로 변환하였다.
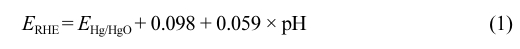
Figure 1에서는 SEM을 통해 촉매의 표면과 구조를 관찰하였다. PANI-0.5(Figure 1(a, b))와 PANI-0.75(Figure 1(c, d))의 SEM 이미지를 보면, 나노섬유의 뭉침이 일어난 구조를 확인할 수 있다. 이는 계면 중합에서의 점진적 산화제 첨가 방법 및 단량체와 산화제의 비율이 PANI의 구조에 미치는 영향으로 해석된다. 1:1 이하의 몰비에서 중합이 이루어지면 나노섬유 구조가 형성되고, 비율이 높아질수록 뭉침 현상이 증가한다. 반면에 단량체와 산화제의 몰비가 1:1을 넘어가면 나노섬유 구조가 아닌 나노입자가 서로 응집된 불균일한 구조가 형성된다. 이는 단량체 대비 산화제의 비율이 1보다 낮은 경우에는 산화제의 농도가 낮기 때문에 초기 PANI 나노섬유 수가 적어 응집을 억제하고, 1보다 높은 비율에선 초기 나노섬유의 수가 높아 빠르게 서로 응집되기 때문이다.12 Figure 1(c-j)를 보면, PANI-1과, PANI-1.25, PANI-1.5는 대체로 구형 입자의 형태를 보여주어 PANI-0.5, PANI-0.75와 명확히 다른 형태를 나타냈다.9,10,12
다음 Figure 2에서는 SEM-EDS mapping을 통해 촉매 표면의 구성 원자 분포를 관찰하였다. EDS-mapping 사진과 Table 1의 원소 성분표를 보면 모든 촉매에서 C, N, O가 균일하게 분포되어 있음을 알 수 있다. 이는 합성 과정에서 구성 원소의 편중된 부분 없이 고르게 합성되었음을 알 수 있다.
Figure 3은 촉매들의 질소 흡탈착 곡선이다. 공통적으로 모든 촉매들은 낮은 P/P0에서는 단층 흡착이 완료되고 P/P0가 증가함에 따라 다중 흡착층의 발달이 보인다. 높은 P/P0 범위에서 나타나는 히스테리시스 루프를 확인하였고 이는 전형적인 Type IV형 질소 흡착-탈착 특성을 가지고 있음을 보여준다. Type IV형 등온선은 mesoporous 흡착체에서 나타나며 Type H3 히스테리시스 루프를 보이는 것을 확인할 수 있다. 이는 PANI의 탄화로 인해 생성된 촉매들에서 mesopores와 macropores가 동시에 존재한다는 것을 의미한다.13,14 BET 비표면적과 평균 기공 크기를 Table 2에 요약하였다. PANI-0.5 촉매가 가장 높은 14.994 m2 g-1를 보인 반면에, PANI-0.75 촉매는 더 낮은 14.511 m2 g−1를 보였다.
PANI-1 촉매에서(11.810 m2 g−1) 급격한 비표면적 감소를 보인다. 이후 산화제의 첨가량을 증가시킴에 따라 유사한 비표면적을 보였다.
이는 Figure 1의 SEM 이미지를 통해 확인한 촉매의 표면 형태와 일치하는 결과이다. PANI-0.5와 PANI-0.75 촉매의 경우 많은 다공성 표면을 가진 반면, PANI-1, PANI-1.25와 PANI-1.5 촉매들의 표면에서는 더 적은 기공들이 관찰되어 비표면적이 적게 나타났다.
Figure 4에서는 PANI-0.5, PANI-0.75, PANI-1, PANI-1.25와 PANI-1.5 촉매들의 탄소결정성 변화를 분석하기 위해 XRD 분석을 수행하였다. 촉매들은 각각 2θ 값이 24°와 44° 부근에서 C(002)면과 C(101)면이 나타나는 것을 볼 수 있다. C(002)면의 피크 위치를 비교했을 때, PANI-0.5 촉매는 21.84°를 보이며, PANI-0.75 촉매는 22.74°를 보였다. PANI-1 촉매는 23.64°를 보여, 산화제의 양이 늘어날수록 탄소 결정성은 증가함을 알 수 있다. 하지만 PANI-1.25와 PANI-1.5 촉매들은 동일하게 23.90°를 보여 일정한 탄소결정성을 보였다. 이는 Bragg’s law에 의해 격자간 거리가 감소하였고, 이에 따라 흑연화도가 증가하였다는 것을 알 수 있다(Table 3).15
Figure 5는 N 1s 영역의 XPS결과이다. 질소는 탄소와 결합한 위치와 형태에 따라 Pyridinic N, Pyrrolic N, Graphitic N, Oxidized N으로 분류된다. 여기서 Pyridinic N, Pyrrolic N, Graphitic N 그리고 Oxidized N의 피크는 각각 약 398.1 eV, 399.3 eV, 400.7 eV 및 403.3 eV의 결합에너지로 위치할 수 있다(Figure 5). 현재 연구자들이 주장하는 바로는 Pyridinic N과 Graphitic N은 촉매의 활성에 도움을 주는 구조이다.16 상기 두 질소 종류가 전자 수용체 역할을 하여 전자 이동을 유도함에 따라 ORR에 도움을 주기 때문에 이들의 비율이 높은 촉매에서 높은 성능을 기대할 수 있다.16,17 하지만 아직까지 Pyridinic N, Graphitic N 둘 사이의 비율이 촉매 성능에 어떠한 영향을 미치는지 보고되지 않아 촉매 성능을 비교하기엔 어려움이 있다. Table 4에 합성한 촉매들의 질소 상태 비율을 나타냈다. Pyridinic N의 비율은 PANI-1.25가 가장 높고, Graphitic N의 비율은 PANI-0.75가 가장 높았다.
합성한 촉매의 성능을 확인하기 위해 LSV 측정을 진행하였다. Figure 6는 PANI 촉매들의 LSV 결과를 보여준다. LSV 측정은 O2 포화된 상온의 0.1 M 수산화칼륨에서 5 mV s−1의 scan rate과 0.05-1.05 V의 potential range에서 1600 rpm을 유지하며 측정하였다. N2 포화된 0.1 M 수산화칼륨에서 background 전류를 측정하여 보정한 결과를 Figure 6에 나타내고, 그 결과를 Table 5에 요약하였다. Figure 6와 Table 5를 보면 산화제의 양이 증가할수록 onset potential이 증가하는 경향성을 보였고 PANI-1.25 비율에서 가장 높은 값으로 0.78 V를 보였다. Onset potential은 촉매의 ORR이 시작되는 부분으로 더 높은 값을 가질수록 전기 촉매 활성도가 더 높은 촉매이다.18 Half-wave potential와 limiting current density 값에서도 마찬가지로 PANI-1.25 촉매가 가장 높은 활성을 보였다. 따라서 LSV 측정 결과에 기반해서 산화제의 비율에 따라 촉매 활성은 변화를 보였고, PANI-1.25 촉매가 가장 우수한 ORR 성능을 보인다. 이는 Table 2에서의 가장 우수한 비표면적 값, Figure 4, Table 3에서의 XRD 분석 결과 몰비가 증가함에 따라 탄소 피크의 위치가 고각으로 이동하며 흑연화도의 증가, 그리고 ORR활성에 관여하는 Pyridinic N의 비율이 증가하는 Table 4의 XPS 결과로 설명될 수 있다.
LSV 측정 결과를 이용하여 0.67-0.77 V 사이 값으로 Tafel plot을(Figure 6(b)) 그려 기울기 값을 비교했을 때, 산화제의 몰비가 증가하며 점차 Tafel 기울기가 감소하였고, 1:1.25에서 가장 낮은 54.81 mV dec−1의 기울기 값을 가지고 다시 증가하는 모습을 보였다. 이에 가장 낮은 기울기 값을 가진 PANI-1.25가 가장 우수한 ORR kinetic을 보인다.19

|
Figure 1 SEM images of PANI: (a, b) PANI-0.5; (c, d) PANI-0.75; (e, f) PANI-1; (g, h) PANI-1.25; (i, j) PANI-1. |

|
Figure 2 SEM and EDS mapping images of (a) PANI-0.5; (b) PANI-0.75; (c) PANI-1; (d) PANI-1.25; (e) PANI-1.5. |

|
Figure 3 N2 adsorption/desorption isotherms of PANI-0.5, PANI0.75, PANI-1, PANI-1.25, and PANI-1.5 catalysts. |

|
Figure 4 XRD patterns of PANI-0.5, PANI-0.75, PANI-1, PANI1.25, and PANI-1.5 catalysts. |

|
Figure 5 XPS N 1s spectra results of (a) PANI-0.5; (b) PANI-0.75; (c) PANI-1; (d) PANI-1.25; (e) PANI-1.5 catalysts. |

|
Figure 6 (a) LSV curves; (b) Tafel plot of PANI-0.5, PANI-0.75, PANI-1, PANI-1.25, and PANI-1.5 catalysts in 0.1 M KOH @1600 rpm |
|
Table 1 Summary of Elemental Concentrations of PANI-0.5, PANI-0.75, PANI-1, PANI-1.25, and PANI-1.5 Catalysts at EDS Mapping Images |

|
Table 2 Summary of BET Surface Areas and Pore Diameters of PANI-0.5, PANI-0.75, PANI-1, PANI-1.25, and PANI-1.5 Catalysts |

|
Table 3 Summary of XRD Peaks for PANI-0.5, PANI-0.75, PANI-1, PANI-1.25, and PANI-1.5 Catalysts |

|
Table 4 XPS N 1s Spectra Results of PANI-0.5, PANI-0.75, PANI-1, PANI-1.25, and PANI-1.5 Catalysts |

|
Table 5 Summary of Electrochemical Characteristics and Tafel Slope for PANI-0.5, PANI-0.75, PANI-1, PANI-1.25, and PANI-1.5 Catalysts in 0.1M KOH @1600RPM |

본 논문에서는 단량체인 aniline과 산화제인 APS를 1:0.5, 1:0.75, 1:1, 1:1.25, 1:1.5의 몰비에서 polymerization에 의해 PANI 촉매를 합성하였다. SEM 분석을 통해 몰비가 1:1 이하일 경우 섬유 구조가 남아있는 것을 확인하였고, 몰비가 1:1이상인 경우에는 나노입자가 모여있는 형태를 띄는 것을 확인하였다. 그리고 EDS mapping을 통해 모든 원소들이 균일하게 분포함을 확인하였다. 질소 흡탈착 분석 결과에서는 mesoporous의 존재를 확인하였고, 섬유 구조를 보이는 PANI-0.5와 PANI-0.75는 비표면적이 약 14 m2 g−1였고, 반면에 나노입자 구조의 PANI-1와 PANI-1.25, PANI-1.5 촉매들은 약 11 m2 g−1을 보였다. 산화제의 양이 증가함에 따라 흑연화도가 증가하고, PANI-1.25 촉매가 가장 높은 pyridinic N의 비율을 보여 ORR 활성에 도움을 주는 것을 확인하였다. 합성한 촉매의 몰비 별 LSV 분석을 통해 성능을 비교한 결과, 분석 결과와 같이 PANI-1.25 촉매가 가장 높은 onset potential (0.78 V), half-wave potential(0.625 V), 그리고 limiting current density(-2.750 mA cm−2)를 보였다. Tafel slope를 통해 기울기를 비교해 본 결과 역시 PANI-1.25 촉매가 54.81 mV dec−1로 가장 우수한 ORR kinetic을 가지는 것을 확인하였다. 따라서, ORR 촉매로써 PANI 합성 방법에 최적화된 단량체와 산화제의 몰비는 1:1.25인 것을 알 수 있다. 본 논문에서는 ORR 등 전기화학 반응에 널리 사용되는 고성능 PANI 유래 비귀금속 촉매를 합성하는 데 큰 역할을 할 것으로 예상된다.
- 1. Jung, W. S.; Lee, W. H.; Oh, H.-S.; Popov, B. N. Highly stable and ordered intermetallic PtCo alloy catalyst supported on graphitized carbon containing Co@CN for oxygen reduction reaction. J. Mater. Chem. A. 2020, 8, 19833-19842.
-

- 2. Yoon, H. S.; Jung, W. S. Effect of Nitrogen Precursors in Non-precious Metal Catalysts on Activity for the Oxygen Reduction Reaction. Korean Chem. Eng. Res. 2022, 60, 151-158.
-

- 3. Li, J.; Wang, S.; Ren, Y.; Ren, Z.; Qiu, Y.; Yu, J. Nitrogen-doped Activated Carbon with Micrometer-scale Channels Derived from Luffa Sponge Fibers as Electrocatalysts for Oxygen Reduction Reaction with High Stability in Acidic Media. Electrochim. Acta 2014, 149, 56-64.
-

- 4. Zamani, P.; Higgins, D.; Hassan, F.; Jiang, G.; Wu, J.; Abureden, S.; Chen, Z. Electrospun Iron–Polyaniline–Polyacrylonitrile Derived Nanofibers as Non–Precious Oxygen Reduction Reaction Catalysts for PEM Fuel Cells. Electrochim. Acta 2014, 139, 111-116.
-

- 5. Wang, G.; Jiang, K.; Xu, M.; Min, C.; Ma, B.; Yang, X. A High Activity Nitrogen-doped Carbon Catalyst for Oxygen Reduction Reaction Derived from Polyaniline-iron Coordination Polymer. J. Power Sources 2014, 266, 222-225.
-

- 6. Quílez-Bermejo, J.; González-Gaitán, C.; Morallón, E.; Cazorla-Amorós, D. Effect of Carbonization Conditions of Polyaniline on Its Catalytic Activity Towards ORR. Some Insights About the Nature of the Active Sites. Carbon 2017, 119, 62-71.
-

- 7. Hu, Y.; Zhao, X.; Huang, Y.; Li, Q.; Bjerrum, N. J.; Liu, C.; Xing, W. Synthesis of Self-supported Non-precious Metal Catalysts for Oxygen Reduction Reaction with Preserved Nanostructures From the Polyaniline Nanofiber Precursor. J. Power Sources 2013, 225, 129-136.
-

- 8. Wang, H.; Wang, W.; Yu, H.; Mao, Q.; Xu, Y.; Li, X.; Wang, Z.; Wang, L. Interface Engineering of Polyaniline-functionalized Porous Pd Metallene for Alkaline Oxygen Reduction Reaction. Appl. Catal. B: Environ. 2022, 307, 121172.
-

- 9. Li, B.; Liu, D. Temperature-induced Evolution of Micro-morphology of Polyaniline Prepared by Gradually Adding Oxidants: Experiments and Mechanism. Polym. Compo. 2016, 37, 28-36.
-

- 10. Huang, J.; Kaner, R. B. Nanofiber Formation in the Chemical Polymerization of Aniline: A Mechanistic Study. Angew. Chem. Int. Ed. 2004, 43, 5817-5821.
-

- 11. Das, T.; Pandey, V. K.; Verma, S.; Pandey, S. K.; Verma, B. Optimization of the Ratio of Aniline, Ammonium Persulfate, Para-toluenesulfonic Acid for the Synthesis of Conducting Polyaniline and Its Use in Energy Storage Devices. Int. J. Energy Res. 2022, 46, 19914-19928.
-

- 12. Wang, Y. Preparation and Application of Polyaniline Nanofibers: an Overview. Polymer International 2018, 67, 650-669.
-

- 13. Donohue, M. D.; Aranovich, G. L. Classification of Gibbs Adsorption Isotherms. Adv. Colloid Interface Sci. 1998, 76-77, 137-152.
-

- 14. Sing, K. S. W. Reporting Physisorption Data for Gas/solid Systems with Special Reference to the Determination of Surface Area and Porosity (Recommendations 1984). Pure Appl. Chem. 1985, 57, 603-619.
-

- 15. Youm, H. N.; Kim, K. J.; Chung, T. J. Graphitization of Petroleum Cokes by Alumunum Catalyst. J. Korean Ceram. Soc. 1995, 32, 677-684.
- 16. Liu, G.; Li, X.; Ganesan, P.; Popov, B. N. Development of Non-precious Metal Oxygen-reduction Catalysts for PEM Fuel Cells Based on N-doped Ordered Porous Carbon. Appl. Catal. B: Environ. 2009, 93, 156-165.
-

- 17. Deng, H.; Li, Q.; Liu, J.; Wang, F. Active Sites for Oxygen Reduction Reaction on Nitrogen-doped Carbon Nanotubes Derived From Polyaniline. Carbon 2017, 112, 219-229.
-

- 18. Batchelor-McAuley, C. Defining the Onset Potential. Curr. Opin. Electrochem. 2023, 37, 101176.
-

- 19. Xing, L.; Song, C.; Kong, A. N–S-codoped Mesoporous Carbons from Melamine-2-thenaldehyde Polymers on Carbon Nanotubes for Oxygen Reduction and Zn-air Batteries. J. Solid State Chem. 2020, 287, 121348.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2024 Impact Factor : 0.6
- Indexed in SCIE
 This Article
This Article
-
2024; 48(3): 318-325
Published online May 25, 2024
- 10.7317/pk.2024.48.3.318
- Received on Dec 27, 2023
- Revised on Jan 24, 2024
- Accepted on Jan 29, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Won Suk Jung
-
Research Center of Chemical Technology, Hankyong National University, 327 Jungang-ro, Anseong 17579, Korea
- E-mail: jungw@hknu.ac.kr
- ORCID:
0000-0001-7443-0474









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.