- Biodegradation of Atelocollagen in the Articular Cavity
Sang Hun Woo
 , Bo Keun Lee, Hee Sang Roh, Andrew S. Kwak, Jin Hyo Yang, Jun Yeong Park*, and Ji Chul Yoo†
, Bo Keun Lee, Hee Sang Roh, Andrew S. Kwak, Jin Hyo Yang, Jun Yeong Park*, and Ji Chul Yoo† 
R&D Division, Cellontech Co., Ltd., Wooyoung Techno Center, 144 Achasan-ro Seongdong-gu, Seoul 04783, Korea
*Department of Orthopaedic Surgery, Hwaseong Jungang Hospital, 5, Baran-ro, Hyangnam-eup,
Hwaseong-si, Gyeonggi-do 18592, Korea- 아텔로콜라겐의 관절강내 생분해도 확인시험
셀론텍㈜ 연구개발본부, *화성중앙병원 정형외과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
This study was conducted to quantitatively evaluate the biodegradability of atelocollagen (CartiZol Ultra) on the surface of articular cartilage and in the synovial fluid after it is intra-articularly injected to NZW rabbit. Atelocollagen, which was labelled with FITC, was injected intra-articularly on both knee of NZW Rabbit, and the remaining amount of atelocollagen was measured by using a fluorescent plate analysis equipment on 0, 14, 28, 42, and 56 days. Atelocollagen-FITC expression on the surface of both articular cartilage and in synovial fluid decreased by about 84% at 56 days after injection, suggesting the possibility of stable in vivo degradation. These results suggest the atelocollagen as potential substance for a treatment in knee osteoarthritis patients, offering an alternative for the management and treatment of pain associated with cartilage damage.
본 연구에서는 NZW Rabbit의 관절강 내에 atelocollagen-fluorescein isothiocyanate(FITC)을 주입하여, 일정 기간 동안 관절 조직 표면 및 활액에 잔존하는 atelocollagen의 생분해성을 정량적으로 평가하였다. Atelocollagen-FITC가 라벨링 된 시험물질을 NZW Rabbit의 양측 관절강 내 주입 후 0, 14, 28, 42, 56일 간격으로 형광 플레이트 분석장비를 이용하여 atelocollagen의 잔존량을 측정하였다. 관절강내 주입된 atelocollagen-FITC의 관절조직 표면 및 활액내 FITC 발현량은 주입 후 56일에 약 84%가 분해되는 것을 확인하였다. 이러한 결과는 무릎 골관절염 환자의 치료물질로서 연골 손상에 따른 통증의 완화와 치료의 대안으로 잠재적 활용 가능성이 있을 것으로 기대된다.
Collagen can be modified to atelocollagen by removing the telopeptides at the end of molecule, and atelocollagen has same effectiveness as collagen but with less antigenicity.
Keywords: atelocollagen, collagen type I, half-life, cartilage, biodegradation.
이 논문은 셀론텍의 지원에 의하여 연구되었음.
저자(들)는 이해상충이 없음을 선언합니다.
최근 인간의 평균 수명 증가로 인한 고령화 사회의 진행으로 퇴행성 질환이 급격하게 증가하고 있다. 이 중 골관절염(osteoarthritis)은 60세 이상 노인의 약 1/3에서 발생하는 흔한 질환으로 관절연골은
대부분 콜라겐과 세포외기질 단백질로 구성되어 있으며 골관절염은 체중을 많이 받은 관절인 무릎관절에서 주로 발생한다.
관절 연골이 손상되면 콜라겐 네트워크가 파괴되어 연골조직을 보호하지 못해 연골의 수분 조절 능력이 저하되며, 삼투압 조절을 담당하는 프로테오글리칸의 손실이 발생하게 되며, 이런 현상이 지속될 경우 골관절염으로 발전하게 된다.1-4
골관절염의 치료법에는 운동, 물리치료, 약물치료, 그리고 관절내 주사 등이 있다.5,6
골관절염 치료법 중 관절내 주사는 보통 물리치료와 약물치료에 반응하지 않는 환자에게 적용된다. 관절염 치료를 위하여 비스테로이드성 항염제(nonsteroidal anti-inflammatory drug, NSAID)와 히알루론산(hyaluronic acid) 관절내 주사는 흔히 통증을 경감시키고 움직임을 용이하게 하기 위해 사용된다. 그러나 이는 치료적인 한계점을 가지며 관절 연골의 손상을 심화시킬 수 있다.7-9
NSAID는 진통 효과와 항염증 작용을 가지고 있지만 관절염의 경과를 변화시키거나 관절손상을 예방하지 못하며 부작용이 심하기 때문에 가능한 최소용량을 단기간 사용하도록 권장된다.10,11 히알루론산 주사는 관절의 움직임을 윤활할 수 있으나, 유동적인 회전율과 짧은 반감기로 인해 이의 유효성을 뒷받침할 수 있는 구체적인 근거가 부족하다.12,13
이에 대한 대체 방법으로 최근 연골 구성성분과 동일한 콜라겐을 활용하여 인대나 연부조직, 관절강 조직에 투여하는 방법이 있다.
콜라겐은 인체를 구성하는 구조단백질로, 연골, 인대, 힘줄 및 피부 등 결합조직을 구성하는 주요성분이다. 특히, 무릎관절 내 구성하는 조직들은 대부분 콜라겐으로 구성되어 있고, 이러한 콜라겐은 생체적합한 천연 생분해성 고분자로서, 다양한 형태로 의료 분야에 사용되고 있다.14-16콜라겐이 손상되거나 부족한 경우에 운동기능 저하, 통증 유발 및 골관절염 발생 등 일어날 수 있으므로, 관절건강을 유지하고 연골을 보호하기 위한 예방적 조치 및 적절한 치료가 필요하다.17
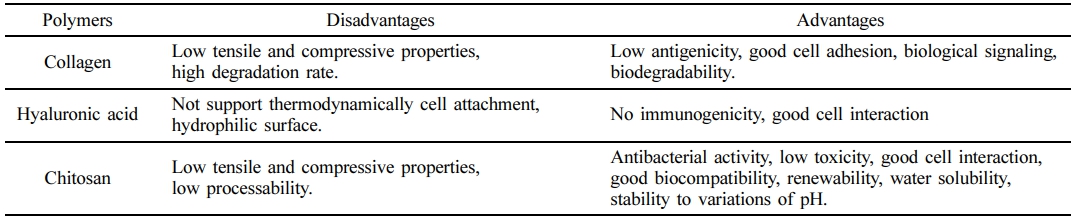
콜라겐은 체내 상호작용 면에 있어서 많은 천연 고분자 또는 합성 고분자들과는 다른 특성을 나타낸다. 조직과 장기의 형성에 중요한 역할을 하며, 지질이 없는 세포막을 관통할 수 있는 좋은 표면활성제(surface-active agent) 성질을 가지고 있다.18,19 또한 콜라겐은 생분해성(biodegradability)을 가지며 항원성(anti-genecity)이 낮은 것으로 알려져 있으며 알부민 또는 젤라틴과 같은 천연 고분자물질과 비교하여 뛰어난 생체적합성(biocompatibility)을 가지고 있다.20 조직공학에 널리 사용되는 천연 생분해성 고분자인 콜라겐, 히알루론산, 키토산의 장단점을 Table 1에 정리하였다.21
콜라겐 제품인 카티졸(CartiZol)은 관절에 주입하여 관절 내 주변조직과 연골의 가장 외부층인 휘판(Laminar splendens)을 코팅하여 손실된 관절연골의 콜라겐을 보충하는 제품이다.이러한카티졸을 이용하여 연골 손상으로 인한 통증에 대한 효과를 임상에서 확인하였다.22 또한 콜라겐의 생분해성 관련하여, 형광물질인 fluorescein isothiocyanate(FITC)를 사용하여 분해기간을 측정한 연구도 보고되었으며,23 membrane 및 scaffold type의 콜라겐의 분해 기간을 측정한 연구도 보고되었다.24-26 하지만 gel type의 콜라겐을 사용하여, 관절내 분해 기간을 연구한 논문은 부족한 상황이다.
이에 본 연구에서는 관절강 내에서 콜라겐의 분해 정도를 확인하기 위해, FITC가 라벨된 시험물질을 NZW Rabbit을 대상으로 관절강 내 활액과 관절 조직 표면에 잔존하는 콜라겐을 확인하였다. 또한 이의 결과를 분석하여 분해 기간을 정량적으로 확인하였다.
|
Table 1 Advantages and Disadvantages of Several Natural Biodegradable Polymers for Cartilage Tissue Engineering21 |
시약 및 재료. 본 연구의 시험 물질인 type I atelocollagen (CartiZol-Ultra)는 Cellontech(Seoul, South Korea)의 제품을 사용하였으며, 형광물질인 FITC는 Thermo Fisher(Seoul, South Korea)에서 구입하였다. 형광물질 측정장비는 BioTek EPOCH2(Agilent, South Korea)를 사용하였다. 동물 실험 모델인 NZW Rabbit은 DooYeolBiotech(Seoul, South Korea)에서 구입하여 사용하였다.
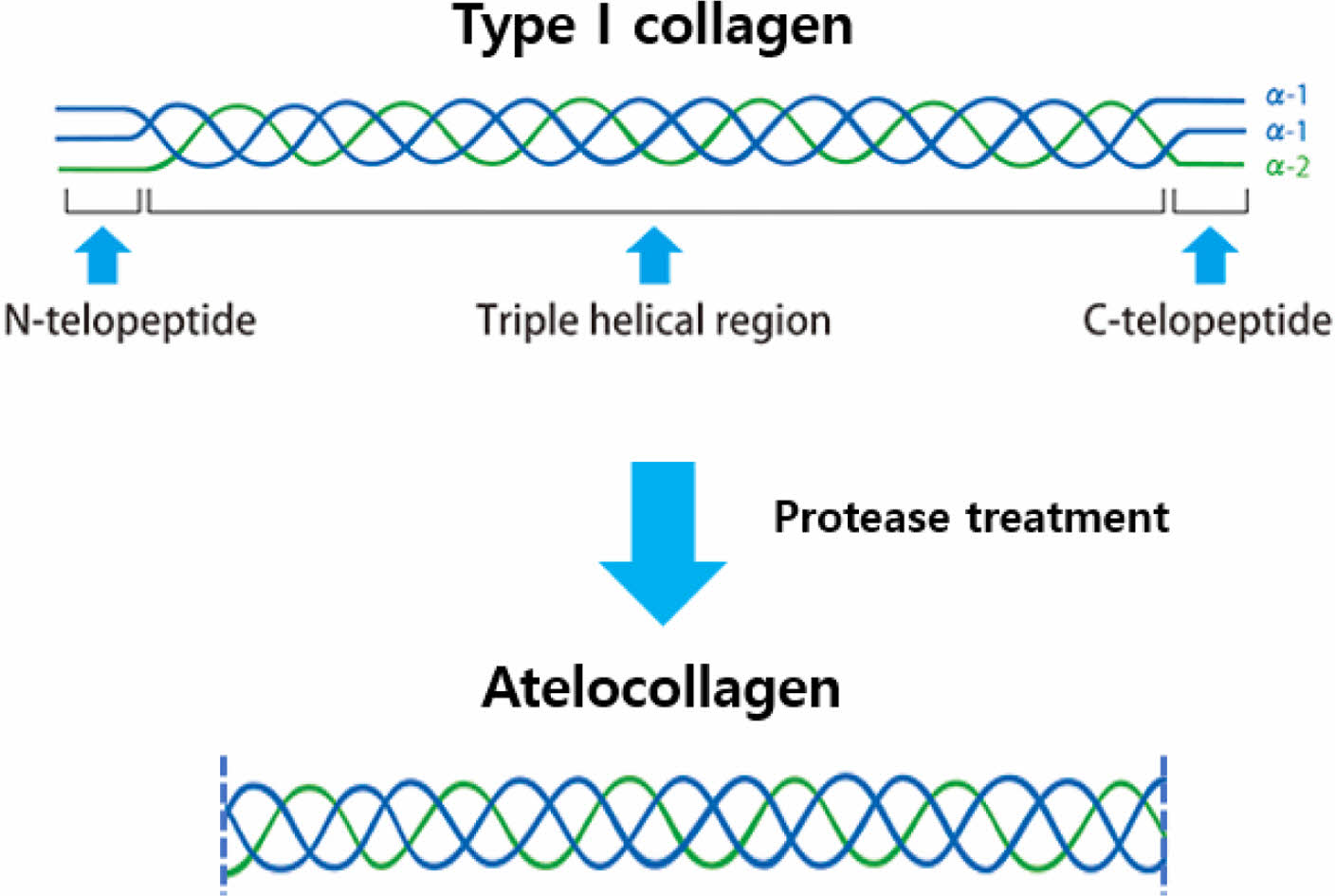
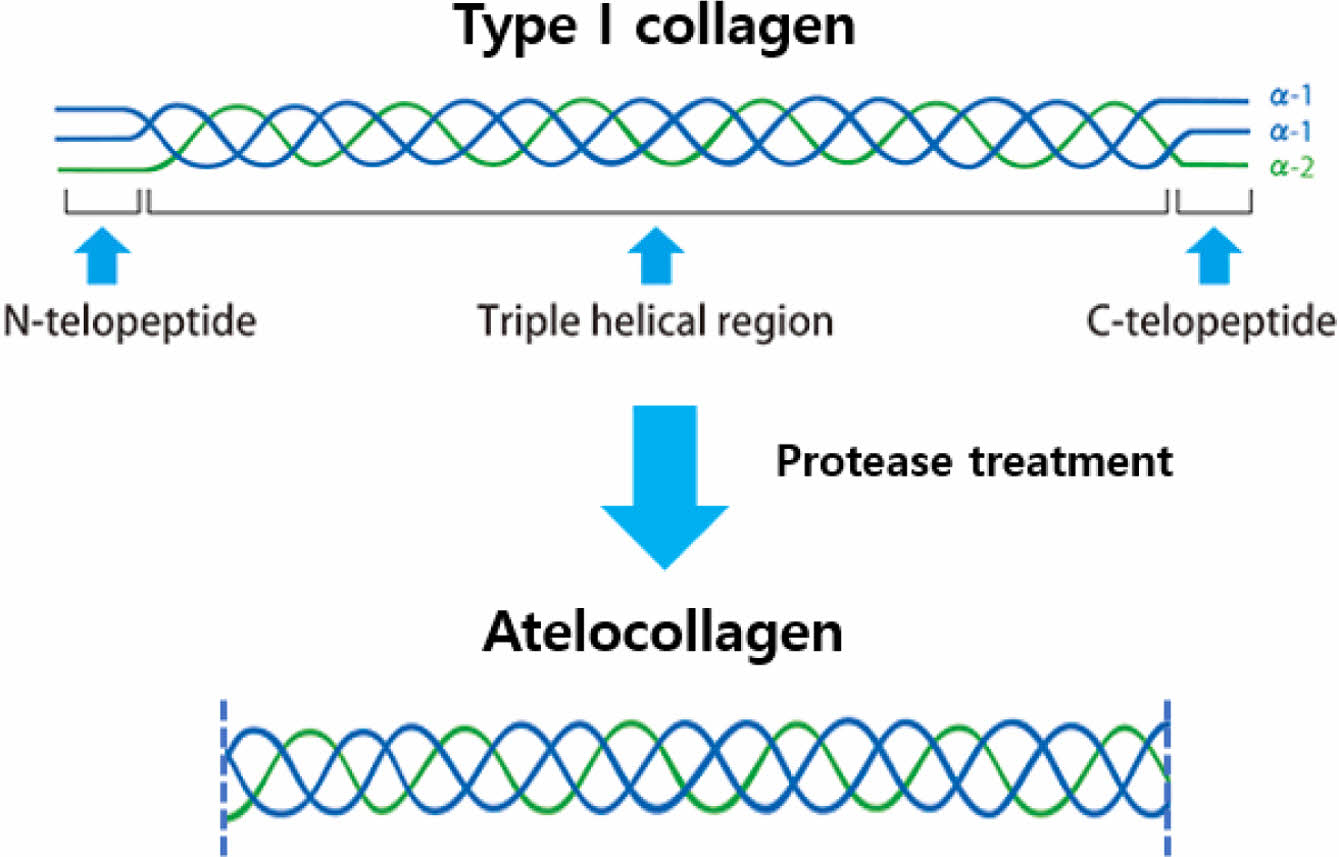
본 연구에 사용된 아텔로콜라겐은 효소를 사용하여 텔로펩타이드가 제거된 콜라겐으로서, 기존 콜라겐과 동일한 특성을 유지하면서 항원성을 제거하여 염증반응이 적은 콜라겐이다. Atelocollagen 제조 모식도는 Figure 1에 제시하였다.
실험물질의 조제. 시험 물질인 atelocollagen은 콜라겐 함유량은 약 6%로, 1 mL당 약 60 mg의 콜라겐을 함유하고 있다. Collagen에 FITC 라벨링을 위하여 atelocollagen 0.5 mL을 0.05 M acetic acid를 사용하여 24배 희석 후 0.1 M borate buffer를 첨가하여 pH 9.0으로 맞춰준다. 희석된 atelocollagen 4 mL에 형광염료인 FITC 50 μL(in DMSO 1 mg/mL) 투입 후 빛이 차단된 장소(20 ℃)에 90분 동안 반응시켰다. 이 후 0.05 M Tris buffer(pH 7.4)를 투입하여 반응을 정지시키고, 반응하지 않고 남은 FITC 제거를 위해 0.05 M acetic acid에 넣고 4 ℃에서 약 12시간 dialysis를 진행하였다. Dialysis가 종료된 atelocollagen 용액의 최종 농도는 2.5 mg/mL이며, 빛이 차단된 장소(4 ℃)에서 보관하였다.
실험방법. 본 연구에 수행된 동물실험은 크로넥스 동물실험윤리위원회(승인번호: CRONEX-IACUC-202007003)의 동물실험 윤리성과 과학성을 승인받아 수행하였다. 체중 약 2.5-3.0 kg, 15주령 내외의 NZW Rabbit(18마리)을 대상으로 atelocollagen-FITC 2.5 mg/mL을 21G 주사바늘을 장착한 주사관을 이용하여 관절강내 0.5 cc씩 1 회/일 단회 투여하였다.
NZW Rabbit의 양측 관절에 0.5 cc 주입 후 0, 14, 28, 42, 56일에 활액 10 μL 채취하였다. 양측 관절은 경골과 대퇴골을 모두 분리하여 미리 준비된 완충 용액에 담아 24시간 동안 4 ℃냉장 진탕하여 연골 표면의 atelocollagen-FITC가 분리될 수 있도록 유도하였다. 이후, 관절연골 표면에 남아있는 atelocollagen-FITC 이 최대한 완충용액에 분리될 수 있도록 20 ℃ 에서 20분간 추가적으로 진탕하였다. 회수한 완충용액은 4000 rpm(20 min) 원심분리 후 상층액은 1 mL만 남기고 모두 제거 후 -80 ℃ 초저온 냉동 보관하였다.
평가방법. FITC 발현량 측정을 위해 관절(경골, 대퇴골)과 활액에서 채취한 atelocollagen-FITC를 형광 분석 장비를 사용하여 측정하였다. 측정된 결과값은 주입 직후 FITC 측정값을 기준으로 시간에 따른 분해 정도를 백분율(%)로 환산하였으며, 추세선을 적용하여 10% 미만 분해양상과 반감기를 분석하여 생분해도를 확인하였다.
|
Figure 1 Schematic diagram of atelocollagen process. |
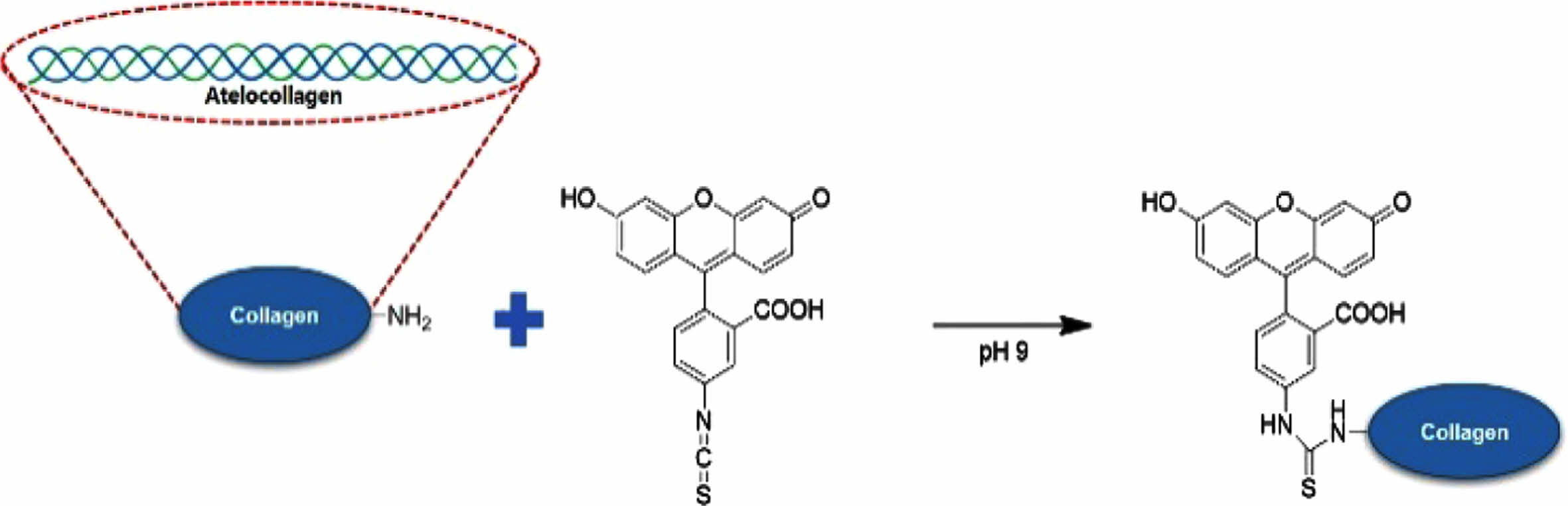
Atelocollagen-FITC 제조. Atelocollagen의 생분해도를 확인하기 위해 FITC를 atelocollagen에 라벨링하였다. 희석한 atelocollagen 용액을 염기성 조건으로 조절한 후 FITC-isothiocyanate를 투입하여, collagen의 아민 그룹에 반응성을 갖는 isothiocyanate가 반응하여 atelocollagen-FITC가 합성된다. 이에 반응 그림은 Figure 2에 나타내었다.
Collagen 분해 기작. Metrix metalloproteinase(MMP)은 콜라겐 분해효소의 일종으로 콜라겐의 생리학적 절단에 관여하는 주요 포유동물 단백질 분해효소이다. MMP는 일반적으로 pro-domain, catalytic domain과 hemopexin domain으로 이루어져 있는데, pro-domain이 제거되면 MMP가 활성화되어 콜라겐 분해가 일어난다.27 MMP group 중 MMP-1, 8, 13으로 인해 collagen fiber degradation을 먼저 발생하고, 이후 MMP-2, 9와 gelatinase가 MMP-1에 의해 발생되는 아미노 말단 텔로펩티드 단편(amino-terminal telopeptide fragment)를 분해한다.28
이런 분해 기작을 가지고 있는 콜라겐의 관절강 내 분해 기간을 조사하기 위하여 FITC가 라벨링된 Atelocollagen-FITC를 이용하여 분해 기간을 연구하였다.
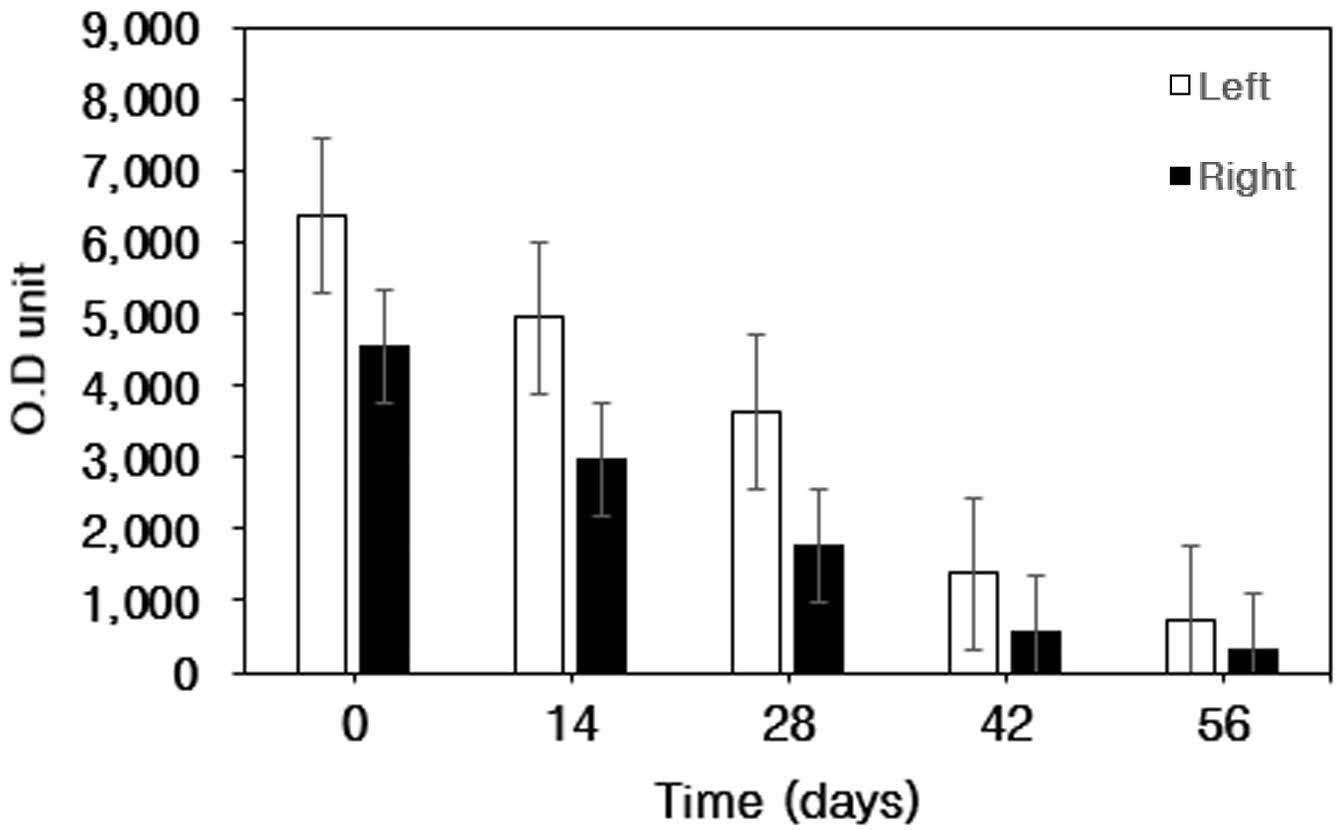
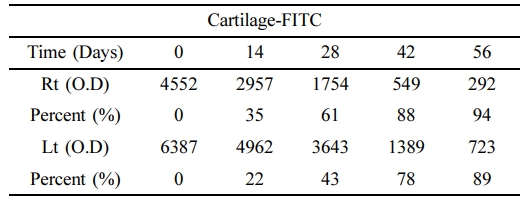
관절연골 표면의 Atelocollagen-FITC 발현량. 대조군(0 day)과 비교한 양측 관절표면의 atelocollagen-FITC 발현량 측정 결과 관절표면에 결합되어 있던 atelocollagen-FITC의 발현량이 감소되는 것을 확인하였다(Table 2, Figure 3).
우측관절의 경우 대조군에 비해 14일에서 발현율이 35% 감소하였으며, 28일과 42일에는 각각 61%, 88% 감소하였으며, 56일에는 94%가 감소하였다.
좌측관절의 경우 대조군에 비해 14일에서 발현율이 22% 감소하였으며, 28일에는 43% 감소, 42일과 56일에는 각각 78%, 89%가 감소하여 양측 관절 모두에서 0일에 비해 atelocollagen-FITC의 발현율이 56일 후 약 90% 이상의 뚜렷한 감소가 확인되었다.
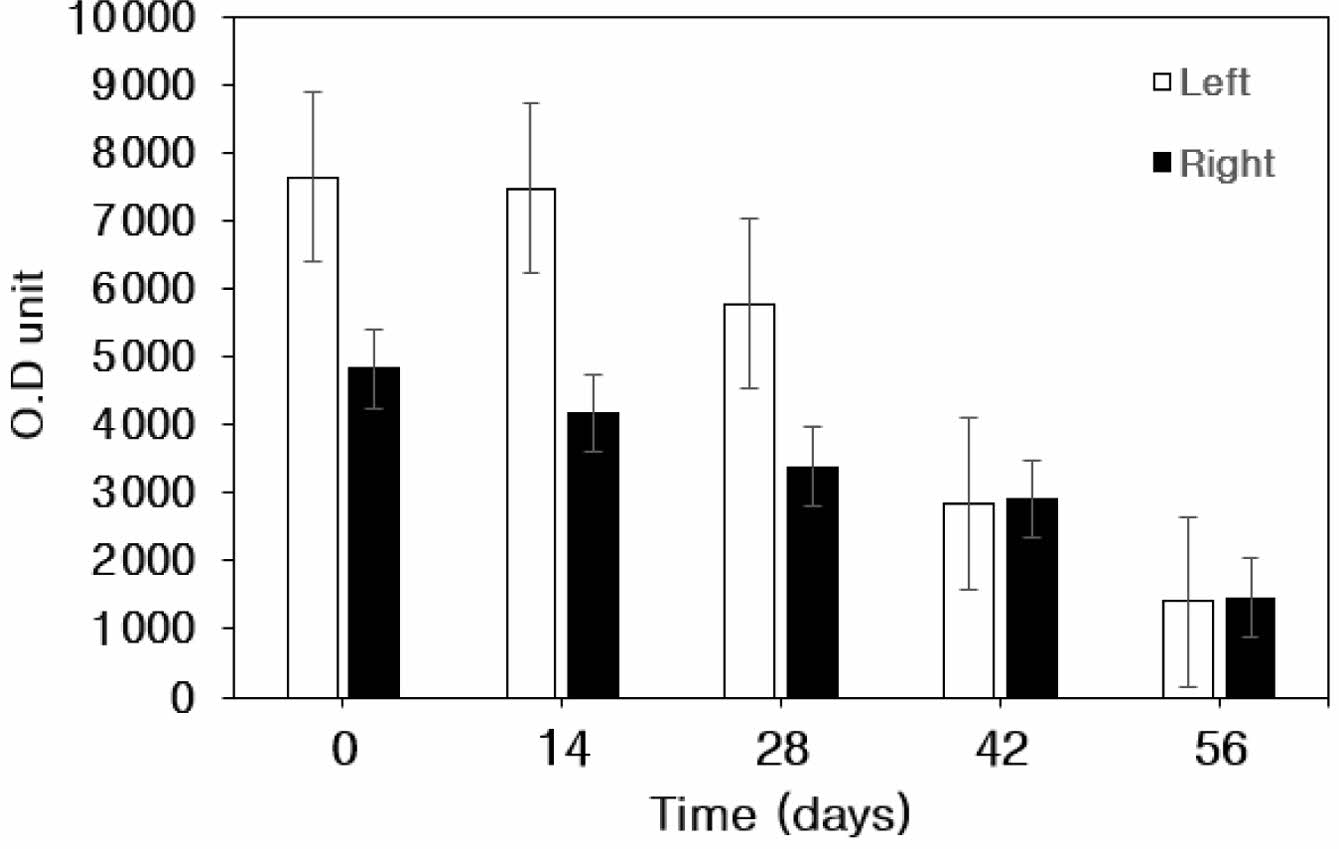
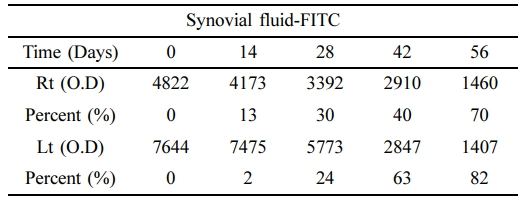
활액의 Atelocollagen-FITC 발현량. 대조군(0 Day)과 비교한 양측 관절내 활액에서의 FITC 발현량 측정 결과 활액내 주입된 atelocollagen-FITC의 발현량 감소가 확인되었다 (Table 3, Figure 4).
우측 활액의 경우 대조군에 비해 14일에서 발현율이 13% 감소하였으며, 28일과 42일에는 각각 30%, 40% 감소하였으며, 56일에는 70%가 감소하였다. 좌측 관절내 활액의 경우 대조군에 비해 14일에서 2% 감소하였으며, 28일과 42일에는 각각 24%, 63% 감소하였으며, 56일에는 82%가 감소하여 양측 관절내 활액에서 대조군에 비해 atelocollagen-FITC의 발현율이 약 76% 이상의 뚜렷한 감소를 나타났다.
단, 양측 관절에서 분해도의 일정 편차가 존재하였는데 이는 atelocollagen 관절 주입 직 후 시험물질이 고루 퍼질 수 있도록 양측 관절 모두 동일하게 움직이도록 하는 과정에서 주입된 atelocollagen이 관절내 퍼지는 정도가 달라 분해정도의 편차가 발생할 수 있을 것으로 예상된다. 또한 실험 개체들 간의 좌·우 관절의 운동성 차이도 편차를 발생시킬 수 있는 요인으로 판단되는데, 실험 과정 중에서도 atelocollagen 주입 후 일부 실험 동물들이 불편을 더 많이 느끼는 다리를 적게 사용하는 것이 관찰되었다.
이처럼 양측 관절에서 같은 주입량으로 실험을 진행하더라도 관절의 조건이 동일하게 나올 수는 없기에 결과값의 일부 편차가 나타난다고 판단할 수 있다. 이런 편차를 보완하기 위해 양측 관절에서의 atelocollagen 분해정도에 대한 평균을 계산하여 분해 추이를 확인해보고자 하였다.
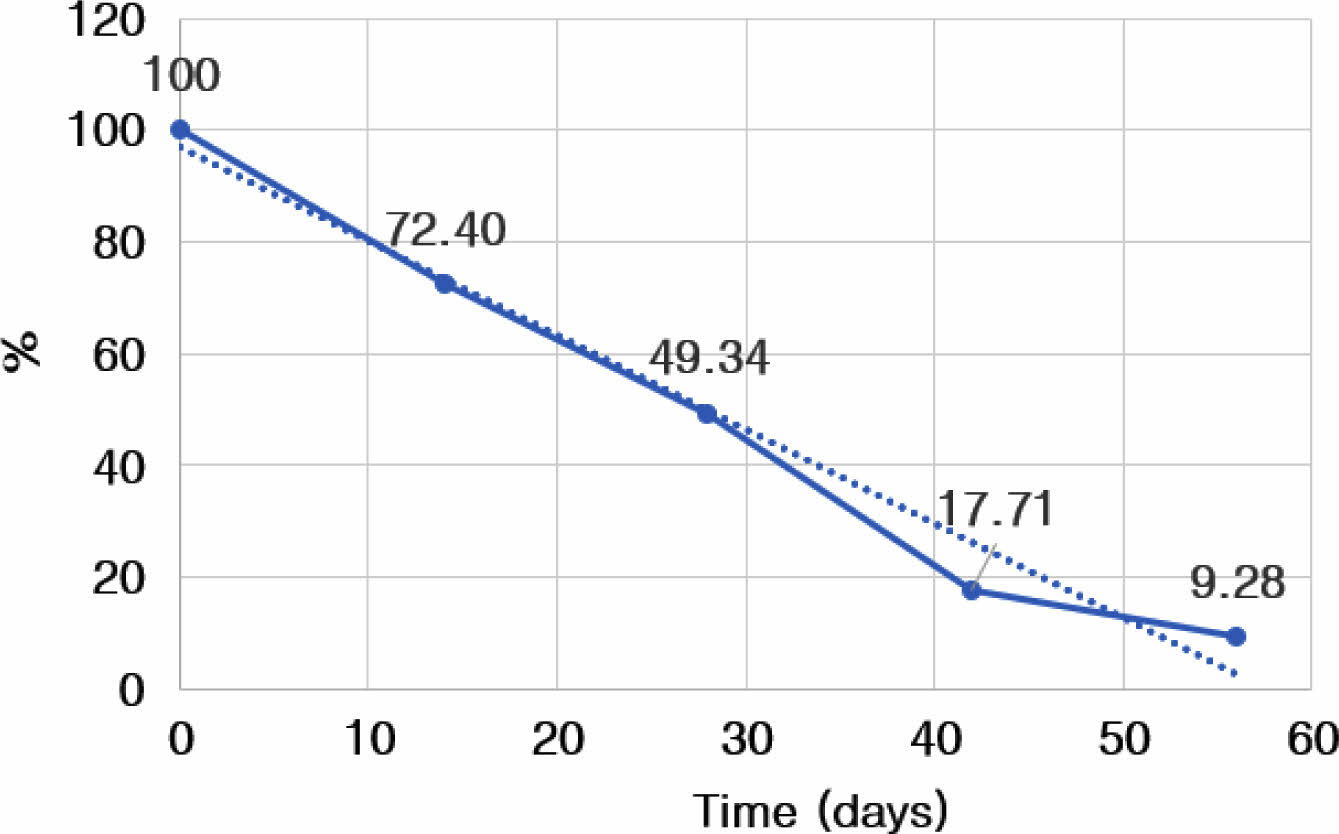
관절 및 활액에서의 Atelocollagen-FITC 발현량 추세선 분석. 관절(경골, 대퇴골) 연골 표면에 부착된 atelocollagen-FITC의 발현량을 추세선 분석한 결과, 57일째 발현량이 10% 미만으로 감소하였으며, 해당 물질의 반감기는 28일로 측정되었다(Figure 5).
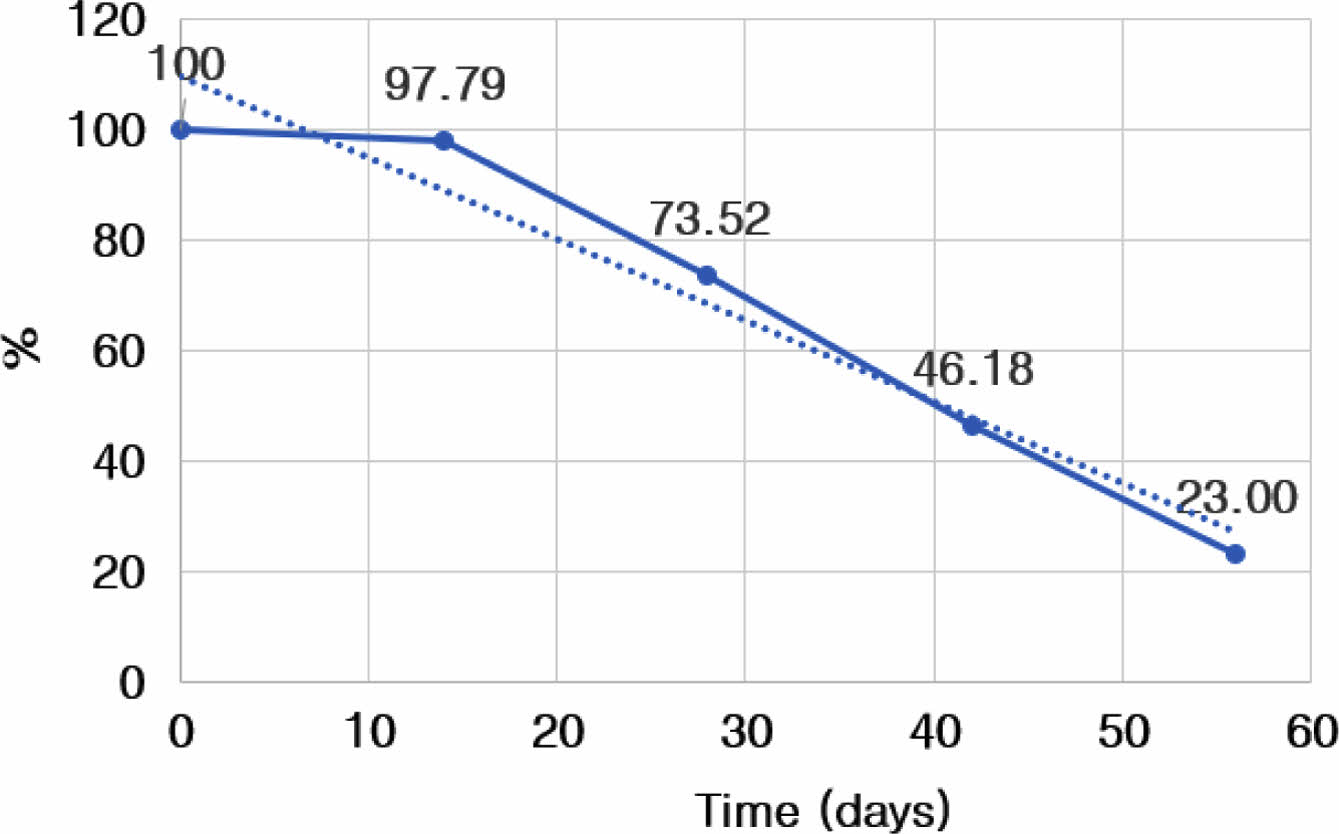
관절 내 활액에서의 atelocollagen-FITC 발현량을 추세선 분석한 결과, 74일째 발현량이 10% 미만으로 감소하였으며, 해당 물질의 반감기는 40일로 측정되었다(Figure 6).
분석 결과 고찰. Atelocollagen은 collagen type I 단백질로, 콜라겐의 양측 말단에 비 나선구조의 항원 활성을 갖는 텔로펩타이드 부분을 제거한 형태이다. 이는 안전한 생체재료로 인정받아 오랜 기간 동안 피부미용 제품 및 재생의학용 생체재료로 널리 사용되어 왔다.
Atelocollagen은 주로 골관절염(osteoarthritis) 환자의 손상된 관절에 직접 주입하여 사용된다. 이 과정에서 atelocollagen은 1차적으로 손상된 관절 연골의 콜라겐 수치를 보충하여 통증을 완화하고, 연골세포의 부착 및 분화를 촉진하여 손상된 연골의 재생에 기여한다.
그러나, 시간이 지남에 따라 콜라겐 분해효소로 인해 콜라겐의 분해는 발생하게 되며, 지속적인 관절의 통증 완화 및 연골의 재생이라는 목적을 달성하기 위해 연골에서의 콜라겐 분해 정도를 확인할 필요성이 존재한다.
본 연구에서는 atelocollagen-FITC를 NZW Rabbit의 양측 관절강내에 주입한 후 0, 14, 28, 42, 56일에 형광분석 장비를 이용하여 관절 조직 표면 및 활액 내에 남아 있는 atelocollagen의 잔존량을 측정하였다.
형광분석 장비를 통한 FITC 발현량 측정 결과, atelocollagen은 56일 후에 우측 관절 표면에서는 94%의 감소, 좌측 관절 표면에서는 89%의 감소가 관찰되었다. 또한, 우측 활액에서는 70%의 감소, 좌측 활액에서는 82%의 감소로, 주입된 atelocollagen이 관절 표면 및 활액 내에서 평균적으로 약 84% 이상 감소한 것으로 확인되었다.
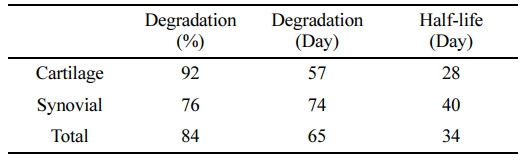
이와 같은 결과를 바탕으로 추세선 적용하여 감소 양상을 분석한 결과 atelocollagen-FITC는 56일에 관절조직에서 92% 감소, 10% 미만 분해일 57일, 반감기 28일 이였으며, 활액에서는 76% 감소, 10% 미만 분해일 74일, 반감기 40일 이였으며, 관절조직 및 활액에서는 84% 감소, 10% 미만 분해일 65일, 반감기 34일로 확인되었다. 이를 통해 활액보다 관절조직에서 atelocollagen의 분해율 및 반감기가 더 짧음을 확인할 수 있다(Table 4).
또한, 골관절염 환자 대상으로 atelocollagen 투여 후 약 6개월간 치료효과가 유지되었다는 임상 연구가 보고되어 있어,17 이를 참고하였을 때, atelocollagen은 골관절염 완화에 효과가 있는 것으로 판단된다.
|
Figure 2 Modification of atelocollagen with FITC. |
|
Figure 3 Expression of FITC on the surface of articular cartilage at 0, 14, 28, 42, and 56 days after intra-articular atelocollagen-FITC injection. |
|
Figure 4 Expression of FITC in the synovial fluid at 0, 14, 28, 42, and 56 days after intra-articular atelocollagen-FITC injection. |
|
Figure 5 Graph of change on expression of FITC for the surface of articular cartilage at 0, 14, 28, 42, and 56 days after intra-articular atelocollagen-FITC injection. |
|
Figure 6 Graph of change on expression of FITC in the synovial fluid at 0, 14, 28, 42, and 56 days after intra-articular atelocollagenFITC injection. |
|
Table 2 Expression of FITC on the Surface of Articular Cartilage at 0, 14, 28, 42, 56 Days after Intra-articular Atelocollagen-FITC Injection (O.D/%) |
|
Table 3 Expression of FITC in the Synovial Fluid at 0, 14, 28, 42, and 56 Days after Intra-articular Atelocollagen-FITC Injection (%) |
본 시험에서는 형광 물질인 FITC를 이용하여 atelocollagen의 체내 생분해성을 평가하였다. 그 결과 NZW Rabbit의 관절강내 주입된 atelocollagen-FITC의 양측 관절조직 표면 및 활액내에서 FITC 발현량은 56일 경과 시, 평균 84% 감소를 보이는 것으로 확인하였다.
본 시험을 통해 atelocollagen의 관절강 내에서의 시간에 따른 분해 정도를 알아보고자 하였으며, 90% 이상 분해까지 약 3개월 정도 시간이 소요되는 것으로 확인되었다. 골관절염에 투입된 atelocollagen에 대한 분해 기간 관련 참조 문헌이 많지 않아 자사 연구와 명확하게 비교를 하기는 힘드나, 자사 연구 및 임상 결과를 바탕으로 판단해보면 해당 결과를 바탕으로 골관절염 및 광범위 연골 손상으로 인한 무릎 통증에 ateolocollagen은 효과적인 완화 치료법 중의 하나라고 기대할 수 있다.
- 1. Heijink, A.; Gomoll, A. H.; Madry, H.; Drobnic, M.; Filardo, G.; Espregueira-Mendes, J.; Dijk, C. N. V. Biomechanical Considerations in the Pathogenesis of Osteoarthritis of the Knee. Knee. Surg. Sprots. Traumatol. Arthrosc. 2012, 20, 423-435.
-

- 2. Maldonado, M.; Nam, J. The Role of Changes in Extracellular Matrix of Cartilage in the Presence of Inflammation on the Pathology of Osteoarthritis. Biomed. Res. Int. 2013, 284873.
-

- 3. Wu, J. P.; Kirk, T. B.; Zheng, M. H. Study of the Collagen Structure in the Superficial Zone and Physiological State of Articular Cartilage using a 3D Confocal Imaging Technique. J. Orthop. Surg. Res. 2008, 3, 29.
-

- 4. Felson, D. T. Osteoarthritis of the Knee. N. Engl. J. Med. 2006, 354, 841-848.
-

- 5. Filardo, G.; Kon, E.; Roffi, A.; Matteo, B. D.; Merli, M. L.; Marcacci, M. Platelet-Rich Plasma: Why Intra-articular? A Systematic Review of Preclinical Studies and Clinical Evidence on PRP for Joint Degeneration. Knee. Surg. Sports. Traumatol. Arthrosc 2015, 23, 2459-2474.
-

- 6. Bhadra, A. K.; Altman, R.; Dasa, V.; Myrick, K.; Rosen, J.; Vad, V.; Vitanzo, P.; Bruno, M.; Kleiner, H.; Just, C. Appropriate use Criteria for Hyaluronic Acid in the Treatment of Knee Osteoarthritis in the United States. Cartilage 2017, 8, 234-254.
-

- 7. Briem, K.; Axe, M. J.; Snyder-Mackler, L. Medial Knee Joint Loading Increases in Those who Respond to Hyaluronan Injection for Medial Knee Osteoarthritis. J. Orthop. Res. 2009, 27, 1420-1425.
-

- 8. Altman, R. D.; Dasa, V.; Takeuchi, J. Review of the Mechanism of Action for Supartz FX in Knee Osteoarthritis. Cartilage 2018, 9, 11-20.
-

- 9. Ozcamdalli, M.; Misir, A.; Kizkapan, T. B.; Uzun, E.; Duygulu, F.; Yazici, C.; Kafadar, I. H. Comparison of Intra-Articular Injection of Hyaluronic Acid and N-Acetyl Cysteine in the Treatment of Knee Osteoarthritis: A Pilot Study. Cartilage 2017, 8, 384-390.
-

- 10. American College of Rheumatology Ad Hoc Committee on Clinical Guidelines. Guidelines for the Management of Rheumatoid Arthritis. Arthritis. Rheum. 1996, 39, 713-722.
-

- 11. Zhang, W.; Nuki, G.; Moskowitz, R. W.; Abramson, S.; Altman, R. D.; Arden, N. K.; Bierma-Zeinstra, S.; Brandt, K. D.; Croft, P.; Doherty, M.; Dougados, M.; Hochberg, M.; Hunter, D. J.; Kwoh, K.; Lohmander, L. S.; Tugwell, P. OARSI Recommendations for the Management of Hip and Knee Osteoarthritis: Part III: Changes in Evidence Following Systematic Cumulative Update of Research Published through January 2009. Osteoarthritis Cartilage 2010, 18, 476-499.
-

- 12. Brown, T. J.; Laurent, U. B.; Fraser, J. R. Turnover of Hyaluronan in Synovial Joints: Elimination of Labelled Hyaluronan from the Knee Joint of The Rabbit. Exp. Physiol. 1991, 76, 125-134.
-

- 13. Levick, J. R. A Method for Estimating Macromolecular Reflection by Human Synovium, using Measurements of Intra-Articular Half-Lives. Ann. Rheum. Dis. 1998, 57, 339-344.
-

- 14. Silver, F. H.; Garg, A. T. Collagen: Characterization, Processing and Medical Applications. Handbook of Biodegradable Polymers;Domb, A. J., Kost, J., Wiseman, D., 1st Eds.; CRC press: Florida, 1998; pp 323-350.
-

- 15. Doppalapudi, S.; Jain, A.; Khan, W.; Domb, A. J. Biodegradable Polymers—an Overview. Polym. Adv. Technol. 2014, 25, 427-435.
-

- 16. Salvatore, L.; Natali, M. L.; Brunetti, C.; Sannino, A.; Gallo, N. An Update on the Clinical Efficacy and Safety of Collagen Injectables for Aesthetic and Regenerative Medicine Applications. Polymers 2023, 15, 1020.
-

- 17. Lee, H. S.; Oh, K. J.; Moon, Y. W.; In, Y.; Lee, H. J.; Kwon, S. Y. Intra-articular Injection of Type I Atelocollagen to Alleviate Knee Pain: A Double-Blind, Randomized Controlled Trial. Cartilage 2021, 13, 1_suppl: 342S-350S.
-

- 18. McPherson, J. M.; Sawamura, S.; Armstrong, R. An Examination of The Biologic Response to Injectable, Glutaraldehyde Cross-Linked Collagen Implants. J. Biomed. Mater. Res. 1986, 20, 93-107.
-

- 19. JoseFonseca, M.; Alsina, M. A.; Reig, F. Coating Liposomes with Collagen (Mr 50000) Increases Uptake into Liver. Biochim. Biophys. Acta. 1996,1279, 259-265.
-

- 20. Maeda, M.; Tani, S.; Sano, A.; Fujioka, K. Microstructure and Release Characteristics of the Minipellet, a Collagen-based Drug Delivery System for Controlled Release of Protein Drugs. J. Control. Release 1999, 62, 313-324.
-

- 21. Puppi, D.; Chiellini, F.; Piras, A. M.; Chiellini, E. Polymeric Materials for Bone and Cartilage Repair. Prog. Polym. Sci. 2010, 35, 403-440.
-

- 22. Suh, D. S.; Yoo, J. C.; Woo, S. H.; Kwak, A. S. Intra-Articular Atelocollagen Injection for The Treatment of Articular Cartilage Defects in Rabbit Model. Tissue. Eng. Regen. Med. 2021, 18, 663-670.
-

- 23. Nakagawa, M.; Tanaka, M.; Miyata, T. Evaluation of Collagen Gel and Hyaluronic Acid as Vitreous Substitutes.Ophthalmic. Res. 1997, 29, 409-420.
-

- 24. Moses, O.; Vitrial, D.; Aboodi, G.; Sculean, A.; Tal, Haim.; Kozlovsky, A.; Artzi, Z.; Weinreb, M.; Nemcovsky, C. E. Biodegradation of Three Different Collagen Membranes in the Rat Calvarium: A Comparative Study. J. Periodontol. 2008, 79, 905-911.
-

- 25. Vallecillo, C.; Toledano-Osorio, Manuel.; Vallecillo-Rivas, M.; Toledano, M.; Osorio, R. In Vitro Biodegradation Pattern of Collagen Matrices for Soft Tissue Augmentation. Polymers 2021, 13, 2633-2650.
-

- 26. Olaechea, A.; Mendoza-Azpur, G.; Valdvia, E.; Rasperini, G.; Biodegradation of Three Different Collagen Mambranes: A Histological Study. J. Osseointeg. 2016, 8, 15-19.
-

- 27. Nguyen, T. T.; Mobashery, S.; Chang, M. Roles of Matrix Metalloproteinases In Cutaneous Wound Healing; Intechopen: London, 2023.
-

- 28. Singh, D.; Rai, V.; Agrawal, D. K. Regulation of Collagen I and Collagen III in Tissue Injury and Regeneration. Cardiology Cardiovascular Medicine 2023, 7, 5-16.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2024; 48(4): 413-418
Published online Jul 25, 2024
- 10.7317/pk.2024.48.4.413
- Received on Mar 29, 2024
- Revised on May 10, 2024
- Accepted on May 27, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Ji Chul Yoo
-
R&D Division, Cellontech Co., Ltd., Wooyoung Techno Center, 144 Achasan-ro Seongdong-gu, Seoul 04783, Korea
- E-mail: yjc@cellontech.com
- ORCID:
0009-0006-0790-7387









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.