- Synthesis and Characterization of P(AA-co-GelMA) Hydrogel Particles for Oral Protein Drug Delivery Applications
Department of Chemical Engineering, Hongik University, Wausanro 94, Mapo-gu, Seoul 04066, Korea
- 단백질약물의 경구투여용 전달체로 사용하기 위한 P(AA-co-GelMA) 수화젤 입자의 합성 및 평가
홍익대학교 화학공학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
pH-Responsive and mucoadhesive hydrogel particles using acrylic acid (AA) and gelatin were synthesized via free-radical suspension polymerization. The methacrylate groups were introduced into native gelatin to make methacrylated gelatin (GelMA) capable of polymerizing with AA. In order to determine the optimal synthesis conditions for producing the well-dispersed hydrogel particles, the effects of various reaction conditions such as concentration of dispersion stabilizer, amount of continuous medium, and stirring speed on the size and dispersibility of hydrogel particles were investigated. When the stabilizer concentration, amount of continuous medium, and stirring speed increased, the dispersibility of particles was improved. The pH-sensitive swelling and release behaviors of P(AA-co-GelMA) hydrogel particles were also investigated according to various composition of AA and gelatin in the hydrogels. P(AA-co-GelMA) hydrogel particles showed low swelling ratio at a pH less than 5 but high swelling ratio at a pH greater than 5, and the swelling ratio of the hydrogel increased at a pH above 5 with AA content in the hydrogel. The P(AA-co-GelMA) hydrogel particles also presented a pH-responsive release behavior. The difference in the released amount of FITC-dextran from the hydrogel particles between pH 2.6 and pH 7.0 decreased, when the AA content in the hydrogel decreased.
천연 젤라틴에 메타아크릴레이트 그룹을 첨가하여 아크릴산(AA)과 중합할 수 있는 메타이크릴레이티드 젤라틴을 공중합하고 이를 이용하여 현탁중합을 통해 pH 감응성 및 점막부착성 수화젤 입자를 합성하였다. 우수한 분산성을 가진 수화젤 입자를 제조하기 위한 조건을 찾기 위하여 분산안정제의 농도, 분산매의 양, 그리고 교반속도 등 합성조건이 수화젤 입자의 크기와 분산성에 미치는 영향을 조사한 결과, 분산안정제의 농도, 분산매의 양, 그리고 교반속도가 증가할수록 입자의 분산성이 향상되는 것을 알 수 있었다. 합성된 P(AA-co-GelMA) 수화젤 입자는 pH 5를 기준으로 5 보다 낮은 pH에서는 작은 팽윤비를, 5보다 높은 pH에서는 큰 팽윤비를 보여주었고 수화젤 내 AA 함량이 증가할수록 5보다 높은 pH에서 수화젤의 팽윤비가 더 많이 증가하였다. 또한 P(AA-co-GelMA) 수화젤 입자는 pH 감응성 방출거동을 보여주었는데, 수화젤 입자에 탑재된 FITC-dextran의 방출량을 pH 2.6과 pH 7.0에서 비교한 결과, pH 7.0에서의 방출량이 많았으며, 수화젤 내 AA 함량이 감소함에 따라 두 pH 사이에서 방출량의 차이가 감소하는 것을 볼 수 있었다.
pH-Responsive and mucoadhesive hydrogel particles of P(AA-co-GelMA) using acrylic acid (AA) and gelatin were synthesized via free-radical suspension polymerization. The final synthesis conditions were the stabilizer concentration of 5%, the amount of the dispersion medium of 30 mL, and the stirring speed of 30000 rpm. Using these conditions, P(AA-co-GelMA) hydrogel particles with an average size of 12.6 ¥ìm and excellent dispersibility were prepared.

Keywords: pH-responsive copolymers, gelatin, hydrogel particles, suspension polymerization, oral drug delivery.
본 연구는 홍익대학교 학술진흥연구비에 의하여 지원되었으며, 이에 진심으로 감사드립니다.
저자들은 이해상충이 없음을 선언합니다.
단백질약물의 경구투여용 전달시스템을 개발하는 데 있어 발생하는 주요 문제점들은 단백질약물이 인체의 위장과 소장에서 변성되거나, 소장에서 흡수될 때 소장벽을 통과하는 흡수율이 상대적으로 낮다는 것이다. 이러한 문제들을 해결하는 방법으로 pH 감응성과 점막부착성을 보유한 약물전달체를 사용하여 단백질약물을 경구 전달하려는 연구가 시도되고 있다.1-5 수화젤은 다량의 물을 흡수할 수 있지만 가교결합으로 인해 불용성인 3차원 네트워크 구조를 가진 물질로, 우수한 생체적합성과 친수성 등의 특성 때문에 생명공학 및 의약학 분야에서 많이 사용되어지고 있다. 특히, 나노 및 마이크로미터 크기로 합성된 수화젤 입자는 작은 크기, 큰 비표면적, 표면 개질의 용이성, 그리고 약물의 캡슐화 등 많은 장점을 갖고 있어서 약물 전달 시스템 분야에서 많이 활용되고 있다.6-10
본 연구에서는 인체의 위장과 소장 사이의 pH 차이에 따라 단백질약물을 선택적으로 방출할 뿐만 아니라 인체의 소장에서 장시간 체류할 수 있는 경구투여용 약물전달체를 제작하기 위하여 아크릴산(AA)과 메타크릴레이트 젤라틴(GelMA)을 사용하여 입자 형태의 P(AA-co-GelMA) 수화젤을 합성하였다. AA 또는 메타크릴산(MAA)를 함유하는 음이온성 수화젤은 주변 pH 변화에 따른 수화젤의 팽윤거동이 큰 영향을 받는다.11-13 따라서 음이온성 수화젤이 산성 환경인 위장에 있으면, 팽윤하지 않기 때문에 수화젤 내부에 탑재된 단백질약물이 방출되지 않으면서 위산 및 분해효소로부터 보호받고, 소장에 다다르면 소장의 염기성 또는 중성인 pH 환경에서 수화젤이 팽윤하여 내부의 단백질약물을 방출할 수 있다. 또한 젤라틴은 소장벽에 존재하는 점막에 우수한 점착력을 가진 것으로 알려져 있으므로,14-18 젤라틴이 포함된 P(AA-co-GelMA) 수화젤은 소장벽에 오랫동안 부착되어 소장내에서 수화젤의 체류시간을 증가시켜 소장벽을 통한 단백질약물의 흡수를 향상시킬 수 있을 것으로 기대한다. 본 연구의 목표는 입자 형태로 P(AA-co-GelMA) 수화젤을 합성하는 방법을 확립하고, 단백질약물의 경구투여 전달체로서 P(AA-co-GelMA) 수화젤 입자의 가능성을 평가하는 것이다. 천연 젤라틴은 AA와 중합할 수 있도록 메타크릴레이트 그룹을 도입하였고, 우수한 분산성을 보유한 P(AA-co-GelMA) 수화젤 입자를 합성하기 위하여 중합에 사용되는 분산안정제의 농도, 분산매의 양, 그리고 교반 속도 등 합성조건이 P(AA-co-GelMA) 수화젤 입자의 크기와 분산성에 미치는 영향을 조사하여 최적의 합성조건을 확립하였다. 합성된 P(AA-co-GelMA) 수화젤 입자의 pH에 따른 팽윤 및 방출 거동과 수화젤 내 다양한 AA와 젤라틴의 조성에 따른 팽윤 및 방출 거동도 조사하여 P(AA-co-GelMA) 수화젤 입자의 단백질약물의 경구투여용 전달체로서의 가능성을 평가하였다.
재료. 실험에 사용된 methacrylic anhydride(MA), acrylic acid (AA), 젤라틴(from porcine skin), 2-hydroxy-2-methylpropiophenone (Irgacure 1173), fluorescein isothiocyanate–dextran(FITC-dextran, MW 3000-5000), poly(ethylene glycol) diacrylate (PEGDA, Mn 575), 그리고 실리콘 오일은 Sigma–Aldrich(미국)로부터 구입하였다. 2-Methoxy(polyethyleneoxy) 6-9propyl heptamethyl trisiloxane과 Dulbecco’s phosphate buffered saline(DPBS)는 Gelest(미국)와 Welgene(대한민국)로부터 각각 구입하여 사용하였다.
메타크릴레이트 젤라틴(GelMA)의 합성. 메타크릴레이트 반응기가 함유된 GelMA는 이전에 보고된 방법을 따라 합성하였다.17 간략하게 정리하면, DPBS에 젤라틴을 용해하여 10%(w/v) 젤라틴 용액을 제작한 후, 제작한 20 mL의 젤라틴 용액에 4 mL의 MA를 시린지 펌프(NE-300, Just Infusion)를 사용하여 0.5 mL/min의 속도로 첨가하였다. 이 혼합물을 65 ℃에서 3시간 동안 교반하여 반응시킨 후, 추가로 과량의 DPBS를 첨가하여 반응을 완성하였다. 반응이 완료된 용액을 투석 카세트(12-14 KDa MW cut off, Spectrum Lab)에 넣고 증류수를 사용하여 일주일간 세척하였으며, 세척하는 동안 증류수를 매일 교체하였다. 세척이 완료된 용액을 50 mL 튜브에 옮기고 7일 동안 동결건조하여 얻은 최종 GelMA는 -80 ℃에서 보관하면서 향후 실험에 사용하였다. GelMA에 도입된 메타크릴레이트 반응기는 1H NMR(Unity Inova 500MHz, Varian)을 사용하여 확인하였다.
P(AA-co-GelMA) 수화젤 입자의 합성. P(AA-co-GelMA) 수화젤 입자는 라디칼 현탁중합에 의해 합성하였는데, GelMA와 AA의 중량비가 각각 0:100, 33:67, 67:33, 그리고 100:0으로 혼합한 단량체 혼합물을 제조하고, 분산안정제인 2-methoxy (polyethyleneoxy) 6-9propyl heptamethyl trisiloxane을 포함한 실리콘 오일에 앞서 제조한 단량체 혼합물과 와 광개시제인 Irgacure 1173을 첨가한 후, 자유 라디칼 반응을 방해하는 용존 산소를 제거하기 위하여 질소가스를 5분간 주입하였다. 현탁중합을 위한 단량체 입자를 생성하기 위하여 호모지나이저(T10 basic Ultra-Turrax, IKA)를 사용하였고, UV(1000 mW/cm2)를 5분간 조사하여 P(AA-co-GelMA) 수화젤 입자를 합성하였다. 합성된 수화젤 입자는 탈이온수를 사용한 세척 과정을 거쳐서 오일과 분리하였으며, 분리된 입자는 24시간 동안 동결건조시켜서 실험에 사용하였다.
P(AA-co-GelMA) 수화젤 입자의 평가. P(AA-co-GelMA) 수화젤 입자를 합성하기 위하여 사용한 반응조건들을 Table 1에 정리하였으며, 수화젤 입자의 합성조건에 따른 P(AA-co-GelMA) 수화젤 입자의 크기와 분산성은 광학현미경(Olympus BX51)과 동적 광산란을 이용한 입도분석기(Partica LA-960, Horiba)를 사용하여 평가하였다.
P(AA-co-GelMA) 수화젤 입자의 팽윤 평가. P(AA-co-GelMA) 수화젤 입자의 pH 감응성 팽윤거동을 평가하기 위하여 건조된 수화젤 입자의 중량을 측정한 후, pH 2.6에서 7.0 사이의 범위에서 제조한 완충용액에 투입하여 팽윤시키고, 24시간 경과 후 여과를 통해 입자를 완충용액으로부터 분리하여 중량을 측정하였다. 중량 팽윤비(q)는 건조 수화젤 입자의 중량에 대한 팽윤 수화젤 입자의 중량의 비로 계산하였다.
P(AA-co-GelMA) 수화젤 입자에 대한 FITC-dextran 탑재 및 방출 평가. 10 mg/mL 농도의 FITC-dextran 고농도 용액을 제조하고 용액의 흡광도를 UV-가시광선 분광 광도계(Agilent Cary 100)를 사용하여 492 nm의 파장에서 측정하였다. P(AA-co-GelMA) 수화젤 입자에 FITC-dextran을 탑재하기 위해서 수화젤 입자를 앞서 제작한 FITC-dextran 고농도 용액에 담가 24시간 방치하였고, 담지하는 동안 일정 시간 간격으로 FITC-dextran 용액의 흡광도를 측정하여 P(AA-co-GelMA) 수화젤 입자에 탑재된 FITC-dextran의 탑재율을 계산하였다. 수화젤로부터 FITC-dextran의 방출은 FITC-dextran이 탑재된 P(AA-co-GelMA) 수화젤 입자를 pH 2.6과 7.0인 20 mL의 완충용액에 각각 투입하고 시간에 따른 완충용액의 흡광도를 측정하여 방출된 FITC-dextran 계산하였다. 모든 FITC-dextran 탑재량과 방출량은 FITC-dextran 농도와 흡광도의 보정곡선으로부터 구하였다.
|
Table 1 Reaction Conditions for Polymerization of P(AA-co-GelMA) Hydrogel Particles |

P(AA-co-GelMA) 수화젤 입자의 합성과 평가. 본 연구에서는 젤라틴과 AA를 수화젤에 포함시켜 입자를 제조하면 젤라틴의 우수한 점막점착성 때문에 소장 내에서 수화젤 입자의 체류시간이 증가하여 단백질약물의 흡수율이 증가하는 한편, AA가 보유한 pH 감응성 때문에 위장과 소장의 pH에 따라서 약물이 선택적으로 방출될 것을 예상하였다. 따라서 AA와 젤라틴을 함께 포함하는 수화젤 입자를 합성하기 위해서는 젤라틴과 AA를 공중합시켜야 하였다. 그러나 천연 젤라틴은 중합 반응에 참여할 수 있는 반응기가 없기 때문에 AA와의 중합이 불가능하였다. 따라서 본 연구에서는 천연 젤라틴에 중합반응기를 도입기 위하여 젤라틴과 MA를 반응시켰고 그 결과, 메타크릴레이트 그룹이 도입된 메타크릴레이트 젤라틴(GelMA)를 합성하였으며 1H NMR 분석을 사용하여 메타크릴레이트 그룹이 젤라틴에 도입된 것을 확인하였다(데이터는 포함하지 않음). 이와 같이 제조한 GelMA를 AA와 공중합시켜서 P(AA-co-GelMA) 수화젤 입자를 합성하는 방법으로 소수성인 실리콘 오일을 분산매로 사용하여 친수성인 단량체 혼합물(GelMA와 AA)을 현탁용액으로 제조한 후, 광중합을 통해 입자를 합성하는 라디칼 현탁중합을 사용하였다. 현탁중합은 입자형 고분자를 생성할 수 있는 중합방법들 중 하나로, 낮은 분산점도, 고분자 생성물의 낮은 불순물, 용이한 열 제거 및 온도 제어, 그리고 저렴한 분리비용 등의 장점을 가지고 있다.19,20 P(AA-co-GelMA) 수화젤 입자가 형성되는 과정은, UV 조사에 의해 광개시제가 자유 라디칼을 생성해서 AA 및 GelMA의 메타크릴레이트 그룹의 이중결합을 활성화시켜서 반응을 시작하는 개시반응, 라디칼에 의해 활성화된 단량체가 중합되어지는 성장반응, 그리고 단량체의 감소에 따른 활성화된 성장사슬의 소멸에 의한 정지반응의 자유 라디칼 중합의 3 단계를 거쳐서 이루어진다. 그리고 GelMA는 중합반응에서 단량체인 동시에 가교결합을 만들어 주는 가교제 역할을 하기 때문에 GelMA가 없으면 가교구조를 가지는 수화젤을 합성할 수 없다. 따라서 본 연구에서 P(AA-co-GelMA) 수화젤 중 GelMA:AA가 0:100인 수화젤 입자를 합성하기 위해서는 GelMA가 없는 대신 가교제로 PEGDA를 사용하였다.
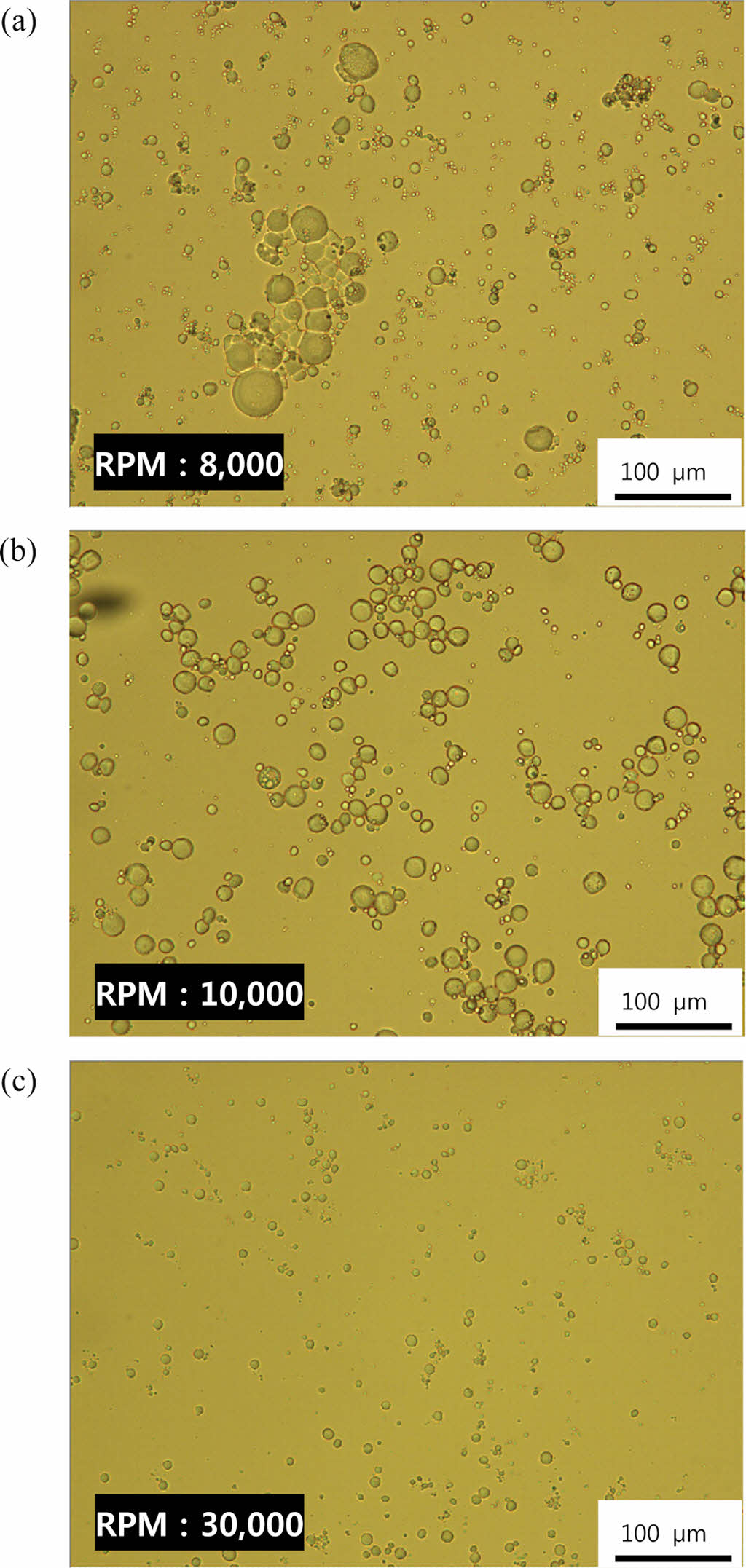
P(AA-co-GelMA) 수화젤 입자의 크기 및 분산성을 제어하기 위하여 분산안정제의 농도, 분산매(실리콘 오일)의 양, 그리고 교반속도 등 다양한 합성조건이 수화젤 입자의 크기와 분산성에 미치는 영향을 조사하였다. 분산안정제를 첨가하지 않고 중합을 하였을 경우, 수화젤 입자들 사이에 응집이 발생하는 것을 볼 수 있었다. 따라서 분산성을 향상시키기 위한 분산안정제로 2-methoxy(polyethyleneoxy) 6-9propyl heptamethyl trisiloxane을 사용하였다. Figure 1은 다양한 농도의 분산안정제를 사용하여 합성한 P(AA-co-GelMA) 수화젤 입자들을 촬영한 광학현미경 사진들이다. 분산안정제를 사용함에 따라 수화젤 입자의 응집이 전반적으로 적어지는 것을 볼 수 있었으며, 분산안정제 농도가 증가함에 따라 수화젤 입자의 크기는 증가하였다. Figure 2는 분산매인 실리콘 오일이 P(AA-co-GelMA) 수화젤 입자의 크기와 분산성에 미치는 영향을 나타낸 것인데, 실리콘 오일의 양이 증가할수록 수화젤 입자의 분산성이 향상되는 것을 볼 수 있었다. 그 이유는 분산매의 양이 증가함에 따라 수화젤 입자들이 합성되어졌을 때 분산할 수 있는 공간이 커지기 때문으로 설명할 수 있다. 그러나 실제적으로 실리콘 오일의 첨가량을 증가시키면 최종 입자를 얻기 위해 오일로부터 분리하는 세척 공정의 횟수가 증가하게 되고 세척 공정에서 손실되는 입자가 많아져서 최종 입자의 수율이 감소하였다. 교반속도가 P(AA-co-GelMA) 수화젤 입자의 크기와 분산성에 미치는 영향은 Figure 3에 나타내었다. 예상한 바와 같이 교반속도가 증가할수록 실리콘 오일 내 분산되는 단량체 방울들의 크기가 작게 되고 따라서 최종 입자의 크기가 더 작은 수화젤 입자를 합성할 수 있었다. 이러한 결과들을 정리하여 최종적으로 P(AA-co-GelMA) 수화젤 입자의 합성조건을 확립하였는데, 분산매인 실리콘 오일 30 mL, 분산안정제의 농도 5%, 그리고 교반속도 30000 rpm으로 결정하였고, 이러한 조건들을 사용하여 합성한 P(AA-co-GelMA) 수화젤 입자의 평균크기는 12.6 μm(± 1.5 μm)이었다.
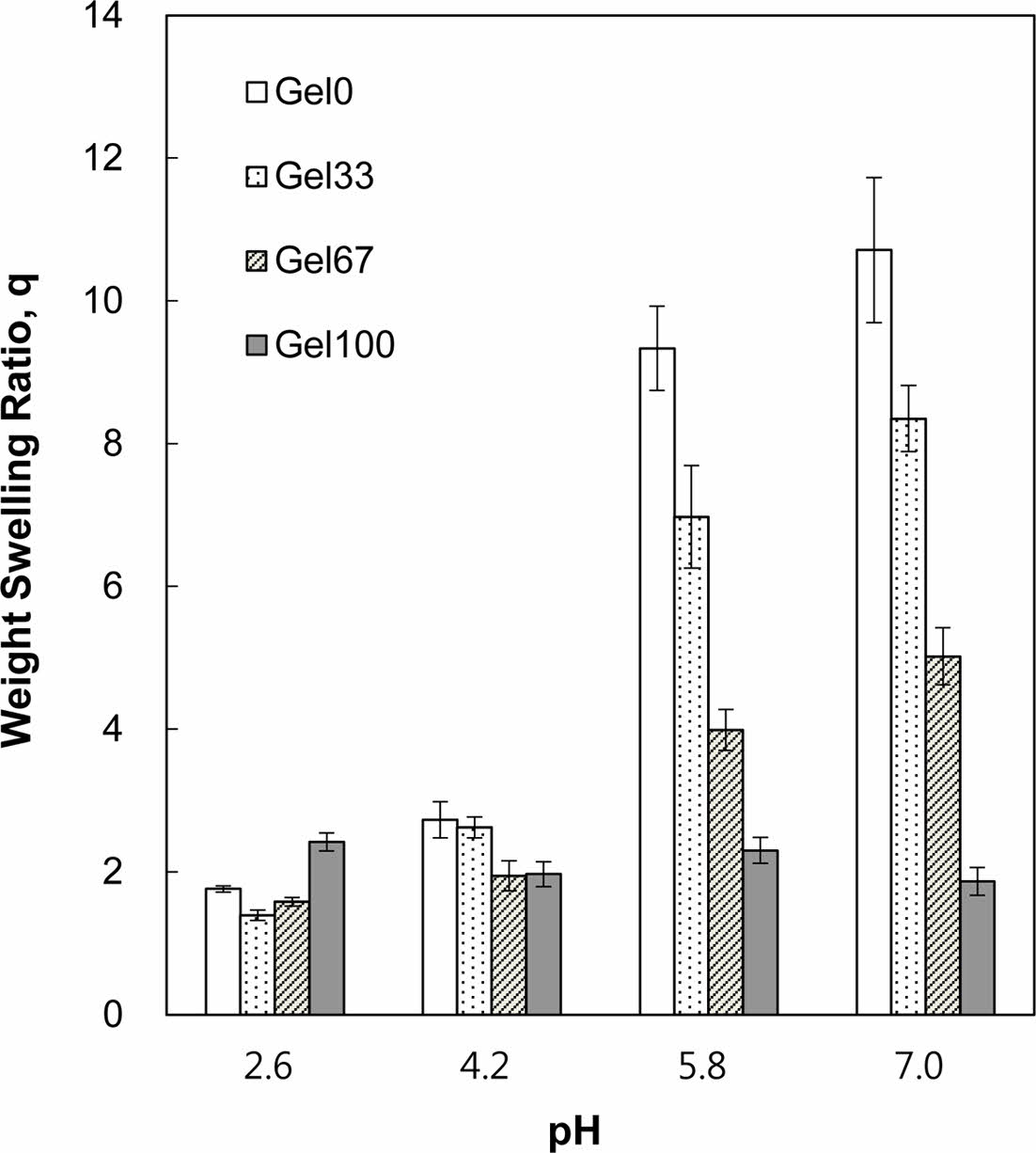
P(AA-co-GelMA) 수화젤 입자의 pH 감응성 팽윤거동. 본 연구에서 합성된 P(AA-co-GelMA) 수화젤은 음이온성으로 수화젤 외부의 pH 변화에 따라 이온화되는 그룹을 포함하고 있기 때문에, 수화젤의 pKa 보다 높은 환경에서는 이온화 그룹의 양성자가 해리되어 음이온을 띄게 되고 음이온을 가진 그룹들 사이에 정전기적 반발력이 생겨서 외부 pH 변화에 감응하는 수화젤의 팽윤거동을 보여 줄 수 있다. 여기서 pKa는 산해리상수(Ka)의 음의 로그이다. Figure 4는 pH 2.6에서 7.0 사이에서 pH 변화에 따른 P(AA-co-GelMA) 수화젤 입자의 중량 팽윤비를 나타낸 것이다. Gel100 수화젤 입자(젤라틴 100%로 구성된 수화젤)는 AA 없이 제조되었기 때문에 외부 pH 변화에 감응하는 이온화 그룹을 포함하고 있지 않아서 수화젤의 팽윤이 pH와는 관계가 없었다. 반면에 AA를 포함한 나머지 수화젤 입자들은 음이온성 수화젤의 전형적인 pH 감응성 팽윤거동, 즉 수화젤의 pKa 보다 높은 pH에서는 큰 팽윤비를, 수화젤의 pKa 보다 낮은 pH에서는 작은 팽윤비를 보여주었다. P(AA-co-GelMA) 수화젤의 pKa에 해당되는 pH는 5이므로 pH 5를 기준으로 P(AA-co-GelMA) 수화젤 입자의 중량 팽윤비가 급격히 변화하는 것을 볼 수 있었다. 즉, pH 5 미만에서는 수화젤이 거의 팽윤하지 않았으나, pH 5 이상에서는 수화젤이 많이 팽윤하였다. 이러한 이유는 수화젤의 pKa 보다 높은 pH에서는 수화젤에 존재하는 AA의 카르복실산 그룹이 이온화되어 음전하를 띄게 되고 음전하를 띤 그룹 사이에 정전기적 반발력이 발생하여 수화젤의 네트워크 구조가 크게 팽윤되기 때문으로 설명할 수 있다. 이와 같은 pH 5를 기점으로 수화젤의 구조가 크게 수축되고 팽윤되는 현상은 본 수화젤을 단백질약물의 경구투여용 전달체로 사용하는 데 매우 중요한 것이다. 왜냐하면 인체 위장의 pH는 약 2이고 소장의 pH는 6 또는 7이기 때문에 P(AA-co-GelMA) 수화젤 입자 내부에 단백질약물을 탑재하면 위장에서는 약물이 수화젤의 수축된 구조 때문에 방출되지 않아서 보호될 수 있으며, 수화젤 입자가 소장에 도달하면 수화젤이 팽윤하기 시작하여 내부에 탑재된 약물이 방출되어 소장벽을 통해 흡수될 수 있기 때문이다. 한편 P(AA-co-GelMA) 수화젤 내 AA의 조성이 증가함에 따라 pH 5보다 높은 pH에서의 팽윤비가 증가하는 것을 볼 수 있는데, 이는 P(AA-co-GelMA) 수화젤의 AA 함량이 증가함에 따라서 pKa 보다 높은 pH에서 이온화되어 음전하를 띌 수 있는 그룹이 많아지는 것으로 설명할 수 있다.
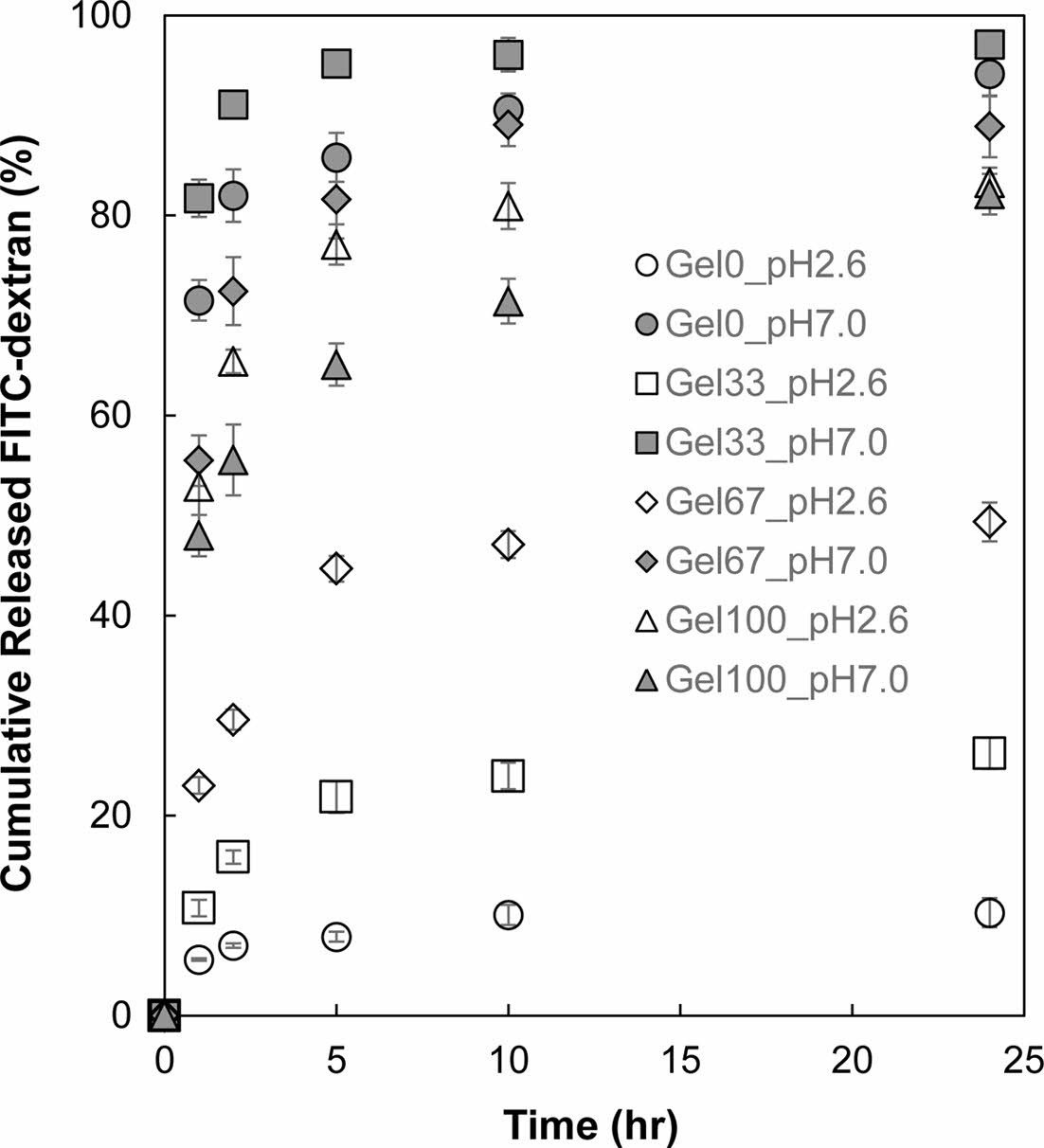
P(AA-co-GelMA) 수화젤 입자의 pH 감응성 방출거동. P(AA-co-GelMA) 수화젤 입자로부터 약물의 pH 감응성 방출거동을 조사하기 위해 모델물질로 FITC-dextran를 선정하여 수화젤 입자에 탑재하였다. 수화젤 입자에 탑재된 FITC-dextran이 수화젤에 내부에서 외부로 방출되는 정도는 수화젤의 팽윤 정도와 밀접한 관계가 있다. FITC-dextran이 탑재된 P(AA-co-GelMA) 수화젤 입자를 pH 2.6 및 pH 7.0 완충용액에 넣고 시간이 경과함에 따라 P(AA-co-GelMA) 수화젤 입자에서 방출된 FITC-dextran의 누적 방출량을 측정하여 Figure 5에 나타내었다. AA가 포함되는 않은 Gel100을 제외한 P(AA-co-GelMA) 수화젤 입자들은 pH 차이에 따른 방출거동을 보여주었다. pH 2.6에서는 미량의 FITC-dextran이 수화젤 입자로부터 방출된 반면, pH 7.0에서는 상대적으로 많은 양의 FITC-dextran이 수화젤 입자로부터 방출되었다. 이러한 이유는 앞서 팽윤거동에서 설명한 바와 같이, 젤라틴 100%로 구성된 수화제인 Gel100 수화젤의 경우 외부 pH에 감응할 수 있는 AA 그룹이 없으므로 pH에 따른 방출거동이 나타나지 않은 반면, AA를 포함한 P(AA-co-GelMA) 수화젤 입자들은 pH 변화에 따라 AA 그룹이 이온화되면서 pH 감응성 방출거동을 보여준 것이다. pH 2.6과 7.0에서 P(AA-co-GelMA) 수화젤 입자로부터 방출되는 FITC-dextran의 pH에 따른 차이를 정량화하기 위해서 24시간 동안 pH 7.0에서 방출된 FITC-dextran의 누적 방출량과 pH 2.6에서의 누적 방출량을 비교하여 Table 2에 정리하였다. P(AA-co-GelMA) 수화젤의 AA 함량이 증가함에 따라서 pH 7.0과 2.6 사이에서 방출된 FITC-dextran 차이가 증가하는 것을 볼 수 있는데, 이러한 pH 감응성 방출거동은 앞서 언급한 P(AA-co-GelMA) 수화젤의 pH 감응성 팽윤거동과 연관된 것으로, AA를 많이 함유한 P(AA-co-GelMA) 수화젤 입자일수록 pH 7.0에서 음이온을 띌 수 있는 AA가 많아서 더 많이 팽윤할 수 있고 따라서 더 많은 FITC-dextran이 수화젤로부터 방출되는 것이다. 이러한 P(AA-co-GelMA) 수화젤 입자의 pH 감응성 방출거동은 인체의 위장과 소장 사이의 pH 차이를 이용한 단백질약물의 경구 투여용 전달체를 구현하는데 있어서 유용하게 사용될 수 있다.

|
Figure 1 Optical microscope images of P(AA-co-GelMA) hydrogel particles synthesized using various concentrations of the stabilizer: (a) stabilizer 3%; (b) stabilizer 5%; (c) stabilizer 7%. |

|
Figure 2 Optical microscope images of P(AA-co-GelMA) hydrogel particles synthesized using various amount of continuous medium (silicone oil): (a) silicone oil 15 mL; (b) silicone oil 30 mL; (c) silicone oil 60 mL. |
|
Figure 3 Optical microscope images of P(AA-co-GelMA) hydrogel particles synthesized using various stirring speed (rpm): (a) 8000 rpm; (b) 10000 rpm; (c) 30000 rpm. |
|
Figure 4 Weight swelling ratio of P(AA-co-GelMA) hydrogel particles as a function of pH having various AA and GelMA compositions. |
|
Figure 5 Cumulative amount of FITC-dextran released from P(AAco-GelMA) hydrogel particles in pH 2.6 and pH 7.0 buffer solutions as a function of time. |
|
Table 2 Ratio of Average Cumulative Amount of FITC-Dextran Released from P(AA-co-GelMA) Hydrogel Particles at pH 7.0 (MR7.0) and at pH 2.6 (MR2.6) for 24 Hours |

메타크릴레이트 그룹을 도입한 젤라틴(GelMA)과 AA를 라디칼 현탁중합을 이용하여 다양한 AA와 젤라틴 조성을 갖는 P(AA-co-GelMA) 수화젤 입자를 합성하였다. 중합에 사용되는 안정제의 농도, 분산매의 양, 그리고 교반속도가 생성되는 입자의 크기 및 분산성에 미치는 영향을 조사하여, 최종적인 합성조건은 안정제 농도 5%, 분산매의 양 30 mL, 그리고 교반속도 30000 rpm으로 확립하였으며, 이러한 조건을 사용하여 평균 크기 12.6 μm에 분산성이 우수한 P(AA-co-GelMA) 수화젤 입자를 제조할 수 있었다. 합성한 P(AA-co-GelMA) 수화젤 입자는 pH 5를 기준으로 급격한 팽윤비의 변화를 보여주었고, AA를 함유하지 않은 수화젤은 pH 감응성을 보여주지 않았지만, AA를 함유하는 경우에는 AA의 조성이 증가함에 따라 pH 5보다 높은 pH에서 팽윤비가 증가하는 것을 볼 수 있었다. 이러한 P(AA-co-GelMA) 수화젤 입자의 pH 감응성 팽윤거동은 수화젤 내부에 탑재된 물질의 방출에도 영향을 미쳐서, 수화젤 입자에 탑재된 FITC-dextran이 낮은 pH(pH 2.6)에서는 소량 방출된 반면, 높은 pH(pH 7.0)에서는 다량이 방출되는 pH 감응성 방출거동을 보여주었으며, pH 7.0과 2.6에서의 방출량 차이가 수화젤에 포함된 AA가 증가함에 따라서 함께 증가하였다. 이러한 결과들을 고려할 때, 본 연구에서 합성한 P(AA-co-GelMA) 수화젤 입자는 단백질약물을 소장에서는 방출하는 경구투여용 약물전달체로 활용할 수 있음을 알 수 있었다.
- 1. Zhang, Y.; Yang, Z.; Hu, X.; Zhang, L.; Li, F.; Li, M.; Tang, X.; Xiao, W. Development and Evaluation of Mucoadhesive Nanoparticles Based on Thiolated Eudragit for Oral Delivery of Protein Drugs. J. Nanopart. Res. 2015, 17, 98.
-

- 2. Ensign, L. M.; Cone, R.; Hanes, J. Oral Drug Delivery with Polymeric Nanoparticles: The Gastrointestinal Mucus Barriers. Adv. Drug Deliv. Rev. 2012, 64, 557-570.
-

- 3. Yang, J.; Cho, G.; Lee, T.-G.; Kim, B. pH-Responsive Hydrogel Microparticles as Intelligent Delivery Carriers for α-MSH Antagonists. AICHE J. 2011, 57, 1919-1925.
-

- 4. Mansuri, S.; Kesharwani, P.; Jain, K.; Tekade, R. K.; Jain, N. K. Mucoadhesion: A Promising Approach in Drug Delivery System. React. Funct. Polym. 2016, 100, 151-172.
-

- 5. Aduba Jr., D. C.; Hammer, J. A.; Yuan, Q.; Yeudall, W. A.; Bowlin, G. L.; Yang, H. Semi-interpenetrating Network (sIPN) Gelatin Nanofiber Scaffolds for Oral Mucosal Drug Delivery. Acta Biomater. 2013, 9, 6576-6584.
-

- 6. Peppas, N. A.; Bures, P.; Leobandung, W.; Ichikawa, H. Hydrogels in Pharmaceutical Formulations. Eur. J. Pharm. Biopharm. 2000, 50, 27-46.
-

- 7. Rosales, A. M.; Anseth, K. S. The Design of Reversible Hydrogels to Capture Extracellular Matrix Dynamics. Nat. Rev. Mater. 2016, 1, 15012.
-

- 8. Langer, R.; Peppas, N. A. Advances in Biomaterials, Drug Delivery, and Bionanotechnology. AICHE J. 2003, 49, 2990-3006.
-

- 9. Lee, S. C.; Kwon, I. K.; Park, K. Hydrogels for Delivery of Bioactive Agents: A Historical Perspective. Adv. Drug Deliv. Rev. 2013, 65, 17-20.
-

- 10. Kim, Y.-H.; Chung, M.; Kim, B. Effect of Polymerization Conditions on the Size Change of Poly(ethylene glycol) Hydrogel Nanoparticles. Korea-Aust. Rheol. J. 2014, 26, 401-404.
-

- 11. Saunders, J. R.; Moussa, W. Dynamic Mechanical Properties and Swelling of UV-photopolymerized Anionic Hydrogels. J. Polym. Sci. Pt. B-Polym. Phys. 2012, 50, 1198-1208.
-

- 12. Lee, E.; Kim, B. Preparation and Characterization of pH-sensitive Hydrogel Microparticles as a Biological on–off Switch. Polym. Bull. 2011, 67, 67-76.
-

- 13. Kim, B.; Lim, S. H.; Ryoo, W. Preparation and Characterization of pH-sensitive Anionic Hydrogel Microparticles for Oral Protein-delivery Applications, J. Biomater. Sci.-Polym. Ed. 2009, 20, 427-436.
-

- 14. Ofokansi, K. C.; Adikwu, M. U.; Okore, V. C. Preparation and Evaluation of Mucin-Gelatin Mucoadhesive Microspheres for Rectal Delivery of Ceftriaxone Sodium. Drug Dev. Ind. Pharm. 2007, 33, 691-700.
-

- 15. Rohrer, J.; Partenhauser, A.; Zupancic, O.; Leonaviciute, G.; Podricnik, S.; Bernkop-Schnurch, A. Thiolated Gelatin Films: Renaissance of Gelatin as Sustained Intraoral Dosage Form. Eur. Polym. J. 2017, 87, 48-59.
-

- 16. Shin, H.; Olsen, B. D.; Khademhosseini, A. The Mechanical Properties and Cytotoxicity of Cell-laden Double-network Hydrogels Based on Photocrosslinkable Gelatin and Gellan Gum Biomacromolecules. Biomaterials 2012, 33, 3143-3152.
-

- 17. Van Den Bulcke, A. I.; Bogdanov, B.; De Rooze, N.; Schacht, E. H.; Cornelissen M.; Berghmans, H. Structural and Rheological Properties of Methacrylamide Modified Gelatin Hydrogels. Biomacromolecules 2000, 1, 31-38.
-

- 18. Wang, J.; Tabata, Y.; Bi, D.; Morimoto, K. Evaluation of Gastric Mucoadhesive Properties of Aminated Gelatin Microspheres. J. Control. Release 2001, 73, 223-231.
-

- 19. Dowding, P. J.; Vincent, B. Suspension Polymerisation to Form Polymer Beads. Colloid Sur. A-Physicochem. Eng. Asp. 2000, 161, 259-269.
-

- 20. Brooks, B. W. Suspension Polymerization Processes. Chem. Eng. Technol. 2010, 33, 1737-1744.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2022 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2024; 48(4): 419-425
Published online Jul 25, 2024
- 10.7317/pk.2024.48.4.419
- Received on Apr 12, 2024
- Revised on Apr 15, 2024
- Accepted on Apr 18, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Bumsang Kim
-
Department of Chemical Engineering, Hongik University, Wausanro 94, Mapo-gu, Seoul 04066, Korea
- E-mail: bskim@hongik.ac.kr
- ORCID:
0000-0001-7519-168X










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.