- Fabrication and Characterization of 3D Printed PGA Scaffolds Immobilized with BMP-2 for Bone Tissue Engineering
Jiyoung Lee# , Yunjeh Ko# , Ho Yun Chung*, and Oh Hyeong Kwon†

Department of Polymer Science and Engineering, Kumoh National Institute of Technology, Gumi, Gyeongbuk 39177, Korea
*Department of Plastic and Reconstructive Surgery, CMRI, Kyungpook National University School of Medicine, Daegu 41944, Korea- 골조직공학을 위한 BMP-2로 고정화된 3D 프린팅 PGA 지지체의 제조 및 특성평가
국립금오공과대학교 고분자공학과, *경북대학교 의과대학 성형외과, 세포기질연구소
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
This study focused on immobilizing bone morphogenetic protein-2 (BMP-2) onto a 3D-printed poly(glycolic acid) (PGA) scaffold to develop a biodegradable scaffold for continuous bone formation stimulation in bone tissue engineering. BMP-2 immobilization was achieved using the UV irradiation method and confirmed through ATR-FTIR and XPS analyses. The scaffold's structure, hydrolytic degradation behavior, and in vitro cell viability were analyzed. Furthermore, the BMP-2 release behavior and calcification performance of the scaffold were evaluated for osteogenic tissue engineering applications. Results from in vivo animal model experiments and histological analyses demonstrated that the BMP-2 immobilized PGA scaffold exhibited superior bone tissue regeneration ability compared to the control group. And, It suggests potential as a scaffold in bone tissue engineering.
본 연구에서는 골형성 촉진인자의 고정화를 통하여 지속적인 자극이 가능한 생분해성 골조직공학용 지지체를 개발하고자 3D 프린팅된 폴리글리콜산(PGA) 지지체에 bone morphogenetic protein-2(BMP-2)를 고정하여 성능을 검증하였다. BMP-2 고정화는 UV 조사법을 이용하였으며, 개질여부는 ATR-FTIR 및 XPS를 통해 확인하였다. 지지체의 구조, 가수분해 거동, in vitro 세포생존율을 분석하였으며, 골형성 조직공학용 지지체로서 BMP-2 방출거동, calcification 성능을 평가하였다. In vivo 동물모델실험 및 조직학적 평가결과에서 BMP-2가 고정된 PGA 지지체는 대조군에 비하여 우수한 골조직 재생능을 보여주었으며, 골조직공학용 지지체로서의 활용이 기대된다.
The 3D printed poly(glycolic acid) scaffold immobilized with BMP-2 has promoted the calcification of MC3T3-E1 cells. Results from in vivo animal model experiments and histological analyses have shown superior bone tissue regeneration ability compared to the control groups, attributed to continuous stimulation of bone regeneration.
Keywords: poly(glycolic acid), scaffold, bone morphogenetic protein-2, 3D printing, bone tissue engineering.
이 연구는 금오공과대학교 학술연구비에 의하여 지원된 논문임(202002220001).
저자들은 이해상충이 없음을 선언합니다.
PGA 지지체의 순차적인 표면개질 단계에서의 XPS spectra 및 고정화된 BMP-2의 백분율 정량에 대한 정보는 다음 사이트에서 얻을 수 있습니다(http:// journal.polymer-korea.or.kr).
PK_2024_048_04_426_Supporting_Information.pdf (260 kb)
Supplementary Information
현대사회는 의학, 약학, 생명과학의 비약적인 발전으로 인간 수명이 늘어나면서, 노인 인구의 증가로 인한 심각한 문제들이 발생하고 있다. 인구의 고령화와 더불어 인간 수명의 증가는 삶의 질에 대한 관심을 증가시키는 추세를 가속화하고 있다. 특히 골, 연골과 같은 경조직의 노화 또는 손상으로 인한 이동성의 제약은 다른 요인에 비해 가장 심각한 삶의 질 저하를 유발하는 요인으로 작용하고 있으며, 손상된 골조직의 대체 및 재생 촉진이 가능한 생체재료 개발이 지속적으로 수행되고 있다.1-4 뼈는 유·무기 복합체로 구성되어 있는 단단하면서도 유연성을 나타내는 신체조직의 한 종류다. 특히 우리 몸에 있어, 골격 형성 외에도 신체의 주요 장기 보호, 지탱, 대사활동을 통한 무기질의 저장소 역할 및 신생 혈액을 공급해주는 등 여러 가지 기능을 한다.5 우리 몸은 성인 기준 206개의 뼈로 이루어져 있으며 그것을 연결하는 연골(cartilage), 관절(joint articulation), 인대(ligament), 결합 및 조혈 조직(connective and hematopoietic tissue)으로 구성되어 골격을 형성하고 있다. 또한 뼈의 내부 구조는 90% 이상의 콜라겐 무기질과 골세포로 구성되어 있다. 골 조직이 손상을 입으면 골격의 발생과 성장의 재현으로 세포와 성장인자 그리고 세포외기질의 복잡한 상호작용으로 인한 회복이 이루어진다. 골조직은 인체 내에서 발생하는 다양한 대사 작용에 관여하는 매우 복잡한 조직이며 골조직 재생에 관한 연구는 다른 생체조직들에 비해 미진한 상황이다.
손상된 골 조직 대체 및 재생을 촉진하기 위한 방법으로는 다양한 형태의 재료를 이식하는 방법이 있다. 이식되는 재료는 생체적합성이 우수하여야 하며, 독성, 발암성, 알러지, 염증 및 이물반응 등을 유발시키지 않아야 한다.5 골 이식재로 사용되는 재료로는 자가골(autograft), 동종골(allograft), 이종골(xenograft), 합성골(alloplastic material)로 분류할 수 있다. 자가골 이식은 환자의 한 부위로부터 다른 부위로 골을 이식하는 방법으로 골 재생능과 면역학적 반응 면에서 가장 안정적인 방법이기 때문에 다른 이식재와 비교했을 때, 뼈의 생성이 가장 활발히 일어날 수 있는 환경을 만들어 줄 수 있다. 하지만 자가골을 채취하는 과정에서 추가적인 2차 수술이 필요하다는 부담과 공급량이 제한적이라는 문제점이 발생된다. 위의 제한점을 해결하기 위해 사후 기증자의 인체조직 또는 다른 생존자 기증 인체 조직을 공신력이 있는 조직 은행에서 획득하여 이식하는 동종골과, 동물조직을 이식하는 이종골 이식방법이 도입되었으나, 흡수속도가 느리며 면역거부반응 유발과 감염 등이 문제로 발생되었다. 반면 금속재료, 세라믹, 고분자 재료 등을 이식하는 합성골 이식은 다양한 형태와 성분으로 재료의 제조가 가능하고, 대량생산이 가능하며 경제적인 측면에서도 장점을 가지기 때문에 현재 합성골 이식재를 이용한 이식법이 널리 연구되고 있는 추세이다. 금속재료는 1829년 H. Levert 박사가 금속재료를 골 이식용 재료로 이용한 연구를 계기로 생체재료로 활용되기 시작했다.5 골 재생 치료법의 개발 초기에는 주로 금속 재료를 이용한 골 대체 기술이 이루어 졌지만, 부식, 독성 등의 단점이 발생되었기 때문에 생체 적합성이 우수한 ceramic 소재에 관한 연구가 진행되었다. 세라믹 재료는 비금속 무기질 재료로서 다양한 조성을 가지며, 기계적 특성과 생물학적 특성이 매우 우수하기 때문에 골 이식재로 널리 활용되고 있다. 기존에는 골조직의 화학적 특성과 가장 유사한 수산화인회석에 관한 연구가 주로 이루어 졌지만 생분해성의 중요성이 대두되면서 생분해성이 높은 β-tricalcium phosphate(β-TCP)를 혼합한 세라믹 골지지체에 대한 연구가 활발히 진행되고 있다.6-14 이온결합과 공유결합으로 이루어진 세라믹 재료는 기계적 강도가 높지만 이온결합이 갖는 특성인 취성(brittless)이 매우 높아 충격에 약하기 때문에 세라믹 재료만을 사용하면 하중을 받는 부위에 골대체제로 적용하기 어렵다는 단점을 가진다. 고분자는 공유결합으로 연결된 긴 사슬로 이루어진 유기화합물로, 최종 제품으로 응용성 및 활용성 측면을 고려할 때 구성성분이 다양하고 물리화학적 개질이 용이하여 여러 가지 기능을 도입할 수 있고, 가격이 저렴하기 때문에 의료용 생체재료로 널리 활용되고 있는 소재이다. 특히 생체 내 또는 자연 환경 하에서 스스로 분해되는 생분해성 고분자는 의료용을 목적으로 널리 사용되고 있다. 생체재료로 활용되는 고분자는 크게 천연고분자와 합성고분자로 나눌 수 있다. 천연고분자는 식물, 동물, 또는 인간으로부터 유래되는 고분자로서 매우 우수한 생체적합성을 가지고 있다. 따라서 천연 고분자로 제작된 재료는 생체에 이식 후 염증 반응이 적을 뿐만 아니라 뛰어난 생체 기능성과 생분해성 등을 제공할 수 있어 이상적인 이식재로 평가받고 있다.15-18 이식재로 사용되는 천연고분자의 예로는 chitosan, alginate, collagen, fibrin, hyaluronic acid 등이 있으며 높은 bioactivity을 가지기 때문에 생체재료로 널리 활용되고 있다. 대표적인 생분해성 합성고분자는 크게 lactic acid(LA), glycolic acid(GA), e-caprolactone(CL)의 단량체를 가진 고분자로 나눌 수 있으며 poly(glycolic aid) (PGA), poly(lactic acid) (PLA), poly(DL-lactic acid) (PDLA), poly(ε-caprolactone) (PCL)등이 그 예에 해당 된다. 위 재료 중 PGA는 주사슬에 존재하는 에스테르 결합 때문에 가수분해를 통한 생분해가 진행 된다. 몸속에서 랜덤하게 가수 분해된 PGA 부산물은 무독성이며, 물과 이산화탄소로 배설되고 일부는 소변으로 배설된다. PGA 고분자는 약 6-8주 기간 내에 유기체에 의해 완전히 재흡수된다. PGA는 결정의 분자사슬로써 평면 지그재그의 형태를 갖는데 그 밀도가 1.605 g/cm3으로 고강도 고탄성률을 나타낸다. 또한 높은 결정성을 가지기 때문에 뼈 주위의 형태를 유지 및 하중을 견딜 수 있는 강도를 가진다.9 PGA 고분자는 두개골 및 골절 시 고정용 재료로써 높은 장점을 갖기 때문에 너무 강한 기계적 특성을 갖는 금속재료가 성인 혹은 성장기 어린이에게 시술시 변형을 일으킬 수 있는 단점을 보완할 수 있다. PGA는 높은 결정성을 가지기 때문에 뼈 주위의 형태를 유지 및 하중을 견딜 수 있는 강도를 가진다.
생물학적 반응을 향상시키는 대표적인 표면처리 기법으로는 재료 위에 생리 활성 물질인 성장인자를 적용하는 방법이 있다. 성장인자의 종류로는 섬유아세포 성장 인자(fibroblast growth factor), 상피 세포 성장 인자(epidermal growth factor), 혈소판 유도 성장인자(platelet-derived growth factor), 인슐린 유사 성장 인자(insulin-like growth factor), 골 형성 단백질(bone morphogenetic protein, BMP)등 다양한 종류가 존재 한다. 특히 BMP는 골과 연골의 형성과 재생을 유도하는 조절인자인 transforming growth factor-β(TGF-β) superfamily에 속하는 복합기능의 성장인자이다.19-23 BMP는 동질 또는 이질의 두 개의 peptide chain이 7개의 disulfide bond로 dimer를 형성하고 있으며, 이러한 dimerization이 골 유도에 필수적인 역할을 하는 것으로 밝혀졌다. BMP는 중간엽 줄기세포로부터 골모세포로의 분화와 증식을 촉진하고 골기질의 생합성을 도와 골 형성을 증진시키는 역할을 하며, 조골세포를 자극하여 alkaline phosphatase(ALP) 활성도를 증가시키고 콜라겐 합성을 작용하는 가장 두드러지는 골 유도능을 가지는 성장인자이다. 현재 많은 연구를 통해 20종류 이상의 BMP가 발견되었지만, BMP-2는 가장 높은 골유도성을 지님과 동시에 재혈관화(re-vascularization)에도 영향을 미친다고 보고된다. Tsuji et al.의 연구에 따르면 BMP-2를 제외한 골재생을 진행시킨 마우스는, 손상된 골절의 완전한 회복을 보이지 않음을 관찰함으로서, 다른 종류의 BMP가 BMP-2의 부족을 보완할 수 있었지만 BMP-2의 골 재생 기능을 대체할 수는 없었다.22 이는 BMP-2는 골절재생에 필수적인 성장인자임을 나타낸다. 그러나 BMP-2를 재료에 적용함에 있어서 여러 가지 제한점을 가진다. BMP-2와 같은 성장인자는 복잡한 구조, 짧은 반감기, 환자의 치료부위로부터의 빠른 소멸 및 분해 등의 문제점(성장인자 burst release)으로 효과가 감소된다는 단점을 가지기 때문이다. 성장인자들을 응용하기 위해서는 성장인자들의 안정성을 유지해야 하며, 이를 위한 연구가 활발히 진행되고 있다.23-51 성장인자의 안정성을 향상시키기 위한 방법에는 물리적 흡착법, 화학적 고정법 그리고 광 고정법이 그 예이다. 흡착법은 가장 쉽게 널리 사용되고 있는 방법으로서 단백질과 지지체 표면의 특성을 이용하여 물리적으로 흡착 또는 약한 이온결합을 통해 고정화하는 방법을 말한다. 이 방법은 성장인자의 conformation의 변화나 활성부위의 파괴 등이 심하게 일어나지 않기 때문에 흡착도중 효소의 실활이 상대적으로 적다는 장점을 가진다. 하지만 가역반응이기 때문에 흡착시킨 성장인자가 반응도중 쉽게 탈착될 수 있다는 단점을 가진다. 화학적 고정화 방법은 관능기가 있는 지지체 표면에 성장인자의 관능기 즉, 아미노기, 카복실기, 티올기 및 방향족 하이드록실기 등과의 공유결합을 이용하여 고정화시키는 방법을 말한다. 일반적으로 지지체를 활성화시켜 반응성이 높은 관능기로 만든 후에 성장인자를 온화한 수용액 조건에서 반응시켜 공유결합을 진행한다. 위 방법은 다양한 종류의 지지체를 수식 후 사용가능하며, 안정된 결합을 할 수 있기 때문에 오랜 기간 연구되었다. 하지만 화학적 고정법은 생체 내에서 분해되는 과정에서 알데히드, 우레아 등의 세포에 독성을 나타낼 수 있는 물질이 생성된다는 문제점이 제기되어 왔다. 이러한 기존의 고정화 방법들의 단점을 극복하기 위한 방법으로 최근 광고정화 기술이 각광받고 있다. 광고정화 기술은 광 조사에 의해 발생한 라디칼들의 가교반응을 이용하며 특별한 가교제 및 작용기를 필요로 하지 않고 오직 빛에 의한 라디칼 반응만이 일어나기 때문에 이전의 고정화 방법들과는 다른 차이를 가진다.24,46 따라서 이러한 광고정화 기술을 응용하여 성장인자를 고정시킨다면 치료부위의 높은 안정성, 지속적 효과 및 낮은 부작용 등의 장점을 가지고 이용할 수 있을 것이다. 가정의 식탁에서 자주 볼 수 있는 친숙한 어패류 중 하나인 홍합은 바다에서 바위, 수초, 이끼 등 다양한 표면에 부착하여 서식하는 것으로 알려져 있다. 홍합의 접착은 단백질로 만들어진 족사라는 가느다란 섬유실에 의해 매개된다고 알려져 있다. 족사는 가늘고 긴 섬유 끝에 납작한 패드가 달려있고, 이 패드 부분이 다양한 표면에 부착하는 역할을 하게 된다. 홍합의 메커니즘을 밝히기 위하여 족사 단백질의 종류 및 그 아미노산 서열이 오랫동안 연구되어 왔고, 그 결과 족사는 12 종류 이상의 단백질로 구성되어 있으며 구성된 단백질의 아미노산 서열상의 특징은 3,4-dihydroxyphenyl-L-alanine(DOPA), 라이신이라는 변형된 아미노산이 풍부하다는 것이 밝혀졌다. 홍합의 접착능에 DOPA와 라이신이 중요한 역할을 한다는 것에 착안하여, DOPA의 중요 작용기인 카테콜기와 라이신의 아민기를 동시에 가지는 카테콜아민류가 연구되고 있다.25-50 대표적인 카테콜 아민기로는 도파민을 들 수 있는데 카테콜과 아민 작용기를 가지는 도파민이 바다 속 환경과 동일한 염기성 pH 8.5의 수용액 상에서 다양한 표면에 코팅된다는 것이 발견되었다. 코팅하고자 하는 표면을 수용액에 담글 경우, 도파민이 수용액 상에서 산화반응을 통해 중합되어 폴리도파민을 형성하고 이는 비특이적 표면개질법에 의해 표면에 간단히 코팅된다. 이런 도파민 코팅은 소수성 표면을 간단히 친수성으로 개질할 수 있기 때문에 주요 기술로 주목을 받아 왔다. 뿐만 아니라 표면에 코팅된 폴리도파민은 아민이나 티올 작용기와 공유결합을 형성할 수 있기 때문에 표면코팅 후 2차 표면개질이 가능하다.
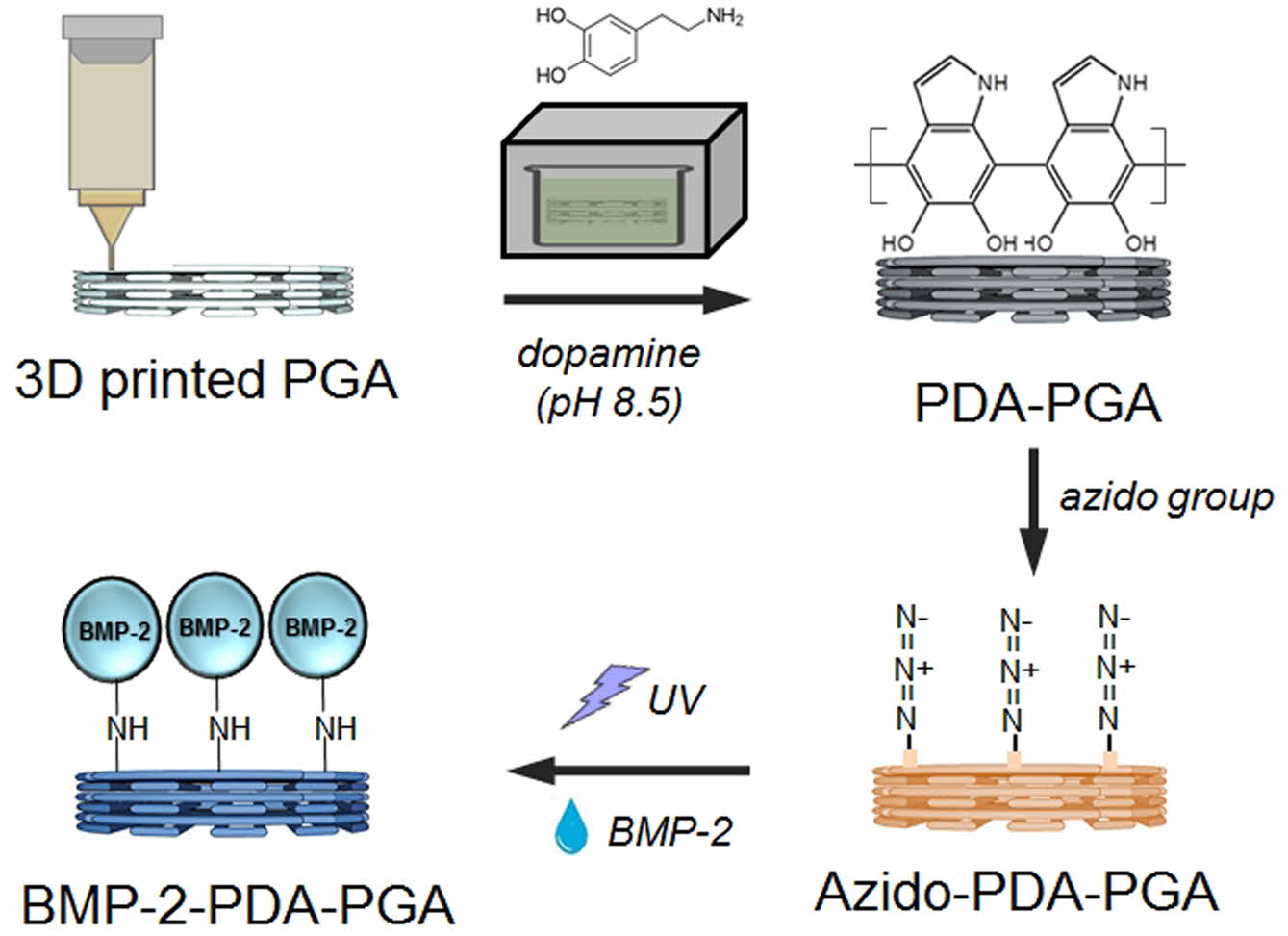
조직공학은 손상된 조직의 대체 및 재생을 목표로 하는 학문이며, 특히 조직공학에서 가장 주목 받고 있는 분야는, 세포배양의 효율과 성능을 높여 조직과 유사한 장기를 구현 가능할 수 있도록 하는 조직공학용 지지체(scaffold)의 제작이다. 3D 프린팅 기술을 조직공학용 지지체 제작에 활용할 경우 다양한 생체 재료의 이용으로 세포활성을 높일 수 있기 때문에 micro-environment 조절이 가능이 가능하여 관련 연구가 활발히 이루어지고 있는 추세이다.28-30 본 연구에서는 골조직공학적 응용을 위해 BMP-2가 고정화된 3D PGA 지지체를 제조하였다. 생체 적합성 3D PGA 지지체 제조를 위하여 3D 프린팅 기술을 이용하였다. 3D 프린팅 기술은 무작위로 결손이 일어난 골 조직에 맞춤형 3D 지지체 제작을 가능하게 하였다. 소수성을 가지는 PGA 지지체는 dopamine 코팅을 통해 친수성 도입 및 아민기와 공유결합을 형성하여 2차 표면개질이 가능한 광 가교 site를 부여하였다. 골 재생을 향상시키기 위하여, 골형성 촉진인자인 BMP-2를 UV 조사법을 이용하여 고정시켰다. 위 고정법을 이용하여 BMP-2가 burst release 없이 오랜 기간 지지체 표면에 고정되어 지속적인 골세포 자극을 통하여 골형성을 유도하는 것을 목표로 하였다. 제조된 후 in vitro 실험을 통해 지지체의 독성여부 및 osteoblast의 분화능을 평가함으로써 제작된 지지체의 골조직공학적 응용 가능성을 판단하였다.
3D 프린팅 기술을 이용한 PGA 지지체의 제조. 폴리글리콜산(poly(glycolic acid), PGA, pellets, Mw 80000, Meta Biomed Co., Ltd., Korea) 지지체는 3D 프린터(SHOTMASTER 200DS, Musashi Engineering, Inc., Japan)를 이용하여 제작하였다(Figure 1). 3D 프린터는 3 축 x-y-z 이동 스테이지, 디스펜서, 노즐, 온도 제어기 및 압력조절기 부분으로 구성하였다. 지지체는 3D 디자인 프로그램(MuCAD®V, Musashi Engineering, Inc., Japan)을 이용하여 높이 1 mm, 지름 8 mm, pore length 400 μm 그리고 strand 직경 200 μm 치수를 가지는 입체 격자 형태의 원판 모형으로 디자인하였다.
지지체의 제작방법으로는 3D 프린터와 연결되어 있는 시린지에 PGA 10 g을 투입 후, 240 ℃까지 온도를 가하여 재료를 용융하고 0.03 MPa의 공기압을 통하여 토출하며 앞서 디자인된 지지체 치수에 따라 변수를 최적화하여 조형하였다. 제조된 PGA 지지체와 디자인 간의 일치성을 확인하기 위하여 scanning electron microscope(SEM, JSM-6380, JEOL Ltd., Japan)를 이용하여 구조를 촬영한 후 image analysis program (i-SOLUTION, iMTechnology, Canada)으로 분석을 진행하였다.
폴리도파민이 코팅된 PGA 지지체 제조(PDA-PGA). 고결정성 고분자인 PGA를 이용하여 제작된 지지체는 표면의 반응기가 적고 소수성이 높아 표면 젖음성이 낮다. 이와 같은 이유로, 본 연구에서는 폴리도파민(dopamine hydrochloride, Mw 189.64, white powder, Trizma®base, Sigma-Aldrich, USA) 코팅을 이용하여 표면 젖음성을 증가시켰다. 코팅된 폴리도파민의 카테콜기는 재료의 젖음성을 증가시킬 뿐만 아니라 마이클첨가반응에 의한 공유결합을 형성시켜 아민작용기를 가지는 azido기의 2차 표면개질 작용기로 도입되었다. 실험방법으로는 먼저, PGA 지지체가 도파민 수용액에 잘 침지될 수 있도록 99% 에탄올 용액에 60초, 정제수에 3분간 넣어 용매교환을 실시하였다. 그 다음으로 바다 속 환경과 동일한 염기성 pH 8.5를 가지는 10 mM Tris-HCl buffer 용액을 이용하여 2 mg/mL 농도의 도파민 용액을 제조하고, PGA 지지체를 침지 후, 암실환경을 유지해 주며 48시간 동안 상온에서 교반하여 표면개질을 진행하였다. 반응 완료된 지지체는 중성이 될 때까지 정제수를 이용하여 세척한 후 상온에서 건조시켰다.
Azido group이 도입된 지지체 제조(Azido-PDA-PGA) 및 광가교를 통한 BMP-2 고정 지지체 제조(BMP-2-PDA-PGA). 단백질의 광 고정화를 위해서는 UV 반응성 작용기 도입이 필요하다. 본 연구에서는 UV 반응성 작용기로 널리 이용되며 azido group을 가지고 있는 1,1-azido-3,6,9-trioxaundecan-1-amine(Sigam-Aldrich, USA)을 도입하였다. 실험방법은 다음과 같다. 먼저, 도파민이 코팅된 PDA-PGA 지지체를 pH 8.5를 가지는 10 mM Tris-HCl buffer용액에 투입하였다. 그 후에, 11-azido-3,6,9-trioxaunedcan-1-amine solution을 넣어 준 후 암실환경을 유지하며 24시간 동안 상온에서 반응시켜 주었다. 반응시킨 azido solution의 양은 각각 30, 60, 90 μL로 결정하였고, attenuated total reflectance-Fourier transform infrared spectroscopy(ATR-FTIR, Vertex 80v, Bruker, USA)을 이용하여 PDA-PGA 지지체에 도입되는 azido peak의 intensity를 비교하여 최종 azido solution의 양을 결정하였다.
그 후, Azido-PDA-PGA 지지체에 BMP-2(CHO cell derived, PeproTech Inc., Korea)를 UV 광반응을 이용하여 고정시켰다. 실험방법으로는 희석된 BMP-2 solution(500 ng/mL)을 azido-PDA-PGA 지지체에 50 μL를 분사한 후 air-drying시켜준다. 건조된 sample은 UV 경화기(SMCM-M1K1, SEMYUNG VACTRON Co., Ltd., Korea)를 이용하여 거리 10 cm 조건으로 광가교를 진행시켜 주었다. UV 조사 반응 시간은 25, 35, 38 초로 결정하였고, ATR-FTIR을 이용하여 azido peak의 소실 여부를 판단하여 최적의 UV 조사시간을 결정하였다.
지지체의 형태 분석. 제작된 지지체의 외형과 치수를 분석하기 위해 SEM을 이용하여 분석하였다. SEM은 고배율 뿐 아니라 10-100배의 저배율 관찰에도 사용할 수 있기 때문에 시편의 표면 및 단면의 관찰에 유용하다. 시편의 표면 관찰 전 180초 동안 SEM을 사용하여 백금 코팅을 진행하였으며, 측정에 사용한 전압은 15 kV로 고정하여 분석을 진행하였다.
지지체 표면의 화학적 조성 분석. 개질한 4가지 지지체의 화학적 구조를 확인하기 위해 ATR-FTIR을 이용하여 지지체 표면의 화학적 특성변화를 관찰하였다. ATR은 프리즘을 통해 입사된 적외선이 프리즘의 표면에서 반사가 일어남에 따라 프리즘에 밀착되어 있는 재료 표면의 다양한 화학결합의 진동에너지와 일치하는 파장의 적외선 파장을 흡수한다. 분자의 작용기에 의한 특성적 스펙트럼을 비교적 쉽게 얻음으로써 재료 표면의 화학 조성에 대한 정보를 제공해준다. 따라서 ATR-FTIR은 재료의 극 표면에 대한 화학조성을 확인하는데 유용한 장비라 할 수 있다. 스캔 조건은 800-4000 cm-1의 스펙트럼 영역을 64회 조합하여 분석을 진행하였다.
지지체 표면의 원소 조성 분석. 재료 표면에 X-선을 입사하여 광전효과를 통해 방출되는 광전자의 운동에너지를 측정함으로써, 재료의 원소조성 및 화학적 결합상태를 분석할 수 있다. 일정한 에너지를 가지는 X-선을 재료 표면에 조사하면 재료로부터 광전자(photoelectron)들이 방출되는데 이 광전자들의 운동에너지를 측정하면 광전자를 재료로부터 방출하기 위해 필요한 에너지인 binding energy를 알 수 있다. 본 연구에서는 PGA, PDA-PGA, Azido-PDA-PGA 그리고 BMP-2-PDA-PGA 지지체의 표면을 X-ray photoelectron spectroscope (Quantera, ULVAC-PHI, Japan)를 이용하여 survey scan을 하여 각 지지체 표면의 화학적 원소조성을 정량화 하였다.
BMP-2 정량 및 방출확인. 본 연구에서는 sandwich enzyme-linked immunosorbent assay(ELISA) 방법을 이용한 BMP-2 Human ELISA Kit(Abcam®, UK)를 이용하여 제작한 지지체의 BMP-2의 고정화를 확인하였다. 실험 방법은 BMP-2를 지지체 표면에 균일하게 분사하여 건조시킨 후, 1 mL 정제수를 이용하여 남아있는 BMP 수집하여 초기 접착량을 확인하였다. 그 후에 고정을 진행시킨 BMP-2-PDA-PGA 지지체를 2 mL 정제수에 흔들어 세척 후 완전히 고정되지 않은 BMP-2를 세정하고 최종 고정량을 측정하였다. BMP-2 antibody가 처리되어 있는 96 well plate에 100 μL sample 용액을 넣고 37 ℃ 조건에서 90분 동안 incubation 시켜준다. 다음은 1:100으로 희석시킨 biotinylated anti-BMP-2를 100 μL씩 투입해준 후 37 ℃에서 한 시간 동안 incubation 시켜 준다. PBS를 이용하여 3회간 세척시켜 준 뒤 Avidin-Biotin-Peroxidase를 100 μL 넣어주어 37 ℃ 조건에서 30분간 반응시켜 준다. PBS를 이용하여 2회 이상 세척한 뒤 90 μL Trimethoprim(TMP) 용액을 이용하여 색을 발현시킨 후 암실환경에서 37 ℃ 조건으로 20분 동안 incubation 시켜준다. 마지막으로 TMP 종결 용액을 100 μL 투입하여 반응을 종결시켜 준 뒤 ELISA reader(PHOmo, Autobio Labtec Instruments Co., Ltd., China)를 이용하여 450 nm에서 흡광도를 측정하였다.
제작된 BMP-2-PDA-PGA 지지체로부터 방출되는 BMP-2 양을 확인하기 위해 BMP-2 Human ELISA Kit를 사용하여 평가하였다. BMP-2-PDA-PGA 지지체를 5 mL 정제수에서 최대 28일 동안 37 ℃에서 천천히 shaking 시켜주었다. 방출은 1, 3, 5, 7, 14, 21, 28 일의 간격으로 측정해 주었다. 각 일차에서 전체 상등액 2 mL를 수집하여 부착되지 않은 BMP-2 양을 측정하여 방출 거동을 평가하였으며, 용액은 deep freezer에 보관하여 측정하였다. ELISA kit를 이용한 실험방법은 표면접착량 확인 실험과 동일하다.
In vitro 세포독성 평가. 제조한 지지체를 체내에서 사용하기 위해서는 세포의 viability 확인이 필요하다. 본 연구에서는 MTT(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide) assay를 통해 시편에 대한 세포생존률을 평가 하였다. 실험 방법으로는 먼저 PGA, PDA-PGA, Azido-PDA-PGA를 15 mL conical tube에 투입하고 5 mL Dulbecco Modified Eagle’s Medium(DMEM, Welgene Inc. Korea)배지를 넣어 24시간 동안 인큐베이터 안에서 용출시켜 준다. 동시에 96 well에 Pre-osteoblasts(MC3T3-E1, mouse calvarias, American Type Culture Collection, USA)를 1×104 cells/well 농도로 파종해준 후 24시간 배양시켜 안정화 과정을 거쳐준다. 24시간 후 표준 DMEM 배지와 용출시킨 샘플의 배지로 교환한 후 인큐베이터 안에서 24시간 동안 다시 배양시켜 준다. 배지를 제거한 후 암실환경에서 PBS(-)에 녹인 5 mg/mL MTT solution을 50 μL 넣은 후 4시간 동안 배양시킨다. MTT solution을 제거한 후 100 μL 넣어 용해한 뒤 540 nm 파장에서의 흡광도를 microplate reader(PHOmo, Autobio Labtec Instruments Co., Ltd., China)로 측정하였다.
Alizarin red staining. 제조한 지지체에 파종한 MC3T3-E1 세포의 칼슘, 무기질 침착 평가를 위해 세포 배양 후 7, 14, 21일에 alizarin red 염색(alizarin red-S reagent, 3,4-dihydroxy-9,10-dioxo-2-anthracenesulfonic acid sodium salt, Sigma-Aldrich, USA)을 실시하였다. 정상적인 골조직에서는 세포외기질이 형성되는데, 이 세포외기질에서 석회화가 진행된다. 이런 석회화된 골 기질 형성 정도는 성숙한 조골세포의 활성 마커로 알려져 있다. Alizarin red는 금속이온과 결합하는 킬레이트 반응에 의해 alizarin red-칼슘을 형성하여 침착부를 붉게 염색한다.
실험 방법으로는 제작한 PGA, BMP-2-PDA-PGA 지지체를 24 well plate에 넣은 뒤 MC3T3-E1 5×104 cell/mL를 파종한다. 37 ℃, 5% CO2 조건에서 4시간 동안 배양시켜 초기 접착을 진행시켜준 후 배지를 넣어주어 7, 14, 21일 동안 배양 시킨다. 세포가 분주된 각각의 지지체는 PBS를 이용하여 두 번 세정 후에 3.7% formaldehyde로 20분 동안 4 ℃ 조건에서 고정하였다. 세포가 고정된 지지체는 pH 4.2로 조정된 40 mM alizarin red staining solution을 이용하여 30분간 37 ℃, CO2 조건에서 incubation 시켜주었다. 30분 후 solution을 제거해준 뒤 정제수를 이용하여 조심스럽게 2번 세정하여 주었다. 염색에 의한 칼슘 침착 정도의 정량 분석은 10% acetic acid를 이용하여 탈착시켜준 후 96 well에 분주한 뒤 NaOH 수용액을 투입하여 반응을 종결시키고 405 nm 파장에서의 흡광도를 ELISA reader로 측정을 진행하였다.
In vitro 가수분해 거동 분석. 손상된 골 조직은 재생되기까지 약 28주 이상의 시간이 필요로 하다. 제조한 지지체가 골조직의 재생 전에 생분해되어 버리면 지지체로써의 역할을 하지 못하게 되고, 골 재생이 완료되었지만 여전히 체내에 남아 있다면 염증반응을 유발하기 때문에 적절한 생분해 거동을 가진 재료의 선택이 중요하다. 본 연구에서는 제작된 PGA 지지체가 골재생에 적합한 재료인지를 알아보기 위하여 in vitro 가수분해 거동 평가를 진행하였다. 실험방법은 15 mL cornical tube에 무게가 측정된 지지체를 투입하고 5 mL phosphate buffered saline(PBS, pH 7.4) 용액을 주입해준다. Cornical tube를 shaking bath에 비스듬하게 고정한 뒤 37 ℃, 40 rpm으로 설정하여 실험을 진행하였다. 지지체는 1, 3, 5, 7, 14, 21, 28, 42, 56일 마다 회수하였으며, 정제수로 세정 후 건조시켜 중량을 측정하여 중량감소율을 산출하였다.
In vivo 골조직 재생능 동물실험. 두개골 조직 결손의 재생을 평가하기 위한 실험 모델로 토끼(New Zealand white rabbit, 2.3-2.8 kg, 8주령, 효창사이언스)를 사용하였다. 모든 동물실험은 경북대학교 동물실험기관 윤리위원회의 검토 및 승인을 받았다. 실험절차는 동물관리위원회(승인번호: 2017-0131)의 승인을 받아 다음과 같이 수행하였다. 간략히 서술하면, 토끼를 Zoletil(Virbac, France)과 Rompun(Bayer, Germany)의 4:1 부피비를 사용하여 마취시켰다. 토끼를 안정화시킨 후, 두개골을 노출하고 직경 8 mm의 원형 천공 4개를 형성하였다. 다음으로, PGA 및 BMP-2-PDA-PGA 지지체를 천공된 두개골에 고정하였다. 4주 및 8주 후에 KCl 주사액(제일제약, 한국)을 사용하여 토끼를 안락사시켰다. 그 후, 두개골을 다시 노출시키고, 후속 분석을 위해 골조직을 절단하여 수집하였다.
골조직 재생 및 조직학적 평가. In vivo 실험 후, 재생된 골조직 표본의 형태와 부피(재생/천공된 골의 백분율)는 micro-CT(Sky Scan 1173TM, Bruker Corp., Belgium, 20-100 kV, 5 μm 스팟 크기, 50 mm 시야각, 12비트 CCD 카메라)를 사용하여 분석하였으며, 신생골 조직 부피 및 bone mineral density를 정량분석하였다.
채취한 골조직의 성숙도 및 염증세포 분포를 평가하기 위해 hematoxylin-eosin(H&E) 및 Masson’s trichrome 염색을 실시하였다. 먼저, 채취한 조직을 10% 포르말린 용액으로 고정시킨 후 세척한 후, 자일린으로 용매를 치환하였다. 그리고 조직을 파라핀으로 포매한 후, 조직절편기를 이용하여 5 μm 정도의 두께로 절편하였다. 절편조직을 슬라이드 글라스 위에 고정하고 전처리를 한 후 염색 및 봉입하였다. 완성된 조직시편을 광학현미경(ECLIPSE TS100, Nikon Corp., Japan)으로 관찰하여 디지털 카메라를 이용하여 촬영하였다.
통계분석. 정량적인 측정수치의 유의성 평가는 통계분석 소프트웨어(KyPlot version 2.0, KyensLab, Inc., Japan)를 사용하여 분석하였다. 각 수치는 평균 ± 표준편차로 표기하였으며 significance level은 parametric Student’s t-test와 one-way ANOVA(analysis of variance)의 Tukey 사후검증법으로 판별하였다. 통계적 유의성은 p < 0.05의 값으로 설정하였다.
|
Figure 1 Fabrication schematic of a BMP-2 immobilized PGA scaffold. 3D printed PGA scaffold was modified with dopamine coating and azido group before immobilizing BMP-2 by UV irradiation. |
3D 프린팅 기술을 이용한 PGA 지지체 제조. 골 조직 재생을 향상시키기 위해 일정한 pore size를 가지는 3D 격자구조의 원판형 지지체를 제조하였다(Figure 1). 골세포가 지지체 내부로 잘 자라 들어와 세포 성장이 활발히 이루어지는 pore 직경은 380-400 μm라는 논문 결과들을 참고하여 지지체의 pore length를 400 μm로 결정하였다.18 또한 본 연구에서는 지지체의 크기를 지름 8 mm, 높이 1 mm를 가지는 원판형 모양으로 제조하였는데 이는 토끼 두개골이 자연적으로 재생이 힘든 critical defect size이기 때문이다. 또한 골재생 실험에 널리 사용하는 평균 8주령 토끼 두개골의 평균 두께의 경우는 평균 1.9 mm로 삽입이 어려울 것을 고려하여 높이는 1 mm로 제작하였다.18
3D 프린터를 이용하여 지지체 제작 시 실린더의 온도, 노즐온도, 토출 압력 및 속도에 의해 pore와 strand의 치수에 오차가 발생되기 때문에 공정변수의 조절 및 재연성이 매우 중요 하다. 디자인한 지지체 pore와 strand 크기를 만족시키는 조건을 선정하여 PGA 지지체를 제작하였다. 3D 프린터를 이용하여 제조한 PGA 지지체는 육안적 평가와, pore 및 strand size를 SEM을 통해 관찰하였고 이미지 분석 프로그램을 이용하여 pore length와 strand size 분석 결과를 Figure 2에 나타내었다. 지지체는 30배의 배율에서 측정하였으며 pore와 strand 모두 15개씩 측정하여 평균값을 계산하였다. 관찰 결과 8 mm 지름을 가지며 1 mm 높이를 가지는 원판형의 PGA 지지체를 관찰할 수 있었으며, SEM을 통해 일정한 pore와 strand를 가지는 지지체 표면을 관찰할 수 있었다. 이미지 분석프로그램 측정 결과 평균 pore length는 399.4 ± 13.9 μm였고, 평균 strand 직경은 199.1 ± 35.9 μm로 일정한 모양을 유지하며 지지체가 제조되었음을 관찰할 수 있었다. 위 결과를 통해 3D 프린터를 이용하여 제조한 PGA 지지체는 골세포가 성장하기에 적합한 환경을 가지는 크기의 평균 pore와 strand 크기를 가지는 설계와 일치한 형태를 나타내는 것을 확인할 수 있었다.
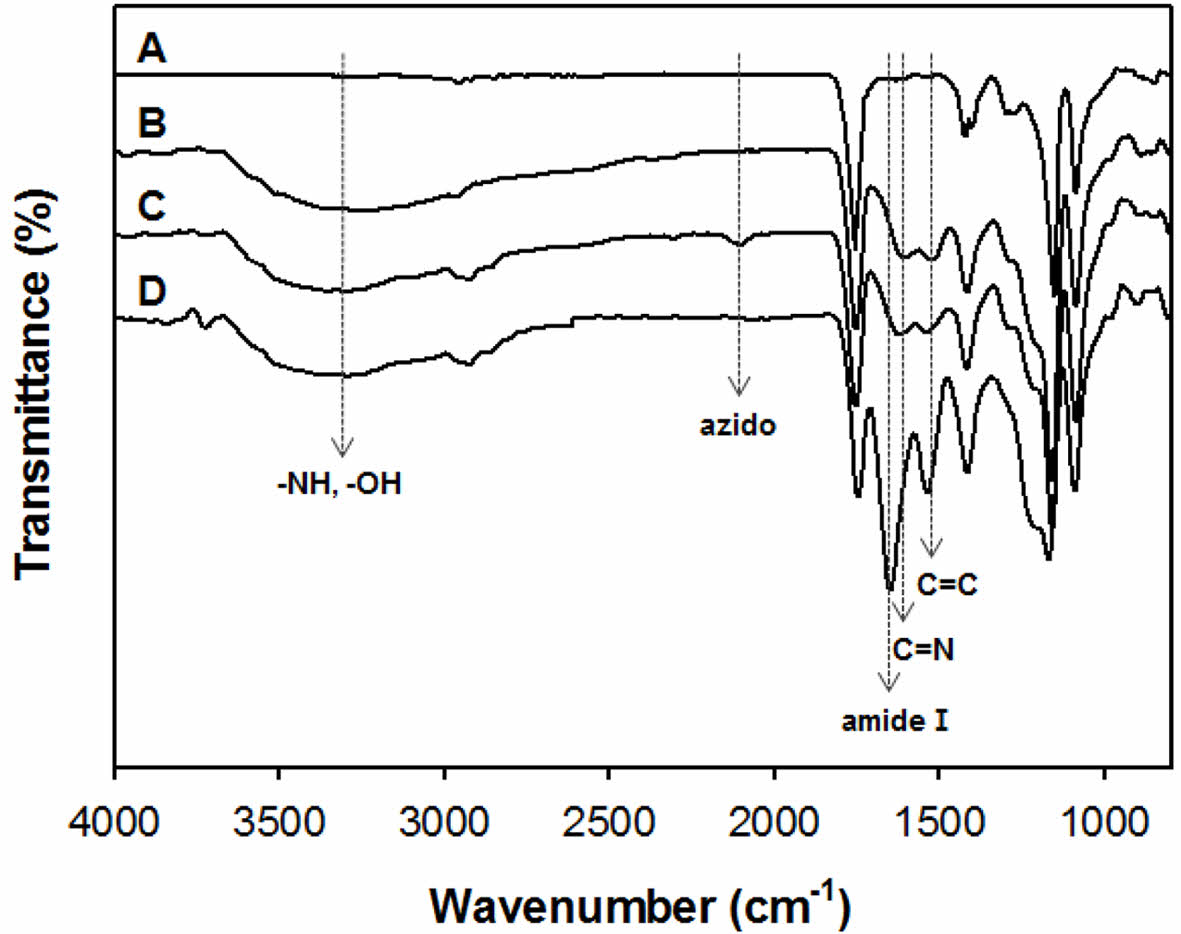
폴리도파민이 코팅된 PGA 지지체의 제조(PDA-PGA). 고결정성 고분자인 PGA 표면에 친수성 부여 및 2차 표면개질 작용기 도입을 위해 폴리도파민을 이용하여 PGA 지지체의 표면개질을 진행하였다(PDA-PGA). 개질된 PDA-PGA 지지체는 육안적 평가와 SEM을 이용하여 표면적 변화와 pore, strand 크기를, 그리고 ATR-FTIR을 이용하여 PGA, PDA-PGA의 화학적 결합 변화를 관찰하였다(Figure 2, 3). 먼저 PDA-PGA 지지체를 육안으로 관찰한 결과, 폴리도파민 코팅에 의해 검은색으로 코팅된 PDA-PGA 지지체를 관찰할 수 있었다. SEM 관찰 및 pore, strand 크기 분석결과 평균 359.3 ± 13.3 μm pore length와 238.4 ± 19.8 μm strand 크기를 나타냄을 확인할 수 있었다. PGA 지지체에 비하여 약 40 μm정도 두꺼운 strand size를 갖는 것을 확인할 수 있었는데, 이는 코팅된 폴리도파민은 약 40 μm 두께의 코팅 층을 형성하기 때문에 나타나는 현상으로 생각된다. 또한 dopamine powder의 ATR-FTIR 측정결과, 도파민의 화학구조인 카테콜기에 존재하는 O-H와 N-H기에 의해 3400-3600 cm-1에서 broad한 peak가 관찰되었으며, 벤젠고리에 존재하는 C=C와 C=N의 peak를 1512, 1620 cm-1에서 관찰할 수 있었다. PDA-PGA 지지체는 PGA 표면에 도파민 산화에 의한 폴리도파민 코팅 층이 형성되었기 때문에 PGA 특성 peak인 C=O, CH2 bending, CH2 wagging peak (1750, 1400, 1440 cm-1)와 도파민 특성 peak인 O-H, C=C, C=N peak가 겹쳐져 나타났다. 위 결과를 바탕으로 폴리도파민을 이용한 PGA 지지체의 표면개질이 성공적으로 이루어졌음을 알 수 있었다.
Azido group이 도입된 지지체의 제조(Azido-PDA-PGA). BMP-2의 광 고정화를 위한 UV 반응성 작용기 도입을 위해 azido group을 가지고 있는 11-azido-3,6,9-trioxaundecan-1-amine을 도입하였다. Tris buffer solution(pH 8.5)에 11-azido-3,6,9-trioxaundecan-1-amine의 amine 용액을 넣어 PDA-PGA 지지체를 코팅시켰다. 11-azido-3,6,9-trioxaundecan-1-amine의 amine기는 재료 표면에 존재하는 도파민 카테콜기와 마이클첨가반응을 통해 고정된다. 도입시킨 azido group은 조사하는 UV에 의해 라디칼을 생성하며 이후 BMP-2 결합 사이트를 제공한다. 반응시킨 azido solution의 양은 각각 30, 60, 90 μL로 결정하였고, ATR-FTIR을 이용하여 PDA-PGA 지지체에 도입되는 azido peak의 크기를 비교하여 최종 azido solution의 양을 결정하였다.
ATR-FTIR 측정 결과, azido기가 도입된 azido-PDA-PGA 지지체에서 2116 cm-1 부근에서 azido 특성 peak를 관찰할 수 있었다(Figure 3C). 도입되는 azido기의 함량을 비교하기 위해 PGA에서 가장 두드러지게 나타나는 1750 cm-1 부근에 나타나는 C=O peak 크기를 동일하게 하여 비교하였다. 그 결과 30 μL azido soution이 첨가된 지지체의 azido peak는 매우 약한 것을 확인할 수 있었다. 반면 60, 90 μL가 첨가된 지지체는 유사한 정도의 azido peak를 나타내는 것을 확인하였다. 이를 통해 효과적인 반응기 도입을 위한 azido solution의 양을 60 μL로 결정하였다.
광가교를 통한 BMP-2 고정 지지체의 제조(BMP-2-PDA-PGA). 골형성 촉진인자인 BMP-2를 제작한 Azido-PDA-PGA 지지체에 고정하기 위한 과정은 본 연구의 핵심이다. 광 반응성을 가지는 Azido-PDA-PGA 지지체에 UV를 조사하면 nitrene이 생성되는데, 생성된 nitrene은 BMP-2의 C-H, N-H와 삽입 반응을 통해 결합하게 된다. Azido기를 이용한 생체분자 고정은 관능기에 관계없이 단순한 광화학 반응에 의해 결합하는 성질을 갖기 때문에 매우 간단하면서도 유용한 방법이라 할 수 있다. 광 고정 반응은 광 반응기의 농도도 중요하지만 최적의 고정화를 위한 반응 시간도 매우 중요하다. 본 연구에서는 ATR-FTIR 측정을 통해 UV 고정시간 25, 35, 38초에 따른 화학 구조 변화를 관찰하였다.
ATR-FTIR 측정 결과 UV에 25초 노출시킨 지지체는 2116 cm-1에서 azido peak가 여전히 남아 있는 것을 관찰할 수 있었다. 노출시간을 늘려 35초 동안 UV 조사를 진행한 지지체는 1650 cm-1 부근에서 나타나는 peak가 증가됨을 관찰하였는데 이는 BMP-2의 amide Ι peak로써 BMP-2 고정에 의한 peak 증가임을 알 수 있다. 하지만 2116 cm-1 부근에서 남아있는 azido 특성 peak가 관찰되었기 때문에 UV 조사량이 충분하지 않음을 알 수 있었다. 반면 38초 반응시킨 지지체는 azido 특성 peak가 모두 사라짐을 관찰할 수 있었고, 1650 cm-1에 나타나는 amide Ι peak가 35초 반응시킨 지지체에 비해 증가된 것을 관찰하였다. 이는 BMP-2 도입에 필요한 광반응 시간은 38초면 충분함을 나타내며 그 이상의 시간에서는 광 반응기가 없어 더 이상의 BMP-2가 도입되기 어려움을 의미한다. ATR-FTIR 결과를 토대로 UV의 노출시간을 최소화 하면서 가장 큰 고정효과를 나타낼 수 있는 고정시간을 38초로 결정하여 실험을 진행하였다.
ATR-FTIR을 이용한 3D 지지체의 화학적 구조분석. 표면 개질한 4가지 3D 지지체의 화학적 구조 변화를 관찰하기 위해 ATR-FTIR을 측정하였다. 분석 결과, PGA를 이용하여 제작한 PGA 지지체는 문헌값과 일치하는 그래프가 나타나는 것을 관찰할 수 있었다. 1750 cm-1에서 매우 강한 C=O peak가 나타났고, 1400, 1440 cm-1에서 분리되는 CH2 피크가 나타났으며 1095 cm-1에서 C-O-C 대칭 peak가 특징적으로 관찰되었다(Figure 3). 폴리도파민이 코팅된 PDA-PGA 지지체에서는 카테콜기에 존재하는 O-H와 N-H기 때문에 PGA 지지체에서는 관찰되지 않았던 broad한 모양의 피크가 3600-3400 cm-1에서 관찰되었으며, 카테콜기의 벤젠고리에 존재하는 C=C와 C=N의 peak 역시 1512, 1620 cm-1에서 새롭게 관찰되었다. 이는 폴리도파민 코팅이 PGA 지지체에 균일하게 진행되었음을 알 수 있다(Figure 3B).
Azido solution을 이용하여 광반응성이 가능한 작용기를 도입한 Azido-PDA-PGA 지지체는 azido 특성 peak가 2100 cm-1부근에서 새롭게 관찰되었다(Figure 3C). 위 결과는 BMP-2 광 고정을 위한 azido기의 도입이 잘 진행되었음을 의미한다. 마지막으로 BMP-2를 고정시킨 BMP-2-PDA-PGA 지지체에서는 UV 조사로 인해 2100 cm-1 부근의 azido 특성 peak는 사라지는 것을 관찰할 수 있었다. 동시에 1650 cm-1 부근에서 peak가 증가하였는데 이는 BMP-2에 존재하는 amide Ι 특성 peak로 UV 가교를 통해 BMP-2가 고정되었음을 나타낸다(Figure 3D).
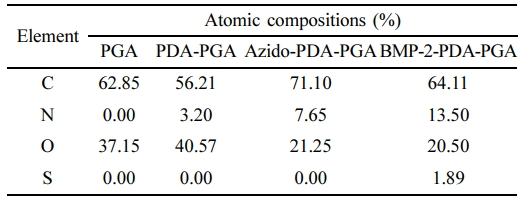
XPS을 이용한 3D 지지체의 화학적 구조분석. 표면 개질에 따른 4가지 3D 지지체의 화학적 원소 조성 차이를 관찰하기 위해 XPS 원소분석을 진행하였다. Supplementary Data 1에 survey scan 결과와 Table 1에 상대적 원소 조성비 분석결과를 나타내었다. 실험결과 표면 개질되지 않은 PGA 지지체에서는 PGA 구조를 이루고 있는 C, H, O 3가지 원소 조성만을 나타내는 것을 확인하였다. 폴리도파민이 코팅된 PDA-PGA 지지체에서는 카테콜기에 존재하는 N-H 때문에 398 eV에서 N 원소의 binding energy가 새롭게 관찰되었고 약 3.2%의 상대적 조성비를 나타내었다. Azido-PDA-PGA 지지체 측정결과 도입된 azido기에 의해 N 원소의 binding energy가 향상되는 것을 관찰할 수 있으며 상대적 원소 조성비 또한 7.65%로 증가되었다. BMP-2가 고정된 BMP-2-PDA-PGA 지지체는 398 eV에서 향상된 N 원소의 binding energy와 150 eV에서 새로운 S 원소의 binding energy를 관찰할 수 있었다. BMP-2는 여러 종류의 아미노산으로 이루어진 단백질이다. BMP-2 sequence 중 cysteine과 methionine은 티올기를 포함하는 아미노산이기 때문에, 1.89%의 S 원소 조성비가 새롭게 관찰되었고, BMP-2에 존재하는 amide bond는 N 원소의 상대적 조성비를 13.5%로 증가시켰다. 따라서, PDA-PGA, Azido-PDA-PGA 지지체 표면에서 새롭게 나타난 N 원소는 도파민 코팅에 의한 표면개질이 성공적으로 이루어졌으며, azido기 도입이 의도된 방향으로 이루어졌음을 의미한다. 또한 BMP-2-PDA-PGA 지지체에서 새롭게 관찰된 S 원소와 증가된 N 원소는 표면에 도입된 BMP-2 sequence를 구성하고 있는 아미노산에 의한 결과로 BMP-2가 지지체 표면에 고정되어 있는 것을 확인할 수 있었다. 이것은 앞서 ATR-FTIR 분석에서의 결과와 일치하였으며 제조된 3D 지지체의 4가지 개질 단계가 의도하고자 하는 방향으로 진행되었음을 확인할 수 있었다.
효소면역정량법을 통한 고정화된 BMP-2의 정량 및 방출거동 분석. 표면 ELISA 분석을 통해 측정한 BMP-2 표면 접착량을 측정하였다. 실험은 지지체에 BMP-2 용액을 도입하여 drying 시킨 후 표면에 도입된 BMP-2의 양을 정량하였고, UV 조사를 통해 고정시킨 후 정제수에 세정하여, 고정되지 않은 BMP-2를 정량하여 최종 접착량을 확인하였다(Supplementary data 2).
실험 결과 Azido-PDA-PGA 지지체에 도입한 BMP-2의 약 90.04%가 재료표면에 코팅되었다. 제조된 지지체는 세포의 증식향상을 위해 400 μm 크기의 pore length를 가지는 다공성 내부구조에도 불구하고 BMP-2의 도입률이 양호하였다. 또한 재료 표면에 도입된 BMP-2의 양 대비 UV 조사에 의해 최종 고정화된 효율은 약 79.34%로 약 10.70%의 감소가 일어났음을 확인할 수 있었는데 이는 UV 조사 후 고정되지 못하거나 약한 결합에 의해 미량의 BMP-2가 세정과정에서 용출되어 손실된 것으로 생각된다.
Jeong 등은 성장인자 표면에 존재하는 아미노기, 카복실기, 티올기 등의 반응기를 지지체에 직접 공유결합 시키는 화학적 가교제에 의한 고정화 방법을 진행하였다.32 그러나 이런 화학적 고정화 방법은 생체 내에서 분해되는 과정에서 알데히드, 우레아 등의 세포 독성을 나타낼 수 있는 물질이 생성된다는 주장이 제기되어 왔다. 이러한 기존의 고정화 방법의 단점 극복을 위해 현재 광 고정법을 이용하여 성장인자를 고정시키는 방법에 관한 여러 가지 연구가 보고 되고 있다. Chen 등의 연구에 따르면, 광 고정된 상피세포성장인자에 의해 혈청이 없는 조건 하에서 세포 증식을 성공하였다. 공유결합으로 지지체에 고정된 상피세포성장인자는 세포증식을 유도하여 증식이 촉진되는 결과를 나타내었다.47 또한 Woo 등은 세포성장인자를 광고정하는 방법으로 결합형 분비를 유발시켜 지속적인 자극을 나타내게 함으로써 세포 증식을 촉진시키는 연구를 발표하였다.48 하지만 위 반응들은 반응기를 성장인자에 직접 결합하여 광 고정을 진행하기 때문에 낮은 수율문제와 성장인자의 변성 문제를 초래할 수 있다. 따라서 본 연구에서는 광 반응기를 지지체 표면에 도입한 뒤 광반응을 통해 성장인자를 도입하여 보다 안정적인 반응이 가능한 BMP-2-PDA-PGA 지지체를 제작하였다.
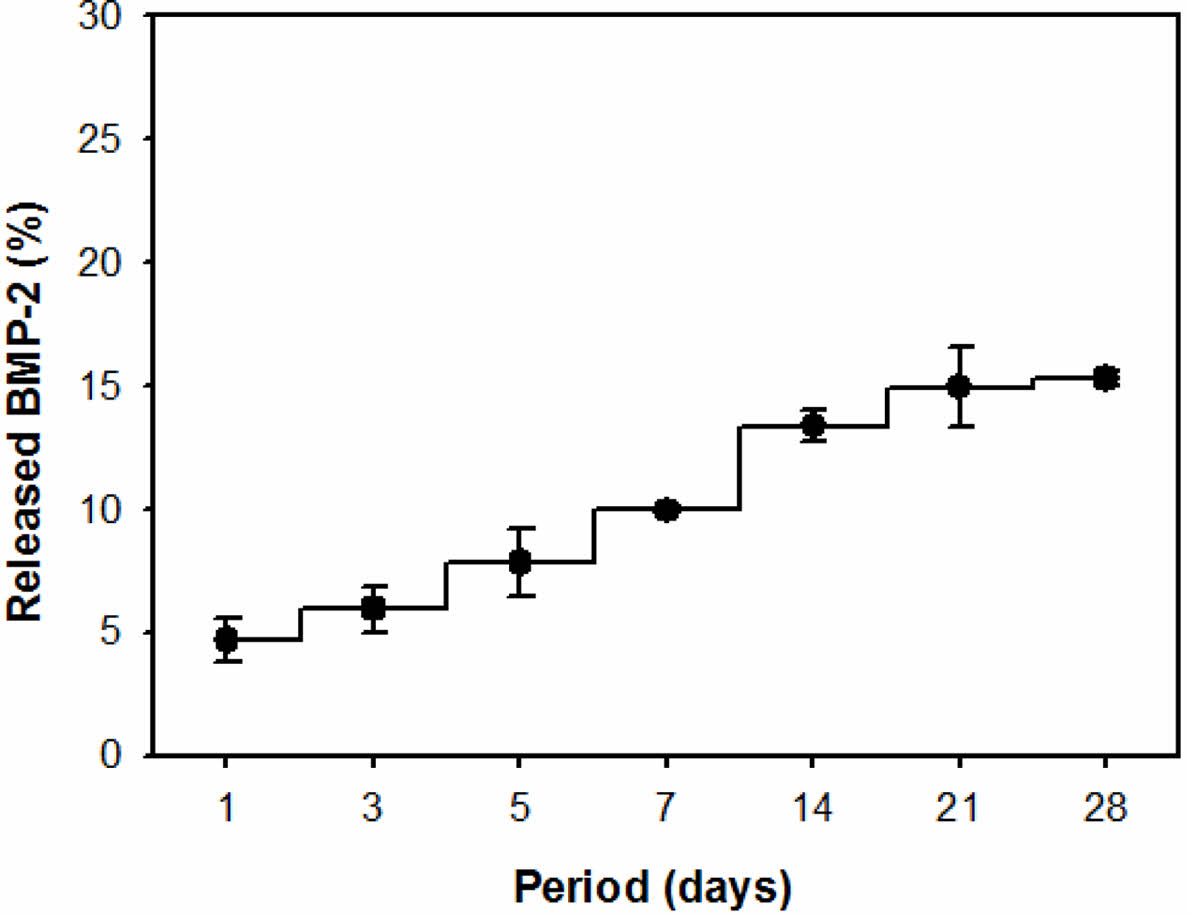
골 재생은 오랜 기간을 필요로 하는 과정이기 때문에, 골 재생 과정에 있어 burst release 없이 성장인자가 고정되어 있는 것은 특히 중요한 요소이다. 제조된 BMP-2-PDA-PGA 지지체의 방출거동은 효소면역정량법인 ELISA법을 이용하여 진행하였고, 1, 3, 5, 7, 14, 21, 28일 동안 방출거동을 관찰하였다(Figure 4). 측정 결과, 고정된 BMP-2는 7일차에 약 9.2%의 방출 거동을 보인 후, 시간이 지남에 따라 천천히 release되며 마지막 28일 차에는 15.3%의 방출거동을 보였다. 이러한 결과로부터 BMP-2가 지지체 상에 고정화되어 안정하게 유지된다는 것을 알 수 있다.
이상적인 성장인자 전달 시스템은 조직 재생에 있어 필요한 투여량만 사용되며 initial burst release가 제어되어야 한다. Seo 등은 양극 산화된 티타늄 표면과 순수한 티타늄 표면에 물리적으로 BMP-2를 흡착시켜 골재생 효과를 평가하였다.43 그러나 물리적으로 흡착시킨 BMP-2는 첫째날에 각 36%와 54%의 방출량을, 7일차에는 67%, 78%를 나타내며 이는 BMP-2의 급격한 분해로 인하여 BMP-2의 적용이 골 형성에 별다른 기여를 하지 못했다는 주장이 제기되었다. Kim 등의 연구에서는 헤파린이 이식된 티타늄 표면에 10 ng/mL와 50 ng/mL의 각기 다른 농도의 BMP-2를 고정시켜 BMP-2의 서방출과 항염증 효과를 확인하였다.50 측정결과 4주 동안 서방출이 되는 것을 확인할 수 있었지만 첫째날 각각 69%와 26%의 initial burst release를 나타냈다. 최근에는 생체 친화적 메커니즘을 모방한 도파민 표면 개질법을 사용하여 성장인자를 고정시키는 방법이 연구되고 있다. 3차원 구조를 가지는 지지체에 도파민코팅 진행 후 성장인자를 고정시킨 결과 3일차에 20% 이상의 initial burst release를 보이며 28일 후에는 80% 이상의 release를 보였다. 또한 UV 광고정을 통해 titanium 표면에 BMP-2를 고정시킨 Jeong 등이 진행한 실험은 120 시간 만에 60% 이상의 release 거동 결과가 나타났다.46 위 방법들은 골재생이 이루어지기 위한 최소 기간인 4주 동안 성장인자가 지속적으로 방출되지 않아 불충분한 osteoinduction을 나타낼 수 있다는 문제점을 가진다.
수많은 연구를 통해 재료 표면에서 불충분한 고정기간을 갖는 BMP-2는 세포의 자극을 감소시키기 때문에, 향상된 고정력을 갖는 BMP-2 고정 지지체의 개발이 요구되고 있으며, 성장인자가 고정된 지지체의 이식은 동물모델 및 사람에서 골 재생을 가속화 시킨다는 것이 밝혀졌다. 본 연구에서 진행한 성장인자 고정법은 initial burst release 없이 방출을 제어함으로써, 체내에서 BMP-2가 충분한 체류시간을 갖게 하여 골 자극을 오랜 시간 유도해 효과적인 골 재생 효과를 볼 수 있을 것으로 기대된다.
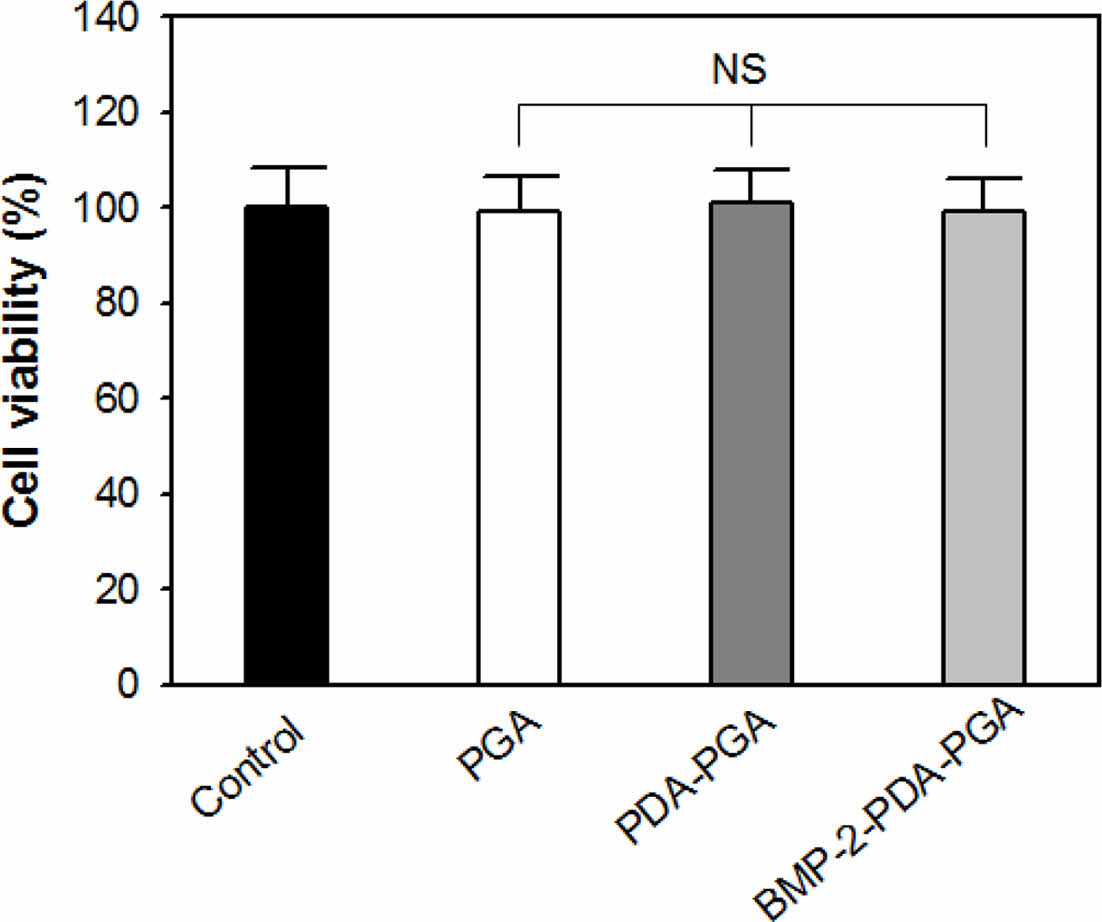
세포생존율 분석. 제조된 지지체에 대한 세포생존율을 MTT assay법을 이용하여 평가하였으며, 그 결과를 Figure 5에 나타내었다. 평가는 PGA, PDA-PGA, BMP-2-PDA-PGA 지지체를 24시간 배양시킨 용출물과 세포배양 배지를 control로 사용하여 진행하였다. 평가결과, PGA, BMP-2-PDA-PGA 지지체 용출물로 세포 배양을 진행시킨 시편은 99.26, 99.07%의 산출값을 나타내었다. 또한 생체적합성 재료인 폴리도파민을 코팅한 PDA-PGA 용출물을 이용하여 평가한 시편은 약 99.91%의 세포생존율을 나타내었다. 이는 오차를 고려하면 control과 유사한 값이며, 세포생존율이 80% 이상으로 규정되는 세포독성 0등급에 해당하는 수치이다. MTT assay를 통해 표면개질 각 단계별 지지체의 세포독성을 평가한 결과 3가지 지지체 모두 세포독성 0등급에 해당하는 세포생존율을 가지는 것을 확인하였으며 이는 제조된 지지체를 체내에 이식하여 사용해도 독성을 나타내지 않으며 세포의 활성에 영향을 미치지 않을 것으로 사료된다.
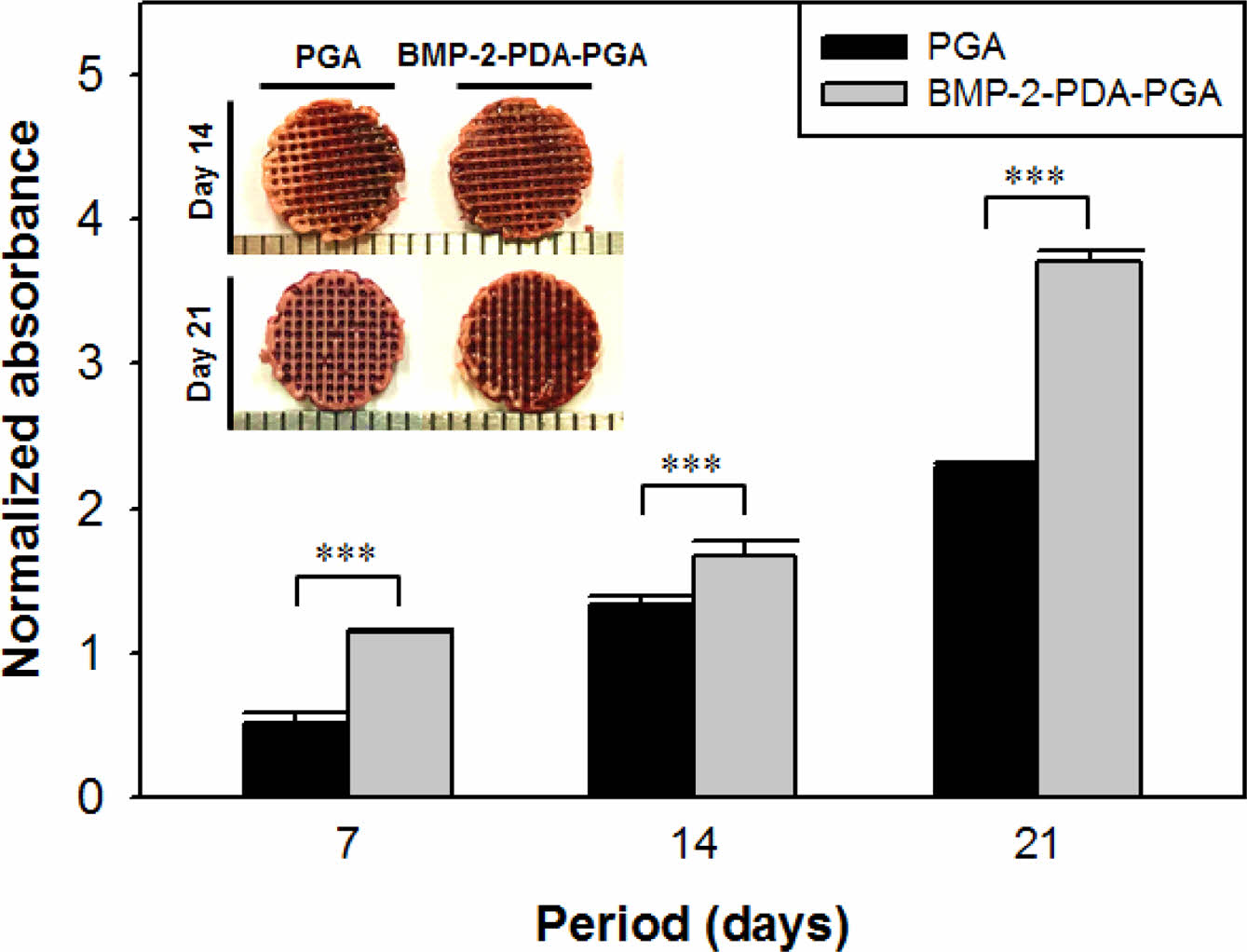
Alizarin Red 염색. 제조된 지지체의 골 분화 활성 평가를 위해 alizarin red 염색을 진행하였다. MC3T3-E1 세포가 골세포로 분화되면 칼슘이 생성되는데 alizarin red staining은 생성된 칼슘 양 측정 및 정량이 가능하다. 실험군은 PGA, BMP-2-PDA-PGA 지지체로 나누어 진행하였으며, 각 7, 14, 21일차에 염색을 진행하여 관찰하였다(Figure 6). 평가결과 일반적으로 2가지 실험군 모두 시간이 지남에 따라 생성되는 칼슘양이 증가되는 것을 확인할 수 있었다. 특히, 지지체에 BMP-2를 도입함으로써 무기화된 칼슘의 양이 현저히 증가되는 것을 알 수 있었고, 본 연구에서 제조한 BMP-2-PDA-PGA 지지체가 MC3T3-E1 세포의 골 형성 분화를 촉진시킬 수 있음을 나타낸다.
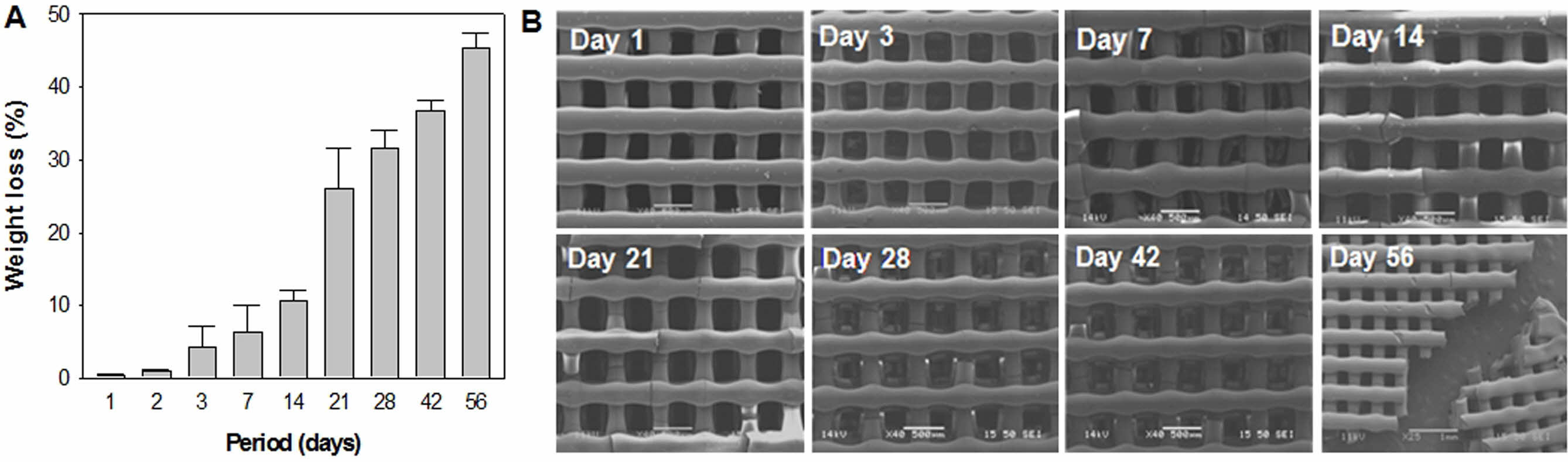
In vitro 가수분해 거동 분석. 제조된 BMP-2-PDA-PGA 지지체의 가수분해 거동 평가를 진행하였다. 실험은 1, 3, 5, 7, 14, 21, 28, 42, 56일 동안 진행하였으며 SEM 이미지 관찰을 통해 지지체의 표면 변화도 함께 관찰하였다(Figure 7). 지지체의 무게 감소율을 측정한 결과 1, 3일차는 각 0.3%와 0.9%의 중량감소를 보이며 가수분해가 거의 발생하지 않았다. 또한 14일차까지 10.64%의 점층적 중량감소를 보이는 것을 관찰할 수 있었다. 하지만 21일차에서는 2배 이상 빠른 속도로 분해되어 25.98%의 급격한 중량감소를 나타며 미세한 외력에도 붕괴되는 물성저하도 함께 나타났다. 이후의 거동은 앞 일차들과 비슷하게 점층적으로 생분해가 진행되었으며, 최종적으로 45.41%의 무게감소 결과가 관찰되었다.
SEM 이미지를 통하여 지지체 표면을 관찰한 결과 분해가 진행초기인 3일차까지는 표면에 변화가 일어나지 않았다. 7일차부터 표면 위 미세한 파단이 발생하였고, 분해가 진행됨에 따라 지지체의 파단 부분이 늘어났다. 또한 급격한 분해가 일어나기 시작한 21일차에는 파단부가 늘어남과 동시에 strand 직경 크기가 감소되는 것을 관찰할 수 있었다. 생분해 진행 관찰 마지막 날인 56일차에는 지지체의 파단으로 인하여 온전한 형태의 관찰이 어려워 조각만을 확인할 수 있었다.
가수분해 거동평가를 통해 지지체는 2주차까지 서서히 분해되다가 3주차부터 빠르게 분해가 진행되는 것을 관찰 할 수 있었고, 최종적으로 8주 동안 45.41%의 분해가 일어났다. 체내로 이식되는 지지체는 세포 부착 후 증식, 분화를 거쳐 새로운 골 조직이 형성됨에 따라 서서히 표면과 내부로 사라지는 생분해성을 가져야 한다. 이때 생분해 속도의 조절이 매우 중요한데 너무 빠른 생분해를 가지는 재료는 골 재생 기간 동안 지지체로써의 역할을 충분히 하지 못하고, 골 생성 완료 후에도 체내에 남아있다면 이물반응과 염증반응을 일으킬 수 있기 때문이다. 보통 6개월 이내의 생분해 기간이 가장 이상적이다. 제조된 지지체는 골 재생이 일어나는 8주 동안 서서히 분해되어 체내로 흡수되기 때문에 이물반응과 염증반응을 일으킬 가능성이 적어질 것으로 기대된다. 또한 8주 후에도 약 54.59% 남아있기 때문에 골 형성 기간 중 지지체로써의 역할을 수행할 수 있을 것이라 기대된다.
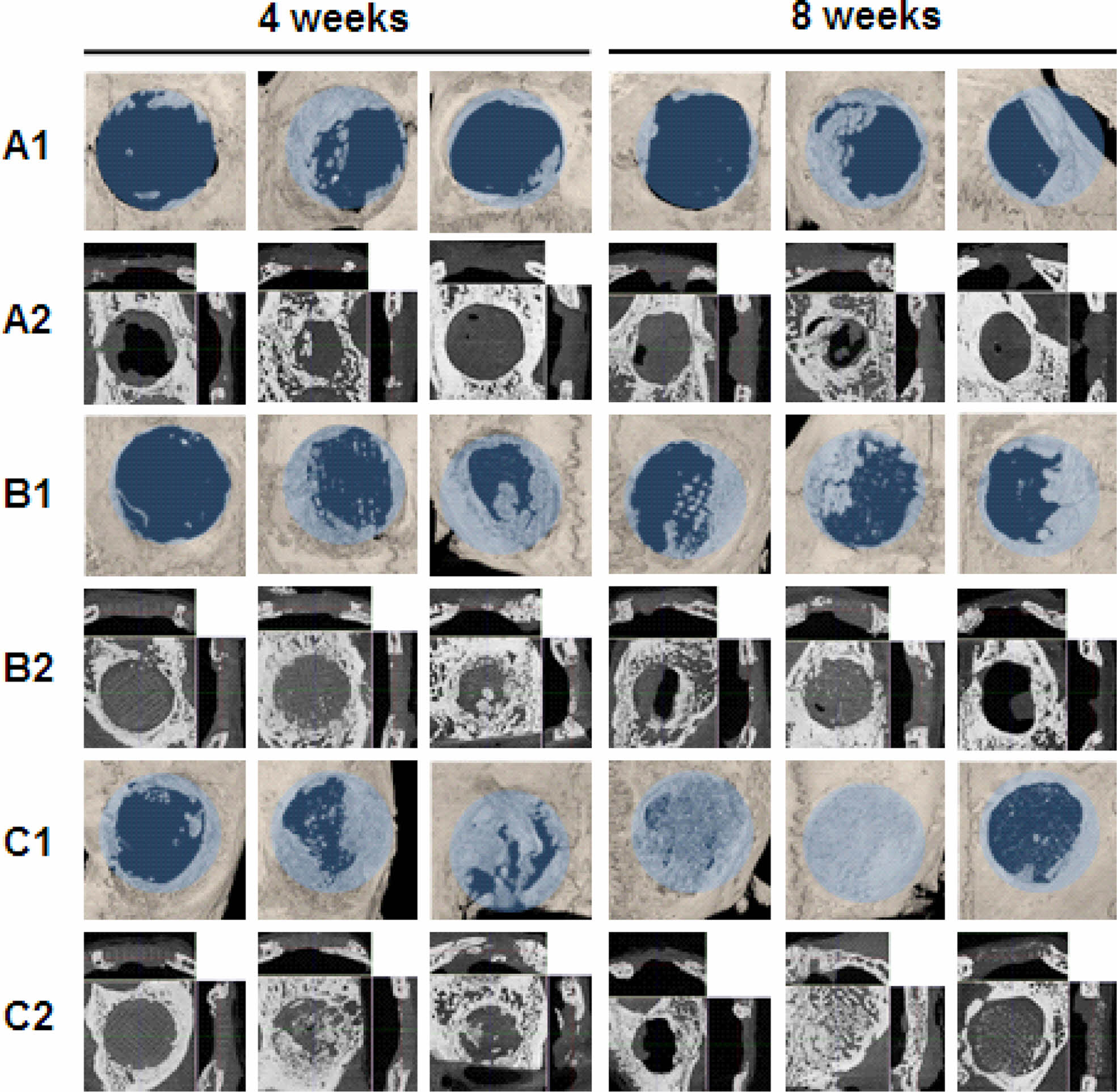
In vivo 골조직 재생 평가. 토끼 모델에 의한 두개골 결손의 재생은 의료 응용 분야의 실제 이식에 중요한 정보를 제공한다. Figure 8에서 볼 수 있듯이 micro-CT 이미지에서는 수술 4주 후 PGA 및 BMP-2-PDA-PGA 그룹이 대조군에 비해 골 형성이 더 큰 것으로 나타났다. 상단 표면과 수직 및 수평 단면은 각 그룹의 골 재생을 명확하게 시각화한다. BMP-2-PDA-PGA 그룹은 중요한 결손영역에서 균일한 골조직 재생을 나타낸 반면, 대조군은 결함 영역의 경계를 따라 무작위 골재생을 나타내었다. PGA 지지체는 골 조직 재생을 촉진했지만 BMP-2-PDA-PGA 그룹은 지지체 가닥을 따라 더 조밀한 골 재생을 나타내었다.
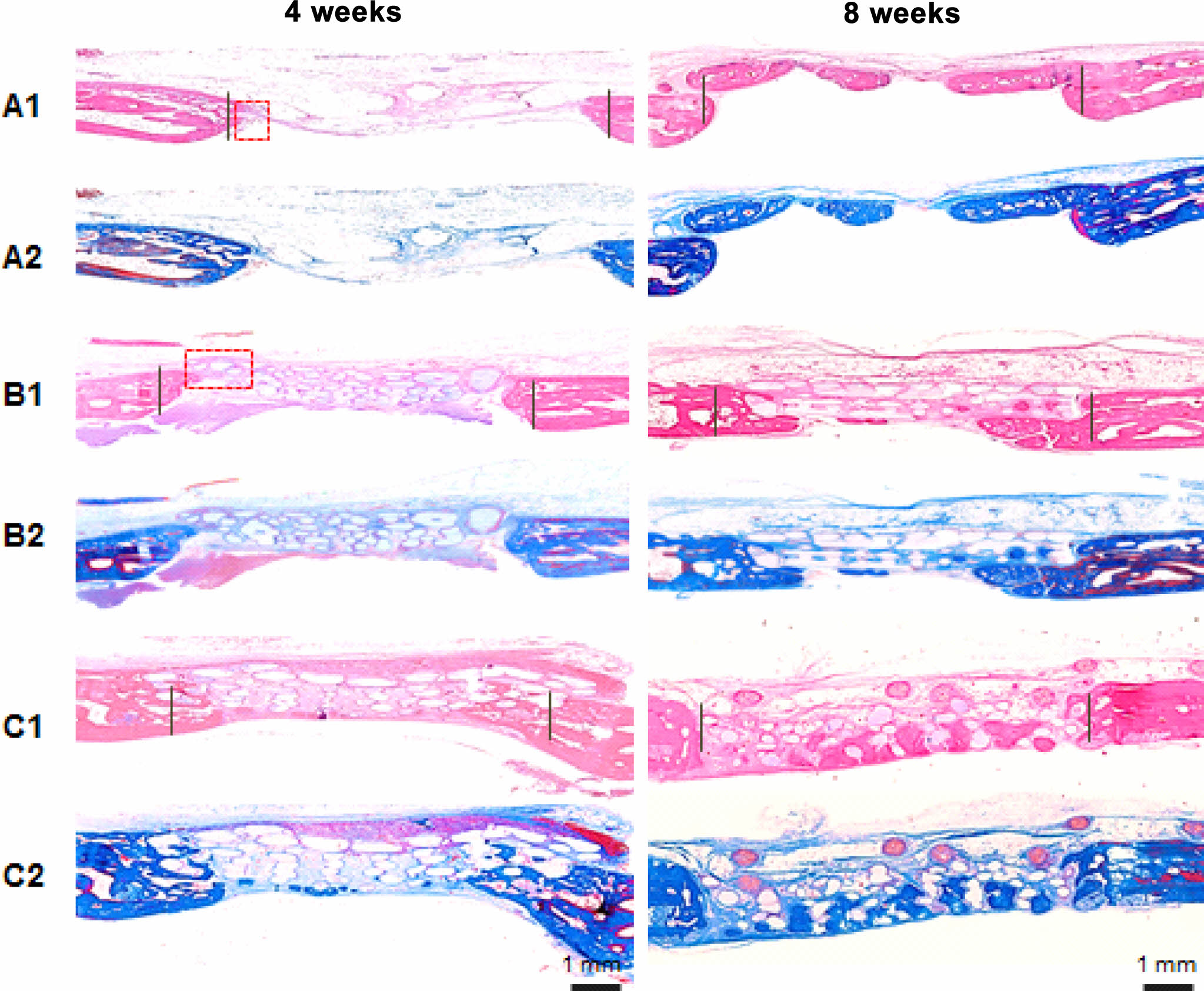
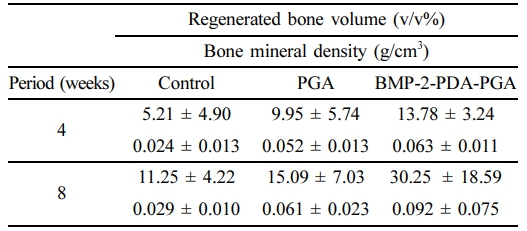
수술 후 4주와 8주에 hematoxylin-eosin과 Masson's trichrome염색을 통하여 연조직, 재생된 신생골, 검체의 원래 골조직의 결합조직 형태를 관찰할 수 있었다(Figure 9). 대조군은 4주 및 8주에 PGA 및 BMP-2-PDA-PGA 그룹과 비교하여 토끼 두개골의 천공 영역에서 연조직 침범으로 얇고 변형된 형태를 나타낸다. 대조적으로, BMP-2-PDA-PGA 그룹의 신생골은 지지체 가닥을 단단히 둘러싸고 있으며, 이는 세 그룹 중에서 골조직과 결합 조직의 가장 두꺼운 재생을 나타낸다. 그러나 4주차에서 대조군의 경우 결손 경계와 PGA 그룹의 경우 지지체 가닥 주변에서 약간의 염증 세포(호중구, 림프구, 거대 세포 대식세포)가 관찰되었다. 이러한 염증 세포는 수술 후 8주가 지나면 증식된 조골세포에 의해 캡슐화된다. 생체 내 이식 후 생분해 제품에 대한 면역 반응 및 부작용을 평가하는 것은 중요하다. 이러한 부분적인 염증에도 불구하고 새로운 골 조직은 조밀하게 형성되며 PGA strand의 분해를 기반으로 PGA 및 BMP-2-PDA-PGA 그룹의 전체 골조직 두께는 8주에 걸쳐 증가하였다. PGA는 면역학적으로 상대적으로 불활성인 것으로 보이며 우수한 임상결과를 갖고 있다.16-18 Kim 및 Lee의 연구에서도 BMP-2에 의한 조직재생능의 향상에 관한 검증이 확인되었으나, 본 연구에서와 같이 3D 프린팅 격자형 생체적합성 고분자 지지체에 표면처리 및 BMP-2 광고정법을 적용한 연구는 없었다.50,51 재생된 골량과 bone mineral density에 대한 정량적 산출값은 Table 2에 정리하였다. BMP-2-PDA-PGA 그룹의 재생골량과 bone mineral density는 대조군과 PGA 그룹에 비해 4주차 및 8주차에서도 일관되게 우수한 값을 나타내었다. 이는 3D 격자형 지지체의 구조가 신생골조직 공간을 효과적으로 제공하고, PGA 표면에 고정된 BMP-2가 지속적으로 골형성 자극을 유도한 복합적인 결과에 의한 것으로 사료된다.

|
Figure 2 Photomicrographs of PGA (A-D) and dopamine coated PGA (E-H) scaffolds (A, B, E, F; top / C, G; side / D, H; cross section). Mean strand diameters and pore lengths of PGA and dopamine coated PGA scaffolds were 199 ± 36 μm, 400 ± 14 μm and 238 ± 20 μm, 359 ± 13 μm, respectively. |
|
Figure 3 ATR-FTIR spectra of PGA (A), dopamine coated PGA (B), Azido-PGA (C), and BMP-2-PDA-PGA (D) scaffolds. |
|
Figure 4 Accumalated release amount of BMP-2 from BMP-2- PDA-PGA scaffolds in PBS solution (n = 3). |
|
Figure 5 Cell viability of PGA, PDA-PGA, and BMP-2-PDA-PGA scaffold groups (n = 3, NS means not significant). |
|
Figure 6 Absorption of alizarin red in PGA and BMP-2-PDA-PGA scaffolds by the calcium salt produced by the MC3T3-E1 cells. Immobilized BMP-2 promotes calcification of pre-osteoblasts (n = 3, ***p < 0.001). |
|
Figure 7 (A) Weight loss profile (n=3); (B) photomicrographs of BMP-2-PDA-PGA scaffolds depend on hydrolytic degradation time (37 ℃, PBS). |
|
Figure 8 Micro-CT images of the top surfaces (A1–C1); the perpendicular and horizontal sections (A2–C2) of the control (A); PGA (B); BMP-2-PDA-PGA; (C) scaffold groups after 4 and 8 weeks after rabbit calvarial defect model surgery (defect diameter = 8 mm, n = 3). |
|
Figure 9 Photomicrographs of hematoxylin-eosin (A1–C1) and Masson’s trichrome (A2–C2) staining of the control (A); PGA (B); the BMP2-PDA-PGA (C) scaffold groups at 4 and 8 weeks after rabbit calvarial defect model surgery. Dark blue represents the original bone and light blue represents the regenerated bone. The white irregular circles represent the scaffolds. The red dotted rectangles (A1, B1) indicate inflammatory cell area. |
|
Table 1 Surface Chemical Composition of PGA, PDA-PGA, Azido-PDA-PGA, BMP-2-PDA-PGA Scaffolds |
|
Table 2 Regenerated Rabbit Calvarial Tissue Volumes and Bone Mineral Densities on PGA, BMP-2-PDA-PGA Scaffold, and Controls by Performing an in vivo Animal Test (n = 3) |
본 연구에서는 3D 프린팅 기술을 이용하여 격자형 구조의 PGA 지지체를 제작한 후, BMP-2 표면고정화에 의한 골형성 자극의 지속성이 향상된 골조직공학용 지지체 개발을 목표로 하였다. UV 광고정 기술을 이용하여 BMP-2가 고정된 3D 지지체를 성공적으로 제조하였으며, ATR-FTIR과 XPS를 통해 개질 단계의 관능기 및 원소조성 변화를 확인하였다. 효소면역정량법을 이용하여 도입량의 79.34%의 BMP-2가 고정되었음을 확인하였고, 28일 동안 15.3%의 성장인자 방출거동을 확인하였다. In vitro 실험에서 MC3T3-E1 cell의 석회화된 골 기질 활성도를 alizarin red staining을 통하여 검증하였다. In vivo 동물모델 실험을 통하여 BMP-2가 고정된 PGA 지지체의 8주차 신재생 골조직 형성능이 30.25%로 가장 우수하였으며, bone mineral density 값도 0.092%로 가장 높았다. 더불어, 조직학적 분석에서 BMP-2가 고정된 PGA 지지체 그룹의 골조직형성의 우수성을 확인할 수 있있다. 따라서, 골형성 촉진인자인 BMP-2가 고정된 BMP-2-PDA-PGA 지지체는 성장인자의 burst release를 막아 지속적인 골세포 자극을 통해 골 조직의 재생을 향상시킬 수 있다는 것을 검증할 수 있었으며 골조직공학적 응용이 기대된다.
- 1. Langer, R.; Vacanti, J. P. Tissue Engineering. Science 1993, 260, 920-926.
-

- 2. Hollister, S. J. Porous Scaffold Design for Tissue Engineering. Nat. Mater. 2006, 4, 518-524.
-

- 3. Hubbell, J. A. Biomaterials in Tissue Engineering. Nat. Biotechnol. 1995, 13, 565-576.
-

- 4. Elanine, N. M.; Patricia, B. W.; Jon, B. M. HumanAnatomy and Physiology, 8th ed.; Benjamin/Cummings Pub. Co: California, 1989.
- 5. Bovin, G.; Menuier, P. J. The Mineralization of Bone Tissue: a Forgotten Dimension. Osteoporos. Int. 2003,14, 19-24.
-

- 6. Currey, J. D. Role of Collagen and Other Organics in the Mechanical Properties of Bone, Osteoporos. Int. 2003, 14, 29-36.
-

- 7. Gundbert, C. M. Matrix Proteins, Osteoporos. Int. 2003, 14, 37-42.
-

- 8. Knott, L.; Bailey, A. J. Collagen Cross-links in Mineralizaing Tissues: a Review of Their Chemistry, Function and Clinical Relevance. Bone, 1998, 22, 181-187.
-

- 9. Peter, A.; Ulrich, S.; Astrid, L.; Lutz, C. Mechanics and Mechano-Biology of Fracture Healing in Normal and Ostoeporotic Bone, Osteoporos. Int. 2005, 6, 36-43.
-

- 10. Thomas, P. R.; Richard, E. B.; Christopher, G. M. AO Principles of Fracture Management, 2nd ed.; Thieme: New York, 2000.
- 11. Rathner, B. D.; Hoffman, A. S.; Scheon, F. J.; Lemons, J. E. Biomaterals: Principles and Applications, Academic Press, 37-49, 1996.
- 12. Hench, L. L.; Clark, A. E.; Schaake, H. F. Effects of Microstructure on the Radiation Stability of Amorphos Semiconductors, J. Non Cryst. Solids 1972, 8, 837-843.
-

- 13. Finkemeier, Christopher G. Bone grafts and bone substitutes, The J. Bone. Joint Surgery, 2002, 84, 454-464.
-

- 14. Kuboki, Y.; Takita, H.; Kobayashi, D.; Tsuruga, E.; Inoue, M.; Murata, N. N.; Dohi, Y.; Ohgushi, H. BMP-induced Osteogenesis on the Surface of Hydroxyapatite with Geometrically Feasible and Nonfeasible Structure: Topology of Osteogenesis, J. Biomedical Mater. Res. 1998, 39, 90-99.
-

- 15. Kim, T.-H.; Kim, D.-E.; Sung, A.-Y. Study on the Functionality and Application of Natural-polymer with Biocompatibility, J. Korean Chem. Soc. 2009,53, 547-553.
-

- 16. Bret, D. U.; Lakshmi, S. N.; Cato, T. L. Biomedical Applications of Biodegradable Polymers, J. Polym. Sci. Part B: Polym. Phys. 2011, 49, 832-864.
-

- 17. Vineet, S.; Meena, T. Structure-Processing-Property Relationship of Poly(Glycolic Acid) for Drug Delivery Systems 1: Synthesis and Catalysis, Int. J. Polym. Sci. 2010, 1-23.
-

- 18. Yeo, T.; Ko, Y.-G.; Kim, E. J.; Kwon, O. K.; Chung, H. Y.; Kwon, O. H. Promoting Bone Regeneration by 3D-printed Poly(glycolic acid)/hydroxyapatite Composite Scaffolds, J. Industrial Eng. Chem. 2021, 94, 343-351.
-

- 19. Lee, W.-K. Development and Application of Hard Tissue Substitutes, KIC News, 2015, 18(4), 25-32.
- 20. Yun, Y.-R.; Kim, H.-W.; Jang, J.-H. Application of Growth Factors in Tissue generation, Biomaterals Research, 2013, 14, 133-137.
- 21. Elisa, M.; Anne, V.; Catherine, P. Elisabetta Ada Cavalcanti-Adam. Tuning cellular responses to BMP-2 with material surfaces, Cytokine Growth Factor Rev. 2016, 27,43-54.
-

- 22. Jeong, S.-Y.; Chang, W.-T.; Chang, Y.-S.; Ahn, M.-H.; Kim, J.-R.; Song, I.-H. Bone Formation by rhBMP-7 Transduced HEK 293 Cells in Nude Mouse, Yeungnam Univ. J. Med. 2003, 20, 142-151.
-

- 23. Tsuji, K.; Bandyopadhyay, A.; Harfe, B. D.; Coc, K.; Kakar, S.; Gerstenfeld, L.; Einhorm, T.; Tabin, C. J.; Rosen, V. BMP2 Activity, Although Dispensable for Bone Formation, is Required for the Initiation of Fracture Healing, Nature Genetics, 2006, 38, 1424-1429.
-

- 24. Wang, Z.; Wang, Z.; Lu, W. W.; Zhen, W.; Yang, D.; Peng, S. Novel Biomaterial Strategies for Controlled Growth Factor Delivery for Biomedical Applications, NPG Asia Materials, 2017, 9, 1-17.
-

- 25. Kim, E.-H.; Jeong, J.-H.; Han, G.-D.; Son, T.-I. Properties of Photo-Reactive Natural Polymer Derivatives and Its Applications, KIC News, 2015, 18(4), 1-9.
- 26. Lin, Q.; Gourdon, D.; Sun, C.; Holten-Anderson, N.; Anderson, T. H.; Waite, J. H.; Israeleachvili, J. N. Adhesion Mechanisms of the Mussel Foot Proteins mfp-1 and mfp-3, Proc. Natl. Acad. Sci. U.S.A. 2007, 104, 3782-3786.
-

- 27. Lee, H.; Dellatore, S. M.; Miller, W. M.; Messersmith, P. B. Mussel-Inspored Surface Chemistry for Multifuntional Coatings, PMC, 2007, 318, 426-430.
-

- 28. Kang, S. M.; Park, S.; Kim, D.; Park, S. Y.; Ruoff, R. S.; Lee, H. Simultaneous Reduction and Surface Functionalization of Graphene Oxide by Mussel-Inspired Chemistry, Adv. Funct. Mater. 2011, 21, 108-112.
-

- 29. Kim, J.; Park, E.; Kim, S.-Y.; Shin, J.-W.; Cho, D.-W. Fabrication of a SFF-based Three-dimensional Scaffold Using a Precision Deposition System in Tissue Engineering, J. Micromech. Microeng. 2008, 18, 27-55.
-

- 30. Gross, B. C.; Lockwood, J. L.; Chen, C.; Spence, D. M. Evaluation of 3D Printing and Its Potential Impact on Biotechnology and the Chemical Sciences, Anal. Chem. 2014, 86, 3240-3252.
-

- 31. Lee, S. J.; Lee, D.; Yoon, T. R. Kim, H. K.; Jo, H. H.; Park, J. S.; Lee, J. H.; Kim, W. D.; Kwon, I. K.; Park, S. A. Surface Modification of 3D-printed Porous Scaffolds via Mussel-inspired Polydopamine and Effective Immobilization of rhBMP-2 to Promote Osteogenic Diffentiation for Bone Tissue Engineering, Acta Biomaterialia, 2016, 40, 182-191.
-

- 32. Jeong, J.-H.; Kim, E.-H.; Han, G.-D.; Nah, J.-W.; Ito, Y. BMP-2 Immobilization by Phosphonated UV-curable Low-molecular-weight Chitosan Derivative on the Surface of Titanium, J. Industrial Eng. Chem. 2016, 34, 33-40.
-

- 33. Cho, S. W. The Introduction of X-ray Spectroscopy for Surface and Interface Electronic Structures, Vacuum Magazine, 2014, 1, 17-20.
-

- 34. Kapuscinski, J. DAPI: a DNA-specific Fluorescent Porbe, Biotech. Histochem. 1995, 70. 220-233.
-

- 35. Russel, W. C.; Newman, C.; Willamson, D. H. A Simple Cytochemical Technique for Demonstration of DNA in Cells Infected with Mycoplasmas and Viruses, Nature, 1975, 36, 461-462.
-

- 36. Park, B.-W.; Choi, M.-J.; Hah, Y.-S.; Cho, H.-Y.; Kim, D. R.; Kim, U.-K.; Kang, H.-J.; Kim, J.-R.; Byun, J.-H. Evalutaion of Osteogenic Activity of Periosteal-derived Cells Treated with Inflammatory Cytokines, J. Korean Assoc. Oral Maxillofac. Surg. 2010, 36, 341-345.
-

- 37. Ciara, M. M.; Matthew, G. H.; Fergal, J. O. The Effect of Meas Pore Size on Cell Attachment, Proliferation and Migration in Collagen-glycosaminoglycan Scaffolds for Boe Tissue Engineering, Biomaterals, 2010, 31, 461-466.
-

- 38. Levengood, S. K. L.; Polak, S. J.; Wheeler, M. B.; Maki, A. J.; Clark, S. G.; Jamison, R. D.; Johnson, A. J. W. Multiscale Osteointegration as a New Paradigm for the Design of Calcium Phosphate Scaffolds for Bone Regeneration, Biomaterials, 2010, 31, 3552-3562.
-

- 39. Salazar, P.; Martín, M.; González-Mora, J. L. Polydopamine-Modified Surfaces in Biosensor Application, In Polymer science: Research Advances, Practical Applications and Educational Aspects, Vilas A. M., Martín, A. S. Eds.; Formatex Research Center S.L.: Badajoz, 2016; pp 385-396.
- 40. Swartjes, J. J. T. M.; Sharma, P. K.; van Kooten, T. G.; van der Mei, H. C.; Mahmoudi, M.; Busscher, H. J.; Rochford, E. T. J. Current Developments in Antimicrobial Surface Coatings for Biomedicla Applications, Current Medical Chem. 2014, 22, 2116-2129.
-

- 41. Hong, S.; You, I.; Song, I. T.; Lee, H. Material-Independent Surface Functionalization Inspired byy Mussel-Adhension, Polym. Sci. Technol. 2012, 23, 396-406.
- 42. Kister, G.; Cassanas, G. Morphology of Poly(glycolic aicd)by IR and Raman Spectroscopies, Spectrochim. Acta A: Mol. Biomol. Spectrosc. 1997, 53, 1399-1403.
-

- 43. Park, S.-H.; Seo, S.-Y.; Kang, J.-H.; Ito, Y.; Son, T.-I. Preparation of Photocured Azidophenyl-fish Gelatin and Its Capturing of Human Epidermal Growth Factor in Titanium Plate, J. Appl. Polym. Sci. 2013, 127, 154-160.
-

- 44. Seo, S.-Y.; Park, S.-H.; Lee H. J.; Heo, Y.; Na, H. N.; Kim, K. I.; Han, J. H.; Ito Y.; Son, T. I. Coating of Titanium Plate by Photocurable Azidophenyl Chitosn Derivative for Application to Implants, J. Appl. Polym. Sci. 2013, 128, 4322-4326.
-

- 45. Gilde, F.; Maniti, O.; Gullot, R.; Mano, J. F.; Logeart-Acramoglou, D.; Sailhan, F.; Picart, C. Secondary Structure of rhBMP-2 in Protective Biopolymeric Carrier Material, Biomacromolecules, 2012, 13, 3620-3626.
-

- 46. Chung, K. H.; Park, S. H.; Kim, M. K.; Park, H. D.; Son, T. I. Stabilization of Epidermal Growth Factor on Thermal and Proteolytic Degradation by Conjugating with Low Molecular Weight Chitosan, J. Appl. Polym. Sci. 2006, 102, 5072-5082.
-

- 47. Chen, G.; Ito, Y.; Imanishi, Y., Photo-immobilization of Epidermal Growth Factor Enhances its Mitogenic Effect by Artificial Juxtacrine Signaling, Biochim. Biophys. Acta-Mol. Cell Res. 1997, 1358, 200-208.
-

- 48. Woo, Y. K.; Kwon, S. Y.; Lee, H. S.; Park, Y. S. Proliferation of Anterior Cruciate Ligaments Cells in vitro by Photo-immobilized Epidermal Growth Factor, J. Orthopaedic Res. 2007. 25, 73-80.
-

- 49. Huh, J. B.; Kim, S. E.; Kim, H. E.; Kang, S. S.; Choi, K. H.; Jeong, C. M.; Lee, J. Y.; Shin, S. W. Effects of Anodized Implants Coated with Escherichia Coli-derived rhBMP-2 in Beagle Dogs, Int. J. Oral Macillofacial Surgery, 2012, 41, 1577-1584.
-

- 50. Kim, S. E.; Song, S. H.; Yun, Y. P.; Choi, B. J.; Kwon, I. K.; Bae, M. S.; Moon, H. J.; Kwon, Y. D. The Effect of Immobilization of Heparin and Bone Morphogenic Protein-2 (BMP-2) to Titanium Surfaces on Inflammation and Osteoblast Function, Biomaterials, 2011, 32, 366-73.
-

- 51. Lee, S.-H.; Jo, J.-Y.; Yun, M.-J.; Jeon, Y.-C.; Huh, J.-B.; Jeong, C.-M. Effect of Immobilization of the Recombinant Human Bone Morphogenetic Protein 2 (rhBMP-2) on Anodized Implants Coated with Heparin for Improving Alveolar Ridge Augmentation in Beagle Dogs: Radiographic Obsevations, J. Korean Acad. Prosthodont. 2013, 51, 307-314.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2024; 48(4): 426-439
Published online Jul 25, 2024
- 10.7317/pk.2024.48.4.426
- Received on Apr 15, 2024
- Revised on Apr 22, 2024
- Accepted on Apr 23, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Oh Hyeong Kwon
-
Department of Polymer Science and Engineering, Kumoh National Institute of Technology, Gumi, Gyeongbuk 39177, Korea
- E-mail: ohkwon@kumoh.ac.kr
- ORCID:
0000-0002-7160-0105









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.