- Antibacterial Gelatin Composite Films Incorporated with Chitosan-Coated Cinnamon Essential Oil Liposome Nanoparticles
Department of Polymer Science and Engineering, Dankook University, 152 Jukjeon-ro, Suji-gu, Yongin-si 16890, Korea
- 키토산으로 코팅된 시나몬 에센셜 오일 리포솜 나노입자를 활용한 항균 젤라틴 복합필름의 제조
단국대학교 고분자시스템공학부 고분자공학전공
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
This study involved the preparation of a gelatin composite film with antimicrobial properties, utilizing chitosan-coated cinnamon essential oil (CEO) liposome nanoparticles, referred to as chitosomes. Liposomes were employed to encapsulate CEO, a natural antibacterial agent, aiming to minimize the release of volatile compounds and enhance oxidative stability. However, liposomes still demonstrate limited thermal stability for application as food contact materials (FCMs). Consequently, a chitosan coating layer was applied to the liposome surface to enhance its thermal resilience. The gelatin composite film containing the prepared chitosomes demonstrated an antimicrobial efficacy of at least 91.7% against Escherichia coli O157:H7 and Staphylococcus epidermidis. Additionally, it was observed that the film helped maintain the freshness of food and extended its shelf life due to its antioxidant effects. Based on these findings, the antibacterial gelatin composite film holds promise for application in environmentally friendly polymer-based FCMs, particularly in addressing concerns regarding potential cross-contamination and transmission.
본 연구에서는 키토솜을 활용하여 항균성을 가지는 젤라틴 복합필름을 제조하였다. 천연 항균물질인 시나몬 에센셜 오일을 리포솜으로 캡슐화하여 성분의 휘발 및 산화 방지를 통해 나노입자의 안정성을 향상시켰다. 그러나 리포솜은 식품접촉물질인 식품포장소재로 사용하기에는 온도와 같은 외부 환경조건에 대한 안정성이 낮다. 따라서 키토산 코팅으로 리포솜 막에 코팅층을 형성하여 열 안정성을 향상시켰다. 이와 같이 제조된 키토솜 나노입자가 도입된 항균 젤라틴 복합필름은 유해 박테리아인 대장균과 표피포도상구균에 대해 91.7% 이상의 높은 항균성을 보였다. 제조된 복합필름은 특히 병원성 미생물에 대한 교차감염과 전이를 차단할 수 있는 친환경성 고분자 기반의 식품접촉물질로써의 활용이 기대된다.
This study involved the preparation of a gelatin composite film with antimicrobial properties, utilizing chitosan-coated cinnamon essential oil liposome nanoparticles, referred to as chitosomes. The antibacterial gelatin composite film holds promise for application in environmentally friendly polymer-based food contact materials, particularly in addressing concerns regarding potential cross-contamination and transmission.
Keywords: composites, encapsulation, chitosan, antibacterial, food contact materials.
이 연구는 2024학년도 단국대학교 대학연구비 지원으로 연구되었음.
저자들은 이해상충이 없음을 선언합니다.
고분자는 모든 산업에서 중요한 기초 재료로 사용되며, 특히 식품산업에서는 수확, 가공, 저장, 포장, 운송 등 다양한 분야에서 활용되고 있다.1 식품접촉물질(food contact materials; FCMs) 중 대표적인 포장소재는 전 세계 플라스틱 총 소비량의 약 40%를 차지하며, 그 중요성이 매우 크다. 식품산업에서는 식품포장소재를 통해 유해 미생물(박테리아, 곰팡이)에 의한 교차감염 및 전이를 방지함으로써 식품안전을 확보를 위해 노력하고 있다. 식품포장소재의 경우 대부분 합성 고분자를 기반으로 하며 세계 시장에서 연간 1억 4600만 톤이 소비된다. 이 중 1억 4100만 톤이 폐기되며, 그 비율은 90% 이상을 차지하고 있다.2 따라서 식품포장소재 폐기물로부터 야기되는 환경문제 해결을 위해 친환경 고분자 소재에 대한 연구가 활발히 진행되고 있다.3 아울러 친환경적일 뿐만 아니라 식품안전을 위한 기능성을 갖춘 식품포장소재에 대한 관심이 증대되고 있는 추세이다.4 식품안전과 연관된 식품포장소재는 인체에 무해(무독성, 저독성)하며 외부 오염원(생물체, 무생물체)에 대한 오염방지 특성이 요구된다. 또한 현재 공중보건을 위협하는 새로운 병원성 미생물이 계속해서 등장하고 있어, 강력하면서도 지속적인 항균효과를 갖는 물질이 필요하다. 이에 식품 생산과 유통 과정에서 유해 박테리아로 인해 발생하는 교차감염 및 전이를 방지하기 위해 고분자와 항균물질을 결합시켜 박테리아를 사멸시키는 소재 제조와 표면처리 기술이 연구되고 있다.5
천연 항균물질인 에센셜 오일은 식물성 원료로부터 증기를 이용한 증류, 기계적인 가압을 통한 추출 등의 공정으로 얻어지며 친유성 및 휘발성 2차 대사물질로 구성되어 있다. 또한 항균, 항곰팡이, 항산화 특성으로 미국 식품의약국(U.S. Food and Drug Administration, FDA)에서 승인된 물질이다.6 에센셜 오일의 구성 성분은 알데하이드기와 페놀기가 많은 부분을 차지하고 있다.7 알데하이드기는 박테리아, 곰팡이를 살균하는 역할을 하며, 페놀기는 식품의 신선도를 유지시키는 항산화 효과를 통해 식품의 변질을 방지하여 보존기간을 연장시킬 수 있다.8,9 하지만 에센셜 오일은 물에 대한 용해도가 낮고 휘발성이 높아 열 안정성이 매우 낮다는 단점이 있다.
이를 개선하는 방법으로 항균물질을 나노캐리어에 흡수시키거나 고정시켜 서서히 방출시키는 방법이 있다.10 에센셜 오일을 효과적으로 분산시키면서 성분의 휘발 및 산화 방지와 같은 저장 안정성 향상을 위해 항균에 필요한 억제제의 방출을 조절할 수 있는 나노캡슐화 기술을 활용한다.11 나노캡슐화는 하나의 물질을 다른 물질 내에 가두어 입자를 생성하는 과정으로 정의되며, 코팅, 멤브레인, 쉘, 캐리어, 매트릭스의 역할을 하는 재료를 기반으로 항균 성분의 방출을 제어하고 외부 반응으로부터 보호한다.12 이러한 나노캡슐화 기술은 기능성 식품, 방부제, 흡수제 등 다양한 제품군에 응용이 가능하기 때문에 식품산업에서 매우 유망한 기술이다.13,14
리포솜은 나노캡슐 제조에 많이 사용되는 물질이며 천연 또는 합성 지질을 수성 매질에서 유화시킴으로써 하나 이상의 지질 이중층으로 구성된 구형의 지질 소포이다.15 리포솜은 생체 적합성과 구조 안정성이 우수하며, 합성이 용이하고 포집효율이 높아 나노캡슐화에 효과적으로 사용될 수 있는 장점이 있다.16 하지만 구성 요소인 인산지질의 화학적 분해에 대한 높은 반응성과 에스터 결합의 가수분해와 불포화 아실 사슬의 산화는 리포솜 막의 구조적 붕괴를 촉진한다. 또한 지질의 분해나 온도 변화로 인해 지질 이중층에서 캡슐화된 화합물의 상분리가 발생하며, 항균 성분 누출로 이어져 식품산업에 적용하는데 제한적이다.17
따라서 리포솜 막 표면에 코팅 기술 도입은 물리적, 화학적, 열 안정성을 향상시키는데 경제적이고 효과적인 방법으로 인식되고 있다. 천연 고분자 재료 중에서 키토산은 갑각류 껍질에서 유래된 친환경 고분자로 항균성, 콜레스테롤 감소, 면역 활성 등의 생리활성 기능이 있는 것으로 알려져 있다.18 키토산은 분자 간의 강한 수소결합으로 견고하게 결합되어 있으며, 음전하를 가지는 리포솜 막 표면과 상호작용하는 키토산의 양전하로 인해 내용물을 열로부터 보호하는 고분자 전해질 계면층을 형성한다.19 이에 키토산을 활용한 표면 코팅은 식품산업에서 식품포장소재로의 적용 가능성이 높다.20
본 연구에서는 식품산업에서 친환경 식품포장소재로 사용될 수 있는 젤라틴 복합필름에 유해 박테리아에 대한 교차감염 및 전이 방지를 통한 식품안전을 위한 항균성을 부여하기 위해 천연 항균물질인 시나몬 에센셜 오일(cinnamon essential oil, CEO)을 활용한 복합필름을 제조하였다. CEO은 휘발성이 높고 열에 대한 내성이 낮기 때문에 리포솜 막과 키토산 코팅을 활용한 나노캡슐화를 통해 나노입자의 안정성을 향상시켰다. 제조한 젤라틴 복합필름은 친환경적일 뿐만 아니라 유해 박테리아에 대한 높은 항균성을 가지고 있기 때문엔 식품안전을 위한 친환경 식품접촉물질로의 적용이 기대된다.
재료 및 시약. 키토솜(chitosome, chitosan-coated liposome; CCL) 제조를 위해 사용된 레시틴(TCI, Tokyo, Japan), 콜레스테롤(덕산화학, Seoul, Republic of Korea), 시나몬 에센셜 오일(cinnamon essential oil CEO, 버블뱅크, Daegu, Republic of Korea), 키토산(chitosan CTS, 대정화학, Seoul, Republic of Korea)을 구매하여 사용하였다. 복합필름 제조를 위해 사용된 젤라틴(gelatin Gel)과 용매인 아세트산은 OCI(Seoul, Republic of Korea)에서 구매하였으며, 가소제로 사용된 글리세롤은 삼전화학(Seoul, Republic of Korea)에서 구매하여 사용하였다.
키토솜 나노입자의 제조. 레시틴(10 mg/mL), 콜레스테롤(5 mg/mL), CEO(10 mg/mL)을 에탄올에 교반을 통해 용해시켰다. 이후 얻어진 유기 용액을 10 mL 주사기를 통해 60 ℃, 400 rpm 속도로 교반 중인 증류수에 주입하였다. 합성된 리포솜(CEO-liposome) 수용액을 40 ℃에 감압하여 회전 증발을 통해 에탄올과 증류수를 제거하였다. 이후 리포솜은 1.5%(w/v) 키토산 수용액과 교반하여 4 ℃에서 24시간 동안 냉장 보관하여 반응이 충분히 이루어지도록 하였다. 상층액을 제거하여 키토솜 나노입자를 얻었다.
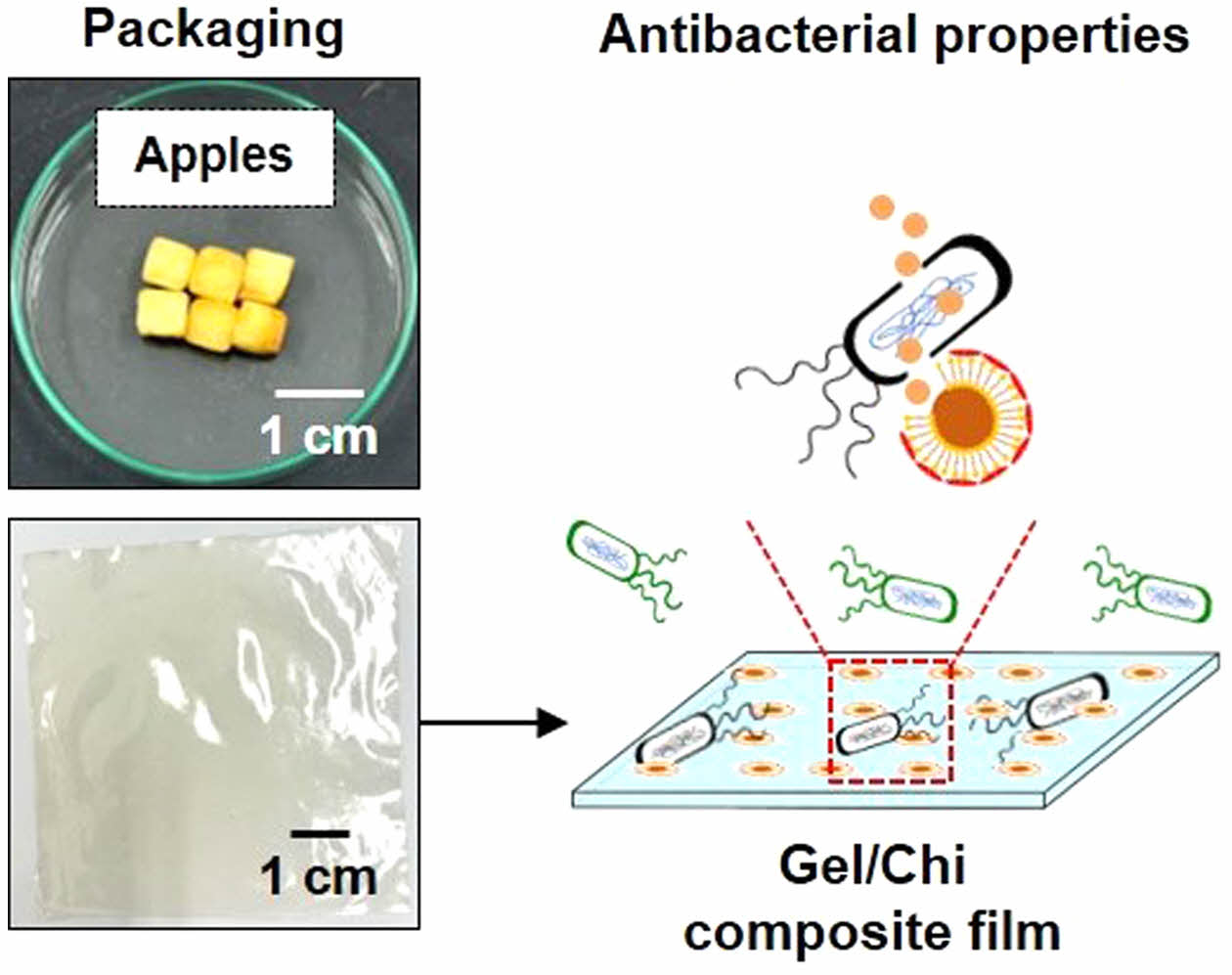
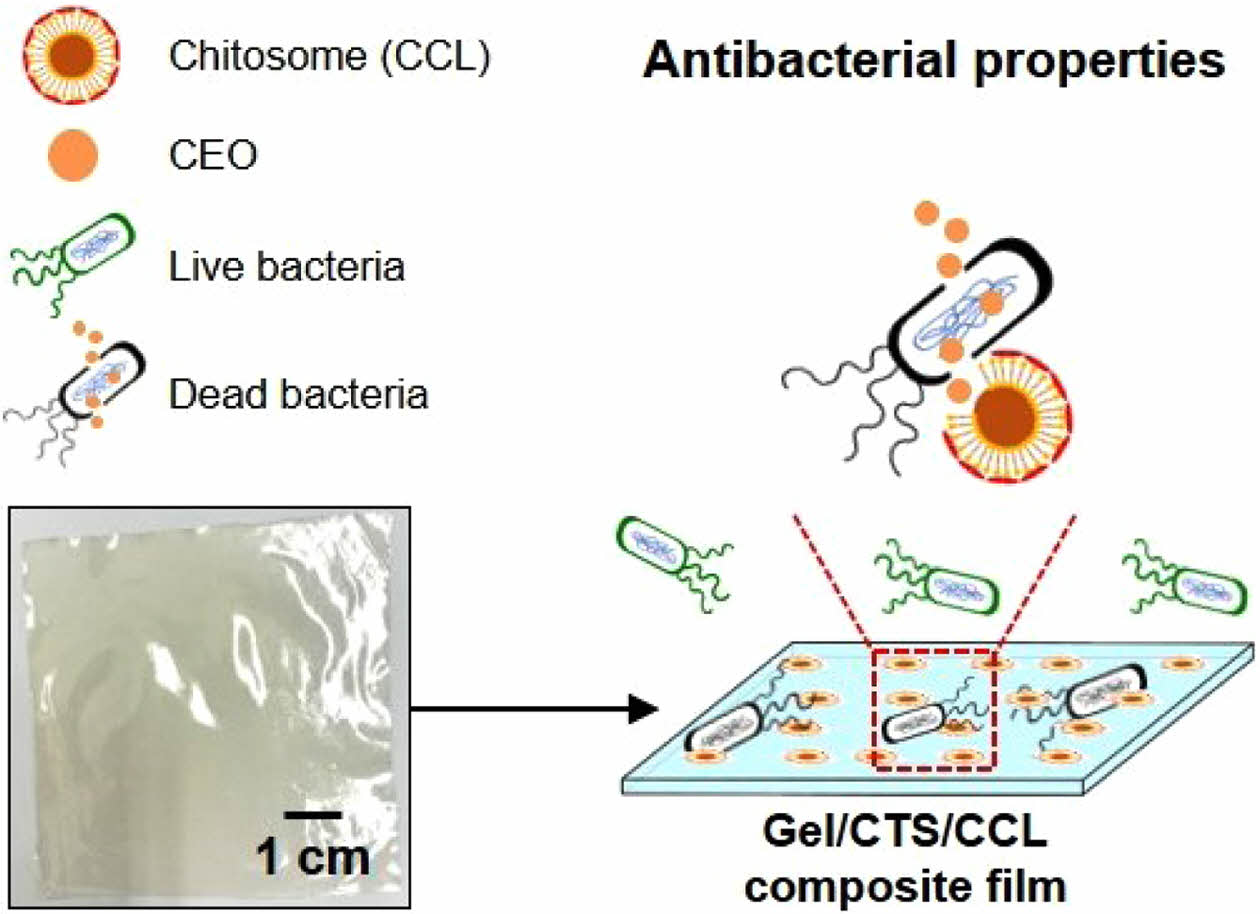
젤라틴-키토솜 복합필름의 제조. 용액 캐스팅 방법을 이용하여 복합필름을 제조하였으며 이를 위해 증류수 25 mL에 젤라틴 1 g을 45 ℃에서 30 분간 교반하였다. 이후 1.5%(w/v) 키토산 수용액 25 mL, 키토솜 수용액 20 mL, 글리세롤 0.41 g을 젤라틴 수용액에 첨가하여 45 ℃에서 30분간 교반하였다. 이어서 멸균 처리된 페트리디쉬에 부어 60 ℃에서 24시간 건조시킨 후 분리하여 항균 젤라틴 복합필름(gelatin/chitosan/chitosome composite film, Gel/CTS/CCL film)을 제조하였다(Figure 1).
FTIR을 통한 재료 표면의 화학적 분석. 합성된 키토솜과 제조된 복합필름 표면의 화학적 분석을 위해 푸리에변환적외선분광기(Fourier transform infrared spectroscopy, FTIR, Nicolet iS10, Thermo Fisher Scientific, Waltham, MA, USA)를 사용하였으며, 스텍트럼은 OMNIC software(Thermo Fisher Scientific)을 이용하여 분석하였다.
TGA를 통한 키토솜의 열 안전성 분석. 제조된 키토솜과 기존 CEO의 열 안정성 비교 분석을 위해 열중량분석기(thermogravimetric analysis, TGA, TGA Q50; TA Instruments, New Castle, DE, USA)를 사용하여 열분해 온도를 측정하였다.
입자 크기 및 제타포텐셜 측정. 제조된 리포솜과 키토솜의 입자 크기와 제타포텐셜은 수용액상에서 동적광산란(dynamic light scattering, DLS) 입자 크기 분석기(Otsuka ELSZ-2000, Otsuka Electronics Co., Ltd., Osaka, Japan)를 사용하여 측정하였다.
포집효율 측정. CEO의 포집효율(encapsulation efficiency, EE)은 표준곡선 측정을 통해 UV-Vis 분광광도계(UV-1650PC, Shimadzu, Kyoto, Japan)를 사용하여 계산되었다. CEO이 포함된 리포솜 혼합물은 원심분리기(Microfuge 16, Beckman Coulter, CA, USA)를 사용하여 15000 rpm으로 30분간 원심분리하였다. 100 uL의 상층액에 대해 UV-Vis 분광광도계 측정을 진행하였으며, 표준용액을 이용하여 표준곡선에서 캡슐화되지 않은 CEO 함유량을 산출하였다. 얻어진 값을 식 (1)에 대입하여 리포솜의 포집효율을 계산하였다.
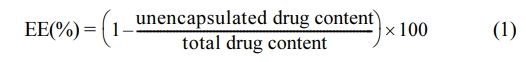
실험에 사용된 박테리아의 배양. 항균 특성을 확인하기 위한 실험에 사용된 tryptic soy agar(TSA), tryptic soy brother(TSB)는 Becton, Dickinson and Co.(Sparks, MD, USA)로부터, 펩톤은 삼전화학으로부터 구입하여 사용하였다. 실험에 사용된 박테리아인 그람 음성(Gram-negative) 대장균(Escherichia coli O157:H7, ATCC 25922)과 그람 양성(Gram-positive) 표피포도상구균(Staphylococcus epidermidis, ATCC 12228)을 한국 미생물 보존센터(Seoul, Republic of Korea)에서 제공받아 배양시킨 후에 사용하였다. 배양시에 사용한 모든 실험 기구는 고압증기 멸균기를 사용하여 멸균 처리하였다.
박테리아 접종 및 항균 실험. 복합필름의 유해 박테리아에 대한 항균 특성을 확인하기 위해서 샘플을 에탄올/물 혼합액을 이용하여 세척한 후 10 × 10 × 1 mm 크기로 준비하였다. TSA 배지에 루프를 이용하여 희석 용액인 균주 10 μL를 9 mL의 TSB에 옮겨 37 ℃에서 24시간 배양하여 박테리아 현탁액을 준비하였다. 합성된 키토솜을 포함하는 항균 젤라틴 복합필름의 생물체 오염인 박테리아에 대한 항균 특성을 확인하기 위하여 농도가 2.3 × 106 ± 2.5 CFU/mL인 E. coli O157:H7와 농도가 3.5 × 106 ± 1.1 CFU/mL인 S. epidermidis 현탁액 9 mL 각각에 2시간 동안 침지시켰다. 복합필름이 침지되었던 박테리아 현탁액 1 mL 채취하여 펩톤 용액 9 mL에 희석하여 TSA 배지에 분주한 후 37 ℃에서 24시간동안 배양하였다. 배양된 박테리아 분포를 직접 계수하여 제조된 젤라틴 복합필름의 항균 특성을 정량화하였으며 모든 실험은 5회 반복하여 경향성을 확인하였다.
식품포장 능력 평가. 복합필름의 식품보관 능력을 평가하기 위해 신선한 사과를 2 × 2 × 2 cm의 크기로 준비하여 무게 변화와 갈변현상을 관찰하였다. 먼저 페트리디쉬에 사과 3조각을 미처리 젤라틴 복합필름과 항균 젤라틴 복합필름으로 포장하여 상온에서 7일간 보관하였다. 24시간 간격으로 사과의 무게를 측정하고 사진을 촬영하여 변화를 확인하였다.
기계적 물성 분석.복합필름의 기계적 물성 확인을 위해 만능시험기(universal test machine; UTM, LR30K, Lloyd Instruments Ltd., Bongnor Regis, United Kingdom)를 사용하였다. 미처리 젤라틴 복합필름과 항균 젤라틴 복합필름 샘플을 50 × 10 × 1 mm 크기로 준비한 후 1 kN의 로드셀을 이용하여 정하중과 함께 시험속도 10 mm/min, 표점거리 30 mm의 조건에서 최대 400%까지 연신을 진행하였으며 5회 반복 실험을 하였다.
통계분석. 박테리아 실험의 결과값은 통계분석을 위해 로그값으로 변환되었다. 일원배치 분산분석과 투키의 사후 검정을 사용하여 유의수준 0.05에서 미처리 복합필름과 항균 복합필름의 항균 실험 결과가 유의미한 차이가 있는지 확인하였다. 모든 통계분석은 Analysis ToolPak in Excel(Microsoft Corp, Redmond, WA, USA) 패키지를 이용하여 수행하였다.
|
Figure 1 Schematic representation and photograph of Gel/CTS/CCL film and its antibacterial properties. |
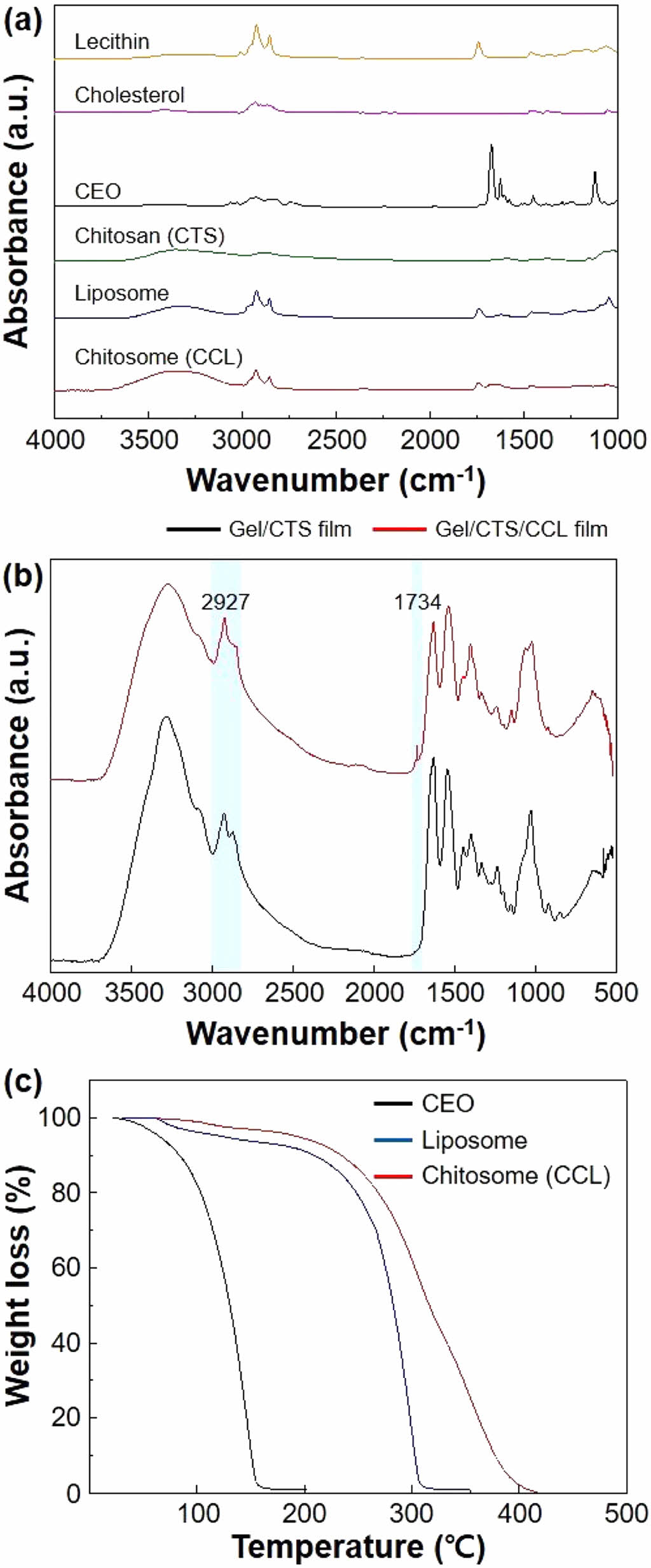
복합필름의 화학적 특성 및 열 안정성. Figure 2(a)에서는 레시틴, 콜레스테롤, CEO, 키토산, 리포솜, 키토솜의 FTIR 스펙트럼을 보여준다. 레시틴은 3281, 1740 cm-1에서 각각 O-H, C=O 스트레칭이 나타나며, 1170, 1062 cm-1에서 C-O, C-C 밴딩이 나타난다. 콜레스테롤은 3415 cm-1에서 O-H 스트레칭이 나타나며, 3000-2800 cm-1에서 CH2, CH3의 대칭 및 비대칭 스트레칭이 나타난다.21 CEO는 1600-1500 cm-1의 영역에서 오일 성분의 베타-펠란드렌의 C=C 스트레칭, 1710-1700 cm-1의 영역에서 보닐 아세테이트의 C=O 스트레칭으로 확인할 수 있다.22 키토산을 친수성의 포스파티딜콜린 분자와 소수성의 아실 사슬을 포함하는 리포솜에 코팅함에 따라 피크 값의 변화가 나타난다. 리포솜의 PO2-의 대칭 스트레칭이 1045 cm-1에서 1052 cm-1로 이동하였으며, 키토산의 C=O 스트레칭이 1674 cm-1에서 1648 cm-1로 이동하였다.23 이를 통해 키토산의 아민기와 인산기 간의 정전기적 인력을 통해 키토솜이 형성되었음을 알 수 있다.24,25
Figure 2(b)에서는 미처리 젤라틴 복합필름(Gel/CTS film)과 항균 젤라틴 복합필름(Gel/CTS/CCL film)의 FTIR 스펙트럼을 보여준다. 미처리 젤라틴 복합필름은 1672 cm-1에서 C=O 스트레칭, 1534 cm-1에서 N-H 밴딩 및 C-N 스트레칭, 1246 cm-1에서 글리신의 CH2 진동이 나타나며, 이는 각각 아마이드-I, 아마이드-II, 아마이드-III 그룹을 나타낸다. 항균 젤라틴 복합필름은 미처리 젤라틴 복합필름과 비교하여 피크 값의 미세한 이동을 볼 수 있다. 2927 cm-1에서 C-H의 메틸렌 비대칭 및 대칭 신축 진동과 키토솜의 -CH2, -CH3에 의해 피크값이 증가하였다. 또한 1734 cm-1에서 새로운 피크가 나타나는데 이는 레시틴 내 트라이글리세라이드 C=O 스트레칭을 의미한다. 이를 통해 젤라틴 복합필름과 키토솜은 화학적 반응 없이 물리적으로 혼합되었음을 알 수 있다.26
Figure 2(c)에서는 CEO, 리포솜, 키토솜의 TGA 그래프를 보여준다. CEO의 열분해 온도는 약 50.5 ℃인 반면, 리포솜으로 캡슐화된 이후의 열분해 온도는 207.1 ℃로 열분해 온도가 크게 증가하였다. 이는 CEO이 레시틴과 콜레스테롤에 의해 안정적인 리포솜 나노캐리어 형태로 합성이 되었기 때문이다. 키토솜의 경우 리포솜에 비해 열분해 온도가 상승한 것을 확인할 수 있다. 리포솜은 지질 이중층이 열에 의해 상전이가 일어나면서 유체 결정상이 동시에 존재하여 막 투과도가 증가하고 CEO이 방출됨에 따라 분해가 이루어진다. 하지만 키토산 코팅에 의해 형성된 코팅층은 상대적으로 강한 정전기적 상호작용과 입체 방해 효과에 의해 지질체 구조의 무결성을 효과적으로 보존하고 이에 따라 열분해 온도가 높아진다.27
입자 크기, 제타포텐셜 및 포집효율. Table 1에서 리포솜과 키토솜의 DLS 측정 결과를 보여준다. 제조된 리포솜의 평균 입자 크기는 179.5 ± 1.9 nm의 크기를 가지며, 키토솜은 339.7 ± 16.0 nm의 입자 크기를 갖는 것으로 확인되었다. 이는 키토산의 아민 그룹과 리포솜의 인지질 그룹 간의 정전기적 상호작용을 통한 리포솜 막 표면에 자가조립으로 리포솜에 얇은 코팅층이 형성되었다. 추가적으로 리포솜과 키토솜의 제타포텐셜 값을 보여주며 리포솜의 제타포텐셜은 -48.1 ± 0.9 mV이고, 키토솜의 제타포텐셜은 +56.5 ± 0.8 mV이다. 이는 리포솜의 표면 전하가 포스파티딜세린 성분으로 음전하를 띄며, 키토솜 구조 내의 아민 그룹이 양전하를 띄기 때문이다.28
Table 1에서 리포솜과 키토솜의 포집효율을 나타내었으며 각각 85.19 ± 1.28%, 92.30 ± 1.41%로 나타났다. 이는 제타포텐셜의 변화에 따른 결과이다. 일반적으로 입자의 제타포텐셜 절댓값이 클수록 정전기적 척력이 강하게 발생됨에 따라 입자 간의 충돌과 응집을 방지하여 높은 포집효율을 보인다.29
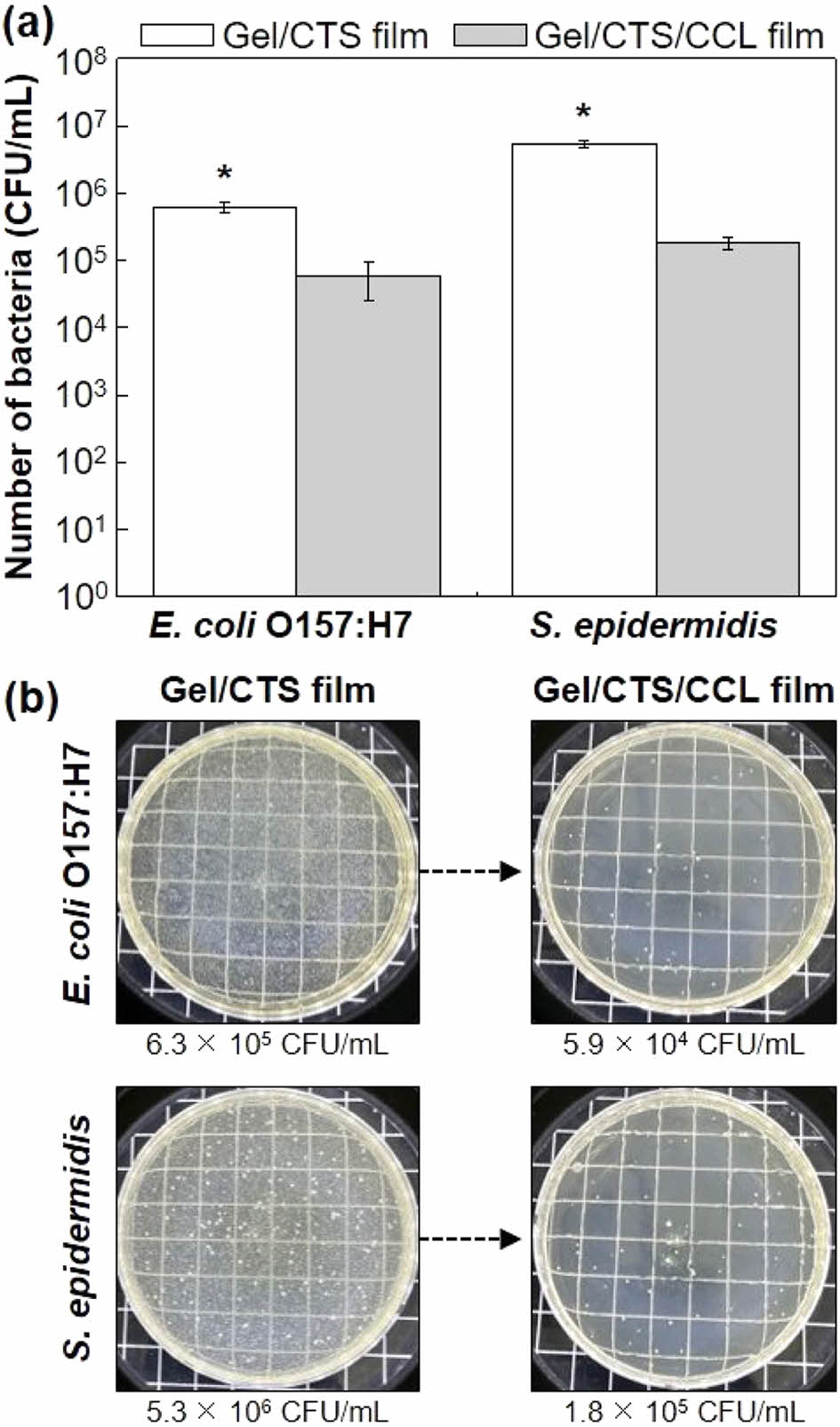
복합필름의 박테리아에 대한 항균 특성. 생물체 오염원인 E. coli O157:H7와 S. epidermidis를 이용하여 항균 젤라틴 복합필름의 박테리아에 대한 항균 특성 결과를 그래프와 배지 플레이트 사진으로 각각 나타내었다(Figure 3). 미처리 젤라틴 복합필름과 같이 배양된 E. coli O157:H7의 군집 수는 6.3 × 105 ± 1.2 CFU/mL이며, 항균 젤라틴 복합필름과 같이 배양된 박테리아 군집 수는 5.9 × 104 ± 1.2 CFU/mL 로 약 91.7% 이상 감소하였다. 마찬가지로 미처리 젤라틴 복합필름과 같이 배양된 S. epidermidis의 군집 수는 5.3 × 106 ± 1.2 CFU/mL이고, 항균 젤라틴 복합필름과 같이 배양된 박테리아 군집 수는 1.8 × 105 ± 0.4 CFU/mL로 약 97.0% 이상 감소한 것을 확인하였다. 이처럼 박테리아에 대한 항균 특성은 항균 젤라틴 복합필름의 키토솜과의 접촉에 의해 발생한다.30 구체적으로 살펴보면, 전기역학적 결합, 반데르발스 힘, 정전기적 인력 등을 통해 키토솜이 박테리아에 흡착이 되며 박테리아 내에 CEO이 침투되게 된다.31 방출된 CEO은 박테리아 세포벽의 막 투과성 저하와 손상을 유발하여 박테리아 내부 물질의 손실을 발생시켜 항균 특성이 발현된다.32
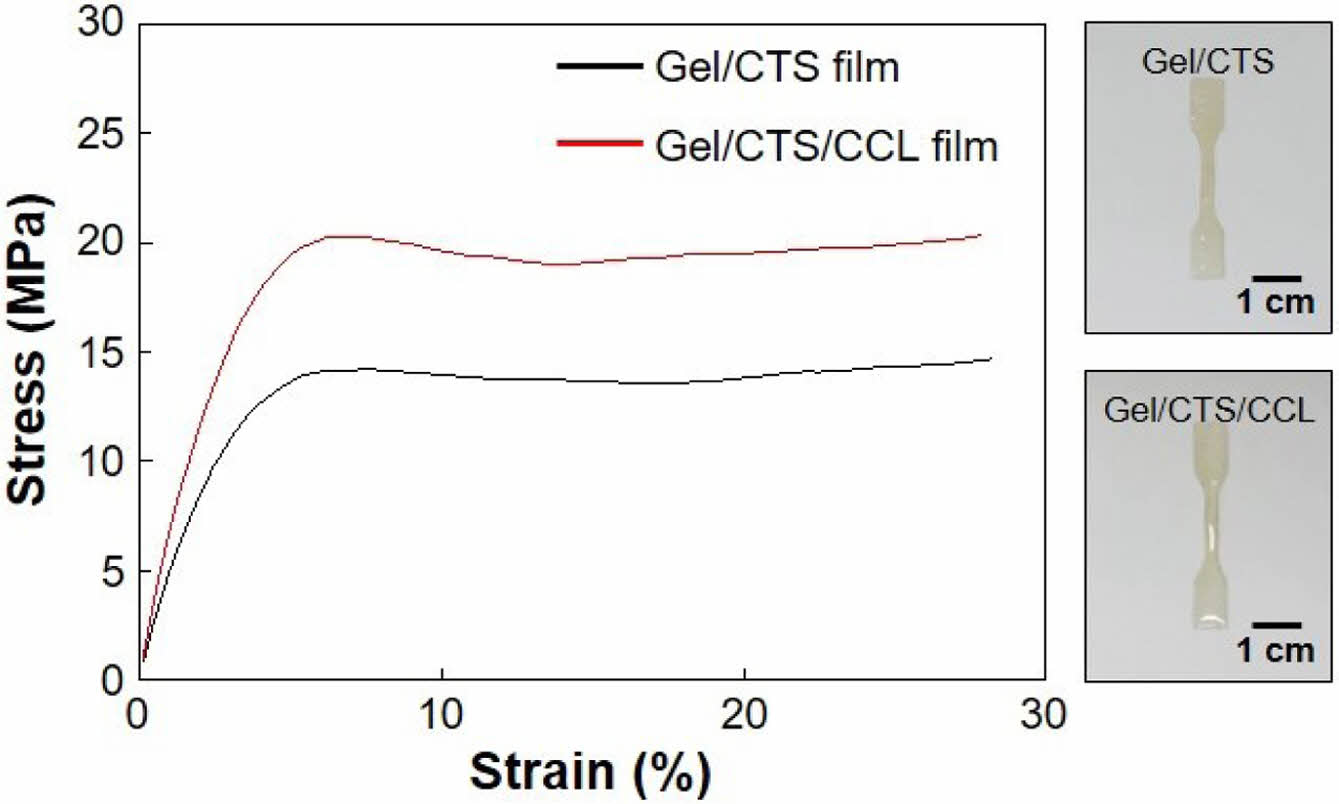
복합필름의 기계적 물성. 미처리 젤라틴 복합필름과 키토솜을 포함하는 항균 젤라틴 복합필름의 기계적 물성은 UTM을 이용한 측정을 통해 확인하였다. Figure 4에서 응력-변형률 곡선을 통해 확인할 수 있듯이 키토솜이 포함되지 않은 젤라틴 복합필름의 인장강도(tensile strength)는 15.19 ± 0.59 MPa, 영률(Young’s modulus)은 634.40 ± 1.22 MPa이며, 키토솜이 포함된 젤라틴 복합필름의 인장강도는 20.67 ± 0.35 MPa, 영률은 850.24 ± 35.62 MPa로 확인되었다. 키토솜이 포함된 젤라틴 복합필름의 인장강도가 미처리 젤라틴 복합필름 대비 37.8% 증가되었는데 이는 키토솜으로 인한 키토산과 CEO의 함유량이 높아졌기 때문이다.33 결론적으로 젤라틴, 키토산, CEO 간의 정전기적 상호작용과 수소결합을 통해 안정적이고 밀도가 높은 필름 네트워크를 형성하게 되면서 인장강도가 향상되었다.34
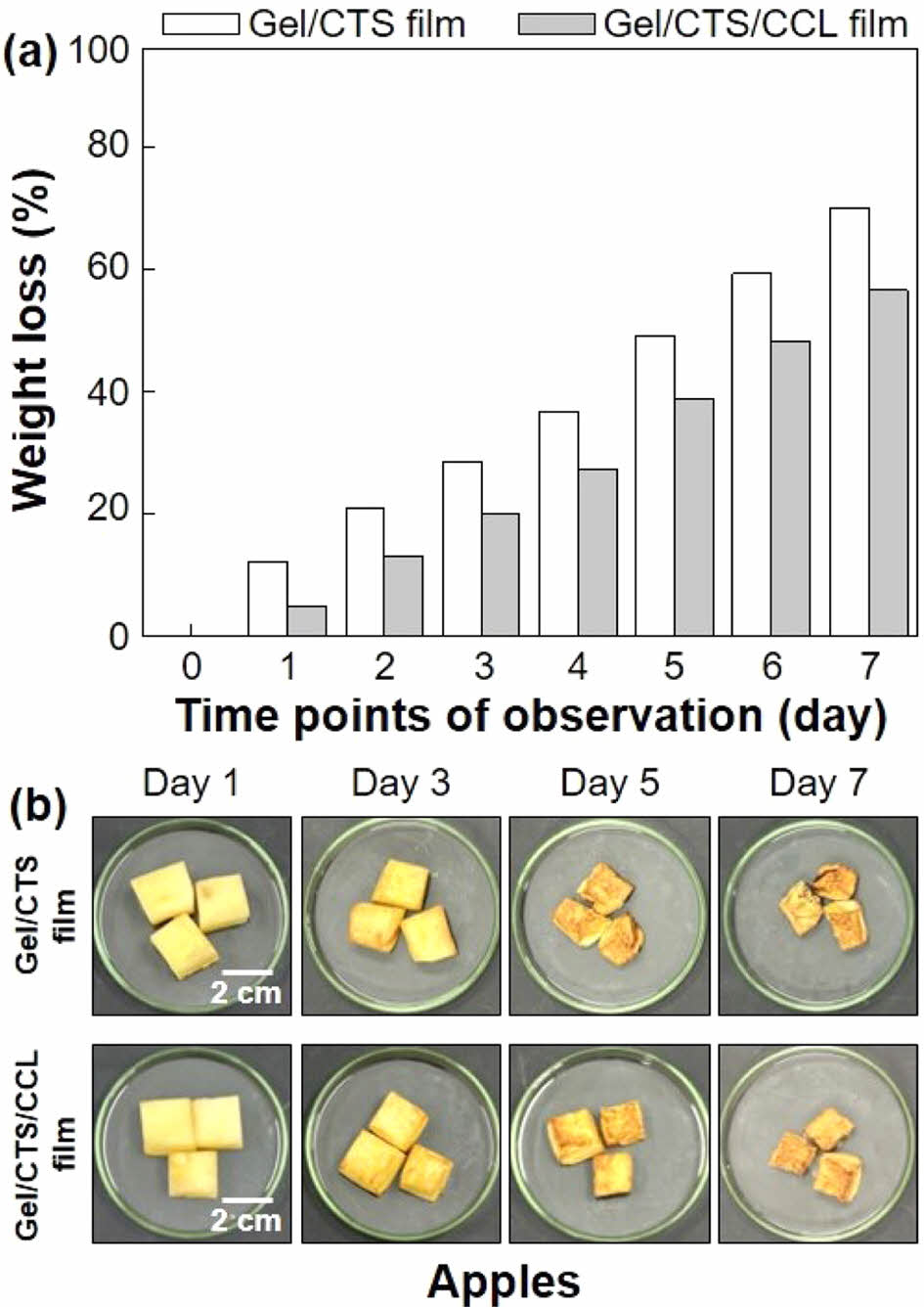
식품포장 효과 평가 결과. 식품의 보관 과정에서 중량 감소는 수분 손실과 관련이 있으며 이는 식품의 변질에 영향을 미친다.35 식품은 박테리아 오염원이나 산소로 인한 효소작용으로 갈변현상이 쉽게 일어난다.36 본 연구에서는 사과의 중량 감소와 갈변현상을 관찰함에 따라 식품포장소재로의 적용 가능성을 확인하였다. Figure 5(a)는 7일간 보관 기간에 따른 중량 손실률을 보여준다. 7일간 젤라틴 복합필름의 중량 손실률은 70.1%까지 증가하였으며, 이는 지속적인 수분 손실로 인한 결과이다. 하지만 항균 젤라틴 복합필름의 경우 7일간 중량 손실률은 56.5%으로 미처리 젤라틴 복합필름에 비해 중량 손실률을 낮출 수 있었다. 이처럼 사과의 수분 손실은 항균 젤라틴 복합필름의 키토솜에 의해 발생한다. 구체적으로 키토솜에서 에센셜 오일이 방출됨에 따라 젤라틴과 키토산 사슬의 반응기와 공유결합을 형성하여 사슬의 하이드록실기와 아민기의 가용성이 감소하게 된다. 따라서 필름과 수분간의 수소결합이 제한적이기에 수분 손실을 막아줄 수 있다.37
Figure 5(b)에서 보이는 것과 같이 사과의 갈변현상을 중량 손실률 변화 유사하다. 미처리 젤라틴 복합필름에 보관된 사과는 5일차에서 표면이 점차 어두워지기 시작하며서 수분 손실로 인해 부피가 줄어들었다. 반면 항균 젤라틴 복합필름에 보관된 사과는 5일차에서 표면의 색 변화가 이루어졌으나 그 정도가 상대적으로 크지 않으며 부피 변화도 적었다. 7일차에는 미처리 젤라틴 복합필름에 보관 중이던 사과는 완벽히 갈변현상이 이루어졌으며 수분 손실로 인한 수축이 많이 진행되었다. 하지만 항균 젤라틴 복합필름에 보관 중이던 사과는 미처리 젤라틴 복합필름에 비해 색 변화가 지연되었으며 부피 변화 또한 여전히 크지 않았다. 이러한 결과를 토대로 키토솜이 첨가된 항균 젤라틴 복합필름은 식품의 수분 손실과 갈변현상을 억제하여 보존기간을 연장시키고 안전성과 신선도를 높이는 식품포장소재로 사용될 수 있는 가능성을 확인하였다.38
|
Figure 2 (a) FTIR spectra are shown for lecithin, cholesterol, CEO, chitosan (CTS), liposome, and chitosome (CCL); (b) FTIR spectra of Gel/CTS film and Gel/CTS/CCL film are provided; (c) TGA thermograms depicting CEO, liposome, and chitosome (CCL) are displayed |
|
Figure 3 (a) Graph shows the antibacterial efficacy of both Gel/ CTS film and Gel/CTS/CCL film surfaces against E. coli O157:H7 and S. epidermidis (asterisk indicate statistically significant differences at p < 0.05); (b) photographs of the bacterial colonies that developed on agar plates treated with Gel/CTS film and Gel/CTS/ CCL film. |
|
Figure 4 Stress-strain diagram is provided for both Gel/CTS films and Gel/CTS/CCL films. Photographs on the left are examples of the Gel/CTS and Gel/CTS/CCL dog-bone shaped samples. |
|
Figure 5 (a) Weight loss (%) in apples packed with Gel/CTS films and Gel/CTS/CCL films over a period of 7 days is presented; (b) impact on the visual appearance changes of apples is examined. |
|
Table 1 The Particle Size, Polydispersity Index (PDI), Zeta Potential, and Encapsulation Efficiency (EE) of Both Liposome and Chitosome (CCL) Are Measured |

본 연구에서는 키토솜을 활용하여 항균성을 가지는 젤라틴 복합필름을 제조하였다. CEO을 리포솜으로 캡슐화함에 따라 성분의 휘발 및 산화를 방지하였으며 키토산으로 리포솜을 코팅함에 따라 열 안정성을 향상시켰다. 이와 같이 제조된 키토솜 나노입자를 젤라틴 복합필름에 첨가함에 따라 91.7% 이상의 항균성을 나타내었다. 기존 젤라틴 복합필름과 비교하였을 때 기계적 물성이 개선되었으며, 식품포장소재에 적용한 결과 수분 손실과 갈변현상을 지연하였다. 이상의 연구 결과로부터 천연 항균물질인 CEO을 리포솜 캡슐화와 키토산 코팅으로 나노입자의 물리적, 화학적, 열 안정성을 증가시켰으며 이를 활용한 항균 젤라틴 복합필름은 생물체 오염원에 대한 우수한 항균 특성을 가지고 있어, 향후 식품산업에서 식품안전을 위한 친환경 식품접촉물질로의 적용이 기대된다.
- 1. Ding, Q.; Zhu, H. The key to solving plastic packaging wastes: Design for recycling and recycling technology. Polymers 2023, 15, 1485.
-

- 2. Meijer, L. J. J.; Emmerik, T. V.; Ent, R. V. D.; Schmidt, C.; Lebreton, L. More Than 1000 Rivers Account for 80% of Global Riverine Plastic Emissions into the Ocean. Sci Adv. 2021, 7, eaaz5803.
-

- 3. Porta, R; Sabbah, M.; Pierro, P. D. Biopolymers as Food Packaging Materials. Int. J. Mol. Sci. 2020, 21, 4942.
-

- 4. Zhao, Y.; An, J.; Su, H.; Li, B.; Liang, D.; Huang, C. Antimicrobial Food Packaging Integrating Polysaccharide-based Substrates with Green Antimicrobial Agents: A Sustainable Path. Food. Res Int. 2022, 155, 111096.
-

- 5. Lee, M. H.; Kim, D. H.; Kim, J. Y.; Oh, J. K.; Castaneda, H.; Kim, J. H. Antibacterial Activities of Thermoplastic Polyurethane/clay Nanocomposites Against Pathogenic Bacteria. ACS Appl. Bio Meter. 2020, 3, 10, 6672-6679.
-

- 6. Turek, C.; Stintzing, F. C. Stability of Essential Oil: A Review. Compr. Rev. Food. Sci. Food Saf. 2013, 12, 40-53.
-

- 7. Dhifi, W.; Bellili, S.; Jazi, S.; Bahloul, N.; Mnif, W. Essential Oils’ Chemical Characterization and Investigation of Some Biological Activities: A Critical Review. Medicines 2016, 3, 25.
-

- 8. Aljaafari, M.; Alkhoori, M.; Hag, A. M. Contribution of Aldehydes and Their Derivatives to Antimicrobial and Immunomodulatory Activities. Molecules 2022, 27, 3589.
-

- 9. Zeb, A. Concept, Mechanism, and Application of Phenolic Antioxidants in Foods. J. Food. Biochem. 2020, 44, e13394.
-

- 10. Liu, S.; Zheng, J.; Hao, L.; Yegin, Y.; Bae, M.; Ulugun B.; Taylor, T. M.; Sholar, E. A.; Cisneros-Zevallos, L.; Oh, J. K.; Akbulut, M. Dual-functional, Superhydrophobic Coatings with Bacterial Anticontact and Antimicrobial Characteristics. ACS Appl. Mater. Interfaces 2020, 12, 21311-21321.
-

- 11. Ruengvisesh, S.; Oh, J. K.; Kerth, C. R.; Akbulut, M.; Taylor, T. M. Inhibition of Bacterial Human Pathogens on Tomato Skin Surfaces Using Eugenol-loaded Surfactant Micelles During Refrigerated and Abuse Storage. J. Food. Saf. 2019, 39, e12598.
-

- 12. Delshadi, R.; Bahrami, A.; Tafti, A. G.; Barba, F. J.; Williams, L. L. Micro and Nano-encapsulation of Vegetable and Essential Oils to Develop Functional Food Products with Improved Nutritional Profiles. Trends Food Sci. Technol. 2020, 104, 72-83.
-

- 13. Yegin, Y.; Yegin, C.; Oh, J. K.; Orr, A.; Zhang, M.; Severin, T.; Nagabandi, N.; Sari, M. M.; Villareal, T. A.; Castillo, A.; Scholar, E. A.; Akbulut, M. Ecotoxic Effects of Paclitaxel-loaded Nanotherapeutics on Freshwater Algae, Raphidocelis subcapitata and Chamydomonas reinhardtii. Environ. Sci.-Nano 2017, 4, 1077-1085.
-

- 14. Ferreira, R. R.; Souza, A. G.; Rosa, D. S. Essential Oil-loaded Nanocapsules and Their Application on PBAT Biodegradable Films. J. Mol. Liq. 2021, 337, 116488.
-

- 15. Large, D. E.; Abdelmessih, R. G.; Fink, E. A.; Auguste, D. T. Liposome Composition in Drug Delivery Design, Synthesis, Characterization, and Clinical Application. Adv. Drug Deliv. Rev. 2021, 176, 113851.
-

- 16. Mozafari, M. R.; Johnson, C.; Hatziantoniou, S.; Demetzos, C. Nanoliposomes and Their Applications in Food Nanotechnology. J. Liposome Res. 2008, 18, 309-327.
-

- 17. Tai, K.; Rappolt, M.; Mao, L.; Gao, Y.; Li, X.; Yuan, F. The Stabilization and Release Performances of Curcumin-loaded Liposomes Coated by High and Low Molecular Weight Chitosan. Food Hydrocoll. 2020, 99, 105355.
-

- 18. Nam, C.-H.; Jeong, G.-W.; Nah, J.-W. Preparation and Characterization of Chitosan Microsphere for Encapsulation of Natural Antioxidant with Effective Protection Against ROS. Polym. Korea 2018, 42, 793-799.
-

- 19. Mady, M. M.; Darwish, M. M. Effect of Chitosan Coating on the Characteristics of DPPC Liposomes. J. Adv. Res. 2010, 1, 187-191.
-

- 20. Mujtaba, M.; Morsi, R. E.; Kerch, G.; Elsabee, M. Z.; Kaya, M.; Labidi, J.; Khawar, K. M. Current Advancements in Chitosan-based Film Production for Food Techonology; A Review. Int. J. Biol. Macromol. 2019, 121, 889-904.
-

- 21. Tai, K.; Liu, F.; He, X.; Ma, P.; Mao, L.; Gao, Y.; Yuan, F. The Effect of Sterol Derivatives on Properties of Soy Bean and Egg Yolk Lecithin Liposomes: Stability, Structure and Membrane Characteristics. Food Res. Int. 2018, 109, 24-34.
-

- 22. Mahcene, M.; Khelil, A.; Hasni, S. Akman, P. K.; Bozkurt, F.; Birech, K.; Goudjil, M. B.; Tornuk, F. Development and Characterization of Sodium Alginate Based Active Edible Films Incorporated with Essential Oils of Some Medicinal Plants. Int. J. Biol. Macromol. 2020, 145, 124-132.
-

- 23. Nkanga, C. I.; Krause, R. W.; Noundou, X. S.; Walker, R. B. Preparation and Characterization of Isoniazid-loaded Crude Soybean Lecithin Liposomes. Int. J. Pharm. 2017, 526, 466-473.
-

- 24. Liu, Y.; Liu, D.; Zhu, L.; Gan, Q.; Le, X. Temperature-dependent Structure Stability and in vitro Release of Chitosan-coated Curcumin Liposome. Food Res. Int. 2015, 74, 97-105.
-

- 25. Jingou, J.; Shilei, H.; Weiqi, L.; Danjun, W.; Tengfei, W.; Yi, X. Preparation, Characterization of Hydrophilic and Hydrophobic Drug in Combine Loaded Chitosan/cyclodextrin Nanoparticles and in vitro Release study. Colloids Surf. B Biointerfaces 2011, 83, 103-107.
-

- 26. Wu, J.; Liu, H.; Ge, S.; Wang, S.; Qin, Z.; Chen, L.; Zheng, Q.; Liu, Q.; Zhang, Q. The Preparation, Characterization, Antimicrobial Stability and in vitro Release Evaluation of Fish Gelatin Films Incorporated with Cinnamon Essential Oil Nanoliposomes. Food Hydrocoll. 2015, 43, 427-435.
-

- 27. Tan, C.; Feng, B.; Zhang, X.; Xia, W.; Xia, S. Biopolymer-coated Liposomes by Electrostatic Adsorption of Chitosan (chitosomes) as Novel Delivery System for Carotenoids. Food Hydrocoll. 2016, 52, 774-784.
-

- 28. Zhou, F.; Xu, T.; Zhao, Y.; Song, H.; Zhang, L.; Wu, X.; Lu, B. Chitosan-coated Liposomes as Delivery Systems for Improving the Stability and Oral Bioavailability of Acteoside. Food Hydrocoll. 2018, 83, 17-24.
-

- 29. Li, Z.; Paulson, A. T.; Gill, T. A. Encapsulation of Bioactive Salmon Protein Hydrolysates with Chitosan-coated Liposomes. J. Funct. Food 2015, 19, 733-743.
-

- 30. Alhariri, M.; Azghani, A.; Omri, A. Liposomal Antibiotics for the Treatment of Infectious Diseases. Expert Opin. Drug Deliv. 2013, 10, 1515-1532.
-

- 31. Gosh, R.; De, M. Liposome-based Antibacterial Delivery: An Emergent Approach to Combat Bacterial Infection. ACS Omega 2023, 8, 35442-35451.
-

- 32. Zhang, Y.; Liu, X.; Wang, Y.; Jiang, P.; Quek, S. Antibacterial Activity and Mechanism of Cinnamon Essential Oil Against Escherichia coli and Staphylococcus aureus. Food Control 2016, 69, 282-289.
-

- 33. Hosseini, S.; Rezaei, M.; Zandi, M.; Ghavi, F. Preparation and Functional Properties of Fish Gelatin-chitosan Blend Edible Films. Food Chemistry 2013, 136, 1490-1495.
-

- 34. Wang, H.; Ding, F.; Ma, L.; Zhang Y. Edible Films from Chitosan-gelatin: Physical Properties and Food Packaging Application. Food Biosci. 2021, 40, 100871.
-

- 35. Lufu, R.; Ambaw, A.; Opara, U. L. Water Loss of Fresh Fruit: Influencing Pre-harvest, Harvest and Postharvest Factors. Sci. Hortic. 2020, 272, 109519.
-

- 36. Nicolas, J. J.; Richard-Forget, F. C.; Goupy, P. M.; Amiot, M. J.; Aubert, S. Y. Enzymatic Browning Reactions in Apple and Apple Products. Crit. Rev. Food Sci. Nutr. 1994, 34, 109-157.
-

- 37. Ojagh, S. M.; Rezaei, M.; Razavi, S. H.; Hosseini, S. M. H. Development and Evaluation of a Novel Biodegradable Film Made From Chitosan and Cinnamon Essential oil with Low Affinity Toward Water. Food Chem. 2010, 122, 161-166.
-

- 38. Xu, J.; Zhou, L.; Miao, J.; Yu, W.; Zou, L.; Zhou, W.; Liu, C.; Liu, W. Effect of Cinnamon Essential oil Nanoemulsion Combined with Ascorbic Acid on Enzymatic Browning of Cloudy Apple Juice. Food Bioprocess Technol. 2020, 13, 860-870.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2023 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2024; 48(4): 440-446
Published online Jul 25, 2024
- 10.7317/pk.2024.48.4.440
- Received on Apr 29, 2024
- Revised on Jun 21, 2024
- Accepted on Jun 21, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Jun Kyun Oh
-
Department of Polymer Science and Engineering, Dankook University, 152 Jukjeon-ro, Suji-gu, Yongin-si 16890, Korea
- E-mail: junkyunoh@dankook.ac.kr
- ORCID:
0000-0002-8199-7628










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.