- [Review]
- Review on the Utilization of Nanoparticles for Enhanced Performance of Polymer Electrolyte Membranes
Chanyong Lee# , Hyeyeon Jung# , Jungchul Noh*, and Sungyeon Heo†

Department of Chemical and Biomolecular Engineering, Seoul National University of Science & Technology, Seoul 01811, Korea
*McKetta Department of Chemical Engineering, The University of Texas at Austin, Austin, TX 78712, USA- 고분자 전해질 막의 성능 향상을 위한 나노입자 활용 연구 동향
서울과학기술대학교 화공생명공학과
*텍사스대학교 오스틴 캠퍼스 화학공학과Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Proton exchange membrane fuel cells (PEMFCs) are highly efficient, environmentally friendly, lightweight, and generate minimal noise, making them suitable for portable and transportation energy conversion applications. The most commonly used proton exchange membranes (PEMs) in PEMFCs are perfluorosulfonic acid (PFSA) membranes, with the Nafion membrane being a notable example that currently dominates the market. However, Nafion membranes have limitations, including low conductivity under anhydrous conditions, high manufacturing costs, and performance degradation at high temperatures. To address these limitations, extensive research has been conducted to improve Nafion's performance through the incorporation of organic and inorganic additives. In this review, we summarize the characteristics related to mechanical, chemical, and thermal properties, as well as proton conductivity, observed in Nafion-based composite membranes incorporating various nanoparticle additives.
양성자 교환 분리막 연료 전지(PEMFCs)는 높은 효율성, 환경친화적, 경량성과 더불어 소음이 적어 휴대용, 운송용으로 적절한 에너지 변환 장치이다. PEMFC에 가장 많이 사용되는 양성자 교환 분리막(PEMs)은 과불소계 술폰산 분리막(PFSA)이다. 그 예로 대표적으로 알려진 Nafion 분리막은 현재 시장에서 지배적이지만 무수 조건에서 낮은 전도도, 높은 제조 비용 및 고온 조건에서의 성능 저하 등 일부 한계로 인해 유기 및 무기 첨가제를 통해 한계점을 극복하려는 연구들이 많이 진행되고 있다. 본 총설에서는 다양한 나노입자 첨가제를 첨가한 나피온 기반의 복합 분리막에서 보여주는 기계적, 화학적, 열적, 양성자 전도도에 대한 특성들을 요약 정리하였다.
Proton exchange membrane fuel cells (PEMFCs) are attractive power generation systems due to their higher efficiency compared to coal combustion engines and their eco-friendly nature. A wide variety of fillers, differing in nature and size, can be blended with the Nafion matrix, creating a new class of nanostructured electrolyte membranes with enhanced properties. These membranes exhibit significant improvements in thermomechanical and thermal stability, as well as proton conductivity, even at very low filler contents. Various types of Nafion-based composite membranes are critically reviewed, and their details are summarized.
Keywords: proton exchange membrane, fuel cell, filler, Nafion, nanoparticle.
이 연구는 서울과학기술대학교 교내 일반과제 연구비 지원으로 수행되었습니다.
저자(들)는 이해상충이 없음을 선언합니다.
산업혁명 이후 화석 연료의 전 세계적 소비 증가로 인해 환경 오염을 비롯한 지구 온난화의 문제로 인하여 재생 가능하고 친환경적인 에너지의 수요가 점차적으로 증가하고 있다. 수소 생산, 수소 저장, 수소를 전기로 전환하는 등 재생 에너지
로 수소를 이용하는 기술을 연구하는 것이 앞으로 친환경 경제로 나아가는 길이다.1 연료 전지는 수소, 메탄올, 천연가스 등을 사용하여 화학 에너지를 전기 에너지로 전환한다.2 수소는 단위 중량당 높은 에너지를 저장할 수 있어, 다른 연료에 비해 효율적인 연료로 각광받고 있다.3 재생 에너지원으로부터 추출된 수소를 활용한다면, 에너지 안보 측면에서 긍정적인 효과를 기대할 수 있고 유일한 부산물은 물이므로 석유를 대체할 만한 효율을 얻는다면, 대기 오염 및 온실 가스 배출 문제 등 환경문제를 해결할 수 있을 것으로 기대된다.4
연료 전지는 다음과 같이 전해 반응의 반대의 전기화학 반응을 통해 전기와 열을 생산한다.
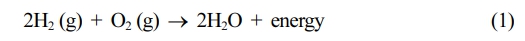
연료 전지 설계는 다양하지만 모두 동일한 기본 원칙으로 작동된다. 다양한 연료전지의 차이점은 전해질의 화학적 특성에서 기인한다.5
Figure 1과 같이 연료전지는 양극, 음극, 전해질, 외부회로의 네 가지 주요 부분으로 구성된다.6 음극에서 수소 기체의 산화반응이 일어나 양성자와 전자가 만들어지고, 양극에서는 산소가 양성자와 반응하여 물을 형성하면서 환원된다. 전해질의 종류에 따라 양성자 또는 수산화 이온이 이온 전도/전자 절연 전해질을 통해 이동하고, 전자는 외부 회로를 통해 이동하여 전력을 만든다. 연료 전지의 효율을 향상시키기 위해서는 전극, 전해질 및 가스 사이의 접촉 면적을 최대화해야 한다. 따라서 기체가 잘 확산될 수 있는 다공성 전극과 얇은(50-150 mm) 전해질 층은 각 구성요소 사이의 저항을 줄여 전체적인 효율을 향상시킨다.7
연료 전지에서 산소와 수소의 반응을 통한 전기 생성 방식은 연료 전지의 종류에 따라 다르다. 산성 전해질을 사용하는 연료전지의 경우, 음극에서 수소 기체가 산화되어 전자와 양성자를 방출한다. 생성된 전자는 외부 전기 회로를 통해 이동하고, 양성자는 전해질을 통해 이동한다. 이 과정에서 전기 에너지를 외부 회로를 통해 사용하게 된다. 한편, 양극에서는 전자와 양성자가 산소와 반응하여 물을 형성한다.
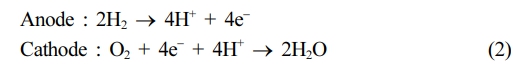
이 두 반응이 동시에 진행되기 위해서는, 음극에서 생성된 전자가 전기 회로를 통해 양극으로 전달되어야 한다. 또한, H+ 이온은 전해질을 통해 양극으로 이동해야 한다. 산성 전해질은 이러한 양성자 이동에 매우 적합하다. 특정 고분자는 이동 가능한 H+ 이온을 포함하도록 설계될 수 있다.
산성 전해질과 자유 수소 이온(H+)을 포함하는 특정 고분자는 'proton exchange membranes(PEM)'이라고 불린다.8 PEMFC는 일반적으로 작동 조건에 따라 저온형(low-temperature)과 고온형(high-temperature)으로 분류된다. 저온형 PEMFC는 가습 조건에서 우수한 이온 전도성을 나타내는 분리막을 사용하며, 100 ℃ 이하의 고습도에서 작동하는 연료 전지이다. 그러나 저온에서는 백금 촉매의 내구성이 낮아 피독에 취약하고, 내부의 물 범람 현상을 고려해야 하는 단점이 있어 추가적인 장치가 필요하다.9 고온형 PEMFC는 120 ℃ 이상의 온도에서 작동하여 내성이 높고, 물 관리가 용이하며, 폐열 재활용이 쉬운 특징을 갖고 있다.10,11

|
Figure 1 Operating principle and structure of fuel cells |
PEMFC에서는 양성자를 전달할 수 있는 고체 고분자 전해질이 사용된다. 양성자 교환 분리막, 즉 PEM은 연료 전지에서 양극과 음극을 분리하며, 양성자 전도 매개체로서 작용하는 동시에 연료와 산화제 간의 직접적인 접촉을 방지하는 역할을 한다. PEM이 연료 전지에 사용되기 위해서는 다음과 같은 몇 가지 필수적인 특성을 가져야 한다.12
1. 높은 양성자 전도성을 가지며, 전자 전도성은 낮아야 하고, 최소한의 저항 손실로 높은 전류를 생성해야 한다.
2. 충분한 기계적 강도와 안정성을 확보해야 한다.
3. 작동 조건에서 화학적 및 전기화학적 안정성을 갖고, 과도한 물의 확산을 방지해야 한다.1
Perfluorinated Membrane: Nafion. 과불소계 술폰산 (Perfluorosulfonic acid-based membranes, PFSA)은 고유한 이온 교환 능력과 안정성을 가진 가장 잘 알려진 양이온 교환막이다.13 1970년대에 Dupont사는 화학적 및 전기화학적 안정성이 확보된 sulfonated polytetrafluoroethylene을 기반으로 한, 양이온 교환막인 Nafion을 개발하였다. 이 막은 polytetrafluoroethylene과 같은 소수성 주사슬과, 친수성 말단 술폰산 그룹으로 구성된 독특한 구조를 가지고 있다. 소수성 주사슬은 구조적 안정성을 제공하고, 친수성 술폰산 그룹은 수화된 상태에서 양성자 전도를 담당한다. 물은 앞서 언급한 것처럼, 양성자 교환막 내 이온 경로의 크기, 연결성, 및 형성에 큰 영향을 미쳐 양성자 전도도에 중요한 역할을 한다.14,15
Nafion 분리막은 현재 가장 시장에서 지배적이지만, 다음과 같은 문제점들이 존재하며 이를 개선할 필요가 있다.
1. 작동 온도에 따른 양성자 전도도 및 안정성 문제
2. 과산화물 라디칼에 의한 고분자 분해
3. 다중 전하 이온에 따른 전도성 저하 및 수분 함량 감소
Nafion의 성능을 향상시키거나 대체하기 위해 많은 연구가 진행되고 있다. 예를 들어, Sulfonated Polyether Ether Ketone (SPEEK), Sulfonated Polysulfone, 그리고 Polybenzimidazole (PBI)는 Nafion에 비해 우수한 열적, 기계적 안정성으로 주목 받고 있다. 하지만 이러한 고분자도 마찬가지로 화학적 안정성, 양성자 전도도 등 향상시켜야 할 부분들이 존재한다. 그리고, 가교 결합 및 술폰화를 통한 막의 기능화, 그리고 유기 및 무기 입자 첨가를 통해 Nafion의 성능을 향상시키는 연구도 활발히 진행되고 있다.16 예를 들어, 양성자 분리막에 다양한 입자를 첨가하면 양성자 전도도, 기계적 강도, 화학적 안정성, 작동 온도, 수화 능력 등 여러 특성을 조절할 수 있다. 이러한 개선은 연료 전지 및 전해조의 효율성과 신뢰성을 높이는 데 기여할 수 있다.
Proton Conduction Mechanism. 입자 첨가 방법은 양성자 이동 경로에서 양성자의 이동 저항을 증가시키고, 이동 경로를 길게 하여 전도도에 부정적인 영향을 미칠 수 있다. 따라서, 양성자 교환막의 양이온 전달 메커니즘을 이해한 후, 입자 첨가로 인한 전도성 저하 문제를 효과적으로 해결할 수 있는 접근법을 개발해야 한다.
분자 수준에서 수화된 고분자 매트릭스 내의 양성자 전달은 Figure 2에서처럼 일반적으로 두 가지 메커니즘, 즉 “Grottus 메커니즘”과 “Vehicular 메커니즘”으로 설명된다.17,18 Grottus 메커니즘에서는 양성자가 가수분해된 이온 사이트 (SO3-, H3O+)에서 다른 이온 사이트로 이동한다. 음극에서 수소의 산화에 의해 생성된 양성자는 하이드로늄 이온을 형성하기보다는 물 분자에 부착되며, 이러한 하이드로늄 이온의 양성자는 인접한 물 분자로 도약하여 이동한다.19
두 번째 메커니즘은 “Vehicular 메커니즘”이다. 이 메커니즘에서는 수화된 양성자(H3O+)가 전기화학적 차이에 반응하여 매질을 통해 확산된다. 전기삼투 항력의 결과로, 물과 약하게 결합된 양성자는 막을 통해 물 분자와 함께 전달된다.20
Nafion의 SO3H 그룹과 물은 양이온 전달에 중요한 역할을 하므로, 분리막은 최적의 수화 상태를 유지하기 위해 적절한 시스템을 통해 수화되어야 한다.21 Nafion 분리막의 경우, 수분 함량과 온도의 영향을 받는다. 98% RH에서 90 ℃ 이상의 온도에 도달하면 양성자 전도도가 크게 감소한다고 보고된 바가 있다. 이는 분리막 내 물 분자의 손실로 인한 결과이다.22 또한, 분리막의 양성자 전도도는 상대 습도에 따라 달라지며, 상대 습도를 항상 높게 유지하려면 추가적인 공정과 비용이 발생하기 때문에, 낮은 수화 상태에서도 높은 전도도를 유지할 수 있는 분리막의 설계가 중요하다.
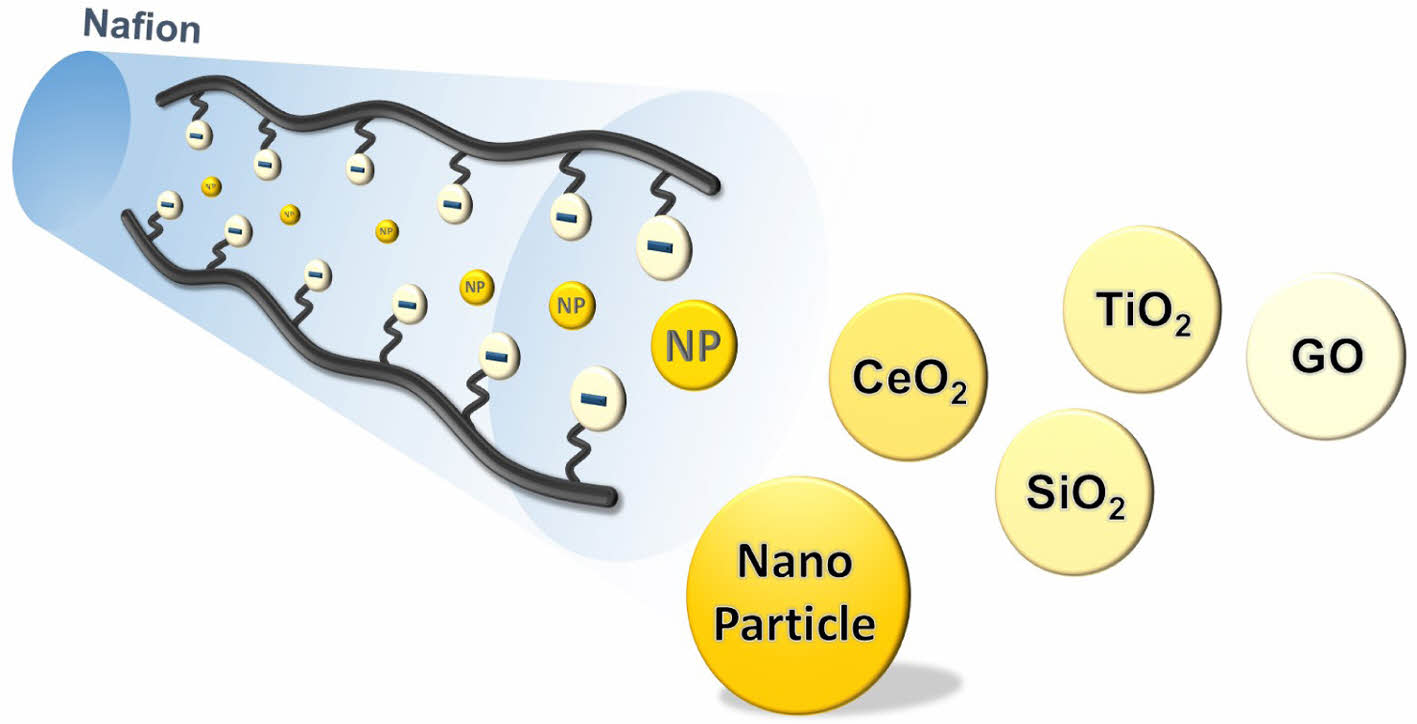
Additive Filler. 분리막에 유기 또는 무기 입자를 첨가함으로써 기계적 안정성, 화학적 안정성, 양성자 전도도, 수분 함유량 등 다양한 특성을 향상시킬 수 있다. 여러 연구에서 금속 산화물 나노 입자(예: TiO2, SiO2, ZrO2, Al2O3, Fe3O4)를 첨가하여 분리막의 특성을 개선하고자 하였다. 이러한 입자 첨가는 분리막의 물리적 및 화학적 성질에 다양한 영향을 미친다. 특히, 입자의 특성에 따라 양성자 분리막의 친수성 이온 채널이 변화하며, 이는 고분자 말단기의 특성에 따라 달라져 양성자 전도성에 영향을 미친다. 또한, 첨가된 입자와 고분자 사슬 간의 상호작용에 따라 팽윤비, 수분 함유량 및 기계적 강도에도 영향을 미친다.
CeO2 Blended Nafion: 상업적으로 널리 쓰이는 PFSA 분리막, 즉 Nafion은 높은 양성자 전도성과 우수한 열적/기계적 특성을 갖는다. 하지만 낮은 상대습도에서 작동할 때, 양성자 전도성 및 내구성이 떨어지는 단점이 있다. PEMFC를 낮은 상대습도에서 작동할 수 있다면, 외부의 다른 가습 장치가 필요 없기에 PEMFC의 구동 비용을 낮출 수 있다.
Cerium Oxide(CeO2) 혹은 Ceria라고 불리는 물질은 결정 격자 내에 산소 결핍과 다가성에서 기인하는 특성을 가진 금속 산화물이다. 실제 PEMFC를 구동할 때, 라디칼이 전기화학 반응에서 생성되는데, CeO2의 Ce3+ 그리고Ce4+로 가역적인 산화·환원 반응을 통해 효과적으로 하이드록실 라디칼에 의한 고분자의 분해를 막을 수 있다. 산화 반응에서 Ce3+ 이온이 OH* 라디칼과 반응하여 물과 Ce4+를 형성한다. 환원 반응에서, Ce4+가 H2O2 혹은 HOO* 라디칼과 반응하여 Ce3+로 환원된다. 또한, CeO2 나노 입자 표면에 하이드록실기를 포함하는데, 이를 통해 입자 표면에 수분 흡착 및 보유에 유리하게 작용한다. 이러한 이유로, 다양한 연구들이 Nafion 분리막에 CeO2를 포함시켜 분리막의 내구성과 낮은 상대습도에서 성능을 향상시켰다.
Figure 3(a-d)에서 Nafion과 CeO2가 포함된 분리막을 나타낸다.23 Nafion 고분자 내에 나노 입자가 첨가될 때, 균일하게 분산되는 것이 중요하다. Figure 3(f)에 명시된 것처럼, Nafion의 이오노머의 정전기적 조립 효과로 균일한 분산을 가능하게 했다. Figure 4(a,b)는 Nafion과 다양한 CeO2 함량의 Nyquist plot과 상대 습도에 따른 양성자 전도도 그래프이다. Figure 4(a)에서 고주파 영역에서 x축과 만나는 지점은 전해질에서 양성자 이동 저항을 나타낸다. 나노 입자의 비율이 늘어남에 따라 저항이 커지는 것을 알 수 있다. 이는 CeO2 나노 입자 첨가가 오히려 양성자의 수송 경로를 길게 만들어 저항이 커지고 결국 양성자 전도도가 떨어지게 만든다. Figure 4(b)에서는 높은 상대습도에서는 CeO2가 첨가되지 않은 Nafion이 더 높은 양성자 전도도를 갖는 것을 알 수 있다. 하지만 상대습도가 낮아짐에 따라 나노 입자가 첨가된 분리막이 양성자 전도도가 더 높은 것을 확인할 수 있다. 이러한 결과는 CeO2 나노 입자의 첨가가 수분 함유량을 향상시키기에 낮은 상대습도에서 높은 성능을 보여줄 수 있다는 것을 알 수 있다.
Figure 4(c)는 실제 작동 셀에서 상대습도 75% RH, 60 ℃ 에서의 Nafion 211과 입자가 첨가된 분리막의 성능을 나타낸다. 낮은 비율의 CeO2첨가 분리막(1 wt%, 3 wt%)의 경우에는 Nafion 211과 비슷하거나 조금 향상된 성능을 보였다. 이러한 결과는 CeO2의 수분 함유량에 의한 결과이고, 나노 입자가 첨가됨에 따라 상대습도에 덜 민감해진다는 것을 보여준다.
양성자 교환 분리막의 내구성을 이해하기 위해, 라디칼에 의한 분리막 분해에 대하여 이해하여야 한다. 앞서 언급했듯이, CeO2입자는 라디칼에 의한 공격을 막는 역할을 할 수 있다. Figure 4(d)는 시간에 따른 Fluoride 방출을 나타낸 것이다(fluoride emission rate, FER). CeO2의 첨가량이 높아짐에 따라 FER이 낮아지는 것을 알 수 있다. Sol-gel 방법으로 합성된 분리막의 경우 같은 입자의 함량에도 불구하고 self-assembled 방법으로 합성된 분리막보다 FER이 높은 것을 알 수 있는데, 이는 입자가 뭉침에 따라 분산도가 낮고 표면적이 낮기에 낮은 라디칼 제거 효과를 나타낸다.
CeO2 입자를 분리막에 첨가시키는 것은 긍정적인 효과들을 나타내지만 몇 가지 해결해야 할 문제점들이 존재한다. CeO2를 양성자 전도기없이 사용하였을 때, 이온의 수송 경로를 막아 경로를 길게 만들어 전도성을 감소시킬 수 있다. 또한 “Hopping Mechanism”을 통해 작은 폴라론 형성만으로도 전자가 전도될 수 있다. 특히 고온에서 높은 전기 전도도를 나타내고 셀 작동 중에 전자 전이를 발생시켜 부정적인 성능을 가져올 수 있다. Dukjoon Kim그룹에서는 이를 해결하기 위해 dopamine sulfonated CeO2를 사용하여 양성자 전도도를 향상시키고, 샌드위치 구조의 PEM 즉, 나노 입자를 분리막 표면에 위치시켜 입자의 높은 전자 전도도에 의한 부정적인 영향을 해결하였다.24
Figure 5는 CeO2 나노 입자의 합성 과정과 합성된 입자의 특성을 나열한 것이다. Figure 5(b,c)를 통해 합성된 준구형의 나노 입자를 확인할 수 있고, Figure 5(d,e)를 통해 코어-쉘 구조의 표면이 코팅된 나노 입자를 확인할 수 있다. 외각 층의 두께는 3 nm이고 Figure 5(f)를 통해 표면 작용기의 변화를 확인할 수 있다. 그리고 Figure 5(g)의 XRD 데이터를 통해 결정 구조가 같지만, 표면 작용기만 다른 입자를 성공적으로 합성하였음을 알 수 있다.
Figure 6(a,b)를 통하여 입자를 첨가한 모든 분리막들이 향상된 수분 함유량과 팽윤 비율을 확인할 수 있다. 이러한 결과는 나노 입자의 흡습 성질에 의한 결과이며, CeO2-DS의 술폰산기 도입이 일반 CeO2 입자보다 친수성을 향상시킨다는 것을 알 수 있다. 수분 함유량의 증가와 팽창 비율의 경향성이 일치하는데, 팽창 비율의 증가가 지나치지 않기 때문에 막의 안정성과 기계적 강도에는 무리가 없다고 보고하였다. 앞서 언급했듯이, CeO2 입자는 이온을 전도하는 첨가제가 아니기 때문에, CeO2 나노 입자를 첨가하는 것은 양성자 전도 채널을 방해하는 역할을 할 것이고, 결론적으로 술폰산 그룹의 농도를 낮춰 양성자 전도도를 감소시킨다(Figure 6(c)). 나노 입자의 표면을 술폰산 그룹으로 치환하게 되면, 양성자의 Hopping site의 역할이 가능해지고 입자가 첨가됨에 따라 전도도가 향상되게 된다. 각 복합막의 저항을 평가하기 위한 Nyquist plot을 통해 양성자 전도도 경향과 일치하는 것을 확인하였다(Figure 6(d)).
Figure 7은 CeO2 나노 입자에 술폰산 치환을 하였을 때 라디칼 공격에 의한 분리막의 분해에 대해서 알아보기 위해 Fenton test를 진행하였다. Figure 7(a)는 술폰산기에 해당하는 1186 cm-1, 1032 cm-1에 해당하는 두 개의 IR 밴드를 나타내는데, 이를 통해 라디칼이 CeO2-DS의 구조에 많은 영향을 미치지 않는다는 것을 확인하였다. CeO2는 라디칼의 Nafion 뿐만 아니라 나노 입자의 술폰화 도파민 기에 대한 공격을 막아 주기에 양성자 전도도의 안정성 측면에서도 매우 우수하다. Figure 7(b)는 분리막으로부터의 FER을 시간에 대한 그래프로 나타낸 것이다. CeO2-DS가 4 wt%, 8 wt%가 되면 거의 F-이온이 감지되지 않고 훌륭한 라디칼 공격의 방어 능력을 보여준다. Figure 7(c-e)를 통해 분리막의 분해를 CeO2-DS가 효과적으로 막아주는 것을 보여준다.
SiO2 Blended Nafion: 나노 크기의 첨가제 중 SiO2는 비교적 풍부하고 저렴하여 많은 연구에 활용되었다. 또한 우수한 열적 저항성을 지니고 쉽게 다양한 형태로 가공이 가능하다는 장점이 있어 분리막 복합체에 적절히 사용될 수 있다.
Gao Qing Lu 그룹은 drop-casting 방법으로 Nafion/SiO2 분리막을 제작하고 SiO2의 양이 많을수록 뭉침 현상이 발생함을 확인했다(Figure 8(a,b)).25 SiO2를 첨가함에 따라 첨가하기 전과 비교하여 인장 강도가 감소했는데 Nafion 변형을 SiO2가 제한한다는 것을 보여준다(Figure 8(c)). 이는 연료 전지 작동 중 분리막의 과도한 팽창을 막는 이점이 될 수 있다. 한편 SiO2 첨가는 수분 함유량 향상과 열적 안정성에도 기여한다. Figure 8(d)를 보면 SiO2가 첨가될수록 200 ℃ 아래 피크의 크기가 커지고 높은 온도에서 나타남을 알 수 있다. 피크는 흡열 반응인 물의 증발을 나타내는 것으로 SiO2의 물 친화성 특징 때문이다. 반면 순수 Nafion분리막에서 보인 200 ℃ 이상의 피크는 결정 영역이 녹는 것을 나타낸다. Nafion/SiO2복합막에서 해당 피크는 나타나지 않았는데 무기물 첨가제인 SiO2 첨가가 열적 안정성 향상에 기여했다는 근거를 보여준다.
하지만, 낮은 습도에서 SiO2 첨가는 양성자 전도도를 감소시킨다(Figure 9(a)). 이는 in-situ sol-gel 방식으로 제작한 복합막에서도 다르지 않다.26 In-situ sol-gel 방식으로 복합막을 만들 경우 더 작은 크기의 SiO2 입자를 얻을 수 있다는 장점이 있다. Drop-casting 방식으로 만든 Gao Qing Lu 그룹의 복합막의 SiO2 입자 크기는 70-140 nm이지만 in-situ sol-gel 방식을 이용한 Bao-Lian Yi 그룹의 SiO2 입자 크기는 5-15 nm이다. Bao-Lian Yi 그룹은 SiO2 입자 크기에 따른 양성자 전도도를 측정했는데 순수 Nafion 분리막에 비해 모든 복합막의 양성자 전도도는 감소했지만 10 nm 크기까지는 증가하다가 15 nm에서 하락하는 형태를 보였다(Figure 9(b)). 이것으로 SiO2 입자 크기가 양성자 전도도에 영향을 준다는 것을 알 수 있으며 이러한 경향은 셀 성능에서도 찾을 수 있었다 (Figure 9(c,d)). 60 ℃, 100% 상대습도 조건에서 cell 성능은 SiO2 10 nm 크기까지 증가하다 감소하였다. 이 조건의 복합막은 순수 Nafion분리막보다 낮은 성능을 보였으나 110 ℃, 59% 상대습도에서의 SiO2 복합막은 순수 Nafion분리막보다 향상된 성능을 보였다. 이것은 높은 온도, 낮은 습도일 때 친수성 SiO2의 영향이 크게 작용한다는 것을 나타낸다.
하지만 sol-gel 방법 동안 SiO2의 전구체로 사용되는 tetraethylorthosilicate(TEOS)의 수화가 발생한다.27 이는 많은 에탄올 부산물과 SiO2 뭉침 현상을 발생시키며 Nafion 사슬의 파괴를 야기한다. 이러한 문제를 극복하기 위해 S. Balog 그룹은 다른 알코올성 용매를 사용한 방법을 고안했다.28 Ionomer matrix에 의한 alcohol의 서로 다른 친화도는 Nafion에서 SiO2의 핵화와 성장을 촉진하며 이는 특징적인 형태를 가져왔다. 그 결과 methanol 환경에서 SiO2를 추가한 분리막에서는 순수 Nafion 분리막과 비교하여 수분 함유량과 양성자 전도도를 향상시켰다고 보고했다.
Drop-casting과 sol-gel 방식 외에도 self-assembled 방식이 존재한다. Self-assembled 방식으로 Nafion/SiO2 분리막을 제작한 Hao Lin Tang의 연구에서 두 방식보다 좋은 내구성을 가진 것을 확인했다.29 SiO2의 표면에서 양전하를 띄는 SiOH2+과 Nafion의 음전하 SO3- 사이에서 발생한 정전기적 인력으로 인해 다른 방식보다 안정적으로 분산된다.
반면 분리막에 물을 더하기 위해 SiO2와 함께 나노 크기의 Pt를 첨가할 수 있다.30 Pt 입자는 H2와 O2가 결합할 수 있는 자리를 제공하여 물을 생성한다. 생성된 물은 SiO2에 의해 흡수되어 분리막의 수화를 유지한다. 하지만 SiO2보다 낮은 Pt의 물 흡수력 때문에 수분 함유량은 Pt를 첨가하지 않은 분리막보다 좋지 않았다(Figure 10). 하지만 술폰화 과정을 거친 S-Pt/SiO2와 Pt-S/SiO2 복합막은 친수성 술폰산기 때문에 비교적 높은 수분 함유량을 갖는다. 습도가 없는 환경의 Nafion/S-Pt/SiO2 복합막의 cell 성능은 0.6 V에서 0.45 A/cm2로 순수 Nafion 분리막과 유사했다. 이는 Pt에 부착된 친수성 술폰산기가 Pt sites에서 형성된 물 분자로부터 수화되었기 때문이다. 하지만 S-Pt/SiO2의 양이 증가할수록 cell 성능이 감소하는 경향을 보였는데 이는 Pt site로부터 너무 많은 물이 생성되어 범람 현상이 발생하고 Pt의 전기 전도성으로 인한 손실이 발생하기 때문이다.
TiO2 Blended Nafion: 비교적 높은 온도인 100 ℃와 120 ℃ 사이에서 연료 전지가 구동될 경우 low temperature-PEMFC보다 양극과 음극의 운동 반응이 향상되고 촉매 기체 CO가 CO2를 형성하기 위한 반응이 더 빠르게 진행된다.31 하지만 높은 온도는 분리막의 저항을 증가시키고 분리막과 전해질 계면의 분해를 야기하여 고분자 전해질의 탈수화가 발생한다.32 따라서 높은 온도에서 기계적, 화학적 안정성을 향상시키기 위해 나노 입자, 고분자 등의 첨가를 필요로 하게 된다. TiO2는 분리막에 적절한 수화를 가능하게 하기 때문에 좋은 친수성 첨가제가 된다. Nafion에 TiO2 나노 입자를 추가함으로써 높은 온도의 PEMFC작동을 향상시켰다는 연구가 있다.33,34
M.H. Eikani 그룹은 sol-gel 방법과 drop-casting 방법을 사용하여 Nafion/ TiO2 복합막을 제작한 후 비교하는 연구를 진행하였다.32 그 중 drop-casting 방법으로 제작한 복합막에는 뭉침 현상이 관찰되었고 도핑 비율이 증가할수록 TiO2 입자의 뭉침 현상이 두드러지게 나타났다(Figure 11(a)). 이와 비슷하게 drop-casting으로 5 mm 두께의 복합막을 제작한 Niklas Wehkamp의 연구에서도 TiO2 입자의 뭉침 현상을 볼 수 있었다.35 반면 sol-gel 방법으로 제작된 복합막에서는 같은 Ti 도핑 수준에서 drop-casting 방법으로 제작한 복합막보다 우수한 균일한 분산성을 보여주었다(Figure 11(b)). 이것으로 drop-casting 방법보다는 sol-gel 방법이 선호되는 이유를 알 수 있다.
분리막에 도핑되는 TiO2의 비율이 증가할수록 유리 전이 온도인 Tg가 높아진다(Table 1).32 Tg의 상승은 분리막의 열적 안정성을 향상시키고 높은 온도에서 PEM 연료 전지의 작동을 가능하게 한다. Tg 이상의 온도에서는 분리막이 단단함을 잃고 수축으로 인해 연료 전지의 성능이 저해되기 때문에 Tg 온도 아래에서 연료 전지를 작동한다. TiO2 첨가에 따라 분리막의 Tg가 상승하여 높은 온도에서 연료 전지 작동을 가능하게 했는데 이것은 온도 증가에 따라 분리막의 부피 변화가 발생했을 때 Nafion 사슬이 움직이는 대신 TiO2가 그 자리를 대신하여 움직임을 저해했기 때문이다. 따라서 Tg의 상승은 막의 열적 안정성을 향상시켜 높은 온도에서 PEMFC 작동을 가능했다.
이러한 TiO2 강화 효과는 분리막 저항을 통해서도 확인할 수 있다. 순수 Nafion 분리막은 80, 100 ℃와 다르게 120 ℃에서 저항이 크게 증가한 반면 TiO2가 포함된 Nafion/TiO2 복합막은 유사한 경향을 보였다(Figure 12).35 이는 TiO2가 첨가됨에 따라 분리막을 강화해 저항이 낮아진다는 것을 보여주며 특히 높은 온도인 120 ℃에서 TiO2의 분리막 강화 효과가 강해져 열적 안정성이 향상되었다는 것을 보여준다.
TiO2 첨가로 강화된 Nafion/TiO2 복합막은 순수 Nafion 분리막에 비해 power density가 향상되었다(Figure 13(a)). 100 ℃와 120 ℃에서 TiO2 첨가에 따른 power density를 비교했을 때 0.2 Wcm-2, 0.6 Wcm-2만큼 증가했다. 뿐만 아니라 전기화학 임피던스 분광 측정을 통해 전하 이동 저항을 비교했을 때, 100 ℃와 120 ℃ 모두 TiO2를 첨가하지 않은 것보다 첨가한 Nafion/TiO2 복합막에서 전하 이동 저항이 낮다는 것을 알 수 있다(Figure 13(b)). 이는 TiO2 첨가가 전하 이동 저항을 낮추면서 cell 성능에 긍정적인 효과를 가져온다는 것을 보여준다.
수분 함유량과 양성자 전도도는 연료 전지의 성능과 수명을 결정하는 중요한 요소이다. 상온에 비해 80 ℃ 환경의 복합막에서 더 높은 수분 함유량를 보여주는데 그 이유는 높은 온도에서 Nafion이 팽창하여 더 많은 수분 함유량을 가져오기 때문이다. M.H. Eikani 그룹은 TiO2 도핑 함량을 다르게 하여 수분 함유량과 양성자 전도도를 측정하였다.31 TiO2의 도핑 비율이 3 wt%인 복합막이 순수 Nafion 분리막보다 수분 함유량이 51% 만큼 더 높았다(Figure 14(a)). 하지만 TiO2의 비율이 높아질수록 TiO2가 Nafion의 친수성 SO3H 그룹을 막아 수분 함유량을 감소시킨다. 이러한 이유로 양성자 전도도 또한 Nafion에 TiO2 가 첨가됨에 따라 감소될 수 있다(Figure 14(b)). 순수 Nafion 분리막의 양성자 전도도는 2.67 mScm-1였지만 TiO2의 도핑 비율이 2, 5 wt%로 올라갈수록 2.11, 1.67 mScm-1로 감소했다.31 TiO2는 양성자 이동 통로를 차단하여 양성자 전도도를 감소시키는데 수분 함유량보다 양성자 전도도에 더 큰 영향을 주는 것으로 나타났다.
TiO2 첨가로 Tg가 높아짐에 따라 높은 온도에서 작동을 가능하게 했고, 순수 Nafion 분리막이 높은 온도에서 갖는 물 손실과 막 저항 증가의 문제를 TiO2의 존재로 해결할 수 있었다. 70 ℃에서는 순수 Nafion 분리막(ME.1)이 Naifon/TiO2 복합막(ME.2, ME.3)보다 좋은 성능을 보였는데 70 ℃에서는 분리막이 충분한 물을 가져 TiO2의 효과가 두드러지게 나타나지 않았고 순수 Nafion 분리막이 가장 높은 양성자 전도도를 가졌기 때문이다(Figure 14(c)). 반면 110 ℃에서는 TiO2 첨가로 높아진 분리막의 Tg와 열적 안정성, 수화 능력, 그리고 감소된 저항으로 순수 Nafion 분리막보다 좋은 성능을 보였다 (Figure 14(d)). 이것으로 무기물 첨가제인 TiO2 는 높은 온도에서 기계적 특성과 열적 안정성을 강화하고 수분 함유량을 향상시킨다는 점에서 긍정적으로 평가된다.
Graphene Oxide Blended Nafion: Graphene oxide(GO)는 그래핀 유도체 종류 중 하나이다. GO 는 양친매성 물질로 카르복실, 하이드록실, 에폭시 그룹들과 같은 산소기의 친수성 부분이 있고, sp2 그래파이트 부분으로 이루어진 소수성 부분으로 구성되어 있다.36 이러한 성질과 더불어 2차원 구조와 넓은 표면적으로 인해 다양한 분리막에 첨가제로 사용되고 있다.37,38 실제로 다양한 연구에서 GO를 분리막에 첨가시켜 양성자 전도도를 향상시켰는데, 이는 GO가 분리막 안에서 친수성 성질을 향상시키고 이온 채널 안의 물의 상태를 조절함으로써 가능하였다.39,40 GO의 물리화학적 특성을 향상시키기 위해 입자에 작용기를 붙이는 연구들도 진행되었다.41,42
실제 GO를 Nafion에 첨가한 후의 수분 보유량을 Figure 15(a), 그에 따른 양성자 전도도를 Figure 15(b)에서 알 수 있다.43 GO는 친수성이기에 첨가될수록 수분 함유량이 증가하고 그에 따라 양성자 전도도가 높아지는 것을 알 수 있다. Figure 15(c)는 Nafion/GO 분리막의 성능을 나타낸 것인데, 입자가 첨가된 후에 성능이 상당히 향상된 것을 확인할 수 있다. 하지만 낮은 상대습도에서 작동할 때 셀의 성능에는 개선이 필요하다.
Hong Wu 그룹에서는 GO에 작용기를 붙여 향상된 양성자 전도도 및 낮은 상대습도에서의 작동을 가능하게 했다.44 Figure 16은 GO에 다양한 작용기를 치환한 DGO와 PGO의 합성 과정이다.
Figure 16(c,d)를 통해 이렇게 합성된 입자를 Nafion에 첨가하였을 때, 수분 함유량이 증가하고 팽윤도가 다소 감소하는 것을 알 수 있다. PGO 분리막이 가장 높은 성능을 나타냈는데, 그 이유는 폴리도파민과 GO의 높은 표면적이 많은 포스폰산기의 로딩이 가능해져 수분 흡수 능력이 향상되었기 때문이다. 팽윤 비율은 기본적으로 두가지 요인에 따라 결정된다. 첫번째는 고분자 매트릭스와 첨가된 입자의 상호작용이 고분자 사슬의 이동을 제한하여 팽윤도를 감소시킨다. 그리고 두번째로는 수분 함유량이 상승함에 따라 친수성 클러스터에 더 많은 물을 포함시키기에 팽윤도를 상승시킨다. Nafion/PGO 복합막의 경우 첫번째 요인이 지배적이기 때문에 팽윤도가 낮아진다고 할 수 있다.
Figure 17(a)는 상대습도에 따른 양성자 전도도를 나타낸 것이다. Nafion/PGO의 경우 첨가량이 높아질수록 양성자 전도도가 높아지는데, 이는 두가지로 설명 가능하다. 친수성 PGO 나노시트를 도입함으로써 분리막의 수분 함유량이 증가하는데, 이는 양성자 전달을 위한 연속 경로 형성에 도움이 된다. 또한, GO 나노 시트의 작용기인 포스폰산기와 물 분자 사이에 수소 결합 네트워크가 형성되는데, 이 네트워크는 양성자 전달을 위한 새로운 양성자 전도 사이트를 제공하여 분리막에서의 양성자 전달을 촉진한다.
하지만 낮은 상대습도에서는 이온 클러스터가 작아지고 친수성 이온 채널이 좁아지기에 양성자 전달의 저항이 높아지게 된다. 게다가 Nafion의 설폰산기의 분해에 영향을 미쳐 양성자 이동성이 낮아지게 된다.42 따라서 낮은 상대습도에서 양성자 전도도를 향상시키려면 수분 보유 능력을 향상시키거나 포스폰산기와 같은 다른 양성자 수용체를 도입하여 향상시킬 수 있다. Nafion/PGO의 경우, 포스폰산기의 수분 유지 능력이 낮은 상대습도에서도 수분을 많이 함유할 수 있게 도와주어 이온 클러스터의 수축을 제한한다. 게다가 포스폰산기 그룹은 양성자 기증체/수용체 능력을 둘 다 가능하게 하므로 PGO의 도입은 양성자 전달 경로를 확보하고 양성자 전달에 유리하다.
Nafion과 복합막들을 사용한 연료 전지의 성능은 양성자 전도도의 경향성과 일치했다(Figure 17(b)). 친수성의 PGO도입은 수분 함유량을 향상시키고 포스폰산기와 물 분자의 수소 결합 네트워크를 형성해 proton hopping site를 제공한다. 따라서 Nafion/PGO-2.0 분리막이 높은 성능을 나타낼 수 있었던 이유는 포스폰산기의 도입으로 양성자 전도가 용이해 낮은 저항성과 높은 양성자 전도도를 나타냈기 때문이다.

|
Figure 2 (a) Scheme of the Grottuss mechanism; (b) schematic design of the vehicular mechanism as proton conduction in pristine membranes |

|
Figure 3 High resolution TEM of (a-d) the self-assembled Nafion/ CeO2 with different ceria content of 1, 3,5,10 wt%; (e) conventional sol-gel method with ceria 5 wt%; (f) schematic diagram of the formation of self-assembled Nafion/CeO2 composite. Reproduced with permission from Ref. 23, Wang, Z. et al., J. Membr. Sci., 2012, 421, 201–210. ©2012, Elsevier. |

|
Figure 4 Electrochemical impedance spectra of (a) the proton exchange membranes at 60 ℃ and 100% RH; (b) proton conductivities of the PEMs as a function of relative humidity at 60 ℃; (c) single cell performances of the PEMs at 60 ℃ and 75% RH; (d) fluoride evolution from the PEMs as function of test time under Fenton’s degradation test. Reproduced with permission from Ref. 23, Wang, Z. et al., J. Membr. Sci., 2012, 421, 201–210. ©2012, Elsevier. |

|
Figure 5 (a) Schematic illustration for the synthesis of CeO2-DS nanoparticles; (b-e) TEM image; (f) DLS analysis of number size distribution; (g) XRD patterns of ceria and CeO2-DS nanoparticles. Reproduced with permission from Ref. 24, Thuc, V. D. et al., J. Membr. Sci., 2022, 642, 119990. ©2021, Elsevier. |

|
Figure 6 (a) CeO2 composite membrane water uptake; (b) swelling ratio; (c) proton conductivity of membranes at the temperature ranging from 30 to 80 ℃; (d) nyquist plot of MEAs. Reproduced with permission from Ref. 24, Thuc, V. D. et al., J. Membr. Sci., 2022, 642, 119990. ©2021, Elsevier. |

|
Figure 7 (a) FTIR spectra of CeO2-DS before and after 120h Fenton test; (b) FER plots of ex-situ oxidation test; (c) O1s XPS spectra of membranes before and after Fenton’s test; (d) in-situ oxidation of membranes at different OCV operation times. Reproduced with permission from Ref. 24, Thuc, V. D. et al., J. Membr. Sci., 2022, 642, 119990. ©2021, Elsevier. |

|
Figure 8 SEM images of (a) the Nafion/SiO2 composite membrane containing a small amount of particles referred to as Composite-1; (b) a large amount of particles referred to as Composite-3; (c) tensile curves of the stress-stain response; (d) DSC curves. Reproduced with permission from Ref. 25, Jin, Y. et al., J. Power Sources, 2008, 185, 664–669. ©2008, Elsevier. |

|
Figure 9 (a) Proton conductivity of membranes at different temperatures and humidity. Reproduced with permission from Ref. 25, Jin, Y. et al., J. Power Sources, 2008, 185, 664–669. ©2008, Elsevier; (b) proton conductivity of Nafion/SiO2 composite membrane containing SiO2 particles of a various diameter; (c) polarization curves of single cells equipped with Nafion/SiO2 composite membranes at 60 ℃ and 100% RH; (d) 110 ℃ and 59% RH. Reproduced with permission from Ref. 26, Ke, C.-C. et al., Polym. Adv. Technol., 2012, 23, 92–98. ©2010, Wiley. |

|
Figure 10 Water uptake of Nafion membrane (★) and composite membranes with SiO2 (■), Pt/SiO2 (▼), Pt-S/SiO2 (●), and S-Pt/ SiO2 (◆). Reproduced with permission from Ref. 30, Yang, H. N. et al., J. Membr. Sci., 2012, 421, 318–326. ©2012, Elsevier. |

|
Figure 11 SEM images of (a) the Nafion/TiO2 composite membrane: by drop-casting method; (b) by sol–gel method. Reproduced with permission from Ref. 32, Amjadi, M. et al., Int. J. Hydrog. Energy, 2010, 35, 9252–9260. ©2010, Elsevier. |

|
Figure 12 (a) Membrane resistance as a function of current density at different temperatures; (b) membrane resistance at three different temperatures for a current density of 1250 mA/cm2 . Reproduced with permission from Ref. 35, Wehkamp, N. et al., RSC Adv., 2016, 6, 24261– 24266. ©2016, RSC. |

|
Figure 13 (a) Relationship between power density and current density for Nafion/TiO2 composite membrane compared to Nafion membrane at two temperatures; (b) electrochemical impedance spectroscopy at 100 ℃ and 120 ℃. Reproduced with permission from Ref. 35, Wehkamp, N. et al., RSC Adv., 2016, 6, 24261–24266. ©2016, RSC. |

|
Figure 14 (a) Water uptake of Nafion/TiO2 composite membranes containing various amount of TiO2 particles; (b) nyquist plot of Nafion/ TiO2 composite membranes; (c) polarization curves at 70 ℃; (d) at 110 ℃. Reproduced with permission from Ref. 32, Amjadi, M. et al., Int. J. Hydrog. Energy, 2010, 35, 9252–9260. ©2010, Elsevier. |

|
Figure 15 (a) Water uptake; (b) proton conductivity of Nafion/GO composite membranes; (c) I-V curve and power density of MEA fabricated with various Nafion/GO composite membranes with 3 wt% GO content under different relative humidity (RH): 100% (□,■), 60 wt% (○,●) and 40% (△,▲). Reproduced with permission from Ref. 43, Lee, D. C. et al., J. Membr. Sci., 2014, 452, 20–28. ©2014, Elsevier. |

|
Figure 16 Synthesis process of DGO and PGO: (a) water uptake; (b) and swelling degree; (c) of the pristine Nafion membrane and composite membranes; Reproduced with permission from Ref. 44, Zhang, B. et al., J. Membr. Sci., 2016, 518, 243–253. ©2016, Elsevier. |

|
Figure 17 Proton conductivity of Nafion and composite membranes as a function of relative humidity: (a) fuel cell performance of Nafion and composite membranes; (b) Reproduced with permission from Ref. 44, Zhang, B. et al., J. Membr. Sci., 2016, 518, 243–253. ©2016, Elsevier. |
|
Table 1 Glass Transition Temperature (Tg) for Different Types of Samples.32 |

Reproduced with permission from Ref. 32, Amjadi, M. et al., Int. J. Hydrog. Energy, 2010, 35, 9252–9260. ©2010, Elsevier. |
연료 전지는 기존의 발전 기술에 비해 환경 오염을 일으키지 않기에 여러 에너지 저장 및 발전 시스템의 대안으로 관심을 받고 있다. 연료 전지의 다양한 구성 요소 중에서 특히, 고분자 전해질 분리막이 PEMFCs의 핵심 요소인데, 이러한 분리막은 양이온을 음극에서 양극으로 수송하고, 전자와 연료의 교차 현상을 막아주는 역할을 한다. PEM으로 널리 사용되는 Nafion 분리막의 경우, 높은 온도 및 낮은 상대습도에서 낮은 양성자 전도도를 보인다는 단점이 존재한다. 따라서 많은 연구들에서 다양한 유/무기 입자를 첨가하여 단점을 보완하고자 하였다. 다양한 종류의 첨가된 입자는 Nafion 분리막의 화학적, 기계적 안정도를 향상시키고 상업적으로 이용될 가능성을 열어주었다. 또한 첨가된 입자들의 친수성의 성질은 쉽게 분리막 내 수분을 더 유지할 수 있게 해주고 결과적으로 높은 작동 온도 및 낮은 상대습도에서 성능 향상을 가능하게 한다. 입자의 크기와 분산도가 분리막의 성능에 중요한 요소 중 하나인데, 따라서 표면적이 넓은 작은 나노입자를 분리막 내 균일하게 분산시키는 것이 중요하다고 할 수 있다. 이렇게 분산된 입자들은 분리막 내에서 물 분자 전도 채널을 만들어 양성자 수송에 유리하게 작용할 수 있다. 하지만 입자들은 대부분 양성자를 전도할 수 없는 성질을 갖기에 이것 또한 고려되어야 한다. 이를 극복하기 위해서는 입자의 표면에 양성자를 전도할 수 있는 작용기를 붙여 추가적인 hopping site를 제공할 수 있다. 이를 통해 입자가 첨가되어 길어진 양성자 수송 경로를 보상할 수 있어 높은 양성자 전도도를 달성할 수 있다. 주목할만한 점은, CeO2 같은 가변적인 원자가 상태를 가진 특정 입자들은 자유 라디칼을 효과적으로 제거할 수 있는 능력을 가지고 있어, 연료 전지에서 사용되는 복합막의 작동 수명을 효과적으로 연장시킬 수 있다. 종합하면, 나노입자를 활용한 적절한 양성자 전도 복합막을 설계할 때, 향후 내구성 및 전도성이 향상된 우수한 성능의 연료 전지 개발이 가능하리라 판단된다.
- 1. Jiao, K.; Xuan, J.; Du, Q.; Bao, Z.; Xie, B.; Wang, B.; Zhao, Y.; Fan, L.; Wang, H.; Hou, Z.; Huo, S.; Brandon, N. P.; Yin, Y.; Guiver, M. D. Designing the next Generation of Proton-Exchange Membrane Fuel Cells. Nature 2021, 595, 361-369.
-

- 2. Liu, S.; Chen, T.; Zhang, C.; Xie, Y. Study on the Performance of Proton Exchange Membrane Fuel Cell (PEMFC) with Dead-Ended Anode in Gravity Environment. Appl. Energy 2020, 261, 114454.
-

- 3. Kraytsberg, A.; Ein-Eli, Y. Review of Advanced Materials for Proton Exchange Membrane Fuel Cells. Energy Fuels 2014, 28, 7303-7330.
-

- 4. Borup, R.; Meyers, J.; Pivovar, B.; Kim, Y. S.; Mukundan, R.; Garland, N.; Myers, D.; Wilson, M.; Garzon, F.; Wood, D.; Zelenay, P.; More, K.; Stroh, K.; Zawodzinski, T.; Boncella, J.; McGrath, J. E.; Inaba, M.; Miyatake, K.; Hori, M.; Ota, K.; Ogumi, Z.; Miyata, S.; Nishikata, A.; Siroma, Z.; Uchimoto, Y.; Yasuda, K.; Kimijima, K.; Iwashita, N. Scientific Aspects of Polymer Electrolyte Fuel Cell Durability and Degradation. Chem. Rev. 2007, 107, 3904-3951.
-

- 5. Sharaf, O. Z.; Orhan, M. F. An Overview of Fuel Cell Technology: Fundamentals and Applications. Renew. Sustain. Energy Rev. 2014, 32, 810-853.
-

- 6. Fan, L.; Tu, Z.; Chan, S. H. Recent Development of Hydrogen and Fuel Cell Technologies: A Review, Energy Rep. 2021, 7, 8421-8446.
-

- 7. Mekhilef, S.; Saidur, R.; Safari, A. Comparative Study of Different Fuel Cell Technologies. Renew. Sustain. Energy Rev. 2012, 16, 981-989.
-

- 8. Pan, M.; Pan, C.; Li, C.; Zhao, J. A Review of Membranes in Proton Exchange Membrane Fuel Cells: Transport Phenomena, Performance and Durability. Renew. Sustain. Energy Rev.2021, 141, 110771.
-

- 9. Shimpalee, S.; Beuscher, U.; Van Zee, J. W. Analysis of GDL Flooding Effects on PEMFC Performance. Electrochim. Acta 2007, 52, 6748-6754.
-

- 10. Asensio, J. A.; Sánchez, E. M.; Gomez-Romero, P. Proton-Conducting Membranes Based on Benzimidazole Polymers for High-Temperature PEM Fuel Cells. A Chemical Quest. Chem. Soc. Rev. 2010, 39, 3210-3239.
-

- 11. Krishnan, P.; Park, J.-S.; Kim, C.-S. Performance of a Poly(2,5-Benzimidazole) Membrane Based High Temperature PEM Fuel Cell in the Presence of Carbon Monoxide. J. Power Sources 2006, 159, 817-823.
-

- 12. Hickner, M. A.; Ghassemi, H.; Kim, Y. S.; Einsla, B. R.; McGrath, J. E. Alternative Polymer Systems for Proton Exchange Membranes (PEMs). Chem. Rev. 2004, 104, 4587-4612.
-

- 13. Saito, M.; Arimura, N.; Hayamizu, K.; Okada, T. Mechanisms of Ion and Water Transport in Perfluorosulfonated Ionomer Membranes for Fuel Cells. J. Phys. Chem. B 2004, 108, 16064-16070.
-

- 14. Yin, C.; Wang, Z.; Luo, Y.; Li, J.; Zhou, Y.; Zhang, X.; Zhang, H.; Fang, P.; He, C. Thermal Annealing on Free Volumes, Crystallinity and Proton Conductivity of Nafion Membranes. J. Phys. Chem. Solids 2018, 120, 71-78.
-

- 15. Kuwertz, R.; Kirstein, C.; Turek, T.; Kunz, U. Influence of Acid Pretreatment on Ionic Conductivity of Nafion® Membranes. J. Membr. Sci. 2016, 500, 225-235.
-

- 16. Ahmad, H.; Kamarudin, S. K.; Hasran, U. A.; Daud, W. W. Overview of Hybrid Membranes for Direct-Methanol Fuel-Cell Applications. Int. J. Hydrog. Energy 2010, 35, 2160-2175.
-

- 17. Kreuer, K.-D.; Paddison, S. J.; Spohr, E.; Schuster, M. Transport in Proton Conductors for Fuel-Cell Applications: Simulations, Elementary Reactions, and Phenomenology. Chem. Rev. 2004, 104, 4637-4678.
-

- 18. Breslau, B. R.; Miller, I. F. A Hydrodynamic Model for Electroosmosis. Ind. Eng. Chem. Fund. 1971, 10, 554-565.
-

- 19. Hogarth, W. H.; Da Costa, J. D.; Lu, G. M. Solid Acid Membranes for High Temperature (>140 ℃) Proton Exchange Membrane Fuel Cells. J. Power Sources 2005, 142, 223–237.
-

- 20. Peighambardoust, S. J.; Rowshanzamir, S.; Amjadi, M. Review of the Proton Exchange Membranes for Fuel Cell Applications. Int. J. Hydrog. Energy 2010, 35, 9349-9384.
-

- 21. Sridhar, P.; Perumal, R.; Rajalakshmi, N.; Raja, M.; Dhathathreyan, K. S. Humidification Studies on Polymer Electrolyte Membrane Fuel Cell. J. Power Sources 2001, 101, 72-78.
-

- 22. Casciola, M.; Alberti, G.; Sganappa, M.; Narducci, R. On the Decay of Nafion Proton Conductivity at High Temperature and Relative Humidity. J. Power Sources 2006, 162, 141-145.
-

- 23. Wang, Z.; Tang, H.; Zhang, H.; Lei, M.; Chen, R.; Xiao, P.; Pan, M. Synthesis of Nafion/CeO2 Hybrid for Chemically Durable Proton Exchange Membrane of Fuel Cell. J. Membr. Sci. 2012, 421, 201-210.
-

- 24. Thuc, V. D.; Tinh, V. D. C.; Kim, D. Simultaneous Improvement of Proton Conductivity and Chemical Stability of Nafion Membranes via Embedment of Surface-Modified Ceria Nanoparticles in Membrane Surface. J. Membr. Sci. 2022, 642, 119990.
-

- 25. Jin, Y.; Qiao, S.; Zhang, L.; Xu, Z. P.; Smart, S.; da Costa, J. C. D.; Lu, G. Q. Novel Nafion Composite Membranes with Mesoporous Silica Nanospheres as Inorganic Fillers. J. Power Sources 2008, 185, 664-669.
-

- 26. Ke, C.-C.; Li, X.-J.; Qu, S.-G.; Shao, Z.-G.; Yi, B.-L. Preparation and Properties of Nafion/SiO2 Composite Membrane Derived via in Situ Sol–Gel Reaction: Size Controlling and Size Effects of SiO2 Nano-Particles. Polym. Adv. Technol. 2012, 23, 92-98.
-

- 27. Xu, G.; Li, S.; Li, J.; Liu, Z.; Li, Y.; Xiong, J.; Cai, W.; Qu, K.; Cheng, H. Targeted Filling of Silica in Nafion by a Modified in Situ Sol–Gel Method for Enhanced Fuel Cell Performance at Elevated Temperatures and Low Humidity. Chem. Commun. 2019, 55, 5499-5502.
-

- 28. Dresch, M. A.; Matos, B. R.; Fonseca, F. C.; Santiago, E. I.; Carmo, M.; Lanfredi, A. J. C.; Balog, S. Small-Angle X-Ray and Neutron Scattering Study of Nafion-SiO2 Hybrid Membranes Prepared in Different Solvent Media. J. Power Sources 2015, 274, 560-567.
-

- 29. Tang, H. L.; Pan, M. Synthesis and Characterization of a Self-Assembled Nafion/Silica Nanocomposite Membrane for Polymer Electrolyte Membrane Fuel Cells. J. Phys. Chem. C 2008, 112, 11556-11568.
-

- 30. Yang, H. N.; Cho, S. H.; Kim, W. J. The Preparation of Self-Humidifying Nafion/Various Pt-Containing SiO2 Composite Membranes and Their Application in PEMFC. J. Membr. Sci. 2012, 421, 318-326.
-

- 31. Chandan, A.; Hattenberger, M.; El-Kharouf, A.; Du, S.; Dhir, A.; Self, V.; Pollet, B. G.; Ingram, A.; Bujalski, W. High Temperature (HT) Polymer Electrolyte Membrane Fuel Cells (PEMFC)–A Review. J. Power Sources 2013, 231, 264-278.
-

- 32. Amjadi, M.; Rowshanzamir, S.; Peighambardoust, S. J.; Hosseini, M. G.; Eikani, M. H. Investigation of Physical Properties and Cell Performance of Nafion/TiO2 Nanocomposite Membranes for High Temperature PEM Fuel Cells. Int. J. Hydrog. Energy 2010, 35, 9252-9260.
-

- 33. Santiago, E. I.; Isidoro, R. A.; Dresch, M. A.; Matos, B. R.; Linardi, M.; Fonseca, F. C. Nafion–TiO2 Hybrid Electrolytes for Stable Operation of PEM Fuel Cells at High Temperature. Electrochim. Acta 2009, 54, 4111-4117.
-

- 34. Sacca, A.; Carbone, A.; Passalacqua, E.; D’epifanio, A.; Licoccia, S.; Traversa, E.; Sala, E.; Traini, F.; Ornelas, R. Nafion–TiO2 Hybrid Membranes for Medium Temperature Polymer Electrolyte Fuel Cells (PEFCs). J. Power Sources 2005, 152, 16-21.
-

- 35. Wehkamp, N.; Breitwieser, M.; Büchler, A.; Klingele, M.; Zengerle, R.; Thiele, S. Directly Deposited Nafion/TiO2 Composite Membranes for High Power Medium Temperature Fuel Cells. RSC Adv. 2016, 6, 24261-24266.
-

- 36. Chen, D.; Feng, H.; Li, J. Graphene Oxide: Preparation, Functionalization, and Electrochemical Applications. Chem. Rev. 2012, 112, 6027-6053.
-

- 37. Fu, X.; Lin, J.; Liang, Z.; Yao, R.; Wu, W.; Fang, Z.; Zou, W.; Wu, Z.; Ning, H.; Peng, J. Graphene Oxide as a Promising Nanofiller for Polymer Composite. Surf. Interfaces 2023, 37, 102747.
-

- 38. Chien, H.-C.; Tsai, L.-D.; Huang, C.-P.; Kang, C.; Lin, J.-N.; Chang, F.-C. Sulfonated Graphene Oxide/Nafion Composite Membranes for High-Performance Direct Methanol Fuel Cells. Int. J. Hydrog. Energy 2013, 38, 13792-13801.
-

- 39. Heo, Y.; Im, H.; Kim, J. The Effect of Sulfonated Graphene Oxide on Sulfonated Poly (Ether Ether Ketone) Membrane for Direct Methanol Fuel Cells. J. Membr. Sci. 2013, 425, 11-22.
-

- 40. Tseng, C.; Ye, Y.; Cheng, M.; Kao, K.; Shen, W.; Rick, J.; Chen, J.; Hwang, B. Sulfonated Polyimide Proton Exchange Membranes with Graphene Oxide Show Improved Proton Conductivity, Methanol Crossover Impedance, and Mechanical Properties. Adv. Energy Mater. 2011, 1, 1220-1224.
-

- 41. Choi, B. G.; Hong, J.; Park, Y. C.; Jung, D. H.; Hong, W. H.; Hammond, P. T.; Park, H. Innovative Polymer Nanocomposite Electrolytes: Nanoscale Manipulation of Ion Channels by Functionalized Graphenes. ACS Nano 2011, 5, 5167-5174.
-

- 42. Zhang, H.; Shen, P. K. Recent Development of Polymer Electrolyte Membranes for Fuel Cells. Chem. Rev. 2012, 112, 2780-2832.
-

- 43. Lee, D. C.; Yang, H. N.; Park, S. H.; Kim, W. J. Nafion/Graphene Oxide Composite Membranes for Low Humidifying Polymer Electrolyte Membrane Fuel Cell. J. Membr. Sci. 2014, 452, 20-28.
-

- 44. Zhang, B.; Cao, Y.; Jiang, S.; Li, Z.; He, G.; Wu, H. Enhanced Proton Conductivity of Nafion Nanohybrid Membrane Incorporated with Phosphonic Acid Functionalized Graphene Oxide at Elevated Temperature and Low Humidity. J. Membr. Sci. 2016, 518, 243-253.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2024 Impact Factor : 0.6
- Indexed in SCIE
 This Article
This Article
-
2024; 48(6): 563-575
Published online Nov 25, 2024
- 10.7317/pk.2024.48.6.563
- Received on Aug 19, 2024
- Revised on Sep 14, 2024
- Accepted on Sep 23, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sungyeon Heo
-
Department of Chemical and Biomolecular Engineering, Seoul National University of Science & Technology, Seoul 01811, Korea
- E-mail: sungyeonh@seoultech.ac.kr
- ORCID:
0000-0001-8690-5748








 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.