- Evaluation of the Survival Rate of Lactobacillus salivarius in the Gastrointestinal Tract According to the Concentration of Alginate Capsules
*4D Convergence Technology Institute (National Key Technology Institute in University), Korea National University of Transportation, Jungpyeong, Chung-Buk 27909, Korea
**Department of Chemical & Biological Engineering, Korea National University of Transportation, Chungju, Chung-Buk 27469, Korea- 알긴산 캡슐의 농도에 따른 위장관에서의 Lactobacillus salivarius 생존율 평가
*한국교통대학교 4D 융합기술원, **한국교통대학교 화학생물공학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Lactic acid bacteria play a vital role in enhancing the immune system by maintaining intestinal microbiota balance. However, their effectiveness is limited due to reduced survival during gastrointestinal transit. In this study, we prepared the 0.5%, 1%, and 1.5% concentrations of alginate-based capsules mixed with Lactobacillus salivarius (L. salivarius) and evaluated their survival rate in simulated gastric and intestinal fluid environments. Initially, the capsules showed viscoelastic strength values of 3864.0, 4762.8, and 6871.0. However, after 2 hours of exposure in simulated gastric fluid, these values declined to 869.2, 1431.3, and 2889.1. Subsequent exposure for 4 hours in simulated intestinal fluid further decreased the strengths to 238.1, 342.6, and 831.1. L. salivarius were encapsulated within each type of alginate capsule, encapsulation efficiencies were measured as 93%, 95%, and 96%. The survival rates of L. salivarius after 2 hours in gastric juice were 22%, 42%, and 64%, with the 1.5% alginate capsule showing the highest survival rate. In intestinal juice, the survival rate of L. salivarius encapsulated in 1.5% alginate capsules was 47%. These findings demonstrate that L. salivarius survival improves with increased alginate concentration; however, achieving high lactic acid bacteria survival rates is limited when using alginate alone.
유산균은 장내 미생물 균형을 유지함으로써 면역 체계를 강화하는 데 중요한 역할을 한다. 그러나 위장관을 통과하는 동안 생존율이 감소하여 효과가 제한되는 문제가 있다. 본 연구에서는 Lactobacillus salivarius(L. salivarius)와 혼합한 알긴산 기반 0.5%, 1%, 및 1.5% 캡슐을 제작하고, 인공 위 및 장액 환경에서 생존율을 평가했다. 초기 캡슐의 점탄성 강도는 각각 Pa 3864.0, 4762.8, 및 6871.0으로 나타났다. 그러나 인공 위액에 2시간 동안 노출된 후, 강도는 각각 Pa 869.2, 1431.3, 및 2889.1로 감소했으며, 인공 장액에 4시간 동안 노출된 후에는 각각 Pa 238.1, 342.6, 및 831.1로 더 감소하였다. 각 유형의 알긴산에 L. salivarius를 캡슐화한 결과, 봉입률은 각각 93%, 95%, 및 96%로 측정되었다. 위액에서 2시간 동안 노출된 후 L. salivarius의 생존율은 각각 22%, 42%, 64%였으며, 1.5% 알긴산 캡슐에서 가장 높은 생존율을 보였다. 장액에서 1.5% 알긴산에 캡슐화된 L. salivarius의 생존율은 47%로 확인되었다. 본 연구를 통하여 알긴산 농도가 증가함에 따라 L. salivarius의 생존율의 증가가 보였으나, 알긴산 단독의 사용만으로는 높은 유산균 생존율을 달성하는 것에는 한계가 있는 것으로 사료된다.
This study aims to improve the survival rate of L. salivarius during digestion by encapsulating it with alginate encapsulation. The strength of the capsules will be examined in simulated gastric and intestinal fluids to evaluate their stability in the gastrointestinal environment.
Keywords: lactobacillus salivarius, alginate, gastrointestinal, encapsulation.
이 논문은 2025년도 정부(교육부, 과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(RS-2021-NR060137, RS-2024-00405287, 2021R1A2C2095113, RS-2025-02217286).
저자들은 이해상충이 없음을 선언합니다.
유산균은 장내 미생물 생태계의 균형을 유지하고 면역체계를 강화하여 장내 병원균 및 유해균의 생장을 억제와 염증성 장 질환 및 암 발병 위험을 감소시켜 인간의 건강 증진에 도움을 주는 것으로 알려져 있다.1,2 이러한 유산균이 장내에 도달하여, 효과를 나태내기 위해 최소 106 CFU/g 생존율을 확보해야 한다.3 그러나 유산균이 위장관을 통과하는 동안 약 2 logCFU/g으로 감소되어, 음식이나 보충제를 통해 8 logCFU/g의 섭취를 권장하고 있다.4 이러한 문제 해결하기 위해 유산균의 생존율을 높이기 위한 방법으로 폴리사카라이드 소재를 사용해 유산균을 캡슐화 하여 소화 효소로부터 보호하여, 장내에 활착 할 수 있도록 사용되고 있다.5,6
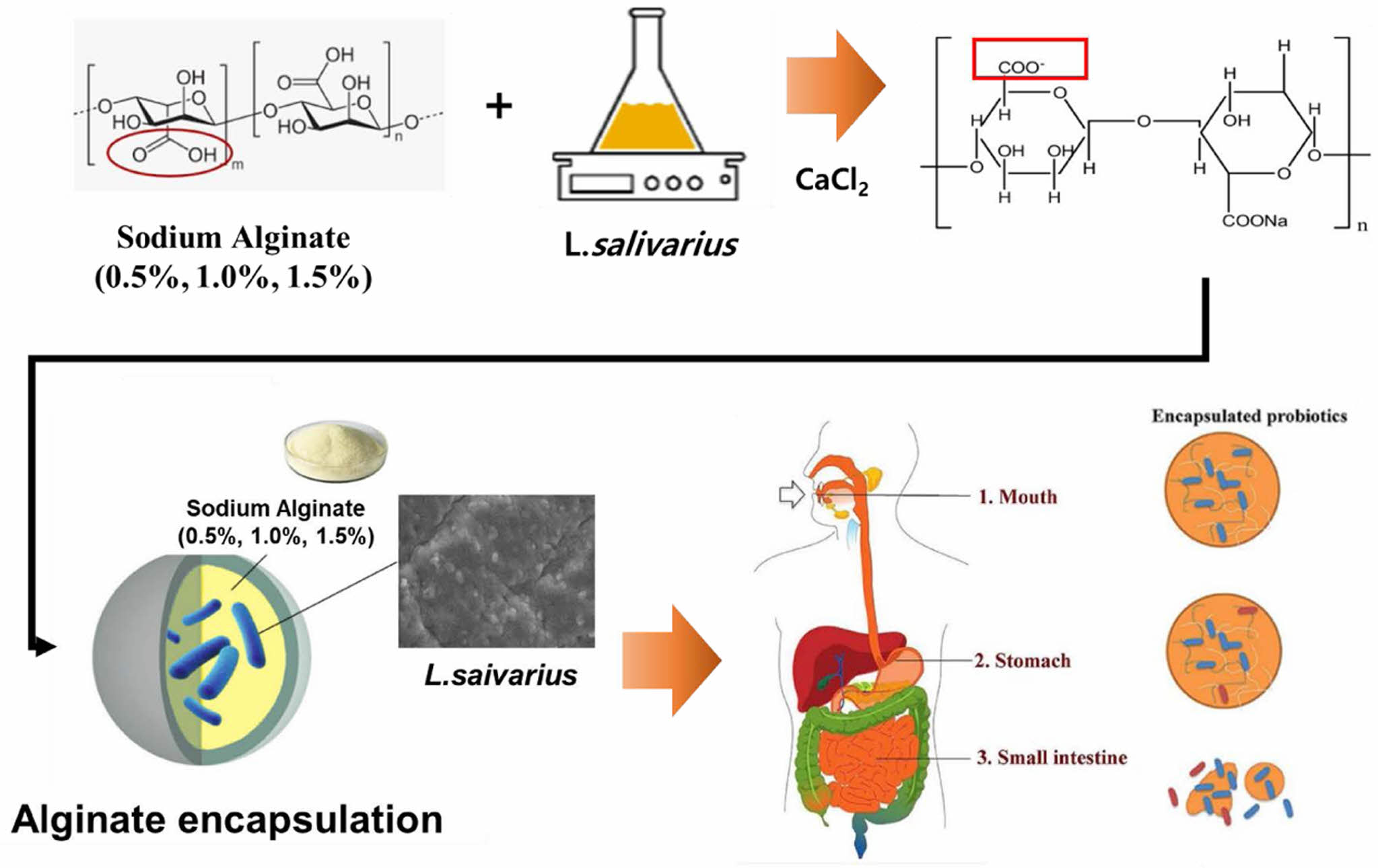
유산균을 캡슐화하기 위한 소재로 가장 일반적으로 사용되는 천연 폴리사카라이드인 알긴산은 β-(1,4) 결합된 β-d-만누론산과 α-l -글루론산으로 구성된 음이온성 폴리사카라이드로 갈조류세포벽에서 추출하여 산업적으로 사용되고 있다.7,8 알긴산 하이드로젤은 산성 매질에 녹지 않고 구조가 치밀 해져 위액과 같은 산성 조건에 약한 물질을 보호되며,9 낮은 pH로 단단해진 알긴산 캡슐은 pH 7.0 이상의 인산염 완충액에서 재 팽윤이 일어나 장액과 같은 알카리 조건에서 약물이 방출되는 특징을 가지고 있다.10
Lactobacillus salivarius(L. salivarius)는 인간, 돼지, 조류의 위장관에서 흔히 발견되는 프로바이오틱스의 대표적인 유산균으로, 유익균의 생장을 촉진하고 장내 면역 세포의 활성을 증가시켜 전반적인 면역력을 강화할 수 있다고 보고되고 있다.11
L. salivarius에서 생성되는 박테리오신은 Entero coccus faecalis, Clostridium perfringens, Helico bacter pylori와 같은 병원성 박테리아의 성장을 억제하는 항균 물질을 만드는 것으로 보고되어 있다.12,13 L. salivarius 특징으로는 염증성 사이토카인의 분비가 감소하고 IL-10생성이 급격히 증가하여 점막 림프 조직에서 면역 반응의 생리적 활성을 유지하는데 면역 조절 활성을 갖고, 간손상을 완화하는데 효과를 갖는다.14,15 하지만 캡슐화되지 않은 L. salivarius의 경우, 위액 조건에서는 초기 20분 이내에 약 2.4 logCFU/mL의 생존율 감소가 관찰되었다.14 따라서, L. salivarius가 위산에 대한 내산성이 부족하다는 것으로 보여주며, 장내 생존율을 높이기 위해 위산으로부터 효과적으로 보호할 수 있는 보호제를 필요로 한다.
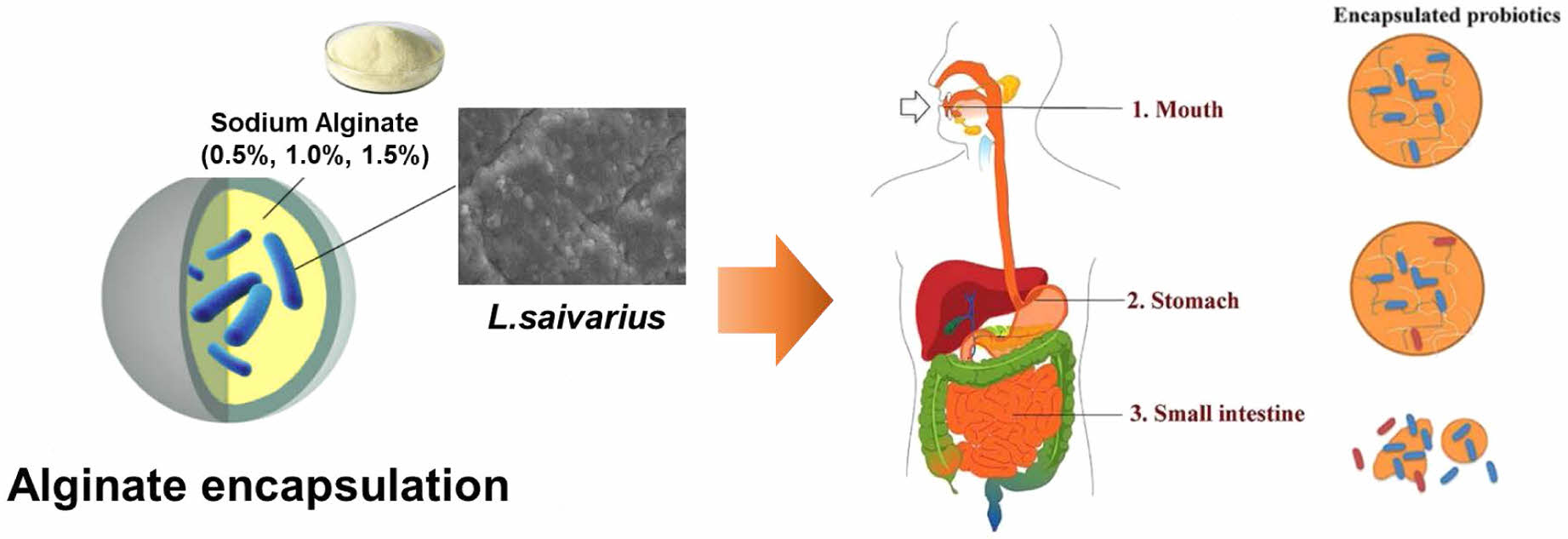
본 연구의 목적은 소화과정에서의 L. salivarius의 생존율을 높이고, 피해를 줄이기위해 알긴산을 이용해 캡슐화 하였을 때 위액과 장액에서 캡슐의 강도 변화를 조사하여, 위장관에서의 특성을 확인하고, 유산균 캡슐화하였을 때 장내 생존율을 조사하여 알긴산 캡슐의 효율을 평가하고자 한다(Figure 1).
|
Figure 1 Schematic diagram of the mechanisms of encapsulated L. salivarius. |
재료 및 시약. 본 연구에 사용한 균주인 Lactobacillus Salivarius CRL 1328은 ㈜이니스트팜(Korea)에서 균주를 제공받았다. Sodium alginate(Junsei chemical Co., ltd, Japan), Calcium chloride dihydrate(CaCl2, Aldrich, USA), Sodium chloride(NaCl, Aldrich, USA), Pepsin(pepsin, Wako, Japan), Dipotassium phosphate (K2HPO4, Aldrich, USA), Pancreatin (pancreatin, Wako, Japan)를 구입하였고, Man Rogosa Sharpe(MRS)broth (Becton, Dickinson and Company, France)를 배지로 사용하였다.
유산균 배양. 동결 보관된 L. salivarius를 멸균된 일회용 플라스틱 루프 10 mL를 사용하여 채취한 후, MRS agar plate(Difco, Chile)에 도말하고 37 ℃에서 24시간 동안 배양하였다. 배양된 MRS agar plate에서 일회용 플라스틱 루프를 사용하여 하나의 콜로니를 선택한 뒤, 100 mL의 MRS broth (Difco, Chile)가 담긴 250 mL 삼각플라스크에 접종하였다. 접종된 배지는 37 ℃의 Shaking Incubator에서 100 rpm으로 24시간 동안 배양하였다.
유산균의 생장 곡선 및 내산성. L. salivarius의 pH에 따른 성장 곡선을 확인하기 위해 pH 1.2와 pH 6.8로 조절된 MRS배지 각각 100 mL를 준비하였다. 준비된 배지 100 mL에 L. salivarius 10 mL를 접종하였으며, 초기 유산균의 OD(Optical Density)값을 1.0으로 맞춘 뒤, 30분 간격으로 측정하여, 유산균의 내산성을 평가했다.
Alginate 캡슐 제조. 알긴산을 증류수에 각각 0.5%, 1.0%, 1.5% 농도로 녹여 10 mL 주사기에 담고 주사기 주입구에 실리콘호스(I.D3 mm×I.D4 mm)를 10 cm정도 잘라 연결하였다. 1.1% CaCl2 용액을 삼각플라스크에 50 mL을 채운 뒤 200 rpm으로 교반 하며 알긴산을 한 방울씩 떨어뜨리며, 10분간 경화시켰다. 경화된 캡슐 표면에 남아 있는 CaCl2를 제거하기 위해 증류수로 3회 세척 후 사용하였다.
진폭 조절 스윕(Amplitude Sweep) 분석. 알긴산의 강도를 평가하기 위해 각각 0.5%, 1.0%, 1.5% 농도로 제조된 알긴산 캡슐을 준비하고, 위액(pH 1.2)조건에서 2시간 동안 처리하고 위액에서의 강도를 평가하였다. 장액에서의 강도 평가는 앞서 언급한 방법과 같이 위액 100 mL에서 2시간 동안 처리한 후 회수하고, 37 ℃로 설정된 shaking incubator에서 100 rpm으로 장액(pH 6.8) 100 mL에서 4시간을 추가로 침지하여 측정하였다. 진폭 조절 스윕(amplitude sweep)으로 강도 평가를 위해 레오미터 MCR302(Anton Paar)장비에 PP25 Parallel Plate을 사용하였다. frequency(f)는 1 Hz이며, 변형률(shear strain, g)은 0.01%에서 100%까지 로그 스케일로 변화시키며 총 21개의 포인트로 데이터를 수집하였다.16
각 농도별 샘플은 동일한 조건에서 3회 반복 측정하여 평균값을 산출해 위장관 환경에서의 알긴산 캡슐의 강도 변화를 평가하였다.
유산균 혼합 Alginate 캡슐 제조. L. salivarius(1×108 CFU/mL)의 배양액에 알긴산 용액(0.5%, 1.0% 1.5%)을 1:1비율 혼합한 후, 1.1% CaCl2 용액을 50 mL을 넣고 200 rpm 속도로 교반기에 주사기 내의 혼합물을 한방울씩 떨어뜨리면서 교반하여 캡슐화 하였다. 경화된 알긴산 캡슐은 증류수로 3회 세척한 후 실험에 사용했다.
Alginate 캡슐 표면 주사전자현미경(SEM) 관찰.알긴산 캡슐 내에 L. salivarius가 균일하게 혼합되여 캡슐를 형성하였는지 확인하기위해 주사전자현미경(SEM)으로 캡슐의 표면을 촬영하였다. 제조된 알긴산 캡슐을 이미징하기 위해 Karnovsky’s fixative로 전처리 후 0.05 M sodium cacodylate buffer로 3회 세척 후 1% osmium tetroxide로 2차 고정하고 에탄올(EtOH)로 탈수시켜 하루동안 후드에서 건조시켰다.15건조된 캡슐은 알루미늄 스터브에 탄소 테이프에 놓은 다음 이온 스퍼터 코터(Coxem, Korea)로 진공 상태에서 120초 동안 코팅하고 주사전자현미경(EVO10, Zeiss)으로 15 kV에서 표면을 관찰하였다.
위장관 실험. 위장관 실험방법은 Aoxiang Zhuge, Bo Li et al.의 논문을 참고하였으며,14 인공위액(SGF)은 US Pharmacopeia (USP;https://www.usp.org)의 방법으로 만들었다. pH 1.2의 1 L 인공위액 조성은 NaCl 2 g, Pepsin 3.2 g, HCL 7 mL 마지막으로 3차 증류수를 넣은 후 HCl을 첨가하여 pH 1.2로 맞추어 사용하였다.
인공위액 80 mL을 250 mL 삼각플라스크에 유산균(1×108 CFU/mL)의 알긴산 캡슐을 모두 넣은 다음 shaking incubator에 37 ℃에서 100 rpm으로 2시간 동안 처리한 후 인공 위액을 모두 제거하였다. 이후 인공 위액을 제거한 후 캡슐 내의 유산균에 생존율을 위해 50 mM sodium citrate용액 100 mL을 37 ℃에서 100 rpm으로 1시간 동안 shaking incubator에 처리하여 알긴산을 제거하였다. 원심분리기에서 4000 rpm에서 10분 실시하여 펠렛을 회수하고, 3차 증류수로 3회 세척한 다음 Serial dilution 후 MRS agar 20 mL씩 접종하였다. 접종한 MRS agar plate는 37 ℃에서 48시간 동안 배양한 후 콜로니 수를 확인한다. 인공장액(SIF)은 US Pharmacopeia(USP; https://www.usp.org)을 참고하여 만들었다. pH 6.8의 1 L 인공장액 조성은 hydrogen phosphate 6.8 g, 0.2 M NaOH 77 mL, 증류수 500 mL을 첨가한 후 pancreatin 10 g을 넣은 후 pH 6.8으로 맞춰 사용하였다.
실험 방법으로는 알긴산으로 캡슐화된 유산균을 인공 위액 80 mL에 모두 넣은 후 Shaking incubator에 37 ℃에서 100 rpm으로 2시간 동안 처리한 다음 캡슐을 꺼내어 다시 인공장액에 200 mL에 37 ℃, 100 rpm으로 Shaking incubator에서 4시간 동안 처리한 후 serial dilution하여 MRS agar에 접종하고, 37 ℃에서 48시간 동안 배양한 후 콜로니 수를 확인한다.
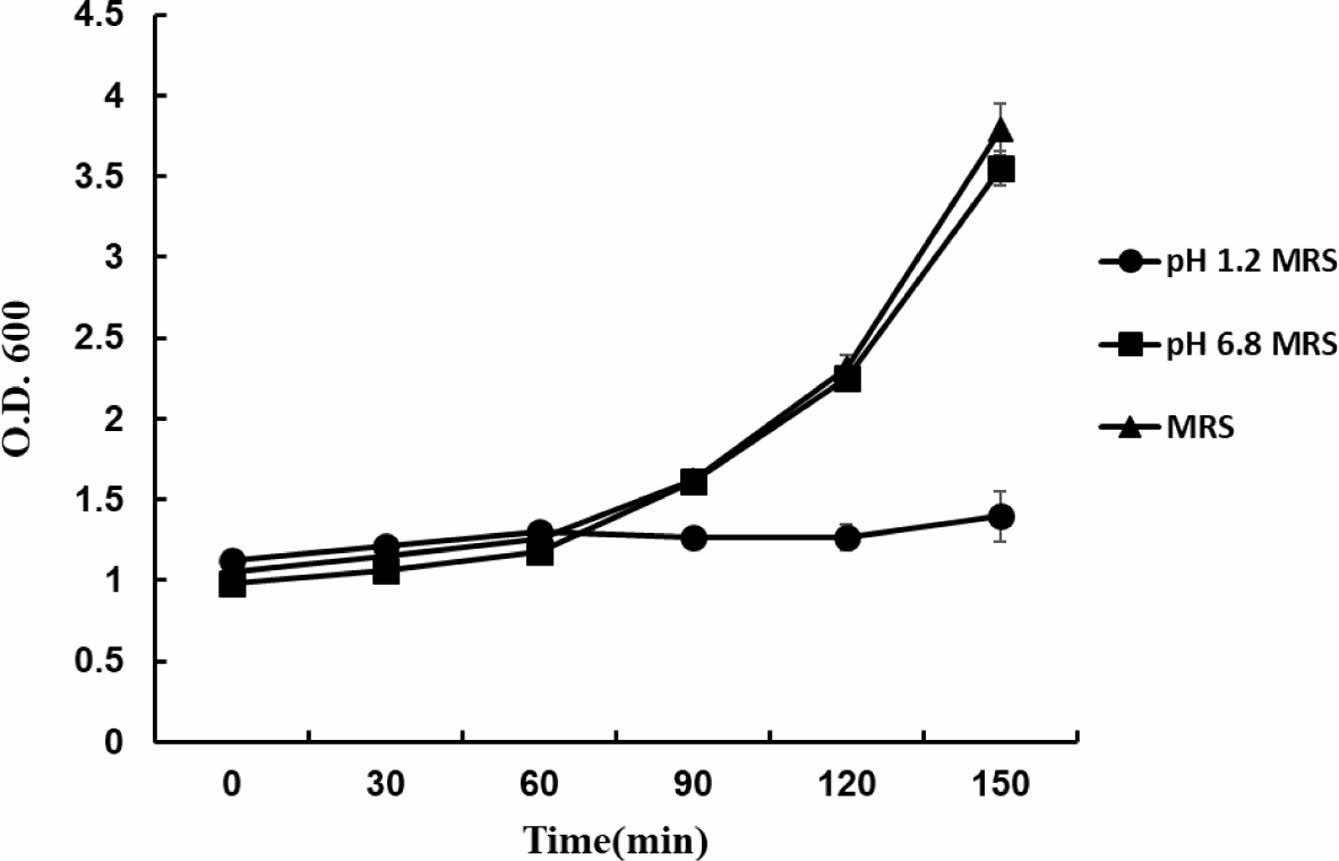
L.salivarius의 pH에 따른 생장. Figure 2는 pH 1.2와 pH 6.8로 조정한 MRS 배지에서, 흡광도(optical density)를 1로 맞춘 뒤 L. salivarius의 성장 속도를 30분 간격으로 측정한 결과이다. pH 1.2의 강산성 조건에서는 균의 성장이 거의 이루어지지 않는 반면, 60분 이후부터 pH 6.8의 중성 조건에서는 빠르고 안정적으로 성장하는 것을 확인하였다.
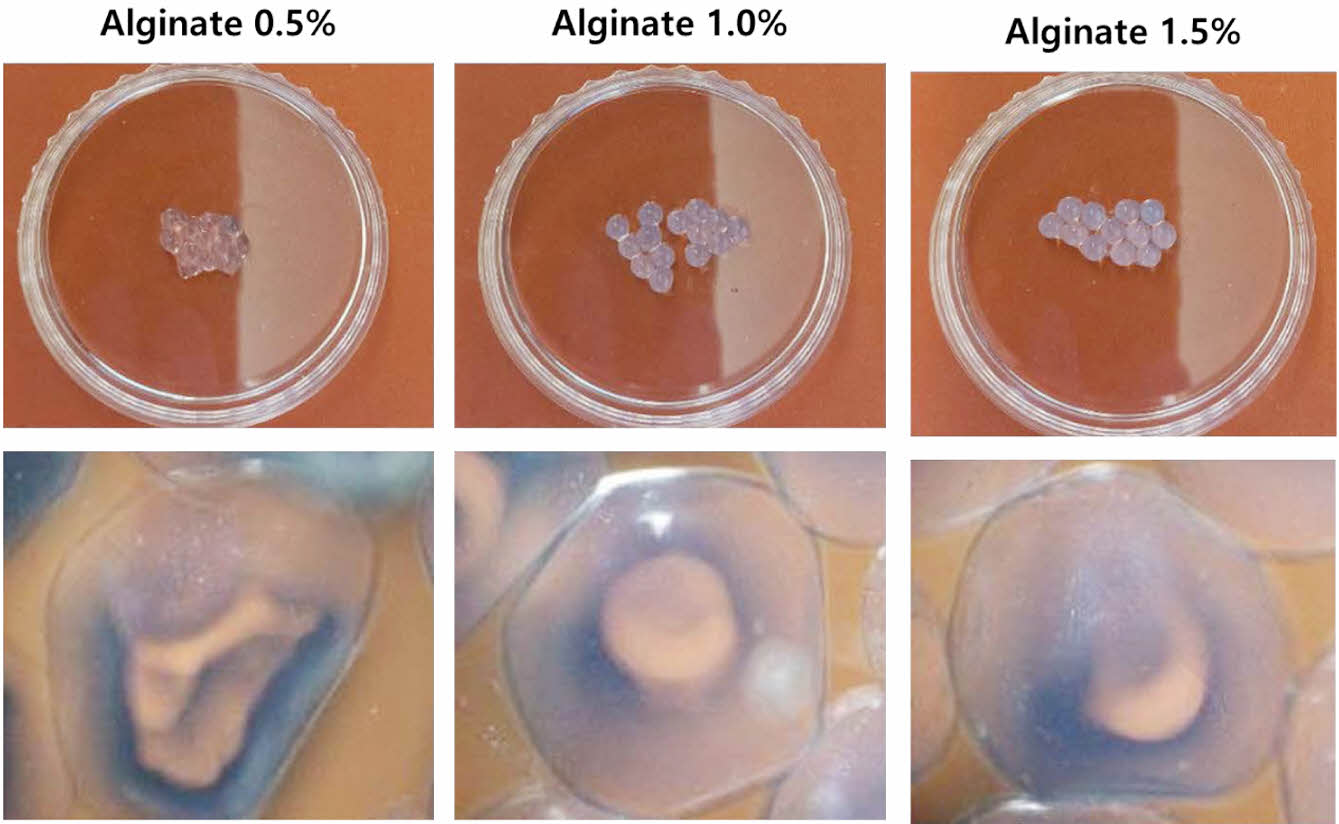
Alginate 농도에 따른 캡슐 특성 분석. Figure 3은 알긴산의 농도에 따른 캡슐 형상을 위상차 현미경을 통해 관찰하였다. 0.5% 알긴산의 경우 표면이 불균일하며, 매끄러운 구형을 유지하지 못하였다. 반면, 1.0%와 1.5% 알긴산에서는 0.5%알긴산에 비교적 균일하고 둥근 형태에 가까운 캡슐을 형성하게 되었다. 위 결과로서로 알긴산의 농도가 높을수록 규칙적인 구형의 형태를 이루고 높은 강도를 갖는 것으로 확인되었다.17
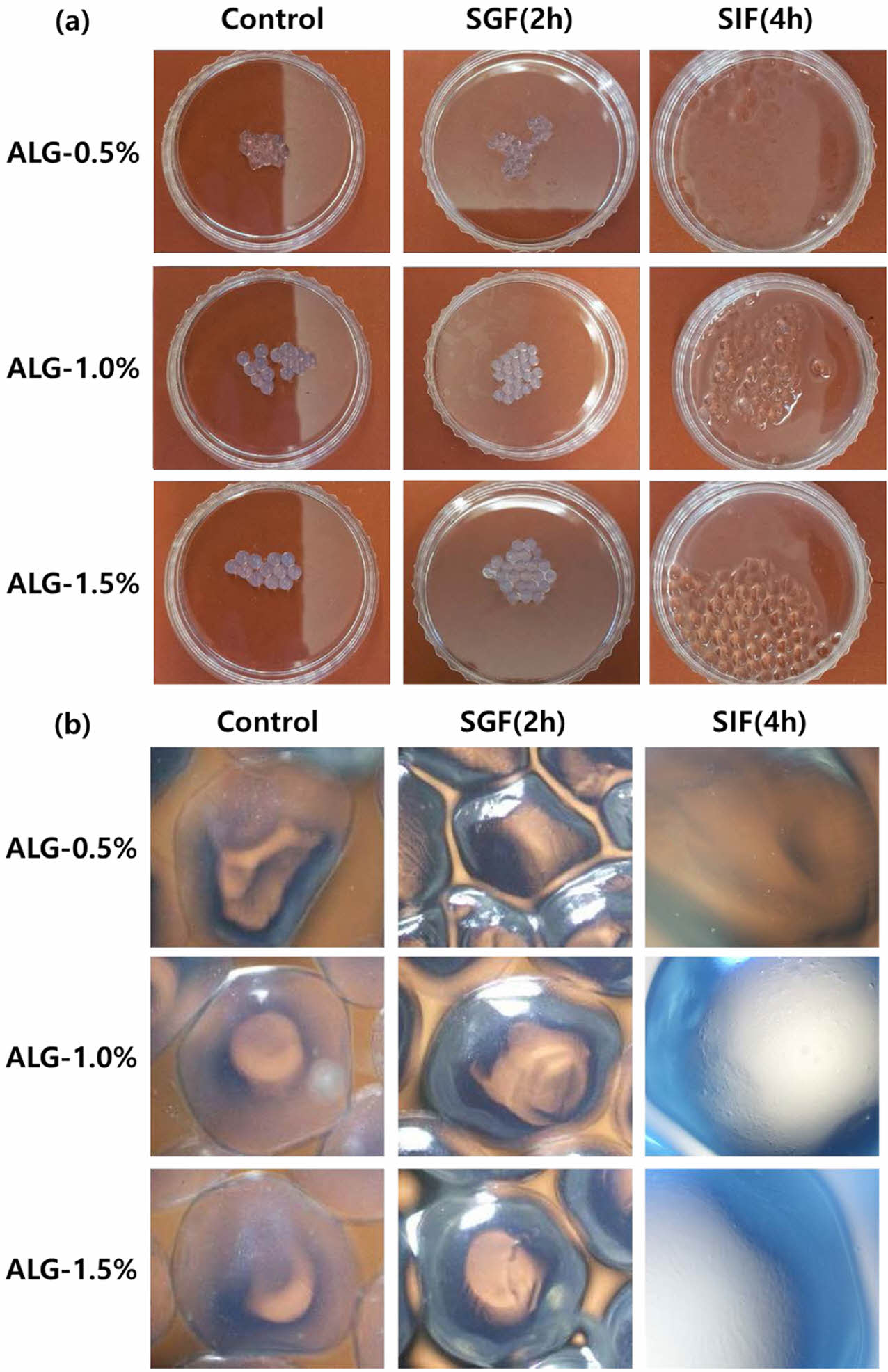
위장액에서의 Alginate 캡슐 변화. 0.5, 1, 1.5% 농도의 알긴산으로 캡슐을 제조한 후, 알긴산 캡슐이 인공 위장액에 노출될 때의 변화를 위상차 현미경을 통해 Figure 4와 같이 관찰였다. 인공위액(pH 1.2)에 2시간 노출하였을 때 0.5, 1, 1.5% 알긴산 캡슐의 외형적인 형태 변화는 관찰되지 않았다. 반면, 인공위액에 2시간동안 노출시킨 후 캡슐을 장액(pH 6.8)에 옮겨 4시간 노출하였 때, 알긴산 캡슐이 부풀어 오르는 현상을 관찰할 수 있었다.
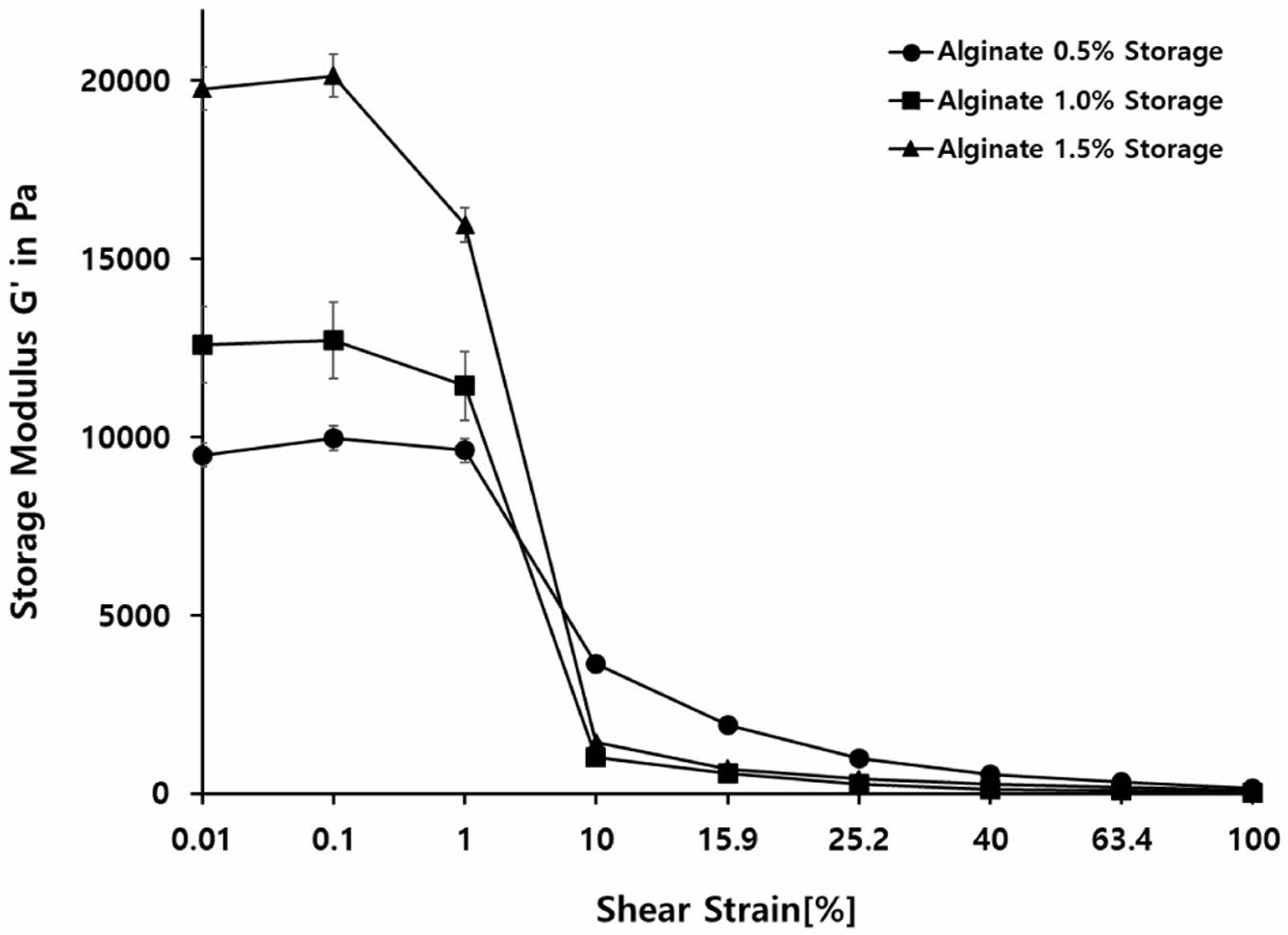
Alginate 농도에 따른 캡슐 강도 분석. 0.5, 1, 1.5% 농도의 알긴산 캡슐을 레오미터를 통해 강도를 측정였다. 캡슐의 강도는 저장탄성률(storage modulus)의 수치를 평균화하여 비교하였다(Figure 5). 실험 결과, 알긴산 0.5%는 3864,07이고, 알긴산 1%는 4762.86, 알긴산 1.5%는 6871.07로 나타났으며, 알긴산의 농도가 높을수록 저장탄성률의 수치가 높게 나타났다(Figure 5). 일반적으로 가교도 밀도가 높아질수록 겔은 외부로부터 가해지는 변형에 대해 더 강한 저항성을 가지며, 구조적 안정성이 더욱 높아지게 된다.18
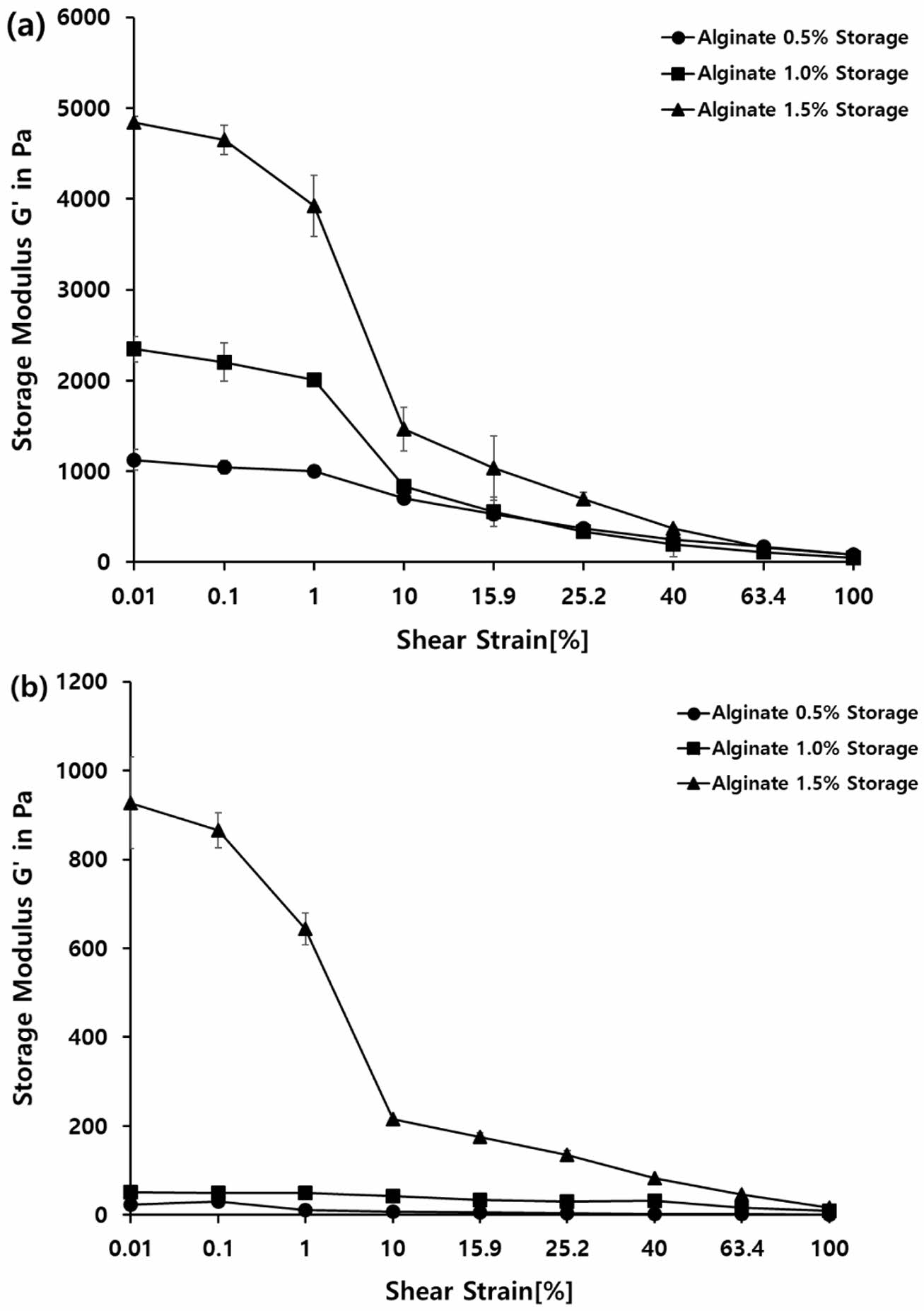
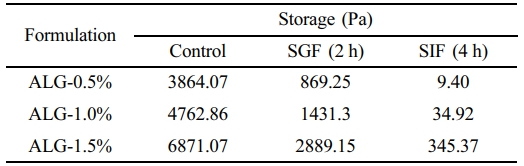
위장액에서의 Alginate 캡슐 강도 변화. 0.5, 1, 1.5% 농도의 알긴산 캡슐을 위장액에 노출 후 레오미터로 강도 측정하였고, 앞선 실험과 같이 저장탄성률의 수치를 평균화하여 측정하였다(Figure 6). 위액 조건에서 알긴산 0.5%는 869.25이고, 알긴산 1%는 1431.3, 알긴산 1.5%는 2889.15로 나타났다(Figure 6(a)). 반면, 장액에서 알긴산 0.5%는 9.40이고, 알긴산 1%는 34.92, 알긴산 1.5%는 345.37로 나타났다(Figure 6(b)). 따라서, 알긴산의 농도가 높을수록 강도가 높아지고, 안정적인 캡슐 구조를 갖는다고 판단된다. 또한, 위산 환경에서 알긴산 캡슐의 강도가 유지됨을 확인할 수 있었다. 반면, 위액과 달리 장액에서는 저장탄성률이 크게 떨어지며, 강도가 약해짐을 확인하였다(Table 1).
전자현미경을 통한 Alginate 캡슐의 표면 관찰. Figure 7은 L. salivarius 균주가 알긴산 캡슐 내부에 안정적으로 봉입되었는지를 확인하기 위해 주사전자현미경(SEM)으로 이미징 하였다. 먼저, L. salivarius를 제외한 알긴산 캡슐은 표면이 매끈하게 관찰되었다(Figure 7(a)). 반면, L. salivarius를 혼합한 알긴산 캡슐에는 알긴산 캡슐 표면에 L. salivarius를 관찰할 수 있다. 또한, 0.5% 알긴산에 비해 1.0%와 1.5% 농도의 알긴산 캡슐에서 L. salivarius가 두껍게 코팅된 것을 확인할 수 있었다(Figure 7(b)).
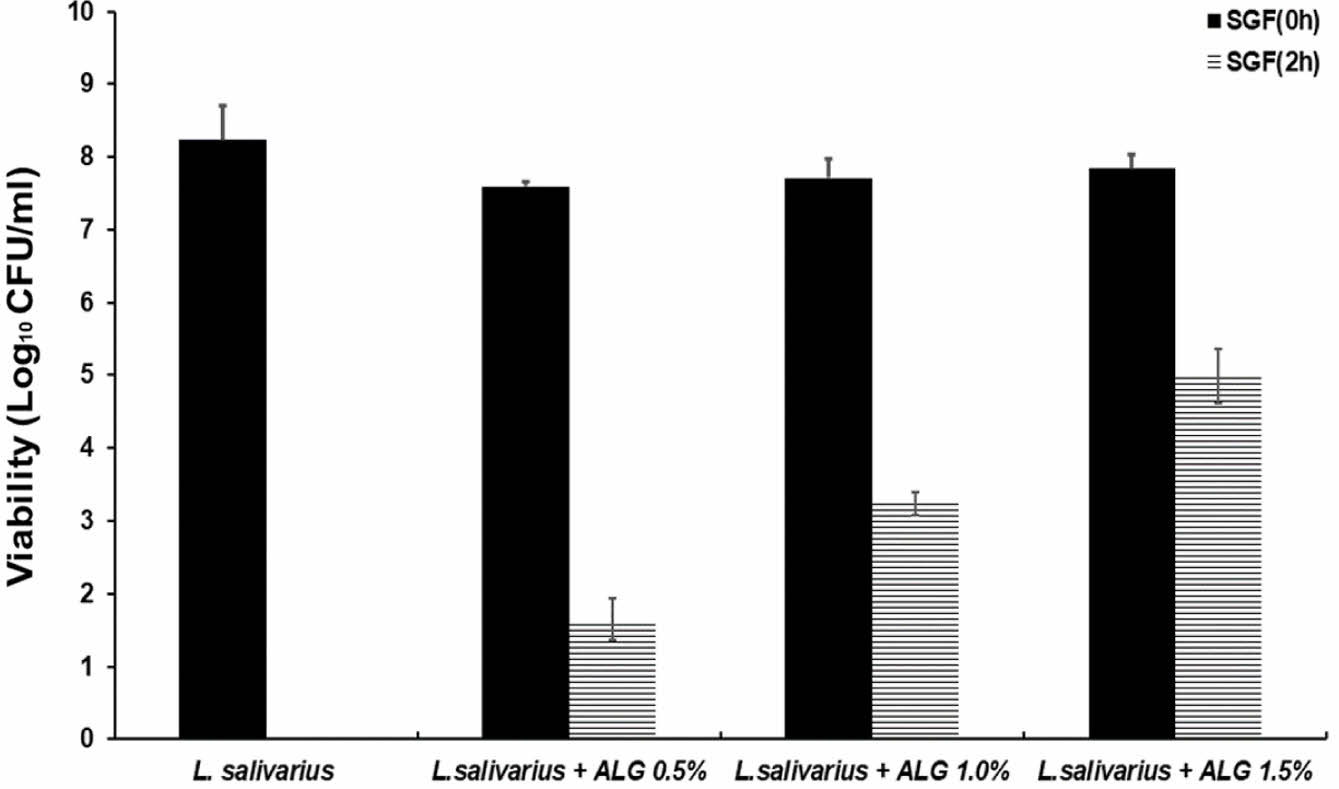
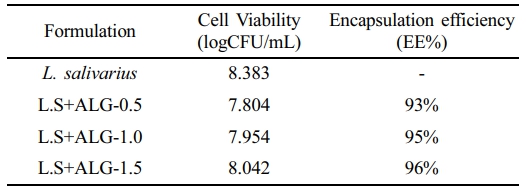
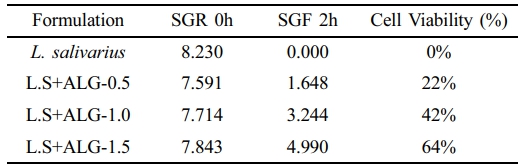
Alginate 캡슐의 L.salivarus의 봉입률. L. salivarius의 알긴산 봉입률은 50 mM Sodium citrate로 캡슐을 제거한 후 봉입률(encapsulation efficiency, EE)을 Figure 8에 나타내었다.19 알긴산 내에 세포 봉입률은 알긴산 0.5%에서의 약 93%, 1%에서는 95%, 1.5%에서는 96%의 봉입률을 보였다(Table 2). 알긴산 캡슐의 내산성을 비교하기 위해 비캡슐화 L. salivarius와 알긴산으로 캡슐화된 L. salivarius을 각각 위액에 2시간 동안 처리한 후 L. salivarius의 생존율을 비교하여 내산성을 확인하였다. 비캡슐화된 L. salivarius는 초기 균 수는 약 8.230 logCFU/mL 였으며, 인공 위산에서 2시간 경과 후 생존율은 0%로 강산 조건에서 생존하지 못하였다. 알긴산 0.5%로 캡슐화한 L. salivarius는 초기 균 수는 약 7.591 logCFU/mL 였고, 2시간 후 1.648 logCFU/mL로 약 22%의 세포 생존율을 보였다. 알긴산 1.0%는 초기 균 수가 7.714 logCFU/mL였고, 2시간 후 3.244 logCFU/mL로 약 42%의 생존율을 나타냈다. 1.5% 알긴산의 초기 균 수는 7.843 logCFU/mL이며, 2시간 후 4.990 logCFU/mL로 약 64%의 생존율을 나타냈다(Figure 8). 실험 결과, 비캡슐화된 L. salivarius를 단독으로 위액에서 생존하지 못하였으나, 알긴산 농도가 높아짐에 따라 생존율이 높게 나타났으며, 실험 조건 중 1.5% 알긴산에서 안정적으로 유산균을 보호할 수 있었다.
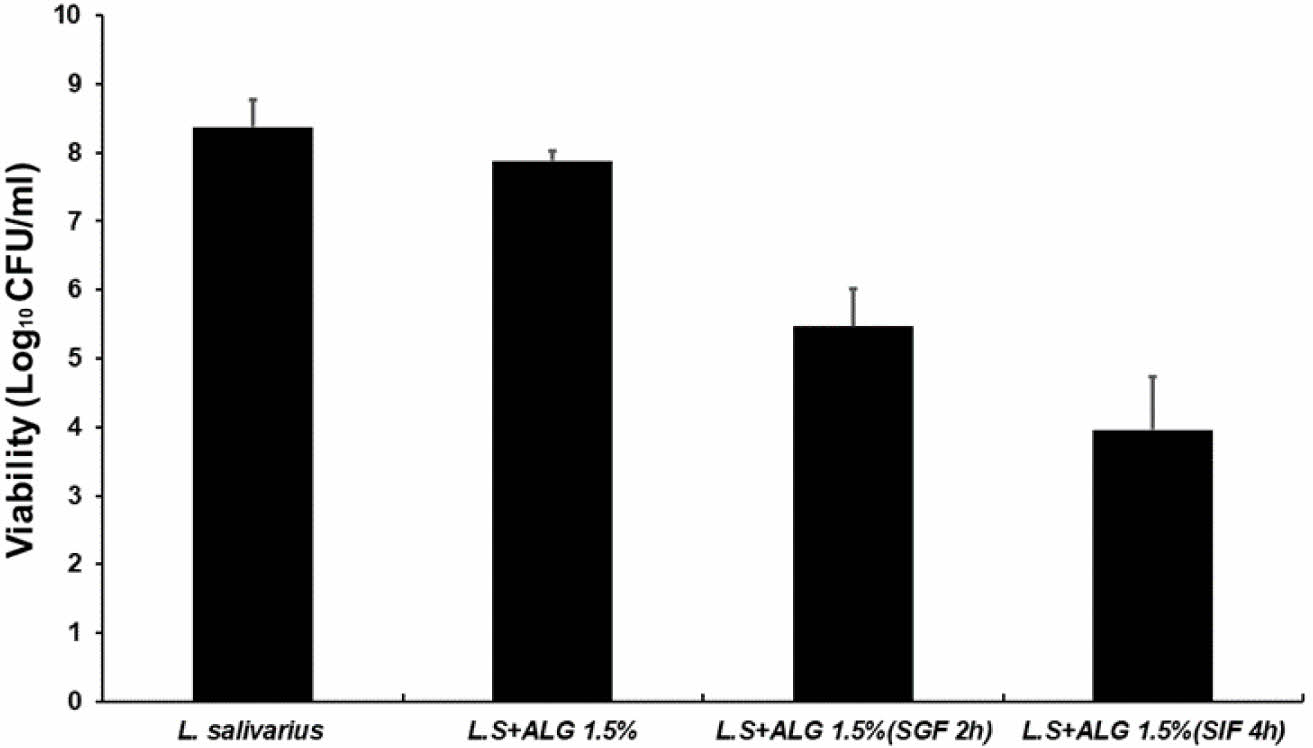
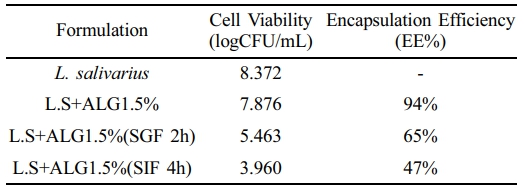
위장액에서의 L.salivarius 생존율. 위액에서 가장 높은 생존율을 보였던 1.5% 알긴산 캡슐 선택하여 위액에 2시간 둔 후 회수하여 장액에 4시간을 노출시켜 최종 생존율을 확인하였다. 비캡슐화 L. salivarius는 8.372 logCFU/mL이였고, 1.5% 알긴산에 캡슐 후 7.876 logCFU/mL로 약 94%의 봉입률을 보였다. 1.5% 알긴산 캡슐을 위액에 2시간 노출한 후 캡슐을 제거하여 L. salivarius의 생존율을 측정한 결과, 5.463 logCFU/mL로 약 65%가 위액에서 생존하였고, 위액을 거쳐 연속적으로 장액에 4시간 노출시킨 후 캡슐에서 빠져나온 L. salivarius는 3.960 logCFU/mL로 약 47%가 장액에서 검출되었다(Figure 9). Table 4
|
Figure 2 Growth phase optical density of L. salivarius incubation time under different conditions, L. salivarius optical density (OD=1) growth phase pH 1.2 and pH 6.8. |
|
Figure 3 Morphology and strength measurements based on alginate concentration. |
|
Figure 4 Changes in morphology of SGF and SIF based on alginate concentration. |
|
Figure 5 Amplitude sweep changes in according to alginate concentration. |
|
Figure 6 Amplitude sweep changes of alginate capsules: (a) SGF on 2 h; (b) SIF on 4 h. |

|
Figure 7 Using a scanning electron microscope (SEM) to observe the surface of alginate capsules: (a) alginate capsule; (b) algiante capsule in L. salivarius. |
|
Figure 8 Survival rate of L. salivarius in alginate capsules under SGF conditions. |
|
Figure 9 Survival rate of L. salivarius in alginate capsules (ALG1.5%) under SIF conditions. |
|
Table 4 Intestinal Juice Survival Rate of L. salivarius in Alginate Capsules (ALG-1.5%) |
본 연구에서는 위산에 취약한 유산균을 선정한 뒤, 생체 고분자인 알긴산을 활용하여 장내까지 안정적으로 전달할 수 있는지 확인하고자 했다. 이를 위해 알긴산 캡슐의 위산 내 내산성 평가와 장액에서의 유산균 방출 실험을 진행하였다.
실험 결과, 알긴산 캡슐의 농도에 따른 강도의 차이는 위액에서 내산성을 증가하고, 장액에서는 재팽윤 과정을 걸쳐 높은 유산균의 생존율과 연관성을 갖는 것으로 확인되었으나, 장내 유산균의 높은 생존율을 유지하는 데에는 여전히 한계점이 있은 것으로 나타났다.
따라서, 팩틴, 키토산 등 천연 다당류를 활용한 복합다당체를 활용한 코팅 방식을 통해 내산성을 높이고, 장내 환경에서 캡슐의 팽윤을 통한 유산균 방출과 장내 점착력을 높여 캡슐내에 빠져나오지 못한 유산균이 장내 활착하여 생존율을 높일 수 있는 캡슐화 연구가 필요하다.
- 1. Lee, J. Y.; Tsolis, R. M.; Bäumler, A. J. The Microbiome and Gut Homeostasis. Science. 2022, 377, 6601.
-

- 2. Zeng, W.; Shen, J.; Bo, T.; Peng, L.; Xu, H.; Nasser, M. I.; Zhuang, Q.; Zhao, M. Cutting Edge: Probiotics and Fecal Microbiota Transplantation in Immunomodulation. J. Immunol. Res. Apr 16, 2019, 1603758.
- 3. Terri, D.; Boylston, Celso, G.; Vinderola, H. B.; Ghoddusi, J. A. Reinheimer, Incorporation of Bifidobacteria Into Cheeses: Challenges and Rewards. Int. Dairy J., 2004, 14, 375-387.
-

- 4. Naissinger da Silva, M.; Tagliapietra, B. L., et al. In Vitro Test to Evaluate Survival in the Gastrointestinal Tract of Commercial Probiotics. Current Res. Food Sci. 2021, 4, 320-325.
-

- 5. Akbari, A.; Gänzle, M. G.; Wu, J. Cruciferin Improves Stress Resistance and Simulated Gastrointestinal Survival of Probiotic Limosilactobacillus Reuteri in the Model Encapsulation System. Food Hydrocoll. for Health. 2023, 3, 100118.
-

- 6. Okolie, C. L.; Rajendran, S. R.; Udenigwe, C. C.; Aryee, A. N.; Mason, B. Prospects of Brown Seaweed Polysaccharides (BSP) as Prebiotics and Potential Immunomodulators. J. Food Biochem. 2017, 41.
-

- 7. Marinova, V. Y.; Rasheva, I. K.; Kizheva, Y. K.; Dermenzhieva, Y. D.; Hristova, P. K. Microbiological Quality of Probiotic Dietary Supplements. Biotechnol. Biotechnol. Equipment, 2019, 33, 834-841.
-

- 8. Harnsilawat, T.; Pongsawatmanit, R.; McClements, D. J. Characterization of β-Lactoglobulin–Sodium Alginate Interactions in Aqueous Solutions: A Calorimetry, Light Scattering, Electrophoretic Mobility and Solubility Study. Food Hydrocolloids, 2006, 20, 577-585.
-

- 9. Matyash, M.; Despang, F.; Ikonomidou, C.; Gelinsky, M. Swelling and Mechanical Properties of Alginate Hydrogels with Respect to Promotion of Neural Growth. Tissue Eng. Part C Methods. 2014, 20, 401-411.
-

- 10. Afzaal, M.; Khan, A. U.; Saeed, F.; Arshad, M. S.; Khan, M. A.; Saeed, M.; Maan, A. A.; Khan, M. K.; Ismail, Z.; Ahmed, A.; Tufail, T.; Ateeq, H.; Anjum, F. M. Survival and Stability of Free and Encapsulated Probiotic Bacteria Under Simulated Gastrointestinal Conditions and in Ice Cream. Food Sci. Nutrition, 2020, 8, 1649-1656.
-

- 11. Lee, R. J.; Hinson, A.; Bauernschmitt, R.; Matschke K.; Fang Q.; Mann D. L.; Dowling R.; Schiller N.; Sabbah H. N. The Feasibility and Safety of Algisyl-LVRTM as a Method of Left Ventricular Augmentation in Patients with Dilated Cardiomyopathy: Initial First in Man Clinical Results. Int. J. Cardiol. 2015, 199, 18-24.
-

- 12. Messaoudi, S.; Manai, M.; Kergourlay, G.; Prévost, H.; Connil, N.; Chobert, J. M.; Dousset, X. Lactobacillus Salivarius: Bacteriocin and Probiotic Activity. Food Microbiol. 2013, 36, 296-304.
-

- 13. Ocaña, V. S.; Pesce De Ruiz Holgado, A. A.; Nader-Macías, M. E. Characterization of a Bacteriocin-like Substance Produced by a Vaginal Lactobacillus Salivarius Strain. Appl. Environ. Microbiol. 1999, 65, 5631.
-

- 14. Zhuge, A.; Li, B.; Yuan, Y.; Lv, L.; Li, Y.; Wu, J.; Yang, L.; Bian, X.; Wang, K.; Wang, Q.; Yan, R.; Zhu, X.; Li, L. Lactobacillus Salivarius LI01 Encapsulated in Alginate-pectin Microgels Ameliorates D-galactosamine-induced Acute Liver Injury in Rats. Appl. Microbiol. Biotechnol. 2020, 104, 7437-7455.
-

- 15. Pathan, A. K.; Bond, J.; Gaskin, R. E. Sample Preparation for Scanning Electron Microscopy of Plant Surfaces-horses for Courses. Micron. 2008, 39, 1049-1061.
-

- 16. Dezfooli, M.; Masoomi, S.; Gherbezza, J. M. Chitosan-coated Alginate Beads as a Probiotic Delivery System for New Zealand Black-footed Abalone (Haliotis iris). J. Appl. Polym. Sci. 2022, e52626.
-

- 17. Salsac, A. V.; Zang, L.; Gherbezza, J. M. Measurement of Mechanical Properties of Alginate Beads Using Ultrasound. CFM 2009-19 éme Congrés Fraçais de Mécanique, Marseille, France, Aug 24-28, 2009.
- 18. Funfakjit, N.; Kanana, N.; Manopakdee, K.; Charnvanich, D. Preparation of Alginate Beads by Ionic Gelation Method Using Encapsulator B-390: Effect of Process Parameters on Physical Properties of Beads. The Thai J. Pharmaceutical Sci. 2024, 48, 5.
-

- 19. Jouki, M.; Khazaei, N.; Rashidi-Alavijeh, S.; Ahmadi, S. Encapsulation of Lactobacillus Casei in Quince Seed Gum-alginate Beads to Produce a Functional Synbiotic Drink Powder by Agro-industrial by-products and Freeze-drying. Food Hydrocolloids. 2021, 120, 106895
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2024 Impact Factor : 0.6
- Indexed in SCIE
 This Article
This Article
-
2025; 49(6): 686-692
Published online Nov 25, 2025
- 10.7317/pk.2025.49.6.686
- Received on Jan 22, 2025
- Revised on Apr 14, 2025
- Accepted on Apr 22, 2025
 Services
Services
Shared
 Correspondence to
Correspondence to
- Yong-kyu Lee
-
*4D Convergence Technology Institute (National Key Technology Institute in University), Korea National University of Transportation, Jungpyeong, Chung-Buk 27909, Korea
**Department of Chemical & Biological Engineering, Korea National University of Transportation, Chungju, Chung-Buk 27469, Korea - E-mail: leeyk@ut.ac.kr
- ORCID:
0000-0001-8336-3592









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.